1.本发明涉及用于悬浮地培养细胞的悬浮培养用培养基添加剂和能够悬浮地培养细胞的培养基组合物以及使用该培养基组合物的培养方法。
背景技术:
2.作为使细胞在与其周围环境三维地相互作用的同时进行培养的方法,已知有三维细胞培养。在三维细胞培养中,例如若在液体培养基中培养细胞,则细胞沉降而凝集。作为用于使细胞不凝集的方法,存在使用水凝胶的方法、用旋转器进行搅拌以使细胞悬浮的方法。
3.然而,在使用水凝胶的方法中,已进入凝胶基质中的细胞的生长受到凝胶的压力的妨碍,另外由于凝胶结构不均匀而导致细胞集合体容易成为不均匀的大小,进而存在难以将凝胶和细胞分离的问题。另外,在利用旋转器进行搅拌的搅拌培养中,担心由于经常搅拌而对细胞造成损伤。
4.在专利文献1中,作为不利用旋转器进行搅拌而能够使细胞悬浮地进行培养的方法,公开了在液体培养基中添加纤维素、几丁质等纳米纤维来培养细胞的悬浮培养法。然而,专利文献1中公开的纤维素的纳米纤维是通过高压均化器等将纤维素微细化(粉碎)而得到的高分子化合物,通常其水分散液为高粘度,因此难以对培养出的细胞进行回收。
5.现有技术文献
6.专利文献
7.专利文献1:国际公开wo2015/111686号
技术实现要素:
8.发明欲解决的技术问题
9.本发明的实施方式的目的在于提供一种悬浮培养用培养基添加剂、培养基组合物以及培养方法,能够以悬浮状态培养细胞,并且能够容易地对培养出的细胞进行回收。
10.用于解决问题的技术方案
11.本发明的实施方式涉及的悬浮培养用添加剂是为了悬浮地培养细胞而添加于培养基中的培养基添加剂,其含有纤维素低聚物。
12.本发明的实施方式涉及的培养基组合物是能够悬浮地培养细胞的培养基组合物,其含有纤维素低聚物。
13.本发明中,纤维素低聚物可以不具有取代基,也可以具有取代基。
14.本发明的实施方式涉及的细胞的培养方法包括在该培养基组合物中培养细胞。
15.发明效果
16.根据本发明的实施方式,通过在培养基中配合纤维素低聚物,从而能够将细胞以悬浮状态培养。另外,即使添加纤维素低聚物,培养基也被维持在低粘度,因此例如能够通过过滤等容易地回收细胞。
附图说明
17.[图1]是示出纤维素低聚物在超纯水中和dmem中的分散稳定性的评价结果的分散液照片;
[0018]
[图2]是示出纤维素低聚物的dls测定结果的曲线图;
[0019]
[图3]是悬浮培养1天后的培养液中的显微镜图像;
[0020]
[图4](a)是悬浮培养1天后的培养基更换前的培养液中的显微镜图像,和(b)是悬浮培养1天后的培养基更换后的培养液中的显微镜图像;
[0021]
[图5](a)是用源自纤维二糖的低聚物悬浮培养5天后的培养液中的显微镜图像,(b)是用源自葡萄糖的纤维素低聚物悬浮培养5天后的培养液中的显微镜图像;
[0022]
[图6]以固定观察部位拍摄不更换培养基且培养了两天后的细胞,(a)是拍摄到的培养前的培养液中的显微镜图像,(b)是拍摄到的培养后的培养液中的显微镜图像;
[0023]
[图7](a)是使用源自纤维二糖的低聚物培养并回收到的球状体的显微镜图像,(b)使用源自葡萄糖的纤维素低聚物培养并回收到的球状体的显微镜图像。
具体实施方式
[0024]
1.悬浮培养用培养基添加剂
[0025]
本实施方式涉及的悬浮培养用培养基添加剂(以下,有时简称为培养基添加剂)含有纤维素低聚物。纤维素低聚物是非水溶性的,在水中的分散稳定性优异,因此具有保持使细胞悬浮于液体培养基中的状态的效果。因此,能够用作用于悬浮地培养细胞的添加剂。
[0026]
(a)纤维素低聚物
[0027]
纤维素低聚物是具有葡萄糖通过β-1,4糖苷键连接的结构的寡糖,也被称为纤维寡糖。纤维素低聚物可以不具有取代基,另外,例如也可以在还原末端的端基异构体位具有烷基等取代基。
[0028]
纤维素低聚物的平均聚合度(dp)(在一分子中存在的葡萄糖单元的数量的平均值)优选为5~20。平均聚合度(dp)优选为6以上,另外,优选为15以下,更优选为12以下,也可以为10以下。纤维素低聚物通常为聚合度不同的化合物的混合物,例如可以含有聚合度4~20的化合物,也可以含有聚合度5~18的化合物,也可以含有聚合度5~13的化合物。
[0029]
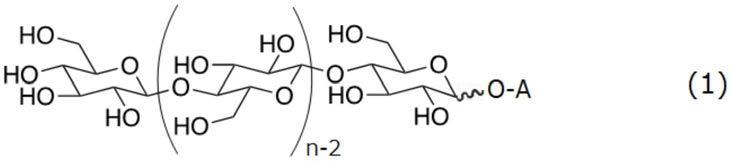
作为纤维素低聚物,优选使用由下述通式(1)表示的化合物。
[0030]
[化1]
[0031][0032]
式中,a表示氢原子或取代基。取代基是为取代氢原子而导入的基团,例如可举出碳原子数为1~12的烷基,也可以为碳原子数为1~5的烷基。另外,还原末端的一位的碳与o-a基之间的键处的波形线表示o-a基可以为α型也可以为β型。n表示平均聚合度,优选为5~20。n优选为6以上,另外优选为15以下,更优选为12以下,也可以为10以下。
[0033]
纤维素低聚物的合成方法没有特别限制。例如,可以列举出:使α-葡萄糖-1-磷酸
(以下有时称为αg1p)和选自由葡萄糖、纤维二糖及它们的衍生物构成的组中的至少一种引物与纤维糊精磷酸化酶(以下有时称为cdp)反应的方法。该反应是利用cdp的逆反应的合成法,将αg1p作为葡萄糖供体,将选自由葡萄糖、纤维二糖及它们的衍生物构成的组中的至少一种作为引物(即,葡萄糖受体),并使它们与cdp反应,从而将αg1p作为单体而逐次与引物聚合。
[0034]
例如,引物为葡萄糖时的反应如下所示。
[0035]
[化2]
[0036][0037]
另外,引物为纤维二糖时的反应如下所示。
[0038]
[化3]
[0039][0040]
需要说明的是,通过将引物中的端基异构体位的羟基的氢原子替换为烷基等取代基,从而能够合成具有由式(1)所示的各种取代基的纤维素低聚物。
[0041]
关于cdp,已知是热纤梭菌(clostridium thermocellum)、纤维胞菌(cellulomonas)属等微生物所产生,能够利用这些微生物通过公知的方法取得。例如,可以根据m.krishnareddy等人,在j.appl.glycosci.,2002年,49,1-8中所记载的方法,利用大肠杆菌表达系统来制备clostridium thermocellum ym4来源的cdp,但并不限于此。
[0042]
cdp的浓度没有特别限制,例如可以为0.1u/ml以上,也可以为0.2u/ml以上。在此,cdp的酶量例如可以基于酶活性来决定。在该情况下,例如能够将αg1p与d-( )-纤维二糖和cdp孵育,对由cdp生成的磷酸进行定量,将每1分钟使1μmol磷酸游离的酶量设为1u。
[0043]
例如,将10~1000mm的αg1p、10~200mm的引物(葡萄糖、纤维二糖及它们的衍生物)、以及0.1u/ml以上的cdp在100~1000mm的2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸(hepes)
modified eagle medium)、伊格尔极限必需培养基(emem:eagle's minimum essential medium)、αmem培养基(minimumessential medium eagle,alpha modification)、格拉斯哥极限必需培养基(gmem:glasgow minimum essential medium)、ham f12培养基(nutrientmixture f-12ham)、dmem/f12培养基(dulbecco's modified eagle medium/nutrientmixture f-12ham)、伊思柯夫改良培养基(imdm:iscove's modifieddulbecco's medium)、rpmi-1640培养基、mccoy 5a培养基(mccoy's 5amedium)等。
[0056]
作为培养基中含有的成分,没有特别限制,例如可以配合氨基酸、无机盐、葡萄糖、维生素等通常配合于培养基中的各种成分。
[0057]
培养基组合物中的纤维素低聚物的浓度没有特别限制,优选为0.01~2%(w/v),更优选为0.5~1%(w/v)。通过使纤维素低聚物的浓度为0.01%(w/v)以上,从而能够提高纤维素低聚物在培养基组合物中的分散稳定性而使细胞悬浮,通过设为0.5%(w/v)以上,能够进一步提高其效果。另外,通过为2%(w/v)以下,在用移液管等进行分注时,作为水分散液,能够容易处理。需要说明的是,在纤维素低聚物的浓度低的情况下,有时会在较短期间内分离为透明的上清液(上层)和分散有纤维素低聚物的下层这两层,但即使在该情况下,在分散有纤维素低聚物的下层也同样能够进行悬浮培养,因此也可以在这样的分离的状态下进行悬浮培养。
[0058]
作为培养基组合物的制造方法,没有特别限制。例如,在使用上述纤维素低聚物的水分散液的情况下,可以将该水分散液和液体培养基分别预先灭菌后,将两者混合而使纤维素低聚物均匀地分散在培养基组合物中。需要说明的是,也可以在培养基中添加分散细胞之后,与纤维素低聚物的水分散液混合,在该情况下,在得到培养基组合物的阶段,该培养基组合物中还含有细胞。或者,也可以将纤维素低聚物的水分散液与液体培养基混合而使纤维素低聚物均匀地分散于培养基组合物中,然后进行灭菌,由此制备培养基组合物。需要说明的是,例如如后述的实施例那样,纤维素低聚物的水分散液的灭菌也可以通过经由碱水溶液调制该水分散液从而视为灭菌处理。
[0059]
在本实施方式中,作为细胞,没有特别限制,可以是来自动物的细胞,也可以是来自植物的细胞。作为来自动物的细胞,可以举出生殖细胞、体细胞、干细胞、前体细胞、永生化细胞(细胞株)、转基因细胞等,可以使用从生物体采集或分离的细胞,根据情况还可以使用被进一步施加人为操作的细胞。干细胞是兼具自我增殖能力和分化能力的细胞,例如可以列举出胚胎干细胞(es细胞)、体干细胞(例如神经干细胞、造血干细胞、皮肤干细胞等)、人工干细胞(ips细胞)等。前体细胞是指处于从干细胞分化为特定的体细胞或生殖细胞的中途阶段的细胞。细胞株是指通过生物体外的人为操作而获得了无限增殖能力的细胞,例如可以列举出hela(来自人子宫颈癌的细胞株)等。
[0060]
本实施方式涉及的培养基组合物能够使细胞悬浮而进行培养,即能够进行悬浮培养。在此,悬浮培养是指细胞不粘接于培养容器而是以悬浮于液体培养基中的状态进行培养。在本实施方式中,优选即使在不伴随对液体的培养基组合物施加来自外部的压力或振动或者进行在该培养基组合物中的搅拌等,而是将培养基组合物静置的状态下,也能够使细胞悬浮在液体的培养基组合物中进行培养,因此,培养基组合物优选能够进行静置悬浮培养。作为在静置培养基组合物的状态下使细胞悬浮、即能够静置悬浮的时间,优选为1小时以上,更优选为24小时以上,进一步优选为48小时以上。
[0061]
培养基组合物的粘度没有特别限制,优选25℃下的粘度为5.00mpa
·
s以下,也可以为3.00mpa
·
s以下。培养基组合物的粘度越低越优选,因此下限没有特别限制,例如可以为0.50mpa
·
s以上。
[0062]
3.培养方法
[0063]
本实施方式涉及的细胞培养方法包括在上述培养基组合物中培养细胞。具体而言,只要以使细胞均匀地分散于培养基组合物中的方式进行混合,并将所得到的培养液在培养容器中培养即可。作为培养容器,没有特别限制,例如可以列举出烧瓶、培养皿、有盖培养皿、多孔板等。
[0064]
作为使细胞分散于培养基组合物中的方法,可以在制备含有纤维素低聚物的培养基组合物后,向该培养基组合物中添加细胞进行混合,或者也可以在培养基中添加细胞并混合后,向其中加入纤维素低聚物而进行混合。
[0065]
培养时,可以使培养液处于静置状态,也可以根据需要将培养液旋转、振荡或搅拌。为了减少对细胞的损伤,优选设为静置状态。在本实施方式中,利用分散于培养液中的纤维素低聚物,细胞不会仅不均地存在于培养液的底面,而是以三维的扩展的方式分散,能够进行静置悬浮培养。
[0066]
在一个实施方式中,细胞也可以通过培养而形成三维的细胞集合体(细胞彼此集合、凝聚而成的球状的细胞聚合物)即球状体。球状体的大小根据细胞种类和培养时间而不同,因此没有特别限制,例如直径可以是20~1000μm,也可以是40μm~500μm,还可以是50~300μm。
[0067]
作为培养时的温度、时间等条件,可以根据要培养的细胞而适当设定。例如,如果是动物细胞,则培养温度通常可以为25~39℃,优选为33~39℃。co2浓度通常在培养的气氛中可以为4~10体积%,优选为4~6体积%。培养时间通常为3~35天,但只要根据培养的目的适当设定即可。另外,如果是植物细胞,则培养温度通常可以为20~30℃,如果需要光,则可以为照度2000~8000勒克斯的照度条件。另外,培养时间通常为3~70天,但只要根据培养的目的适当设定即可。
[0068]
作为细胞浓度,也可以根据培养的细胞适当设定,没有特别限制,例如以播种时(即,将细胞接种于培养基组合物的阶段)的细胞浓度计,可以为1.0
×
103个/ml~1.0
×
10
10
个/ml,也可以为1.0
×
104个/ml~1.0
×
108个/ml。
[0069]
在培养中,也可以进行培养基更换。即,本实施方式涉及的细胞的培养方法可以包括:在上述培养基组合物中培养细胞的工序;以及将该培养得到的细胞与纤维素低聚物一起从培养基中分离,并将分离出的细胞和纤维素低聚物与新培养基混合,进一步进行培养的工序。作为将细胞与纤维素低聚物一起从培养基中分离的方法,例如通过离心分离使细胞和纤维素低聚物沉降,并除去作为上清液的培养基即可。通过在分离出的细胞和纤维素低聚物中添加新的培养基并混合,从而能够使细胞和纤维素低聚物在培养液中再分散。因此,能够在不添加新的纤维素低聚物的情况下悬浮培养,能够反复使用纤维素低聚物。
[0070]
本实施方式涉及的培养方法还可以包括对培养出的细胞进行回收的工序。回收是将培养出的细胞从培养液中分离的工序,例如可以通过过滤处理来进行。上述纤维素低聚物通过在培养液中分散从而将细胞保持为在培养液中具有三维扩展地分散的状态,但纤维素低聚物与细胞不结合。因此,纤维素低聚物与细胞的分离是容易的。另外,纤维素低聚物
实质上不使水分散液的粘度上升,因此培养基组合物和培养液也为低粘度。因此,能够进行基于自然过滤的过滤处理,能够减少对细胞的损伤。
[0071]
在一个实施方式中,培养出的细胞(例如球状体)比纤维素低聚物大。例如,培养优选实施至细胞比纤维素低聚物大为止。由于这样地使纤维素低聚物比培养出的细胞(球状体)小,通过使用具有比纤维素低聚物的粒径大且比培养出的细胞小的孔径的过滤器进行过滤,能够容易地将培养出的细胞从培养基和纤维素低聚物中分离、回收。
[0072]
实施例
[0073]
以下,通过实施例进一步描述本发明,但本发明并不限定于这些实施例。
[0074]
1.试剂
[0075]
α-葡萄糖-1-磷酸(αg1p)二钠水合物、dmem、青霉素-链霉素、杜氏磷酸缓冲液(dpbs)从富士胶片和光纯药工业购入。重水从默克(sigma-aldrich)购入。40质量%的氘氧化钠重水溶液从剑桥同位素实验室(cambridge isotope laboratories)购入。超纯水由milli-q系统(milli-q advantage a10、merck-millipore)供给。此外,从nacalai tesque购入特级以上的试剂并使用。
[0076]
2.实验方法
[0077]
(1)纤维素低聚物的合成
[0078]
按照“t.serizawa等,polym.j.,2016年,48,539-544”中记载的方法(使用d-葡萄糖作为引物),合成了平均聚合度为10的纤维素低聚物(来自葡萄糖)。另外,按照“t.serizawa等人,langmuir,2017年,33,13415-13422”中记载的方法(使用纤维二糖作为引物),合成了平均聚合度为7的纤维素低聚物(源自纤维二糖)。
[0079]
详细而言,将200mm的αg1p、50mm的d-葡萄糖或纤维二糖以及0.2u/ml的纤维糊精磷酸化酶(cdp)混合在500mm的2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸(hepes)缓冲液(ph 7.5)中,在60℃下孵育3天。对含有产物的反应液进行离心(15000rpm、10分钟以上、4℃),除去上清液后,加入超纯水使产物再分散,反复进行离心(同条件)操作,从而精制至上清液的取代率为99.999%以上,得到纤维素低聚物。
[0080]
产物的平均聚合度通过质子核磁共振(nmr)装置进行测定。试样是通过使冷冻干燥后的12mg以上的产物溶解于600μl的4质量%氘氧化钠重水溶液中来制备。nmr装置使用advance iii hd500(benker biospin,磁场强度:500mhz,累计次数16次)。平均聚合度基于纤维素低聚物的还原末端的端基异构体位(δ~5.1、4.5)及其之外的端基异构体位(δ~4.3)的质子的积分值来计算。
[0081]
(2)纤维素低聚物的水分散液的制备
[0082]
将1n氢氧化钠水溶液加入到在1.5ml管中冷冻干燥后的规定量的纤维素低聚物中,使其分散。将其在-20℃下孵育20分钟后恢复至室温,由此使其溶解,制备了纤维素/氢氧化钠水溶液。以氯化钠的终浓度为137mm、纤维素低聚物的终浓度在使用了源自葡萄糖、源自纤维二糖的纤维素低聚物的情况下分别为1%(w/v)、2%(w/v)的方式,将含有磷酸缓冲液(ph 7.4)的0.18n盐酸和纤维素/氢氧化钠水溶液混合,在25℃下静置1天。对含有产物的反应液进行离心(15000rpm、10分钟以上、25℃),除去上清液后,加入灭菌精制水,使产物再分散,进行离心(同条件)。通过重复该操作,精制至上清液的取代率为99.999%以上为止,得到纤维素低聚物的水分散液。
[0083]
(3)纤维素低聚物的分散稳定性评价
[0084]
将(2)中制备成的纤维素低聚物水分散液调整为1%(w/v),将得到的水分散液250μl与超纯水或2
×
dmem(2倍浓度的dmem)250μl在1ml小瓶中混合。在37℃孵育规定时间,通过目视经时地观察纤维素低聚物的分散性。进而,将孵育了3天的分散液移至1.5ml管中并进行离心(15000rpm、5分钟、25℃)后,加入超纯水或dmem500μl,在1ml小瓶中再分散。将其在37℃孵育规定时间,同样地观察分散性。
[0085]
(4)纤维素低聚物分散液的dls测定
[0086]
将(2)中制备成的纤维素低聚物水分散液调整为0.005%(w/v),将得到的水分散液80μl加入到池(cell)中,在25℃下静置3分钟后进行测定。在测定中,使用zetasizer nano zsp(malvern),设温度:25℃、散射角度:173
°
,通过以聚苯乙烯乳胶(polystyrene latex)为标准试样的累积分析算出流体力学直径。dls测定实施3次(n=3),求出其平均值。
[0087]
(5)培养基组合物的粘度测定
[0088]
将(2)中制备成的纤维素低聚物水分散液调整为1%(w/v),将1ml的所得到的水分散液和1ml的2
×
dmem在2ml管中混合。另外,将1ml的0.2%(w/v)纤维素纳米纤维水分散液(rheocrysta,第一工业制药)和1ml的2
×
dmem在2ml管中混合。对于如此制备的培养基组合物,使用音叉振动式粘度计(sv-1a、a&d、30hz),测定温度为25℃,测定粘度。
[0089]
(6)细胞培养
[0090]
hela细胞(jcrb细胞库)在含有10%fbs、100u/ml的青霉素和100μg/ml的链霉素的dmem中,在37℃、5%co2条件下在10cm培养皿中培养,传代培养至约80%汇合。传代通过以下操作实施:去除培养基、将10ml的dpbs加入到培养皿中温和搅拌。除去dpbs,加入1ml的0.5mg/ml胰蛋白酶溶液,在整个面上展开,在37℃、5%co2条件下孵育5分钟。加入9ml的dmem使其悬浊,向新的培养皿中转移0.3~1ml,以总量为10ml的方式加入dmem并且温和地搅拌,在37℃、5%co2条件下进行培养。
[0091]
(7)使用纤维素低聚物分散液的悬浮培养
[0092]
将在(6)中传代时没有使用的细胞悬浊液移至15ml管中,进行离心(500rpm、3分钟)。除去上清液后,加入10ml的2
×
dmem并使其悬浊,反复进行3次离心(条件相同)的操作。将以1:1(体积比)混合了细胞悬浊液和0.4%的台盼蓝溶液而得到的溶液应用于血球计数盘,并对活细胞数进行计数,用2
×
dmem稀释成细胞浓度成为1.0
×
105个/ml。在96孔板中混合50μl的细胞悬浊液和50μl的纤维素低聚物水分散液,在37℃、5%co2条件下孵育规定时间。作为纤维素低聚物水分散液,将(2)中制备成的物质调整为1.0%(w/v)加以使用。培养基更换按每天通过以下的操作实施:将细胞培养液移至1.5ml管中,添加1ml的dmem,进行离心(200g、5分钟、25℃)。除去上清液后,加入dmem使总量成为100μl并进行再分散,转移到96孔板中。细胞的形态通过荧光显微镜(zoe荧光单元成像仪、bio-rad)的明视野模式进行观察。在将观察部位固定时,在96孔板的底面标注记号,使显微镜的高度固定进行观察。
[0093]
(8)培养出的细胞的回收
[0094]
将按照(7)悬浮培养5天后的细胞培养液转移至1.5ml管中,添加1ml的dpbs使其分散。将分散液利用尼龙制网过滤器(孔径40μm、funakoshi)进行过滤。通过从过滤器的相反侧流动200μl的dpbs,从而将残留在过滤器上的细胞回收到96孔板中,并利用荧光显微镜(zoe荧光单元成像仪、bio-rad)的明视野模式对其形态进行了观察。
[0095]
3.结果和考察
[0096]
(1)纤维素低聚物的分散稳定性评价结果
[0097]
将使纤维素低聚物分散于超纯水中和血清培养基(dmem)中并静置了规定时间时的外观示于图1。尽管在静置了3天时观察到若干沉降,但无论使用哪种纤维素低聚物的情况,均在超纯水中很好地分散。另外,可知即使在血清培养基中,纤维素低聚物也很好地分散,即使在蛋白质或无机盐等各种物质共存的溶液中也能够稳定地分散。还发现,在对静置3天后的纤维素低聚物分散液进行离心并使其再分散而再次孵育的情况下,纤维素低聚物也很好地分散,即使在离心、再分散后也能够维持纤维素低聚物的分散性。
[0098]
在图1中,“源自cel(dmem)”是指将源自纤维二糖的纤维素低聚物分散于血清培养基中而成的分散液,“源自cel(milliq)”是指使源自纤维二糖的纤维素低聚物分散于超纯水中而成的分散液。“源自glc(dmem)”是指使源自葡萄糖的纤维素低聚物分散于血清培养基中而成的分散液,“源自glc(milliq)”是指使源自葡萄糖的纤维素低聚物分散于超纯水中而成的分散液。
[0099]
(2)纤维素低聚物的dls测定结果
[0100]
将纤维素低聚物分散液(源自纤维二糖)的dls测定的结果示于图2。观测到作为主成分的602nm、作为副成分5719nm这2个粒径的峰。最大强度的粒径为602nm。可知通过基于中和的自组织化而生成的纤维素集合体具有亚微米至几微米左右的粒径。
[0101]
(3)培养基组合物的粘度测定结果
[0102]
对使纤维素低聚物分散于dmem中而成的溶液的粘度进行测定。悬浮培养中使用的含有0.5%(w/v)浓度的源自葡萄糖、源自纤维二糖的纤维素低聚物的培养基组合物中,分别为1.64
±
0.2、2.82
±
0.06mpa
·
s的粘度。对于天然来源且含有0.1%(w/v)的作为更高分子量的纤维素集合体的纤维素纳米纤维的培养基组合物,为2.99
±
0.34mpa
·
s的粘度。含有纤维素低聚物的培养基组合物尽管具有更高的浓度,但与含有纤维素纳米纤维的培养基组合物相比,粘度相同或更低。
[0103]
(4)悬浮培养结果
[0104]
将使用源自纤维二糖的纤维素低聚物培养细胞1天时的培养液中的显微镜图像示于图3。可知由于在1天后细胞也不沉降而是在培养液中能够观察到,因此通过使用含有纤维素低聚物的培养基,能够将细胞在培养液中三维地保持、培养。
[0105]
另外,如上所述培养1天后,进行利用了离心、再分散的培养基更换。将培养基更换前后的培养液中的显微镜图像示于图4。其结果,可知,在培养基更换后,细胞也能够保持在培养液中,能够在不添加新的纤维素低聚物的情况下进行培养基更换。
[0106]
将使用源自葡萄糖、源自纤维二糖的纤维素低聚物培养5天时的培养液中的显微镜图像示于图5。无论在使用了哪种纤维素低聚物的分散液的情况下,均观察到了细胞增殖而形成球状体(细胞的凝集块)的情形,由此可知细胞以悬浮状态增殖。
[0107]
对于使用源自纤维二糖的纤维素低聚物进行2天细胞培养而得到的细胞,将在培养基更换之后的2天不进行培养基更换而培养出的细胞以使培养前后的观察部位固定的方式进行观察时的显微镜图像示于图6。由于在培养前后在相同的部位观察到细胞的凝集块,因此可知细胞在培养过程中不移动,而是保持在相同的位置而增殖,由此形成球状体。
[0108]
由以上结果可知,纤维素低聚物的分散液能够用于细胞的悬浮培养。
[0109]
(5)培养细胞的回收结果
[0110]
将对培养出的hela细胞的球状体进行回收后的显微镜图像示于图7。图7(a)是使用了源自纤维二糖的纤维素低聚物的图,图7(b)是使用了源自葡萄糖的纤维素低聚物的图,是回收后沉降到板底面的球状体的显微镜图像。培养后的分散液可以通过稀释并利用移液器操作使其分散从而自然过滤。因此,通过使用具有比培养出的球状体小、且比纤维素低聚物集合体大的孔径(40μm)的筛网过滤器进行过滤,能够仅将球状体分离到过滤器上,并进行回收。
[0111]
以上,说明了本发明的若干实施方式,但这些实施方式仅作为示例而给出,并非用于限定发明的范围。这些实施方式能够以其他各种方式实施,在不脱离发明的主旨的范围内,能够进行各种省略、替换、变更。这些实施方式及其省略、置换、变更等包含在发明的范围或主旨中,同样包含在权利要求书所记载的发明及其等同的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。