1.本发明属于微生物技术领域,具体为一种植物乳杆菌胞外多糖的制备方法及其应用。
背景技术:
2.乳酸菌一类革兰氏阳性非产孢细菌,在自然界中广泛存在。乳酸菌是常见的益生菌,许大量研究表明,益生菌具有加强肠道黏膜屏障、阻止病原菌的黏附和定植、增强机体免疫功能等多种生理功能。同时有研究发现,乳酸菌发挥益生作用,可能和其在生长代谢过程中产生的细菌素、胞外多糖及超氧化物歧化酶等物质有关。植物乳杆菌是乳酸菌中常见的一种。乳酸菌胞外多糖是乳酸菌在生长代谢过程中分泌到胞外的一种多糖类高分子化合物。按照乳酸菌胞外多糖与菌体依附关系的不同可以分为黏液多糖和荚膜多糖。黏液多糖是分泌到细胞壁外的胞外多糖,而荚膜多糖依附于细胞壁。按照主链聚合物单糖类型可以分为同型多糖和异型多糖,同型多糖由单一单糖类型组成;异型多糖由一种以上单糖类型组成。已有研究证实,乳酸菌产生的胞外多糖具有抗氧化、调节免疫、抗肿瘤、调节肠道菌群平衡、降血压、降胆固醇等多种生物活性。同时胞外多糖基本无细胞毒性,具有广阔的应用前景。其中,关于具有免疫调节活性的乳酸菌胞外多糖的研究受到广泛关注,乳酸菌胞外多糖通常通过增强细胞介导的免疫反应,如提高单核细胞吞噬能力、提高nk细胞的杀伤作用,促进t/b淋巴细胞增殖、分泌细胞因子等,从而增强宿主的免疫防护作用。研究发现,不同菌株产生的胞外多糖受到单糖组成、分子量、功能团、所带电荷等多方面因素的影响,其生物活性差别很大。同时由于乳酸菌具有菌株特异性,不同菌株产生的多糖差异性很大,不同的多糖具有各自特定的功能。
3.因此,此研究新分离菌株的胞外多糖的结构及免疫活性很有必要,对于解析eps结构与功能的关系,开发功能性食品和饲料,扩展胞外多糖在食品、药品和化妆品行业的应用具有重要意义。
技术实现要素:
4.本发明的目的就在于为了解决上述问题而提供一种植物乳杆菌胞外多糖的制备方法及其应用,解决了背景技术中提到的问题。
5.为了解决上述问题,本发明提供了一种技术方案:
6.一种植物乳杆菌胞外多糖的制备方法,包括以下步骤:
7.s1、菌种活化:将植物乳杆菌pa01活化后得到种子发酵液;
8.s2、扩大培养:将步骤s1中的种子发酵液按体积比3:100接入扩大培养基中,静置培养,得到发酵液;
9.s3、除菌体:将步骤s1中的发酵液离心,除去菌体沉淀,保留上清液;
10.s4、除蛋白:向步骤s3中所得上清液中加入三氯乙酸试剂,4℃过夜,经离心,保留上清液;
11.s5、醇沉:向步骤s4中所得上清液中加入乙醇,静置后离心取沉淀,收集沉淀溶于水得到粗多糖液,并将粗多糖液进行透析冻干,得到粗胞外多糖;
12.s6、将步骤s5中的粗胞外多糖配置成30mg/ml溶液,经deae-cellulose52离子交换柱洗脱,其中,洗脱液为0.1mol/l nacl溶液,然后再减压浓缩,经过真空冷冻干燥,得到胞外多糖冻干粉。
13.作为优选,所述步骤s2中的培养条件为:ph为6.2-6.8,发酵温度34
±
3℃,接种量3%,发酵时间为36h。
14.作为优选,所述步骤s5中的上清液与乙醇的体积比为1:3。
15.作为优选,所述步骤s5中的粗多糖液与sevag试剂的体积比为25:1。
16.作为优选,所述步骤s5中的乙醇为95%的乙醇。
17.作为优选,所述胞外多糖冻干粉中的单糖组成为甘露糖:葡萄糖:半乳糖:阿拉伯糖:氨基葡萄糖=74.06:14.53:6.16:3.41:1.84。
18.作为优选,所述胞外多糖冻干粉中的糖苷键为t-manp、
→
2,6)-manp-(1
→
、
→
2)-manp-(1
→
、
→
2)-glcp-(1
→
、3-glcp-(1
→
和
→
6)-manp-(1
→
,含量分别为36.186%、25.953%、10.589%、5.295%、4.534%、4.235%。
19.该植物乳杆菌胞外多糖的应用方式是,植物乳杆菌pa01胞外多糖在制备免疫增强剂中的应用。
20.与现有技术相比,本发明的有益效果是:本发明通过将植物乳杆菌pa01活化,接种至液体发酵培养基进行扩大发酵培养,获得发酵液,并对发酵液进行除菌体、除蛋白、醇沉、透析,并经离子交换柱洗脱,得到胞外多糖,其具有新的结构,组分均一,并且其具有良好的免疫调节效果。
附图说明:
21.为了易于说明,本发明由下述的具体实施及附图作以详细描述。
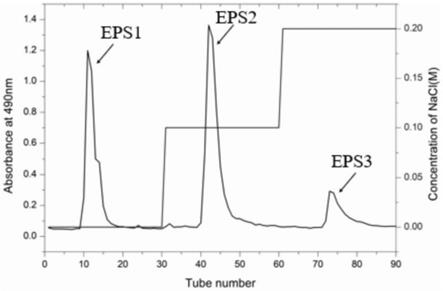
22.图1是本发明植物乳杆菌pa01胞外多糖的deae-cellulose 52离子交换柱洗脱曲线;
23.图2是本发明植物乳杆菌pa01胞外多糖的gpc高效液相色谱图;
24.图3是本发明植物乳杆菌pa01胞外多糖单糖组成离子色谱图;
25.图4是本发明植物乳杆菌pa01胞外多糖的红外光谱图;
26.图5是本发明植物乳杆菌pa01胞外多糖在2μm比例下的扫描电镜图;
27.图6是本发明植物乳杆菌pa01胞外多糖在10μm比例下的扫描电镜图;
28.图7是本发明植物乳杆菌pa01胞外多糖的的1h nmr谱图;
29.图8是本发明植物乳杆菌pa01胞外多糖的
13
c nmr谱图;
30.图9是本发明植物乳杆菌pa01胞外多糖的h-h cosy图谱;
31.图10是本发明植物乳杆菌pa01胞外多糖的hsqc图谱;
32.图11是本发明植物乳杆菌pa01胞外多糖的hmbc图谱;
33.图12是本发明植物乳杆菌pa01胞外多糖的noesy图谱;
34.图13是本发明植物乳杆菌pa01胞外多糖对raw264.7增殖的影响示意图;
35.图14是本发明植物乳杆菌pa01胞外多糖对raw264.7吞噬能力的影响示意图;
36.图15是本发明植物乳杆菌pa01胞外多糖对raw264.7分泌no的影响示意图;
37.图16是本发明植物乳杆菌pa01胞外多糖对raw264.7细胞因子mrna表达的影响示意图(其中,a:tnf-α;b:il-6;c:il-1β);
38.图17是本发明研究植物乳杆菌pa01胞外多糖对环磷酰胺(cy)诱导免疫抑制小鼠脾脏指数的影响(*p《0.05,**p《0.01与nc空白组相比,#p《0.05,##p《0.01与cy模型组相比统计学意义上的有显著差异,置信区间取95%);
39.图18是本发明利用研究植物乳杆菌pa01胞外多糖对环磷酰胺(cy)诱导免疫抑制小鼠脾脏形态结构的影响示意图。
具体实施方式:
40.如图1-18所示,本具体实施方式采用以下技术方案:
41.实施例:
42.一种植物乳杆菌胞外多糖的制备方法,包括以下步骤:
43.s1、菌种活化:将植物乳杆菌pa01活化后得到种子发酵液;
44.s2、扩大培养:将步骤s1中的种子发酵液按体积比3:100接入扩大培养基中,静置培养,得到发酵液,其中培养条件为:ph为6.2-6.8,发酵温度34
±
3℃,接种量3%,发酵时间为36h;
45.s3、除菌体:将步骤s1中的发酵液离心,除去菌体沉淀,保留上清液;
46.s4、除蛋白:向步骤s3中所得上清液中加入三氯乙酸试剂,4℃过夜,经离心,保留上清液;
47.s5、醇沉:向步骤s4中所得上清液中加入乙醇,静置后离心取沉淀,收集沉淀溶于水得到粗多糖液,并将粗多糖液进行透析冻干,得到粗胞外多糖,其中上清液与乙醇的体积比为1:3,并且乙醇为95%的乙醇,同时粗多糖液与sevag试剂的体积比为25:1;
48.s6、将步骤s5中的粗胞外多糖配置成30mg/ml溶液,经deae-cellulose52离子交换柱洗脱,其中,洗脱液为0.1mol/l nacl溶液,然后再减压浓缩,经过真空冷冻干燥,得到胞外多糖冻干粉,所述胞外多糖冻干粉中的单糖组成为甘露糖:葡萄糖:半乳糖:阿拉伯糖:氨基葡萄糖=74.06:14.53:6.16:3.41:1.84,所述胞外多糖冻干粉中的糖苷键为t-manp、
→
2,6)-manp-(1
→
、
→
2)-manp-(1
→
、
→
2)-glcp-(1
→
、3-glcp-(1
→
和
→
6)-manp-(1
→
,含量分别为36.186%、25.953%、10.589%、5.295%、4.534%、4.235%。
49.该植物乳杆菌胞外多糖的应用方式是,植物乳杆菌pa01胞外多糖在制备免疫增强剂中的应用。
50.以下通过具体实施例来说明本发明的有益效果:
51.实施例1:植物乳杆菌pa01胞外多糖分离和分子量测定
52.固体培养基配方为:1000ml蒸馏水中加入蛋白胨10.0g,葡萄糖20.0g,牛肉膏10.0g,酵母粉5.0g,乙酸钠5.0g,磷酸氢二钾2.0g,柠檬酸三钠2.0g,mgso40.58g,mnso40.153g,吐温801.0ml,琼脂15g。
53.种子培养基配方为:1000ml蒸馏水中加入蛋白胨10.0g,葡萄糖20.0g,牛肉膏10.0g,酵母粉5.0g,乙酸钠5.0g,磷酸氢二钾2.0g,柠檬酸三钠2.0g,mgso40.58g,mnso40.153g,吐温801.0ml。
54.发酵培养基配方为:1000ml蒸馏水中加入蛋白胨19.0g,葡萄糖15g,牛肉膏10.0g,酵母粉5.0g,乙酸钠5.0g,磷酸氢二钾2.0g,柠檬酸三钠2.0g,mgso40.58g,mnso40.153g,吐温801.0ml。
55.(1)菌种活化:将植物乳杆菌pa01菌液涂于固体培养基上放入霉菌培养箱在37℃条件下静态培养48h,待其生长后挑取单独菌落于液体培养基中,反复活化2-3次得到种子发酵液;(2)扩大培养:将上述种子发酵液按体积比3:100接入发酵培养基中,霉菌培养箱中培养,得到植物乳杆菌pa01发酵液;培养条件为:发酵培养基初始ph为6.5,发酵温度37℃,接种量3%,发酵时间36h;
56.(3)除菌体:将植物乳杆菌pa01发酵液离心(8000rpm,20min),除去菌体沉淀,保留上清液;
57.(4)除蛋白:向步骤(3)中所得的粗多糖液加入三氯乙酸试剂(粗多糖液:三氯乙酸试剂=25:1,v/v),4℃过夜,经离心(8000rpm,20min),保留上清液;
58.(5)醇沉:向步骤(4)中所得上清液加入95%乙醇(上清液:95%乙醇=1:3,v/v),4℃静置过夜,离心取沉淀(10000rpm,30min),收集沉淀溶于水得粗多糖液;将粗多糖液进行透析冻干,得到粗胞外多糖;
59.(6)deae-cellulose 52离子交换柱分离纯化:将上述步骤(5)后的胞外多糖,配置成30mg/ml溶液,取10ml加样于deae-cellulose 52离子交换柱中,依次用去离子水、0.1mol/l nacl溶液、0.2mol/l nacl溶液均以流速为1.0ml/min下进行梯度洗脱,每管收集9ml,每个组分收集30管,采用苯酚-硫酸法跟踪检测多糖含量,如图1所示,依次获得eps1,eps2,epsp3等三个组分。收集0.1mol/l nacl溶液洗脱的组分(eps2),减压浓缩,用去离子水透析2d,收集透析液,真空冷冻干燥,得到干燥的胞外多糖。
60.步骤(6)经deae-cellulose 52离子交换柱收集获得eps1为中性胞外多糖。eps3多糖含量较少,因而未进行后续研究。
61.(7)分子量测定:采用凝胶色谱法测定eps2分子量,使用配置waters 515泵、激光检测器(ls)及示差检测器(dri)的wyatt eleos system凝胶色谱仪进行检测。多糖样品溶于超纯水,经0.22um滤膜过滤,上机检测。检测条件:检测器为激光检测器和示差检测器,流动相为水 0.02%nan3,色谱柱为shodex ohpak系列sb-806与sb-803串联,柱温40℃,进样量为500μl,流速1ml/min。
62.由图2可知,多糖组分eps2经凝胶色谱仪的双检测器检测后均呈现单一对称峰,说明eps2均为单一多糖,可进一步进行单糖组成成分的测定。计算植物乳杆菌pa01胞外多糖的分子量为7.334
×
104g/mol。
63.实施例2:植物乳杆菌pa01胞外多糖单糖组成分析标准品的配制:
64.准备标准品与试剂,如表1所示。
65.表1标准品与试剂信息
[0066][0067][0068]
在ep管中加入8ml无菌水,依次加入岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、甘露糖醛酸、古罗糖醛酸、氨基半乳糖、氨基葡萄糖各100mg,溶解后定容至10ml得到10mg/ml的母液。稀释100倍,制备成100μg/ml工
作液,将取上述溶液按照以下梯度稀释,装入1.5ml的ep管中。各单糖混标梯度浓度信息(μg/ml)如表2所示。
[0069]
表2单糖混标梯度浓度信息(μg/ml)
[0070][0071][0072]
样品前处理:处理实施例1步骤(6)的植物乳杆菌pa01胞外多糖,具体步骤如下:取干净的色谱瓶,精确称量多糖样品5mg(
±
0.05mg),加入1ml 2m tfa酸溶液,105℃加热6小时。通氮气,吹干。加入甲醇清洗,再吹干,重复甲醇清洗2-3次。加入无菌水溶解,转入色谱
瓶中待测。
[0073]
分析检测:色谱系统采用的是thermo ics5000离子色谱系统(ics5000,(thermo fisher scientific,usa),利用电化学检测器对单糖组分进行分析检测。采用dionex
tm carbopac
tm pa10(250*4.0mm,10um)液相色谱柱;进样量为5ul。流动相a(0.1m naoh),流动相b(0.1m naoh,0.2m naac),流速0.5ml/min;柱温为30℃;洗脱梯度:0min a相/b相(95:5v/v),30min a相/b相(80:20v/v),30.1min a相/b相(60:40v/v),45min a相/b相(60:40v/v),45.1min a相/b相(95:5v/v),60min a相/b相(95:5v/v)。
[0074]
表3单糖含量及摩尔比
[0075]
外多糖组成摩尔比为甘露糖(man):葡萄糖(glu):半乳糖(gal):阿拉伯糖(ara):氨基葡萄糖(glun)=74.06:14.53:6.16:3.41:1.84。
[0076]
实施例3:植物乳杆菌pa01胞外多糖红外光谱分析采用溴化钾压片法,称取实施例1步骤(6)制得的植物乳杆菌pa01胞外多糖加入kbr粉末,用压片机压成均匀的薄片,采用thermo fisher nicolet is5型傅里叶变换红外光谱仪在4000-400cm-1
范围内进行红外光谱扫描,记录谱图。图4可知,3395.45处出现宽而强的吸收峰,表明存在大量羟基;2930.43处出现的小尖峰是c-h键伸缩振动的结果,1400~1200cm-1
处是c-h的变角振动,与2930.43cm-1
处的c-h的伸缩振动构成了糖环的特征吸收,以上这些特征吸收峰是多糖类物质的一般特征,说明该物质为糖类物质。1647.13cm-1
处的吸收峰是由c=o非对称伸缩振动引起的,1410.20cm-1
处的吸收峰为糖环c-h的弯曲振动吸收峰,1131.34cm-1
和1051.72cm-1
是吡喃糖苷的特征吸收峰,这两处的吸收是c-o-c结构中c-o键或c-o-h的弯曲振动,812.47cm-1
处的吸收为甘露糖存在的特征吸收。
[0077]
实施例4:植物乳杆菌pa01胞外多糖表观形态分析
[0078]
扫描电镜是目前常用的观察多糖形貌和判定多糖种类的方法,具有操作简单、结果直观和分辨率高的优点。取充分干燥的实施例1步骤(6)植物乳杆菌pa01胞外多糖组分,取少量涂抹于导电胶上,喷金后采用扫描电镜观察其表面形态。由图5和图6可知,植物乳杆菌pa01胞外多糖为不规则片状结构,表面粗糙的并具有多孔结构和较小的球形碎片。
[0079]
实施例5:植物乳杆菌pa01胞外多糖甲基化和核磁分析
[0080]
(1)甲基化及gc-ms分析
[0081]
准备标准品与试剂,如表4所示。
[0082]
表4标准品与试剂信息
[0083][0084]
[0085]
多糖样品衍生化:称取10mg实施例1步骤(6)植物乳杆菌pa01胞外多糖,加入1ml一级水溶解后加入1ml 100mg/ml碳二亚胺,反应2h。加入1ml 2m的咪唑,将样品平均分为两份,分别加入1ml 30mg/ml的nabh4和1ml 30mg/ml的nabd4,反应3h。加入100μl冰醋酸终止反应。透析样品48h,透析完成后冷冻干燥样品。冻干样品中加入500μl dmso溶解。加入1mg naoh,孵育30min。加入50μl碘甲烷溶液反应1h。加入1ml水和2ml二氯甲烷,涡旋混匀,离心,弃水相。重复水洗3次。吸取下层二氯甲烷相并蒸干。加入100μl 2m tfa,121℃反应90min。30℃蒸干。加入50μl 2m氨水,50μl 1m nabd4,混匀,室温下反应2.5h。加入20μl乙酸终止反应,氮气吹干,250μl甲醇洗两次,氮气吹干。加入乙酸酐250μl,涡旋混匀,100℃反应2.5h。加入1ml水静置10min。加入500μl二氯甲烷,涡旋混匀,离心,弃水相。重复水洗3次。取下层二氯甲烷相,上机检测。气质联用色谱分析:分析仪器为安捷伦公司(agilent technologies inc.ca,uas)的7890a-5977b气质联用仪。色谱系统采用的是agilent气象色谱系统(agilent 7890a;agilent technologies,usa),进样量为1μl,分流比10:1,载气为高纯氦气;柱温的初始温度为140℃,保持2.0min,以3℃/min程序升温至230℃,保持3min。
[0086]
质谱系统采用的是美国aiglent公司的四极杆质谱检测系统(agilent5977b;agilent technologies,usa),配有电子轰击离子源(ei)和masshunter工作站。采用电子轰击离子源(ei),分析物在全扫描(scan)模式下进行检测,质量扫描范围(m/z):30-600。
[0087]
植物乳杆菌pa01胞外多糖的甲基化分析如表5所示。
[0088]
植物乳杆菌pa01胞外多糖的甲基化分析如表5所示。
[0089]
表5胞外多糖的甲基化及gc-ms分析表
[0090]
[0091]
[0092][0093]
由表6中可得,植物乳杆菌pa01胞外多糖主要的糖苷键的连接方式包括t-man(p)、2,6-man(p)、2-man(p)、2-glc(p)、3-glc(p)和6-man(p),并且它们的含量为比为36.186%、25.953%、10.589%、5.295%、4.534%、4.235%。
[0094]
(2)核磁共振分析
[0095]
分别称取适量实施例1步骤(6)所制备的植物乳杆菌pa01胞外多糖溶解至500uld2o中,配置成浓度大于等于30mg/ml多糖饱和溶液。将溶解后溶液加入至核磁管中,加入量3.5-4cm。将核磁管放入bruker av iii-500核磁仪中扫描一维h谱、c谱,二维h-h cosy、hmqc、hmbc、noesy谱图。
[0096]
植物乳杆菌pa01胞外多糖的1h nmr图谱如图7所示。植物乳杆菌pa01胞外多糖1h nmr谱图显示其存在6个异头质子信号,化学位移分别为4.4、5.05、5.01、4.69、4.5、5.4ppm,表明植物乳杆菌pa01胞外多糖链中可能包含6种糖残基。如图8
13
c nmr谱可知植物乳杆菌pa01胞外多糖共有6个异头碳信号,说明它含有6种糖苷键类型,化学位移分别为104.56、107.49、102.3、102.16、103.7、102.6,结合甲基化与氢谱碳谱相关文献可推出测其含β-d-manp(1
→
、
→
2,6)-α-d-manp(1
→
、
→
2)-β-d-manp(1
→
、
→
2)-β-d-glcp(1
→
、
→
3)-β-d-glcp(1
→
、
→
6)-α-d
‑‑
manp(1
→
,多糖的可能结构为主链由
→
2,6)-α-d-manp(1
→
,
→
6)-α-d
‑‑
manp(1
→
和β-d-manp(1
→
组成,支链连接在主链
→
2,6)-α-d-manp(1
→
的c6上。
[0097]
实施例6:植物乳杆菌pa01胞外多糖对raw264.7细胞增殖和吞噬能力的影响
[0098]
(1)采用cck8法测定胞外多糖对raw264.7细胞增殖的影响
[0099]
用新鲜的dmem细胞培养液调整细胞浓度为1
×
105个/ml,每孔100μl接入96孔板中,细胞贴壁后加入有药品的dmem细胞培养液替换原培养液。实验设control组(dmem培养液)、eps组(eps2浓度均为50μg/ml、100μg/ml、200μg/ml、400μg/ml)、阳性对照组(lps,1μg/ml),每组设5个重复。37℃,5%co2培养箱中培养24h。培养结束后,吸去旧的培养基,每孔加入100μl含10%cck8的细胞培养液,避光,放入co2培养箱中继续培养30min;在450nm下检测各孔od值,按下面的公式计算细胞相对增殖率。
[0100][0101]
如图13,植物乳杆菌pa01胞外多糖在浓度为50μg/ml、100μg/ml、200μg/ml和400μg/ml时均能显著刺激巨噬细胞raw264.7增殖(p《0.05),且呈剂量依赖性。
[0102]
(2)采用中性红法测定胞外多糖对raw264.7细胞吞噬能力的影响
[0103]
用新鲜的dmem细胞培养液调整细胞浓度为1
×
105个/ml,按每孔100μl细胞悬液接种于96孔板中,细胞贴壁后,弃掉原培养基,加入含有药品的dmem细胞培养液。实验分组同实施例6(1),每组设6个重复。37℃,5%co2培养箱中培养24h;弃去孔内的上清培养液,然后避光条件下,加入0.1%的中性红-pbs溶液,置于37℃,5%co2培养箱中孵育1h;孵育结束后,弃去上清液,室温下pbs洗三遍。然后向各孔中加入裂解液(乙酸:无水乙醇=1:1)避光静置,待细胞完全裂解之后,使用酶标仪在540nm波长处测定各孔的吸光度值。如图14,
[0104]
不同浓度植物乳杆菌pa01胞外多糖刺激巨噬细胞raw264.7在24h后,其吞噬中性红的能力均显著提高,与空白对照组相比,差异均具有统计学意义(p《0.05)。
[0105]
实施例7:植物乳杆菌pa01胞外多糖对raw264.7细胞分泌no的影响
[0106]
用新鲜的dmem细胞培养液调整细胞浓度为1
×
105个/ml,按每孔100μl细胞悬液接种于96孔板中,向贴壁的细胞中加入浓度为50μg/ml、100μg/ml、200μg/ml和400μg/ml的eps2培养液100μl,37℃,5%co2培养箱中培养24h;收集上清,根据no试剂盒测定。如图15所示,植物乳杆菌pa01胞外多糖在50-400μg/ml的浓度下能够显著刺激raw264.7细胞分泌no(p《0.01),并且呈明显的剂量效应关系。
[0107]
实施例8:植物乳杆菌pa01胞外多糖对raw264.7细胞因子mrna表达的影响
[0108]
取对数生长期的细胞接种于24孔细胞培养板中,每孔加01.5ml。于37℃,5%co2培养箱中培养4h后,吸去上清液,每孔分别加入0.5mldmem培养基(空白对照组)、浓度分别为100、250、500、1000μg/ml)、1μg/ml lps(阳性对照组)。孵育反应24h后,吸去上清液,加入4℃ pbs缓冲液洗2遍细胞,加入trizol,反复吹打混匀,使细胞充分裂解。提取总rna,按照rna逆转录说明书,将总rna逆转录为cdna后,再用cdna为模板进行扩增反应。采用2-δδct
法进行样品的目的基因的相对定量结果分析。如图16所示,与空白对照组相比,各浓度植物乳杆菌pa01胞外多糖均能显著提高raw264.7细胞tnf-α、il-6和il-1βmrna表达水平。
[0109]
实施例9:植物乳杆菌pa01胞外多糖对环磷酰胺(cy)诱导免疫抑制小鼠脾脏指数的影响
[0110]
balb/c小鼠,雄性,6~8周龄。所有小鼠被标准饲料适应(23~25℃和12h的光/暗周期)7天。将24只小鼠随机分为4组(n=6/组)。正常对照组(nc):每日腹腔注射生理盐水,共10天;环磷酰胺模型对照组(cy):每日腹腔注射生理盐水;共10天,并从第7天开始同时腹
腔注射环磷酰胺溶液(80mg/kg);植物乳杆菌pa01胞外多糖组(eps2):每日用腹腔注射eps2溶液(50mg/kg),共10天;植物乳杆菌pa01胞外多糖 环磷酰胺组(eps2 cy):每日用腹腔注射eps2溶液(50mg/kg),共10天,并从第7天开始同时腹腔注射环磷酰胺生理盐水溶液(80mg/kg)。末次处理24h后,所有小鼠称重,采用脱颈法所有小鼠,摘除脾脏,称重,计算器官指数。如图17所示,与环磷酰胺模型组和正常对照组相比,植物乳杆菌pa01胞外多糖组脾脏指数显著提高。环磷酰胺模型组脾脏指数较正常对照组显著降低,环磷酰胺 植物乳杆菌pa01胞外多糖组脾脏指数显著高于环磷酰胺模型组。
[0111]
实施例10:植物乳杆菌pa01胞外多糖对环磷酰胺(cy)诱导免疫抑制小鼠脾脏指数的影响
[0112]
实例9所得脾脏称重后,取部分置于4%多聚甲醛固定液中固定24小时,经过脱水、包埋、切片、染色、封片等步骤制成he染色切片,于显微镜下观察并拍照。如图18所示,正常对照组和植物乳杆菌pa01胞外多糖组脾脏组织结构完整,红髓和白髓界限清晰,细胞排列紧密有序;环磷酰胺模型组脾脏红髓和白髓界限,细胞排序杂乱,环磷酰胺 植物乳杆菌pa01胞外多糖组脾脏组织形态得到较大的改善,红髓和白髓界限清晰。
[0113]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
