pqs和霍氏肠杆菌的组合在抑制藻类生长繁殖中的应用
技术领域
1.本发明属于微生物技术领域,具体涉及pqs和霍氏肠杆菌的组合在抑制藻类生长繁殖中的应用。
背景技术:
2.近年来,由于废水和污水中含有大量的氮、磷等元素,导致了水体中微藻、蓝藻、绿藻、硅藻等有害藻类的生长,这些有害藻类可以使水体自净能力逐渐丧失,破坏自然景观,造成水生动物的死亡,甚至危害人类的健康。因此藻类的治理成为了水污染治理中所面临的主要问题。
3.控制藻类的常用方法有物理法、化学法和生物法。物理法主要是通过机械筛分、强制截留和过滤除藻等方法进行除藻,常用微滤机、活性炭吸附、超声波等方法。但是其缺点是投资大、能耗大且难以从根本上解决藻类再生的问题。化学法是加入除藻剂(化学氧化剂、化学盐类)来达到除藻的目的,常用的除藻化学物质包括al2(so4)3、cuso4、agno3、agbio3、nabio3、h2o2、kmno4、clo2等,化学除藻具有操作方法简单,而且效果显著的优点,但是化学除藻中存在二次污染。生物法主要采用微生物预防治理、陆生或水生植物抑制等,其主要是利用了各生物制剂对环境中营养、水分和光的竞争或者释放化学物质使得藻类生长受到抑制。具有成本低、无污染、易降解、环境友好的优点。但是目前生物除藻中可用的溶藻细菌的种属单一,因此限制了溶藻细菌的溶藻效果,进而限制了生物除藻的应用。
4.因此,开发一种能够改善溶藻细菌对藻类的处理能力的方法对于水体污染治理和生态环境的保护具有重要的意义。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出了pqs和霍氏肠杆菌的组合在抑制藻类生长繁殖中的应用,本发明中的溶藻菌剂中的3,4-二羟基-2-庚基-喹诺酮(pqs)本身并不具有溶藻和抑藻的功能,通过pqs和霍氏肠杆菌f2的协同配合作用,可以提高霍氏肠杆菌f2的抑藻效果,抑藻率高达83.81%;此外,pqs的加入在不影响霍氏肠杆菌f2的生物量的同时可以显著降低藻液中的叶绿素a含量,可以显著提高藻液中活性氧(ros)的活力,从而能有效控制水华的泛滥,在水体富营养化治理中具有较大的应用前景。
6.本发明的第一方面,提供了一种溶藻菌剂,所述溶藻菌剂中包括霍氏肠杆菌和pqs。
7.根据本发明第一方面的内容,在本发明的一些实施方式中,所述霍氏肠杆菌为霍氏肠杆菌f2。
8.在本发明的一些优选实施例中,该霍氏肠杆菌f2的ncbi id为5476961,genbank序列编号为cp047570.1,具体信息可参见https://www.ncbi.nl.nih.gov/assembly/gcf_009905155.1/。
9.在本发明的一些优选实施例中,所述溶藻菌剂中pqs的终浓度是2μmol/l~200μmol/l。
10.在本发明的一些更优选实施例中,所述溶藻菌剂中pqs的终浓度是4μmol/l~100μmol/l。
11.在本发明的一些更优选实施例中,所述溶藻菌剂中pqs的终浓度是6μmol/l~50μmol/l。
12.在本发明的一些更优选实施例中,所述溶藻菌剂中pqs的终浓度是8μmol/l~30μmol/l。
13.在本发明的一些优选实施方式中,所述藻类包括铜绿微囊藻。
14.当然,本领域的技术人员根据实际使用需求,将该溶藻菌剂用于杀灭其他的水华藻类,其并不局限于铜绿微囊藻。
15.本发明第二方面的内容,提供了一种本发明第一方面所述的溶藻菌剂的制备方法,具体步骤为:将霍氏肠杆菌和pqs混合后即得。
16.根据本发明第二方面的内容,在本发明的一些实施方式中,所述霍氏肠杆菌的有效活菌数为1
×
108~1
×
10
11
cfu/g。
17.在本发明的一些优选实施方式中,所述霍氏肠杆菌的有效活菌数为1
×
109~1
×
10
10
cfu/g。
18.在本发明的一些优选实施方式中,所述溶藻菌剂中pqs的终浓度是2μmol/l~200μmol/l。
19.在本发明的一些更优选实施例中,所述溶藻菌剂中pqs的终浓度是4μmol/l~100μmol/l。
20.在本发明的一些更优选实施方式中,所述溶藻菌剂中pqs的终浓度是6μmol/l~50μmol/l。
21.在本发明的一些更优选实施方式中,所述溶藻菌剂中pqs的终浓度是8μmol/l~30μmol/l。
22.在本发明的一些更优选实施方式中,所述霍氏肠杆菌为霍氏肠杆菌f2。
23.在本发明的一些优选实施例中,该霍氏肠杆菌f2的ncbi id为5476961,genbank序列编号为cp047570.1,具体信息可参见https://www.ncbi.nl.nih.gov/assembly/gcf_009905155.1/。
24.在本发明的一些优选的实施方式中,所述霍氏肠杆菌f2采用肉汤培养基(lb培养基)进行培养。
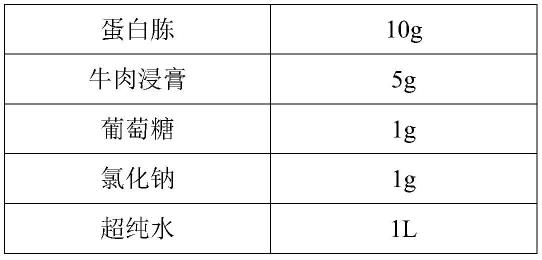
25.在本发明的一些优选的实施方式中,所述lb培养基中包括5~15g/l蛋白胨、2~8g/l牛肉浸膏、0.5~2g/l葡萄糖和0.5~2g/l氯化钠。
26.在本发明的一些更优选的实施方式中,所述lb培养基中包括10g/l蛋白胨、5g/l牛肉浸膏、1g/l葡萄糖和1g/l氯化钠。
27.在本发明的一些更优选的实施方式中,霍氏肠杆菌f2的具体培养步骤为:在1l超纯水中加入上述配方后调节ph至7.2,所得到的培养基在121℃下高压灭菌30min,待培养基冷却至室温后,用接种环接入霍氏肠杆菌f2菌株,置于37℃和150r/min摇床中震荡培养。
28.本发明的第三方面,提供了一种本发明第一方面所述的溶藻菌剂在抑制藻类生长
中的应用。
29.根据本发明第三方面的内容,在本发明的一些实施方式中,所述藻类包括铜绿微囊藻。
30.在本发明的一些优选实施方式中,所述应用的具体步骤为:将本发明第一方面所述的溶藻菌剂加入藻液中,在25~35℃下培养。
31.在本发明的一些更优选实施方式中,所述溶藻菌剂和藻液的体积比为的1:(30~100)。
32.在本发明的一些更优选实施方式中,所述溶藻菌剂和藻液的体积比为的1:(50~60)。
33.本发明的第四方面,提供了一种本发明第一方面所述的溶藻菌剂在水环境治理中的应用。
34.本发明的有益效果是:
35.本发明的溶藻菌剂中的pqs本身并不具有溶藻和抑藻的功能,通过pqs和霍氏肠杆菌f2的协同配合作用,可以提高霍氏肠杆菌f2的抑藻效果,其抑藻率高达83.81%,此外,pqs的加入在不影响霍氏肠杆菌f2的生物量的同时可以显著降低藻液中的叶绿素a的含量,可以显著提高藻液中ros活力,从而能有效控制水华的泛滥,在水体富营养化治理中具有较大应用前景。
附图说明
36.图1为本发明实施例6和对比例2的藻液中的霍氏肠杆菌f2的生长曲线。
具体实施方式
37.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
38.霍氏肠杆菌f2的培养
39.本发明实施例中所用的抑藻细菌为霍氏肠杆菌f2,该霍氏肠杆菌f2的ncbi id为5476961,genbank序列编号为cp047570.1,具体信息可参见https://www.ncbi.nl.nih.gov/assembly/gcf_009905155.1/。采用lb培养基进行培养,lb培养基的配方如表1所示。
40.表1lb培养基的配方
41.[0042][0043]
具体培养步骤:将蛋白胨、牛肉浸膏、葡萄糖和氯化钠溶于超纯水后定容至1l的体积,用naoh(浓度为3mol/l)或hcl(浓度为1mol/l)将ph调节至7.2,所得到的培养基在121℃下高压灭菌30min,待培养基冷却至室温后,用接种环接入霍氏肠杆菌f2菌株,置于37℃、150r/min摇床中震荡培养。
[0044]
其中,霍氏肠杆菌f2的有效活菌数是1
×
109cfu/g。
[0045]
铜绿微囊藻的培养
[0046]
本发明实施例中所用到的藻种为铜绿微囊藻(microcystis aeruginosa)fachb 315,其购于中国科学院淡水藻种库。铜绿微囊藻的活化和培养所用的培养基为bg11培养基。
[0047]
bg11培养基的配方如表2所示。
[0048]
表2bg11培养基的配方成分及用量
[0049]
配方用量配方用量nano31.5gedta0.001gmgso4·
7h2o0.075g铁铵0.006gna2co30.02gcacl2·
2h2o0.036gk2hpo40.04g柠檬酸0.006gna2sio3·
9h2o0.058g蒸馏水999mla5 co solution1ml
‑‑
[0050]
其中a5 co solution的配方如表3所示。
[0051]
表3a5 co solution的配方成分及用量
[0052]
配方用量配方用量co(no3)2·
6h2o0.05gna2moo4·
2h2o0.39gznso4·
7h2o0.22gmncl2·
4h2o1.86gh3bo32.86gcuso4·
5h2o0.08g蒸馏水1000ml
‑‑
[0053]
培养基配制完成后用naoh或hcl调节ph至7.1,经121℃高压蒸汽灭菌30min,待培养基冷却后接入铜绿微囊藻,放置于恒温培养箱培养,培养条件为:25℃、光照强度2500lux、光暗比为15h:9h。
[0054]
实施例1
[0055]
实施例1中的溶藻菌剂是由2ml的霍氏肠杆菌f2菌液和pqs混合而成,其中,pqs的终浓度为2μmol/l,霍氏肠杆菌f2的有效活菌数是1
×
109cfu/g。
[0056]
实施例2
[0057]
实施例2中的溶藻菌剂是由2ml的霍氏肠杆菌f2菌液和pqs混合而成,其中,pqs的终浓度为10μmol/l,霍氏肠杆菌f2的有效活菌数是1
×
109cfu/g。
[0058]
实施例3
[0059]
实施例3中的溶藻菌剂是由2ml的霍氏肠杆菌f2菌液和pqs混合而成,其中,pqs的终浓度为20μmol/l,霍氏肠杆菌f2的有效活菌数是1
×
109cfu/g。
[0060]
实施例4
[0061]
实施例4中的溶藻菌剂是由2ml的霍氏肠杆菌f2菌液和pqs混合而成,其中,pqs的终浓度为200μmol/l,霍氏肠杆菌f2的有效活菌数是1
×
109cfu/g。
[0062]
溶藻菌剂的抑藻效果检测
[0063]
实施例5
[0064]
将2ml实施例1中的溶藻菌剂和100ml的铜绿微囊藻藻液加入锥形瓶中。将锥形瓶置于25℃的培养箱中,在光照(光照强度2500lux,光暗比15h:9h)条件下培养7天。
[0065]
实施例6
[0066]
将2ml实施例2中的溶藻菌剂和100ml的铜绿微囊藻藻液加入锥形瓶中。将锥形瓶置于25℃的培养箱中,在光照(光照强度2500lux,光暗比15h:9h)条件下培养7天。
[0067]
实施例7
[0068]
将2ml实施例3中的溶藻菌剂和100ml的铜绿微囊藻藻液加入锥形瓶中。将锥形瓶置于25℃的培养箱中,在光照(光照强度2500lux,光暗比15h:9h)条件下培养7天。
[0069]
实施例8
[0070]
将2ml实施例4中的溶藻菌剂和100ml的铜绿微囊藻藻液加入锥形瓶中。将锥形瓶置于25℃的培养箱中,在光照(光照强度2500lux,光暗比15h:9h)条件下培养7天。
[0071]
对比例1
[0072]
将2ml的蒸馏水和pqs(终浓度为10μmol/l)作为溶藻物质,与100ml的铜绿微囊藻藻液加入锥形瓶中。将锥形瓶置于25℃的培养箱中,在光照(光照强度2500lux,光暗比15h:9h)条件下培养7天。
[0073]
对比例2
[0074]
将2ml的霍氏肠杆菌f2菌液作为溶藻物质,与100ml的铜绿微囊藻藻液加入锥形瓶中。将锥形瓶置于25℃的培养箱中,在光照(光照强度2500lux,光暗比15h:9h)条件下培养7天。
[0075]
同时设立空白对照组,即将2ml的蒸馏水和100ml的铜绿微囊藻藻液加入锥形瓶中。将锥形瓶置于25℃的培养箱中,在光照(光照强度2500lux,光暗比15h:9h)条件下培养7天。
[0076]
抑藻效果的判断标准
[0077]
实施例1~4中的溶藻菌剂的抑藻效果是根据实施例5~8中的藻液中检测到的铜绿微囊藻细胞个数、叶绿素a含量、ros活力判断。
[0078]
一、铜绿微囊藻细胞个数的统计
[0079]
铜绿微囊藻细胞个数的统计是采用血球计数板在光学显微镜下直接计数,当然,也可以采用其他本领域常规方法进行测定。铜绿微囊藻细胞个数的计算公式为:
[0080]
铜绿微囊藻细胞个数(个/ml)=n
×5×
稀释倍数
×
104。
[0081]
式中,n为在光学显微镜下直接得出的藻细胞个数(个)。
[0082]
二、叶绿素a的含量测试
[0083]
分别在培养的第4天和第7天,从实施例5~8中的锥形瓶中各取样5ml藻液作为待测样品,分别测定待测样品中叶绿素a的含量。
[0084]
藻类的叶绿素a的含量可以反映水体中藻类生物量及其变化状况,是藻类生物量的重要表征。正常生长的藻类中有较高的叶绿素a含量,死亡的藻类中叶绿素a的含量则较低,因此,把藻类中叶绿素a的含量作为衡量藻类存活的重要指标。
[0085]
叶绿素a含量的测定采用的是丙酮萃取法。具体步骤为:将从实施例5~8中取得的5ml藻液进行抽滤,抽滤后的样本与0.15g左右的碱式碳酸镁同时放入研钵,加入2-3ml丙酮研磨,研磨10-30s后在4000r/min条件下离心10min,吸取上清液并定容至10ml,分别测定所得到的上清液在630nm、645nm、663nm以及750nm波长光下的吸光度a。
[0086]
其中,叶绿素a含量的计算公式如下:
[0087][0088]
其中,v为抽滤前藻液的体积(ml),即5ml;a为吸光度;v1为上清液定容后的体积(ml),即10ml;δ为比色皿光程(cm)。
[0089]
三、ros活力的测定
[0090]
ros的测定采用的是南京建成生物工程研究所的ros测定试剂盒测试。分别取5ml实施例5~8中的培养第4天以及第7天的藻液,制备待测样的单细胞悬液,加入提前稀释好的工作浓度为10μmol/l的2,7-二氯荧光素二乙酸酯(dcfh-da)荧光探针重悬细胞沉淀,37℃下孵育60min后收集具有探针标记的悬液,1000r/min下离心10min,弃掉上清液收集细胞沉淀,用磷酸盐缓冲液(pbs)洗涤1-2次,再次离心并收集细胞沉淀。用pbs缓冲液重悬细胞沉淀后吸取200μl于96孔板,用酶标仪进行检测,其中,最佳激发波长为500nm(范围在500
±
15nm均可以),最佳发射波长为525nm(范围在530
±
20nm均可以),ros的测定结果以荧光度值表示。
[0091]
抑藻效果的结果统计
[0092]
表4为空白对照组、实施例5~8和对比例1~2的藻液中检测到的铜绿微囊藻细胞个数、叶绿素a含量和ros活力的统计结果。
[0093]
表4空白对照组、实施例5~8和对比例1~2的藻液中检测到的铜绿微囊藻细胞个数、叶绿素a含量和ros活力
[0094]
[0095]
从表4中可以看出,与空白对照组相比,实施例5~8中经过本发明实施例中的溶藻菌剂处理过的藻液中的铜绿微囊藻细胞个数大幅降低,其中,在处理的第4天,实施例6中的藻液中的铜绿微囊藻细胞个数最少,约为空白对照组的37%;在处理的第7天,空白对照组的藻液中的铜绿微囊藻细胞个数呈现略微的上升趋势,而本发明实施例5~8的藻液中的铜绿微囊藻细胞个数是持续下降的,同样还是实施例6的藻液中铜绿微囊藻细胞个数下降的幅度最大,培养第7天后实施例6的藻液的铜绿微囊藻细胞个数约为培养4天后的50%。无论是在处理的第4天还是第7天,对比例1的藻液中的铜绿微囊藻细胞个数相比于空白对照组都没有明显的变化,表明单纯的pqs对于藻液的铜绿微囊藻细胞个数是没有抑制作用的。对比例2的藻液的铜绿微囊藻细胞个数相比于空白对照组也是呈下降的趋势,但是在处理的第4天,对比例2藻液中的铜绿微囊藻细胞个数要高于本发明实施例5~8,尤其是在处理的第7天,相比于处理第4天的结果,对比例2的藻液中的铜绿微囊藻细胞个数基本上没有变化,表明霍氏肠杆菌f2菌液在第4~7天内对铜绿微囊藻细胞个数的抑制作用较弱。
[0096]
对比叶绿素a的含量,从表4中可以看出,与空白对照组相比,实施例5~8中经过本发明实施例的溶藻菌剂处理过的藻液中的叶绿素a的含量大幅下降,其中,在处理的第4天,实施例6的藻液中的叶绿素a的含量最低,约为空白对照组的42%;在处理的第7天,空白对照组的藻液中的叶绿素a的含量呈现略微的上升趋势,而随着培养时间的增加,本发明实施例5~8的藻液中的叶绿素a的含量持续下降,同样还是实施例6中藻液的叶绿素a的含量下降的幅度最大,培养第7天后实施例6中的叶绿素a的含量约为培养4天后的50%。相比于空白对照组,对比例1中的叶绿素a的含量有所下降,但是下降的幅度较小,尤其是随着培养时间的增加,对比例1中的叶绿素a的含量同空白对照组一样均表现出上升的趋势,同样说明单纯的pqs对于藻液中的叶绿素a的含量没有抑制的作用。相比于空白对照组,对比例2中的叶绿素a的含量有所下降,但是相比于本发明实施例5~8,对比例2中的叶绿素a的含量下降的幅度较小。
[0097]
藻类细胞中的ros的大量积累会造成藻细胞的细胞膜的破坏和抑制光合作用,因此,ros的大量积累会对藻液中藻细胞的生长起到抑制的作用。对于ros活力,在培养的第4天,相比于空白对照组,本发明实施例5~8的藻液中的ros活力大幅上升,尤其是在实施例6中,经过本发明实施例2中的溶藻菌剂处理后,ros活力提升为空白对照组的3倍左右,且随着培养时间的增加,空白对照组的藻液中的ros活力呈现下降的趋势,而在本发明实施例5~8中,ros活力随着培养时间的增加持续增加。在对比例1中,ros活力基本上和空白对照组相同,且随着培养时间的增长,对比例1的藻液的ros活力呈现下降的趋势,同样表明单纯的pqs对于藻细胞没有抑制的作用。在对比例2中,虽然藻液中的ros活力相比于空白对照组有所增加,但是对比例2中的ros活力同样不如本发明实施例5~8的藻液中的ros活力高。
[0098]
综上所述,可以得出结论,单纯的pqs并不能抑制铜绿微囊藻的生长,但是pqs的加入可以提高霍氏肠杆菌f2的抑藻效果,且pqs的加入还可以延长霍氏肠杆菌f2发挥抑藻作用的时间。此外,本发明实施例中的溶藻菌剂的抑藻率最高可达83.81%。
[0099]
霍氏肠杆菌f2生长曲线的绘制
[0100]
分别取3ml实施例6和对比例2的藻液至比色皿中,分别测定各组藻液在600nm下的吸光值,并绘制霍氏肠杆菌f2的生长曲线。
[0101]
图1为实施例6和对比例2中的霍氏肠杆菌f2的生长曲线,从图1中可以看出,添加
pqs后对于霍氏肠杆菌f2本身的生长并没有造成明显的变化,在霍氏肠杆菌f2的对数生长期也并没有出现生物量的突增,因此,图1中的结果表明pqs并不是通过调控霍氏肠杆菌f2的生物量变化来促进抑藻的,可能的原因是通过pqs对霍氏肠杆菌f2抑藻的过程进行调控来达到促进抑藻的效果。进一步对霍氏肠杆菌f2进行基因测序,发现在溶藻过程发生后,与pqs相关的基因的相对表达量呈上升的趋势,进一步说明pqs可能是通过调控霍氏肠杆菌f2的抑藻过程来达到促进霍氏肠杆菌f2抑藻的作用。
[0102]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。