1.本发明涉及一种动物模型的构建方法,具体涉及一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型建立、评价及应用。
背景技术:
2.糖尿病已成为21世纪全球最严重的公共卫生问题之一,其中绝大多数为2型糖尿病。临床主要表现为“三多一少”,“三多”指多尿、多饮、多食,“一少”指身体消瘦,兼有疲乏、烦渴等症状。2型糖尿病属于中医学“消渴”范畴,阴虚是该病的主要病理基础,阴虚证是人体阴精或津液亏虚所导致的中医基本证候之一,阴虚证在中医临床疾病中分布较广,以糖尿病最为常见其中,2型糖尿病患者占糖尿病患者总数的90%以上。
3.肠道菌群是一个复杂且庞大的群体,在一个健康的成年人体内,肠道菌群总重量 可达约1 ~ 2千克,其中包含的细胞数量高达1013 ~ 1014个,约是人体细胞数目的10倍,肠道微 生物编码基因组数目约为人体编码基因数目的100倍,因此也被称为“第二基因组”。
4.粪菌移植”(fecal microbiota transplantation,fmt),其定义是,将健康人粪便中的功能菌群,移植到患者胃肠道内,重建新的肠道菌群,实现肠道及肠道外疾病的治疗,粪菌移植(fecal microbiota transplantation,fmt) 作为重建肠道菌群的有效手段。
5.目前,粪便移植试验的小鼠模型不仅构建繁琐、模型效果较差、难以反映真实情况;且未发现通过粪便移植方法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型相关报道。
技术实现要素:
6.本发明的目的克服了现有技术的不足,提供了一种建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型方法、评价方法和应用。
7.本发明由如下技术方案实现的:本发明提供一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法,具体包括如下步骤:(1)制备粪菌液:将来源于临床确诊为2型糖尿病阴虚证和/或2型糖尿病非阴虚证患者的粪便制成粪菌液;(2)小鼠灌服和饮水方式服用四联抗生素药物,所述的四联抗生素为氨苄青霉素、万古霉素、新霉素、甲硝唑;(3)模型建立:步骤2中小鼠分别移植步骤1制备的粪菌液,得到2型糖尿病阴虚证和/或2型糖尿病非阴虚证模型。
8.进一步的,所述的一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法,步骤(1)具体包括如下步骤:a:配置0.9%生理盐水内含10%甘油、0.1%l-半胱氨酸混合溶液,作为粪便保护液,
高压灭菌锅内115℃煮熟20 min,粪便样本置入装有粪便保护液中,混匀;b:将步骤a得到的混匀粪便的粪便保护液过滤,得到滤液进行离心处理,弃上清液,所得沉淀为收集到的菌体;c:使用粪便保护液重悬步骤b所得沉淀菌体;d:根据需要分装粪菌液,-80℃保存。
9.优选的,所述的一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法,所述步骤b中通过无菌200目尼龙网进行过滤;离心条件为4000rpm 10min。
10.优选的,所述的一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法,步骤b、c、d均在厌氧环境下完成,其中厌氧环境要求o2浓度《2%。
11.进一步的,一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法,其特征在于,所述步骤(2)具体包括如下步骤:步骤1:小鼠选取阶段,选取spf级雄性c57bl/6小鼠,鼠龄6周;步骤2:小鼠分类阶段,将c57bl/6小鼠分类,分为糖健康菌液组(c组)、2型糖尿病阴虚证菌液组(ty组)、2型糖尿病非阴虚证菌液组(tny组);步骤3:清除菌群阶段,步骤2所述小鼠于第1周每日灌服四联抗生素,第2周通过饮水给予四联抗生素。
12.步骤 4:造模阶段,步骤3所述小鼠分别灌胃移植健康志愿者、2型糖尿病阴虚证患者及非阴虚患者粪菌液优选的,一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法,上述的灌服四联抗生素量为氨苄青霉素5mg/只,万古霉素5mg/只,新霉素5mg/只,甲硝唑4mg/只,饮水给予四联抗生素量为氨苄青霉素1g/l,万古霉素0.5g/l,新霉素1g/l,甲硝唑1g/l。
13.优选的,一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法,上述移植粪菌液量为200μl/只/次,一天一次,连续7周。
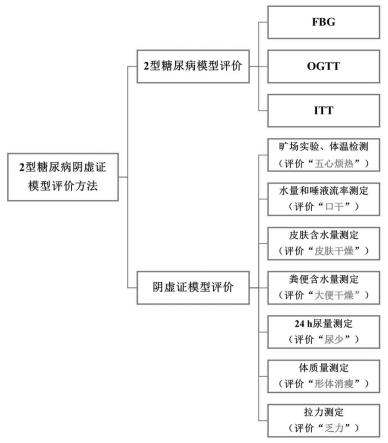
14.另外,本发明提供了一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型评价方法,包括旷场实验、易激惹评分;小鼠体温变化,饮水量、唾液流率、粪便含水量、皮肤含水量、体质量、24h尿量、尿胆素原和胆红素及摄食量、空腹血糖、ogtt和itt进行评价。
15.优选的,所述的一种运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型评价方法,所述的旷场试验为小鼠的探索行为、小鼠在正中格停留时间、穿格次数、旷场区运动距离及运动速度。
16.另外,本发明还提供了运用粪菌移植法建立2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型的方法在糖尿病治疗中的应用,将所述方法构建的糖尿病动物模型包括用于研发糖尿病的早期诊断试剂及方法和研发糖尿病的治疗药物。
17.本发明的有益效果主要体现在:本研究采用阴虚证造模方法进行模型构建,创新性结合
ꢀ“
五心烦热、潮热、口干、皮肤干燥、便干、形体消瘦、尿赤”等阴虚证典型表现制定评价指标,探索阴虚证动物模型评价方法,为实现阴虚证模型评价的标准化与规范化提供思路。
18.本发明提供一种稳定性高、易于推广、重复性好、成功率高,经济实用的2型糖尿病阴虚证和/或2型糖尿病非阴虚证动物模型,为中医药治疗糖尿病临床前期研究提供实验基础。
附图说明
19.图1为各组小鼠旷场中活动情况。
20.图2各组小鼠易激惹评分情况。
21.图3 各组小鼠体温变化。
22.图4各组小鼠饮水量变化。
23.图5各组小鼠唾液流率情况。
24.图6各组小鼠粪便含水量情况。
25.图7各组小鼠皮肤含水量情况。
26.图8各组小鼠体质量变化情况。
27.图9各组小鼠24小时尿量情况。
28.图10各组小鼠摄食量情况。
29.图11各组小鼠fbg情况。
30.图12各组小鼠ogtt情况。
31.图13各组小鼠itt情况。
具体实施方式
32.为使本发明的目的、技术方案及优点更加清楚明白,下面结合具体实施例对本发明进一步说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,但凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
33.实施例1。
34.一、粪便液收集和制备。
35.1)、新鲜粪便收集配制粪便保护液:配置0.9%生理盐水内含10%甘油、0.1%l-半胱氨酸混合溶液,作为粪便保护液,高压灭菌锅内115℃煮熟灭菌20 min,粪便样本置入装有粪便保护液中,混匀。
36.在厌氧工作站内进行粪便收集管准备。即取50 ml无菌离心管在厌氧工作站内操作,每管加入30ml灭好菌的粪便保护液,旋紧盖子后用封口膜密封,作为收集管。
37.收集供体新鲜粪便样本20g(取样部位为粪便中段内部),置于上述收集管内,立即旋紧管盖并用封口膜密封,密封后震荡粪便。粪便与粪便保护液充分混匀后尽快置于冰袋上,用冰袋包裹四周,另外再收集两管用于冻存的粪便,每管2-3g,置于冰上。冰上运输,2h内运输至江苏集萃药康生物科技公司实验室,用于粪菌液制备的粪便立即进行后续粪菌液制备工作,冻存粪便存于-80℃冰箱内。
38.2)、制备过程。
39.在集萃公司厌氧工作站内,将收集的人源粪便样本悬浮在配置好的粪菌保护液中,通过无菌200目尼龙网去除食物残渣,重复2次。在厌氧工作站内将离心管管盖旋紧,并
且用封口膜密封管盖后拿出厌氧工作站进行离心,4000rpm离心10min收菌。离心结束后再将其转移至厌氧工作站内,去尽上清液,底部沉淀即为收集到的菌体,使用粪便保护液重悬菌体。粪便初始体积:重悬加入粪便保护液得到的终体积比为1:5,使用粪便保护液重悬菌体,分装在后用于移植,粪菌液分装好后立即转移至-80℃冰箱保存。
40.实验过程使用的厌氧工作站目的为试验提供厌氧环境,厌氧环境下要求o2浓度《2%,也可使用厌氧培养箱提供厌氧环境。
41.3)、粪便供体信息。
42.。
43.二、动物模型构建。
44.spf级c57bl/6j雄性小鼠36只,6周龄,购自江苏集萃药康生物科技股份有限公司。
45.spf级6周龄c57bl/6小鼠随机分为移植健康菌液组(简称c组)、移植2型糖尿病阴虚证患者菌液组(简称ty组)、移植2型糖尿病非阴虚证患者菌液组(简称tny组),每组12只。各组小鼠均予四联抗生素清扫肠道微生物2周:第1周每日灌服抗生素(氨苄青霉素5mg/只,万古霉素5mg/只,新霉素5mg/只,甲硝唑4mg/只);第2周通过饮水给予抗生素(氨苄青霉素1g/l,万古霉素0.5g/l,新霉素1g/l,甲硝唑1g/l)。抗生素清扫2周后,分别移植健康志愿者、2型糖尿病阴虚证患者及非阴虚患者粪菌液200μl/只,连续7周。
46.三、动物模型评价。
47.模型构建完成后,每周观察小鼠空腹血糖、食水量及体质量变化。采用ogtt、itt评价小鼠糖耐量及对胰岛素反应情况。通过旷场实验、易激惹评分观察小鼠烦躁程度;动态观察小鼠体温变化,并比较各组饮水量、唾液流率、粪便含水量、皮肤含水量、体质量、24h尿量、尿胆素原和胆红素及摄食量改变以评价是否出现阴虚证表型。
48.四、结果评价。
49.测量结果以
±
s表示。采用graphpad 8.0统计软件对两组间数据进行t检验, 多组间数据进行单因素方差分析, p《0.05为差异有统计学意义,其中*p<0.05,**p<0.01,***p<0.001,****p<0.0001;与tny组相比,#p<0.05,##p<0.01, ###p<0.001, ####p<0.0001。
50.4.1旷场实验。
51.探究小鼠自主行为、探究行为,评价烦躁程度。以视频追踪系统记录小鼠的探索行为,观察5min内小鼠活动情况,并分析小鼠在正中格停留时间、穿格次数、旷场区运动距离
及运动速度。
52.结果如图1所示,旷场实验中相比于c组,ty组中央格停留时间百分比升高(p<0.05),与ty组相比,tny组中央格穿格次数及停留时间百分比下降(p<0.05,p<0.001)。
53.4.2易激惹评分。
54.根据捉持小鼠颈部时反应进行判定并分级:1级:指捉持颈部时出现尖叫、惊跳,记1分;2级:指捉持颈部时欲咬人或咬人,记2分:3级:指提拿尾部时即出现尖叫、惊跳甚至咬人或与同笼小鼠频繁打斗,记3分;无上述情况者为0级,记0分。评价烦躁程度。
55.易激惹评分结果如图2显示,ty组小鼠易激惹评分明显高于c组和tny组(均为p<0.0001)。
56.4.3体温检测(肛温、四肢爪心温度、心前区温度)。
57.采用红外测温仪于上午8点30、下午3点及晚20点检测小鼠肛温、四肢爪心温度、心前区温度,评价五心烦热程度。
58.结果如图3所示,与c组和tny组相比,在15点时ty组肛温、心前区温度、四肢爪心温度升高,20点时肛温和四肢爪心温度升高,差异具有统计学意义。
59.4.4饮水量。
60.测定小鼠平均每日饮水量。
61.结果见图4,抗生素清扫第1周,ty及tny组饮水量较c组降低(p<0.01,p<0.001),抗生素饮水第2周各组差异不显;fmt阶段,fmt第1-2周ty及tny组饮水量较c组降低(p<0.0001),第3-4周tny组饮水量相比于c组增加(p<0.05,p<0.01),第5周ty组小鼠饮水量高于c组及tny组(均p<0.0001),至fmt第6-7周,各组饮水量差异不显。
62.4.5唾液流率检测。
63.将定性滤纸剪成半径约2cm的等大扇形,重量差别在10%以下,用镊子夹持探入小鼠口中,在舌面停留5秒后取出,用电子天平称重以检测唾液流率。唾液流率(mg/s)=(滤纸湿重-滤纸干重)/5s,评价出现阴虚证典型表现口干程度。
64.结果图5所示,ty组小鼠唾液流率较c组及tny组降低(p<0.01,p<0.05)。
65.4.6粪便含水量。
66.将老鼠捉起,按摩其肛门部,促使其排便,取2-3粒粪便立即称量湿重后放入快速水分测定仪中,选择自动模式105℃加热至机器停止,测量干重。粪便含水量=(湿重-干重)/湿重
×
100%。
67.结果图6所示,相比于c组及tny组,ty组小鼠粪便含水量降低(p<0.01,p<0.05)。
68.4.7.皮肤含水量检测。
69.使用便携弹性水分油光皮肤测试仪(hkj-sk03)测定小鼠背部及四肢爪心皮肤含水量,评价皮肤干燥程度。
70.如图7所示,ty组小鼠四肢皮肤含水量相比于c组及tny组下降(均p<0.01),背部皮肤含水量差异不显。
71.4.8.体质量检测。
72.测定每只小鼠体质量,评价形体消瘦程度。
73.如图8所示,检查体质量结果表明,三组小鼠体质量随时间变化有增加趋势,但组间差异不显。
74.4.9 .24h尿量。
75.将小鼠放于代谢笼中,下段接口放置量筒接尿量,24h后将小鼠取出,记录每笼小鼠尿液体积。
76.如图9所示,相比于c组及tny组,ty组小鼠24h尿量降低(均为p<0.05)。
77.4.10.尿色(测定尿胆素原和胆红素含量)。
78.采集小鼠尿液,使用uro尿液分析试纸条(尿八联8n)采用尿液干化学分析检测尿液尿胆原及尿胆红素含量。将试纸条充分浸入尿液,在色标上规定的时间内与标准色标进行比色,判断并读取结果并记录。
79.。
80.结果显示,相比于c组及tny组,ty组小鼠尿胆素原弱阳性率及尿胆红素阳性率增加。
81.4.11.摄食量。
82.测定每笼小鼠摄食量,结果如图10所示,抗生素清扫第1周各组摄食量无明显差异,抗生素清扫第2周、fmt第1周及第2周ty组食量低于tny组(p<0.0001,p<0.05,p<0.01),fmt第3周tny组较c组食量增加(p<0.05),fmt第4周ty组较c组食量增加(p<0.05),fmt第5周ty组和tny组食量较c组增加(p<0.0001,p<0.01),fmt第6周tny食量低于c组(p<0.01),ty组食量高于tny组(p<0.01),至fmt第7周,tny食量低于c组(p<0.05)。
83.4.12.空腹血糖。
84.每周检测小鼠空腹血糖,结果如图11所示,与c组相比,表型观察第3-7周阴虚组和非阴虚组小鼠空腹血糖增加,阴虚组相比于非阴虚组空腹血糖有增加趋势,且在第5周最为显著(p<0.05)。
85.4.13. ogtt。
86.禁食12 h后用50%葡萄糖溶液,按2 g/kg体质量灌胃,在服糖前(0 min)、服糖后30、60、90、120 min时尾静脉取血, 测定血糖水平,如图12所示,验证小鼠是否存在糖耐量异常。
87.4.14.itt。
88.禁食6 h,腹腔注射普通短效胰岛素(0.75 u/kg体质量),于注射胰岛素前(0 min)及注射后15、30、60、90、120min尾静脉取血测定血糖水平。如图13所示,与c组相比,阴虚组血糖在0、15、60、90、120min时增加,非阴虚组血糖在0、15、30、60、90、120min时增加,差异具有统计学意义;曲线下面积结果显示阴虚组和非阴虚组itt auc相比于健康组增加(p<0.0001)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。