伊努帕地南盐酸盐、药物组合物及其使用方法与流程
- 国知局
- 2024-06-20 10:55:19
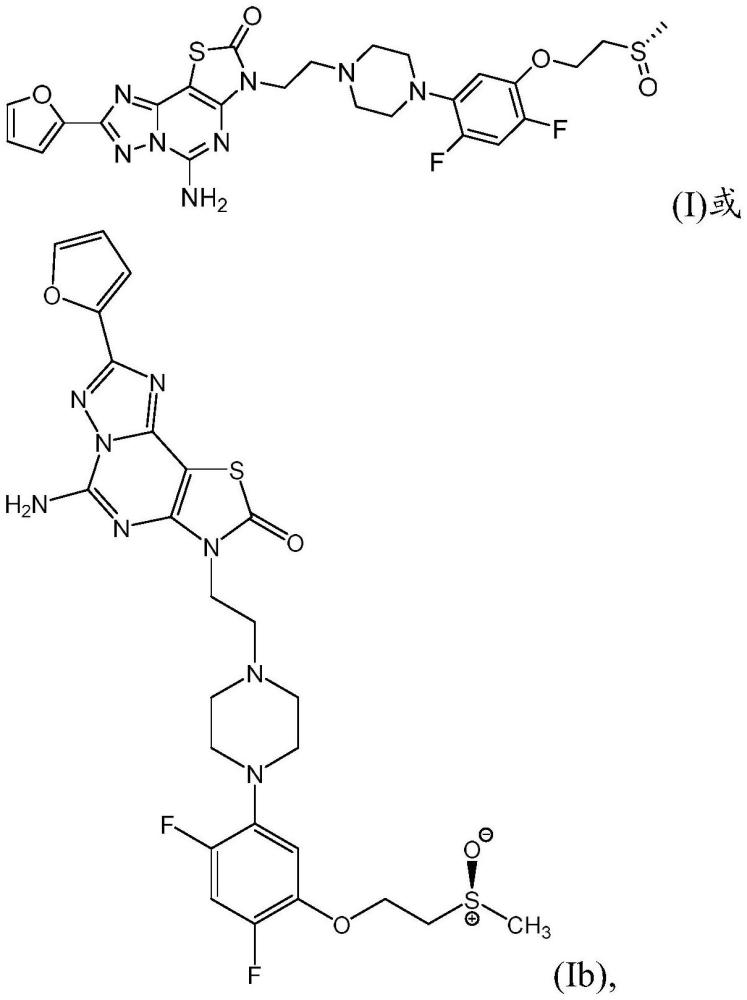
发明领域本发明涉及伊努帕地南(inupadenant)和伊努帕地南盐酸盐的固体形式以及包含伊努帕地南或伊努帕地南盐酸盐的药物组合物。本发明的固体形式和药物组合物特别可用于治疗癌症(例如非小细胞肺癌(nsclc),包括非鳞状nsclc)中的口服给药。
背景技术:
1、肿瘤中的许多免疫抑制机制是正常组织中生理免疫调节所共有的。这种免疫调节对于保持免疫系统处于控制之下非常重要,以阻止自身反应性免疫应答并防止正在进行的免疫应答引起严重的组织损伤。生理免疫调节的缺乏常常导致伴随自身免疫的压倒性的免疫激活。例如,ctla-4是通过阻断经由cd28-b7相互作用的共刺激信号来负调节t细胞活性的生理机制。ctla4的缺乏会引起非特异性t细胞活化,而ctla-4缺陷型小鼠会在数周内因大量淋巴细胞组织浸润而死亡。pd-1在与其配体pd-l1和pd-l2相互作用时也提供t细胞抑制信号。已知小鼠中pd-1的缺乏会导致各种类型的自身免疫性病症,这取决于遗传品系。
2、除了免疫抑制信号的细胞表面转导物(例如ctla-4和pd-1)外,肿瘤微环境中的免疫抑制还涉及抗炎性细胞因子(il-10、tgf-b)、酶(吲哚胺-2,3-双加氧酶)和专职的免疫调节细胞(调节性t细胞、骨髓来源的抑制性细胞mdsc)。这些免疫抑制机制在控制正常组织的免疫应答中起重要作用。由于肿瘤利用这种生理性免疫调节机制来保护其组织免受免疫攻击,所以这些旨在预防炎症性并发症的机制现已证明是阻碍自发性癌症消退和免疫性癌症治疗的主要障碍。对肿瘤中免疫抑制机制的鉴定指出了恢复抗肿瘤免疫应答的分子靶标。因此,这些负免疫调节机制,即所谓的免疫检查点,成为药物开发中的焦点。针对pd1、pd-l1或ctla-4的抗体已被批准用作多种适应症(诸如转移性黑色素瘤、非小细胞肺癌(nsclc)、肾细胞癌、霍奇金氏淋巴瘤、头颈癌、尿路上皮癌和肝细胞癌)的抗癌疗法,以及具有两种特定遗传特征(即错配修复缺陷和高微卫星不稳定性)之一的实体肿瘤患者的治疗(与癌症类型无关)。
3、细胞外腺苷已知是免疫功能的抑制剂。虽然细胞内腺苷参与能量代谢、核酸代谢和甲硫氨酸循环,但细胞外腺苷在细胞间信号传导中起重要作用。它的信号通过细胞表面上的g蛋白偶联腺苷受体传递,并影响多种生理功能,包括神经系统、心血管系统和免疫系统。
4、肿瘤含有高水平的细胞外腺苷,提示肿瘤细胞可能受益于其免疫抑制作用和分解代谢能量的产生(allard等人,curr.opin.pharmacol.,2016,29,7-16;otta a.,frontiersin immunology,2016,7:109)。这种高水平的细胞外腺苷可能是由于cd73酶的过表达,该酶负责细胞外腺苷的产生。cd73被许多肿瘤过表达,通过免疫组织化学法(www.proteinatlas.org)测得以下所有肿瘤均在>50%的肿瘤表面中表达中等或高水平的cd73:乳腺癌、类癌瘤、宫颈癌、结肠直肠癌、子宫内膜癌、神经胶质瘤、头颈癌、肝癌、肺癌、黑色素瘤、卵巢癌、胰腺癌、前列腺癌、肾癌、胃癌、甲状腺癌和尿路上皮癌。
5、在4种已知类型的腺苷受体中,a2a腺苷受体(a2ar)是大多数免疫细胞中主要表达的亚型。刺激a2ar通常会提供抑制t细胞(增殖、细胞因子产生、细胞毒性)、nk细胞(细胞毒性)、nkt细胞(细胞因子产生、cd40l上调)、巨噬细胞/树突状细胞(抗原呈递、细胞因子产生)和中性粒细胞(氧化迸发)的活性的免疫抑制信号。发现肿瘤中高水平的细胞外腺苷的存在在逃避抗肿瘤免疫应答中起重要作用。特别是,已证明a2ar缺陷型小鼠可自发地消退接种的肿瘤,而野生型小鼠则没有显示出相似的肿瘤消退。a2ar拮抗剂在携带肿瘤的野生型动物中也是有益的。重要的是,t细胞和nk细胞的耗竭削弱了a2ar拮抗剂对肿瘤生长的阻滞作用,提示抗肿瘤细胞免疫应答得到了改善。t细胞和nk细胞的效应功能对a2ar刺激敏感。另外,当在存在a2ar激动剂的情况下被激活时,即使去除a2ar激动剂后,t细胞的效应功能也持续受到损害。这一结果表明,肿瘤中富含腺苷的环境可能诱导对肿瘤细胞无反应的t细胞。因此,鉴于a2a受体在大多数免疫细胞且特别是效应免疫细胞(诸如t细胞和nk细胞)中表达,并且鉴于a2a受体参与产生腺苷的组织,因此认为a2a抑制剂可在所有癌症适应症中发挥作用。因此,需要能够在肿瘤环境中恢复免疫功能的a2a抑制剂。
6、已知腺苷是许多其他生理功能的内源性调节剂。例如,在中枢神经系统(cns)层面上,已知腺苷诱导镇静、抗焦虑和抗癫痫作用。因此,先前已开发出a2a抑制剂用于治疗抑郁症和神经退行性疾病,诸如帕金森氏病或阿尔茨海默氏病(pinna a.,cnsdrugs,2014,28,455)。开发用于治疗cns疾病的最先进的a2a抑制剂之一是preladenant(hodgson ra等人,j.pharmacol.exp.ther.,2009,330(1),294-303;hauser ra等人,jama neurol.,2015,72(12),1491-1500)。然而,为了在cns中靶向a2a受体,已将此类先前开发的a2a抑制剂设计为穿过血脑屏障。
7、由于与脑相比,肿瘤中的腺苷水平更高,因此需要量高得多的化合物才能达到治疗癌症的免疫功能恢复所需的效果。因此,为了避免有害的副作用,与所有先前开发的a2a抑制剂相反,应当提供具有有限(如果有的话)的cns穿透性的a2a抑制剂。
8、申请人在国际专利申请pct/ep2018/058301中提供了一系列作为a2a抑制剂的非脑穿透性硫代氨基甲酸酯衍生物。这些化合物可用于恢复肿瘤环境中的免疫功能。然而,这些化合物在水性缓冲液中的溶解度非常低,肠溶解度低,因此口服生物利用度低。因此,开发和制造具有必要的生物利用度、化学和物理稳定性以及具有生产用于治疗癌症和其他疾病和病症的安全有效的口服药品所需的材料特性的非脑穿透性a2a抑制剂的药物制剂仍然是一个重大的挑战。
9、因此,需要非脑穿透性a2a抑制剂的药物制剂,其显示出理想的理化性质,适合于促进患者依从性的简单口服施用方案,并表现出提供足够的药物暴露以治疗人类患者癌症的生物利用度特性。
10、如下面的实验部分所证明的,申请人特此提供了能够使伊努帕地南具有合适的口服生物利用度的药物组合物。
11、另外,申请人提供了通过向患者施用本文所述的包含伊努帕地南盐酸盐的药物组合物来治疗人类患者的癌症(例如,nsclc,包括非鳞状nsclc)的方法。
12、此外,抗癌剂例如免疫治疗剂、化疗剂或抗血管生成剂或其组合的抗癌作用可能仍然不足。这可能至少部分归因于如上所述的肿瘤的免疫逃逸机制。本文中,申请人还提供了用盐酸盐形式的伊努帕地南药物组合物与卡铂和培美曲塞中的一种或多种组合治疗癌症的方法。
技术实现思路
1、一方面,本文提供无定形伊努帕地南盐酸盐。
2、在某些实施方案中,无定形伊努帕地南盐酸盐具有基本上与图1的任一衍射图所示相同的x射线粉末衍射图。
3、在某些实施方案中,无定形伊努帕地南盐酸盐的差示扫描量热法(dsc)热分析图包含峰值起始温度为约155℃至约165℃之间的放热曲线。在某些实施方案中,无定形伊努帕地南盐酸盐的dsc热分析图包含峰起始为约230℃至约250℃之间的吸热曲线。在某些实施方案中,无定形伊努帕地南盐酸盐的特征在于基本上与图2a所示相同的dsc热分析图。
4、在某些实施方案中,无定形伊努帕地南盐酸盐的特征在于中点为约110℃的玻璃化转变温度。在某些实施方案中,无定形伊努帕地南盐酸盐的特征在于中点处于约140℃至约160℃之间的温度的玻璃化转变温度。
5、在某些实施方案中,当将无定形伊努帕地南盐酸盐从约31℃加热至约83℃时,发生小于或等于约3.5%的重量损失。在某些实施方案中,无定形伊努帕地南盐酸盐具有与图3所示基本相同的热重分析(tga)热分析图。
6、另一方面,本文提供结晶伊努帕地南盐酸盐。
7、另一方面,本文提供伊努帕地南盐酸盐形式2。
8、另一方面,本文提供伊努帕地南盐酸盐水合物。
9、另一方面,本文提供结晶伊努帕地南盐酸盐水合物。
10、在某些实施方案中,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有包括在约8.9°2θ处的峰的x射线粉末衍射(xrpd)图。在某些实施方案中,结晶伊努帕地南盐酸盐具有包括在约9.3°2θ处的峰的xrpd图。在某些实施方案中,结晶伊努帕地南盐酸盐具有包括在约8.9°和约9.3°2θ处的峰的xrpd图。在某些实施方案中,xrpd图还包括选自约14.8°和约26.7°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约5.3°、约18.1°和约22.6°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括在约32.2°2θ处的峰。在某些实施方案中,xrpd图还包括选自约19.3°、约23.5°和约27.5°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约28.2°和约29.3°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约6.7°、约12.6°、约13.4°、约15.4°、约16.1°、约16.5°、约17.4°、约19.8°、约24.3°和约24.9°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约30.4°、约31.0°和约31.6°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约14.5°、约22.2°、约23.1°、约25.4°和约25.9°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括在约34.4°2θ处的峰。在某些实施方案中,xrpd图还包括选自约21.5°、约22.8°、约25.7°和约27.1°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约33.0°和约33.9°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约25.0°和约25.8°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约22.0°和约25.2°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约9.4°、约13.3°、约15.5°、约17.5°、约23.5°、约24.4°和约26.1°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约28.3°、约30.5°、约31.1°和约33.7°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约12.7°、约16.8°、约19.9°、约20.4°、约22.1°、约25.5°和约27.6°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约14.6°、约16.6°、约22.4°和约24.0°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约31.7°和约34.5°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约18.2°和约18.8°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约9.5°和约23.2°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括在约18.9°2θ处的峰。在某些实施方案中,xrpd图还包括选自约13.5°、约16.3°、约16.7°、约20.0°、约21.7°、约23.7°、约24.1°、约25.1°、约26.0°和约27.7°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约28.6°、约30.6°和约33.1°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约15.6°和约27.0°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括在约29.5°2θ处的峰。在某些实施方案中,xrpd图还包括在约19.4°2θ处的峰。在某些实施方案中,xrpd图还包括选自约12.9°、约15.3°、约16.0°、约18.4°和约27.4°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括在约29.9°2θ处的峰。在某些实施方案中,xrpd图还包括选自约3.3°、约6.5°、约22.3°、约23.9°、约24.8°和约26.8°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约26.8°、约29.1°、约29.3°和约32.9°2θ的一个或多个峰。
11、在某些实施方案中,伊努帕地南盐酸盐形式2具有基本上与图5所示相同的xrpd图。在某些实施方案中,结晶伊努帕地南盐酸盐具有与图6所示基本相同的xrpd图。在某些实施方案中,结晶伊努帕地南盐酸盐具有与图7所示基本相同的xrpd图。在某些实施方案中,结晶伊努帕地南盐酸盐具有与图8所示基本相同的xrpd图。
12、在某些实施方案中,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有的dsc热分析图包含一个或多个峰起始点选自约70℃、约140℃和约240℃的吸热曲线。在某些实施方案中,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有基本上与图9中所示相同的dsc热分析图。
13、在某些实施方案中,当在25℃测量,当相对湿度在0%至约95%之间变化时,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物表现出小于或等于约5%wt的质量变化。在某些实施方案中,当在25℃测量时,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有基本上与图10a中所示相同的水吸附等温线。
14、在某些实施方案中,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有约1:1至约1:1.5的伊努帕地南与水的摩尔比。在某些实施方案中,当将结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物从约31℃加热至约83℃时,发生约1%wt至约3.2%wt之间的重量损失。在某些实施方案中,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有与图11a所示基本相同的tga热分析图。在某些实施方案中,结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐形式2、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有约2.7wt%至约3.5wt%的水含量。
15、在某些实施方案中,无定形伊努帕地南盐酸盐、结晶伊努帕地南盐酸盐、2型伊努帕地南盐酸盐、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有约1:1的伊努帕地南与盐酸的摩尔比。在某些实施方案中,无定形伊努帕地南盐酸盐、结晶伊努帕地南盐酸盐、2型伊努帕地南盐酸盐、伊努帕地南盐酸盐水合物和/或结晶伊努帕地南盐酸盐水合物具有1:1的伊努帕地南与盐酸的摩尔比。
16、另一方面,本文提供了药物组合物,通常包含:
17、无定形伊努帕地南盐酸盐和/或结晶依伊努帕地南盐酸盐;和
18、至少一种药学上可接受的赋形剂。
19、在某些实施方案中,所述至少一种药学上可接受的赋形剂包含脂质载体。
20、在各种实施方案中,本文描述的药物组合物包含:
21、结晶伊努帕地南盐酸盐;和
22、脂质载体。
23、在某些实施方案中,本文所述的药物组合物还可包含共聚维酮。
24、在各种实施方案中,本文描述的药物组合物包含:
25、(a)伊努帕地南盐酸盐;
26、(b)脂质载体;和
27、(c)共聚维酮。
28、在某些实施方案中,本文所述的药物组合物还可包含聚乙二醇(peg)。在某些实施方案中,本文所述的药物组合物还可包含抗氧化剂。
29、在各种实施方案中,本文描述的药物组合物包含:
30、(a)伊努帕地南盐酸盐;
31、(b)脂质载体;
32、(c)共聚维酮;
33、(d)聚乙二醇;和
34、(e)抗氧化剂。
35、在某些实施方案中,伊努帕地南盐酸盐作为无定形伊努帕地南盐酸盐和/或结晶伊努帕地南盐酸盐存在于本文所述的药物组合物中。在某些实施方案中,无定形伊努帕地南盐酸盐是本文所述的无定形伊努帕地南盐酸盐。在某些实施方案中,伊努帕地南盐酸盐是本文所述的结晶伊努帕地南盐酸盐。在某些实施方案中,伊努帕地南盐酸盐是伊努帕地南盐酸盐水合物。在某些实施方案中,伊努帕地南盐酸盐水合物是本文所述的结晶伊努帕地南盐酸盐水合物。在某些实施方案中,伊努帕地南盐酸盐是伊努帕地南盐酸盐形式1和/或伊努帕地南盐酸盐形式2中的一种或多种。
36、在某些实施方案中,本文所述的药物组合物包含约4%(w/w)至约6%(w/w)伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约4.5%(w/w)至约5.5%(w/w)伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约4.8%(w/w)至约5.2%(w/w)伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约5.1%(w/w)伊努帕地南盐酸盐。在这些和其他实施方案中,伊努帕地南盐酸盐是无定形伊努帕地南盐酸盐、结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐水合物、结晶伊努帕地南盐酸盐水合物、伊努帕地南盐酸盐形式1和伊努帕地南盐酸盐形式2中的一种或多种。
37、在某些实施方案中,本文所述的药物组合物包含约5mg至约60mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约5mg至约15mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约15mg至约25mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约35mg至约45mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg、约25mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约44mg或约45mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约9.6mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约9.8mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约10.0mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约10.2mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约10.4mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约10.6mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约10.8mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约11.0mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约11.2mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约11.4mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约11.6mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约20.0mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约20.2mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约20.4mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约20.6mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约20.8mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约21.0mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约21.2mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约21.4mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约21.6mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约21.8mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约22.0mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约41.0mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约41.2mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约41.4mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约41.6mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约41.8mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约42.0mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约42.2mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约42.4mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约42.6mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约42.8mg伊努帕地南盐酸盐。在某些实施方案中,本文所述的药物组合物包含约43.0mg伊努帕地南盐酸盐。在这些和其他实施方案中,伊努帕地南盐酸盐是无定形伊努帕地南盐酸盐、结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐水合物、结晶伊努帕地南盐酸盐水合物、伊努帕地南盐酸盐形式1和伊努帕地南盐酸盐形式2中的一种或多种。
38、在某些实施方案中,本文所述的药物组合物包含约4%(w/w)至约6%(w/w)结晶伊努帕地南盐酸盐水合物。在某些实施方案中,本文所述的药物组合物包含约4.5%(w/w)至约5.5%(w/w)结晶伊努帕地南盐酸盐水合物。在某些实施方案中,结晶伊努帕地南盐酸盐水合物是伊努帕地南盐酸盐形式1和伊努帕地南盐酸盐形式2中的一种或多种。
39、在某些实施方案中,本文所述的药物组合物包含约5mg至约60mg结晶伊努帕地南盐酸盐水合物。在某些实施方案中,本文所述的药物组合物包含约5mg至约15mg结晶伊努帕地南盐酸盐水合物。在某些实施方案中,本文所述的药物组合物包含约15mg至约25mg结晶伊努帕地南盐酸盐水合物。在某些实施方案中,本文所述的药物组合物包含约35mg至约45mg结晶伊努帕地南盐酸盐水合物。在某些实施方案中,本文所述的药物组合物包含约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg、约25mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约44mg或约45mg结晶伊努帕地南盐酸盐水合物。
40、在这些和其他实施方案中,本文所述的药物组合物包含约70%(w/w)至约90%(w/w)的脂质载体。在某些实施方案中,本文所述的药物组合物包含约70%(w/w)至约85%(w/w)的脂质载体。在这些和其他实施方案中,本文所述的药物组合物包含约75%(w/w)至约85%(w/w)的脂质载体。
41、在这些和其他实施方案中,本文所述的药物组合物包含约150mg至约800mg的脂质载体。在这些和其他实施方案中,本文所述的药物组合物包含约150mg至约250mg的脂质载体。在这些和其他实施方案中,本文所述的药物组合物包含约300mg至约400mg的脂质载体。在这些和其他实施方案中,本文所述的药物组合物包含约600mg至约700mg的脂质载体。
42、在这些和其他实施方案中,脂质载体是月桂酰聚乙二醇-32甘油酯。
43、在这些和其他实施方案中,本文所述的药物组合物包含约1.0%(w/w)至约1.5%(w/w)的共聚维酮。在这些和其他实施方案中,本文所述的药物组合物包含约2.0mg至约20mg的共聚维酮。
44、在这些和其他实施方案中,本文所述的药物组合物包含约10%(w/w)至约20%(w/w)的peg。在这些和其他实施方案中,本文所述的药物组合物包含约12%(w/w)至约18%(w/w)的peg。在这些和其他实施方案中,本文所述的药物组合物包含约20mg至约200mg的peg。在这些和其他实施方案中,本文所述的药物组合物包含约20mg至约120mg的peg。
45、在这些和其他实施方案中,抗氧化剂是丁基化羟基甲苯(bht)。在这些和其他实施方案中,本文所述的药物组合物包含约0.05%(w/w)至约0.15%(w/w)bht。在这些和其他实施方案中,本文所述的药物组合物包含约0.09%(w/w)至约0.11%(w/w)bht。在这些和其他实施方案中,本文所述的药物组合物包含约0.1%(w/w)bht。
46、在这些和其他实施方案中,本文所述的药物组合物包含约0.1mg至约1.00mg bht。在这些和其他实施方案中,本文所述的药物组合物包含约0.15mg至约0.25mg bht。在这些和其他实施方案中,本文所述的药物组合物包含约0.35mg至约0.45mg bht。在这些和其他实施方案中,本文所述的药物组合物包含约0.75mg至约0.85mg bht。
47、在各种实施方案中,本文描述的药物组合物包含:
48、(a)约2%(w/w)至约15%(w/w)伊努帕地南盐酸盐;
49、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
50、(c)约10%(w/w)至约20%(w/w)peg;
51、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
52、(e)约0.05%(w/w)至约0.2%(w/w)bht。
53、在某些实施方案中,本文描述的药物组合物包含:
54、(a)约4%(w/w)至约6%(w/w)伊努帕地南盐酸盐;
55、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
56、(c)约12%(w/w)至约18%(w/w)peg;
57、(d)约3%(w/w)至约6%(w/w)共聚维酮;和
58、(e)约0.08%(w/w)至约0.12%(w/w)bht。
59、在各种实施方案中,本文描述的药物组合物包含:
60、(a)约2%(w/w)至约15%(w/w)结晶伊努帕地南盐酸盐;
61、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
62、(c)约10%(w/w)至约20%(w/w)peg;
63、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
64、(e)约0.05%(w/w)至约0.2%(w/w)bht。
65、在某些实施方案中,本文描述的药物组合物包含:
66、(a)约4%(w/w)至约6%(w/w)结晶伊努帕地南盐酸盐;
67、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
68、(c)约12%(w/w)至约18%(w/w)peg;
69、(d)约3%(w/w)至约6%(w/w)共聚维酮;和
70、(e)约0.08%(w/w)至约0.12%(w/w)bht。
71、在各种实施方案中,本文描述的药物组合物包含:
72、(a)约2%(w/w)至约15%(w/w)结晶伊努帕地南盐酸盐水合物;
73、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
74、(c)约10%(w/w)至约20%(w/w)peg;
75、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
76、(e)约0.05%(w/w)至约0.2%(w/w)bht。
77、在某些实施方案中,本文描述的药物组合物包含:
78、(a)约4%(w/w)至约6%(w/w)结晶伊努帕地南盐酸盐水合物;
79、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
80、(c)约12%(w/w)至约18%(w/w)peg;
81、(d)约3%(w/w)至约6%(w/w)共聚维酮;
82、(e)约0.08%(w/w)至约0.12%(w/w)bht。
83、在各种实施方案中,本文描述的药物组合物包含:
84、(a)约2%(w/w)至约15%(w/w)伊努帕地南盐酸盐形式1;
85、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
86、(c)约10%(w/w)至约20%(w/w)peg;
87、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
88、(e)约0.05%(w/w)至约0.2%(w/w)bht。
89、在某些实施方案中,本文描述的药物组合物包含:
90、(a)约4%(w/w)至约6%(w/w)伊努帕地南盐酸盐形式1;
91、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
92、(c)约12%(w/w)至约18%(w/w)peg;
93、(d)约3%(w/w)至约6%(w/w)共聚维酮;
94、(e)约0.08%(w/w)至约0.12%(w/w)bht。
95、在各种实施方案中,本文描述的药物组合物包含:
96、(a)约2%(w/w)至约15%(w/w)伊努帕地南盐酸盐形式2;
97、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
98、(c)约10%(w/w)至约20%(w/w)peg;
99、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
100、(e)约0.05%(w/w)至约0.2%(w/w)bht。
101、在某些实施方案中,本文描述的药物组合物包含:
102、(a)约4%(w/w)至约6%(w/w)伊努帕地南盐酸盐形式2;
103、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
104、(c)约12%(w/w)至约18%(w/w)peg;
105、(d)约3%(w/w)至约6%(w/w)共聚维酮;
106、(e)约0.08%(w/w)至约0.12%(w/w)bht。
107、在某些实施方案中,本文所述的药物组合物中存在的peg选自peg 400和peg1000。在某些实施方案中,peg是peg 400。在某些实施方案中peg是peg 1000。
108、另一方面,本文提供了包含本文所述的药物组合物的剂型。
109、在某些实施方案中,剂型是固体剂型。在某些实施方案中,剂型是口服剂型。在某些实施方案中,剂型选自粉末、药囊(sachet)、条形包装(stick pack)、胶囊、迷你片(minitab)和片剂。
110、在某些实施方案中,剂型是胶囊。在某些实施方案中,胶囊是凝胶胶囊。在某些实施方案中,凝胶胶囊是硬凝胶胶囊。在某些实施方案中,胶囊的尺寸选自000、00、0、1、2、3、4和5。
111、在某些实施方案中,胶囊中的本文所述的药物组合物的总重量为约200mg至约1000mg。在某些实施方案中,胶囊中的本文所述的药物组合物的总重量为约300mg至约500mg。在某些实施方案中,胶囊中的本文所述的药物组合物的总重量为约350mg至450mg。在某些实施方案中,胶囊中的本文所述的药物组合物的总重量为约700mg至900mg。在某些实施方案中,胶囊中的本文所述的药物组合物的总重量为约780mg至880mg。在某些实施方案中,胶囊中的本文所述的药物组合物的总重量为约150mg至300mg。在某些实施方案中,胶囊中的本文所述的药物组合物的总重量为约200mg至250mg。
112、在各种实施方案中,本文提供包含药物组合物的胶囊,其中药物组合物包含:
113、(a)约2%(w/w)至约15%(w/w)伊努帕地南盐酸盐;
114、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
115、(c)约10%(w/w)至约20%(w/w)peg;
116、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
117、(e)约0.05%(w/w)至约0.2%(w/w)bht。
118、在某些实施方案中,胶囊包含药物组合物,其中药物组合物包含:
119、(a)约4%(w/w)至约6%(w/w)伊努帕地南盐酸盐;
120、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
121、(c)约12%(w/w)至约18%(w/w)peg;
122、(d)约1%(w/w)至约6%(w/w)共聚维酮;和
123、(e)约0.08%(w/w)至约0.12%(w/w)bht。
124、在各种实施方案中,本文提供包含药物组合物的胶囊,其中药物组合物包含:
125、(a)约2%(w/w)至约15%(w/w)结晶伊努帕地南盐酸盐;
126、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
127、(c)约10%(w/w)至约20%(w/w)peg;
128、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
129、(e)约0.05%(w/w)至约0.2%(w/w)bht。
130、在某些实施方案中,胶囊包含药物组合物,其中药物组合物包含:
131、(a)约4%(w/w)至约6%(w/w)结晶伊努帕地南盐酸盐;
132、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
133、(c)约12%(w/w)至约18%(w/w)peg;
134、(d)约1%(w/w)至约6%(w/w)共聚维酮;和
135、(e)约0.08%(w/w)至约0.12%(w/w)bht。
136、在各种实施方案中,本文提供包含药物组合物的胶囊,其中药物组合物包含:
137、(a)约2%(w/w)至约15%(w/w)结晶伊努帕地南盐酸盐水合物;
138、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
139、(c)约10%(w/w)至约20%(w/w)peg;
140、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
141、(e)约0.05%(w/w)至约0.2%(w/w)bht。
142、在某些实施方案中,胶囊包含药物组合物,其中药物组合物包含:
143、(a)约4%(w/w)至约6%(w/w)结晶伊努帕地南盐酸盐水合物;
144、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
145、(c)约12%(w/w)至约18%(w/w)peg;
146、(d)约1%(w/w)至约6%(w/w)共聚维酮;和
147、(e)约0.08%(w/w)至约0.12%(w/w)bht。
148、在各种实施方案中,本文提供包含药物组合物的胶囊,其中药物组合物包含:
149、(a)约2%(w/w)至约15%(w/w)伊努帕地南盐酸盐形式1;
150、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
151、(c)约10%(w/w)至约20%(w/w)peg;
152、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
153、(e)约0.05%(w/w)至约0.2%(w/w)bht。
154、在某些实施方案中,胶囊包含药物组合物,其中药物组合物包含:
155、(a)约4%(w/w)至约6%(w/w)伊努帕地南盐酸盐形式1;
156、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
157、(c)约12%(w/w)至约18%(w/w)peg;
158、(d)约1%(w/w)至约6%(w/w)共聚维酮;和
159、(e)约0.08%(w/w)至约0.12%(w/w)bht。
160、在各种实施方案中,本文提供包含药物组合物的胶囊,其中药物组合物包含:
161、(a)约2%(w/w)至约15%(w/w)伊努帕地南盐酸盐形式2;
162、(b)约50%(w/w)至约90%(w/w)月桂酰聚乙二醇-32甘油酯;
163、(c)约10%(w/w)至约20%(w/w)peg;
164、(d)约2%(w/w)至约8%(w/w)共聚维酮;和
165、(e)约0.05%(w/w)至约0.2%(w/w)bht。
166、在某些实施方案中,胶囊包含药物组合物,其中药物组合物包含:
167、(a)约4%(w/w)至约6%(w/w)伊努帕地南盐酸盐形式2;
168、(b)约65%(w/w)至约85%(w/w)月桂酰聚乙二醇-32甘油酯;
169、(c)约12%(w/w)至约18%(w/w)peg;
170、(d)约1%(w/w)至约6%(w/w)共聚维酮;和
171、(e)约0.08%(w/w)至约0.12%(w/w)bht。
172、在某些实施方案中,存在于本文所述胶囊中的peg选自peg 400和peg 1000。在某些实施方案中,peg是peg 400。在某些实施方案中,peg是peg 1000。
173、在某些实施方案中,药物组合物作为固体组合物或半固体组合物存在于本文所述的胶囊中。
174、在某些实施方案中,伊努帕地南盐酸盐作为无定形伊努帕地南盐酸盐和/或结晶伊努帕地南盐酸盐存在于本文所述的胶囊中。在某些实施方案中,无定形伊努帕地南盐酸盐是本文所述的无定形伊努帕地南盐酸盐。在某些实施方案中,伊努帕地南盐酸盐是本文所述的结晶伊努帕地南盐酸盐。在某些实施方案中,伊努帕地南盐酸盐是本文所述的伊努帕地南盐酸盐水合物。在某些实施方案中,伊努帕地南盐酸盐水合物是本文所述的结晶伊努帕地南盐酸盐水合物。
175、另一方面,本文提供了用于制造包含本文所述的药物组合物的胶囊的方法,该方法通常包括以下步骤:
176、(a)加热脂质载体和聚乙二醇以形成熔融混合物;
177、(b)将伊努帕地南盐酸盐、共聚维酮和bht添加到熔融混合物中以形成中间组合物;
178、(c)均质化中间组合物;
179、(d)低剪切混合中间组合物以形成药物组合物;和
180、(e)用药物组合物填充胶囊。
181、在该方面,伊努帕地南盐酸盐是无定形伊努帕地南盐酸盐、结晶伊努帕地南盐酸盐、伊努帕地南盐酸盐水合物、结晶伊努帕地南盐酸盐水合物、伊努帕地南盐酸盐形式1和伊努帕地南盐酸盐形式2中的一种或多种。
182、另一方面,本文提供了用于在有需要的患者中治疗癌症的方法,该方法通常包括向患者施用本文描述的药物组合物、本文描述的剂型或本文描述的胶囊。
183、另一方面,本文提供了用于在有需要的患者中治疗癌症的方法,该方法通常包括向患者施用有效量的本文所述的无定形伊努帕地南盐酸盐和/或本文所述的结晶伊努帕地南盐酸盐,例如,伊努帕地南盐酸盐形式1和/或伊努帕地南盐酸盐形式2。
184、在某些实施方案中,癌症是转移性的。在某些实施方案中,癌症是非转移性的。在某些实施方案中,癌症选自乳腺癌、膀胱癌、类癌、宫颈癌、结肠直肠癌、子宫内膜癌、神经胶质瘤、头颈癌、肝癌、肺癌、黑色素瘤、卵巢癌、腮腺癌、胰腺癌、前列腺癌、转移性去势抗性前列腺癌、肾癌、胃癌、鼻窦癌、鼻腔癌、甲状腺癌、肾移行细胞癌(tcc)、肾尿路上皮癌(uc)和尿路上皮癌。
185、在某些实施方案中,癌症是非小细胞肺癌(nsclc)。在某些实施方案中,nsclc是非鳞状细胞癌。在某些实施方案中,nsclc是鳞状细胞癌。在某些实施方案中,nsclc是转移性的。
186、另一方面,本文提供了用于在有需要的患者中治疗nsclc的方法,该方法包括向患者施用本文所述的药物组合物、本文所述的剂型或本文所述的胶囊与培美曲塞和卡铂的组合。
187、另一方面,本文提供了用于在有需要的患者中治疗nsclc的方法,该方法包括向患者施用有效量的本文所述的无定形伊努帕地南盐酸盐和/或本文所述的结晶伊努帕地南盐酸盐,例如,伊努帕地南盐酸盐形式1和/或伊努帕地南盐酸盐形式2与培美曲塞和卡铂的组合。
188、在某些实施方案中,药物组合物、剂型或胶囊在卡铂和培美曲塞之前施用。在某些实施方案中,在卡铂和培美曲塞之前施用有效量的无定形伊努帕地南盐酸盐和/或结晶伊努帕地南盐酸盐,例如伊努帕地南盐酸盐形式1和/或伊努帕地南盐酸盐形式2。
189、在某些实施方案中,该方法向患者提供约20mg至约1000mg伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约40mg至约640mg之间的伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约40mg至约320mg之间的伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约40mg、约80mg、约160mg、约320mg或约640mg伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约40mg伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约80mg伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约160mg伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约320mg伊努帕地南的每日剂量。在某些实施方案中,该方法向患者提供约640mg伊努帕地南的每日剂量。
190、在某些实施方案中,药物组合物、剂型或胶囊每天施用一次。在某些实施方案中,药物组合物、剂型或胶囊每天施用两次。
191、在某些实施方案中,该方法包括向患者每日两次(bid)施用约10mg至约500mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约20mg至约320mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约20mg至约160mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约20mg、20mg、80mg、160mg或320mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约20mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约40mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约80mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约160mg剂量的伊努帕地南。在某些实施方案中,该方法包括向患者每日两次(bid)施用约320mg剂量的伊努帕地南。
192、在某些实施方案中,该方法包括施用铂化疗的标准批准剂量的卡铂和500mg/m2的培美曲塞剂量。在某些实施方案中,铂化疗的标准批准剂量对应于每分钟5mg/ml的卡铂曲线下面积。在某些实施方案中,该方法包括每3周[q3w]施用铂化疗和培美曲塞,持续4个周期,随后进行培美曲塞维持疗法。
193、另一方面,本文提供了用于治疗非鳞状nsclc的方法,其包括向有需要的患者施用本文所述的药物组合物、本文所述的剂型或本文所述的胶囊。
194、另一方面,本文提供了用于治疗非鳞状nsclc的方法,其包括向有需要的患者施用有效量的本文所述的无定形伊努帕地南盐酸盐和/或本文所述的结晶伊努帕地南盐酸盐,例如伊努帕地南盐酸盐形式1和/或伊努帕地南盐酸盐形式2。
195、在某些实施方案中,nsclc是转移性的。在某些实施方案中,nsclc处于3期。在某些实施方案中,nsclc在先前的抗程序性死亡(pd)-配体(l)1疗法之后已复发或进展。
196、另一方面,本文提供伊努帕地南盐酸盐形式1。
197、在某些实施方案中,伊努帕地南盐酸盐形式1具有包含在约9.6°2θ处的峰的xrpd图。在某些实施方案中,xrpd图还包括选自约9.0°、约15.7°、约18.2°、约25.6°和约27.0°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约16.2°、约17.5°、约17.8°、约22.5°、约22.7°、约24.3°、约24.8°和约25.2°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约15.1°、约19.4°、约19.6°、约21.5°、约23.7°和约27.9°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约5.5°、约7.6°、约12.9°、约13.5°、约14.0°和约20.9°2θ的一个或多个峰。在某些实施方案中,xrpd图还包括选自约28.4°、约29.5°、约29.7°、约30.8°、约32.8°和约33.8°2θ的一个或多个峰。
198、在某些实施方案中,伊努帕地南盐酸盐形式1具有与图12所示基本相同的xrpd图
199、在某些实施方案中,当将伊努帕地南盐酸盐形式1形式1从约20℃加热至约80℃时,发生约2.1%的重量损失。在某些实施方案中,伊努帕地南盐酸盐形式1具有与图13所示基本相同的tga热分析图。
200、在某些实施方案中,伊努帕地南盐酸盐形式1具有包含一个或多个峰起始点选自约60℃和约250℃的吸热曲线的dsc热分析图。在某些实施方案中,伊努帕地南盐酸盐形式1具有与图13所示基本相同的dsc热分析图。
201、在某些实施方案中,当相对湿度在0%至约95%之间变化时,伊努帕地南盐酸盐形式1表现出小于或等于约5%wt的质量变化。在某些实施方案中,当在25℃测量时,伊努帕地南盐酸盐形式1具有与图15中所示基本相同的水吸附等温线。
202、在某些实施方案中,伊努帕地南盐酸盐形式1中伊努帕地南与盐酸的摩尔比为约1:1。在某些实施方案中,伊努帕地南盐酸盐形式1中伊努帕地南与盐酸的摩尔比为1:1。
203、另一方面,本文提供研磨的伊努帕地南盐酸盐。
204、另一方面,本文提供研磨的无定形伊努帕地南盐酸盐。
205、另一方面,本文提供了通过研磨结晶伊努帕地南盐酸盐制备的无定形伊努帕地南盐酸盐。
206、在某些实施方案中,无定形伊努帕地南盐酸盐是本文所述的无定形伊努帕地南盐酸盐。在某些实施方案中,结晶伊努帕地南盐酸盐是本文所述的结晶伊努帕地南盐酸盐。
207、在某些实施方案中,将结晶伊努帕地南盐酸盐研磨约30分钟至约60分钟。
本文地址:https://www.jishuxx.com/zhuanli/20240619/648.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表