一种电还原CO2催化剂及其制备方法
- 国知局
- 2024-07-27 11:06:21
本发明属于电还原co2催化剂领域,更具体地,涉及一种电还原co2催化剂及其制备方法。
背景技术:
1、大气中二氧化碳的过度排放被认为是全球气候变暖的主要影响因素。为缓解温室效应,二氧化碳的捕获与利用引起了人们的广泛关注。业界人士采用了许多方案来解决这一问题,如光催化、电催化和生物催化等。其中,二氧化碳的电还原(co2er)因其工艺简单、质子源(即水)成本低、设备易于扩大规模等特点,有望成为未来商业生产中最重要的技术手段。
2、金属/金属氧化物复合体系已被证明是一种高效、高选择性的co2er催化剂,金属氧化物部分还原的欠配位位点的结合以及金属氧化物与金属之间的协同效应对提高co2er选择性起主要作用。其中,铋(bi)是一种廉价无毒的金属材料。由于其原子轨道中,6p轨道上存在未成对的电子,这使得bi原子有单电子可与o原子p轨道的未成对电子配对成键,且bi原子的电负性较低,而o原子的电负性较高(在元素周期表中仅次于f),这种电负性差异促使o原子倾向于得到电子,bi原子倾向于失去电子,形成离子键或极性键;此外,bi的分子量较大,原子半径较大,因此其电子云分布范围也较大,其相对于其他元素更容易接近氧分子。这些因素共同导致了bi元素具有良好的亲氧性。bi的亲氧性有利于co2分子中的o优先吸附,更趋向于在碳原子上进行质子化,进而主要的还原产物为hcooh/hcoo-。bi复合材料对co2er具有高选择性和催化活性,bi0-biδ+结构是co2rr制备甲酸/甲酸盐的本征活性中心,biδ+位点使反应能垒大幅降低,促进反应决速步的发生。
3、但是,研究人员想要在此基础上进一步提高电还原co2催化剂对中间产物的吸附性、使其选择性更高、产物更单一,因此,需要开发出相对应的催化剂。
技术实现思路
1、针对现有技术的缺陷,本发明的目的在于提供一种电还原co2催化剂及其制备方法,旨在提供一种新型的电还原co2催化剂,该催化剂能使电催化降解co2的过程中的对中间产物的吸附性更高、选择性更高、产物更单一。
2、为实现上述目的,按照本发明的一个方面,提供一种电还原co2催化剂,其成分为bi-er0.6bi1.4o3-δ,0<δ<3,金属单质bi分布在er0.6bi1.4o3-δ的表面。
3、进一步的,其呈颗粒状或者小棒状,金属单质bi以纳米颗粒的形式分布在颗粒状er0.6bi1.4o3-δ的表面。
4、进一步的,bi-er0.6bi1.4o3-δ粒径范围为100~500nm,金属单质bi的粒径为10nm~50nm。
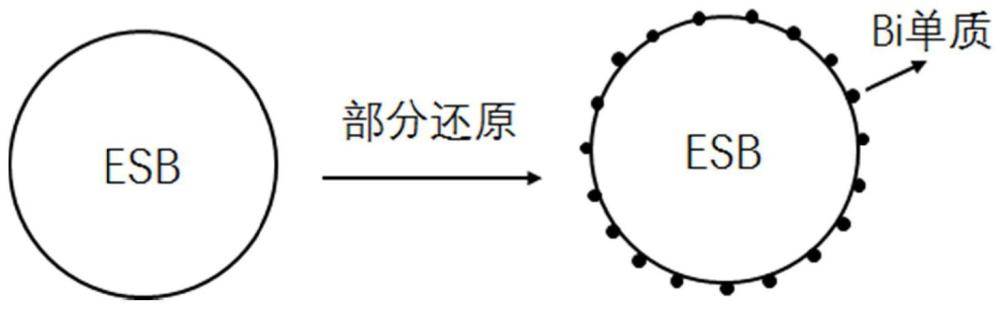
5、进一步的,其由bi0.8er0.2o1.5被部分还原出bi获得。
6、按照本发明的第二个方面,提供制备如上所述的电还原co2催化剂的方法,先制备获得bi0.8er0.2o1.5,再将bi0.8er0.2o1.5部分还原获得bi-er0.6bi1.4o3-δ。
7、进一步的,制备bi0.8er0.2o1.5的步骤如下:
8、s1:将bi(no3)3·5h2o和er(no3)3·5h2o按化学计量比加入氮氮二甲基甲酰胺的溶液中,搅拌直至澄清,
9、s2:再加入适量的聚丙烯腈搅拌后得到电纺丝前驱体溶液,
10、s3:将电纺丝前驱体溶液执行静电纺丝工艺,获得纳米纤维,然后去除纳米纤维中残留的有机物,
11、s4:使纳米纤维断裂或者粉碎,获得bi0.8er0.2o1.5纳米颗粒。
12、进一步的,将bi0.8er0.2o1.5部分还原获得bi-er0.6bi1.4o3-δ的步骤如下:
13、将bi0.8er0.2o1.5纳米颗粒溶解在n2h4·h2o和超纯水的混合溶液中,获得混合溶液,将所述混合溶液倒入反应釜中,在110℃~130℃下加热1~3h,冷却至室温后,离心分离得到部分还原产物,清洗并干燥所述部分还原产物。
14、进一步的,将bi0.8er0.2o1.5部分还原获得bi-er0.6bi1.4o3-δ的步骤如下:将bi0.8er0.2o1.5纳米颗粒置于坩埚中,并使用高温还原炉对其进行热还原处理,在300~500℃温度下,通入氢气和氮气的混合气体,气体流速为20~40ml/min,保温2~5h,得到部分还原产物。
15、进一步的,氢气和氮气的混合气体中,氢气的体积比为5%~10%,氮气的体积比为90%~95%。
16、按照本发明的第三个方面,还提供如上所述的电还原co2催化剂在降解co2中的应用,其工作过程为:
17、首先,co2分子在界面biδ+位点被活化吸附生成co2*,h2o分子在bi0位点发生解离,以提供质子;
18、接着,co2*质子化生成中间体*ocho;
19、然后,*ocho经质子耦合电子转移过程生成hcooh/hcoo-。
20、总体而言,通过本发明所构思的以上技术方案与现有技术相比,具有以下
21、有益效果:
22、(1)引入稀土元素铒作为溶质元素掺杂到bi2o3晶格中,使其结构更加稳定,获得bi0.8er0.2o1.5,也即esb。这种掺杂可以提高基体材料在电流长期极化条件下的结构稳定性。此外,er可以抑制材料的老化效应,从而避免老化效应导致的材料电导率降低。
23、(2)掺杂er3+后的esb为具备更高氧离子电导率的立方相,而氧离子参与了电子与质子传递,高氧离子导电性的材料能提供更充足的电子传输路径,因此可以有效促进co2er过程中所涉及的电子转移步骤,从而提高co2er的效率和选择性。此外,还原产物甲酸或甲酸盐有很大潜力成为储氢介质,通过电催化还原co2生成甲酸,可以实现碳的循环利用,将co2转化为更高附加值的燃料。
24、(3)通过er3+稳定的esb在所设置还原条件下(n2h4·h2o或还原性气体)相结构稳定性更好,不易于被完全分解,更利于bi金属单质被部分还原析出的同时esb基体物相的稳定。此外,原位还原路径可以有效实现bi金属单质于esb表面的均匀分布,从而实现复合催化剂更高的比表面积,对于co2及其还原过程中间产物有较强的吸附作用,从而可以进一步提升bi-esb体系对于co2er的高选择性与可靠性。
25、(4)在esb中,bi2o3部分还原为bi可以增加欠配位bi活性位点的数量,从而提高吸附co2的能力、加速电子转移过程。在催化反应过程中,由bi2o3作为δ+位点,吸附在biδ+处的中间体co2*经历c-h键形成从而得到关键中间体(*ocho),大大提高了co2er对hcooh/hcoo-产物选择性。bi和bi2o3之间的协同效应在co2er中起关键作用,该催化剂的活性中心在金属-载体界面,bi0与biδ+在界面处共存,co2*与界面biδ+位点之间的强库仑相互作用促进了第一步co2分子的活化,且反应中关键的中间体(*ocho)在该界面位点通过双齿bi-o键表现出很强的相互作用,界面位点是促进包含c-h键的中间体(*ocho)生成的活性位点。得益于界面结构的协同作用和co2活化与h2o解离之间的平衡,本发明申请的催化剂表现出优异的催化性能。
本文地址:https://www.jishuxx.com/zhuanli/20240726/117451.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表