芯壳的制作方法
- 国知局
- 2024-07-27 12:16:02
本专利申请要求2017年2月2日提交的美国临时专利申请号62/453,877,和2018年2月1日提交的美国临时专利申请号15/886,635的优先权,这些专利的公开内容全文以引用方式并入本文中。
技术领域
本公开整体涉及用于将二氧化碳转化成有用产物的电化学电池。电化学电池包括具有提供高水平的催化活性、产物选择性和稳定性的多功能芯@壳纳米颗粒的电极,以及制备该电极的方法。
背景技术:
当通电时还原二氧化碳的电化学体系提供有吸引力的电源选择,因为它们不仅能够抵消二氧化碳(主要温室气体)的排放,而且还能够将二氧化碳转化成燃料和其他有用的产物。然而,这种类型的电化学电池提出了主要的技术挑战,诸如低催化活性,产物选择性,以及用于这种类型的体系中的电极的稳定性等等。虽然已经研究了几乎所有纯金属及其合金在二氧化碳还原中用作电催化剂,但目前不存在克服所有上述挑战的电极材料。因此,本领域需要提供高水平的催化活性、产物选择性和稳定性的电极材料。
技术实现要素:
本公开整体涉及可用于电化学电池,具体地用作电催化剂材料的多功能芯@壳纳米颗粒(CSN)。根据本公开的多功能CSN包含由一个或多个外壳所包围的催化芯组件。本公开还整体涉及电化学电池电极和电化学电池,该电化学电池电极和电化学电池将二氧化碳电化学转化为例如可用的燃料(例如,合成燃料)或其他产物,并且其包含本文所述的多功能CSN。
本公开还整体涉及制备本文所述的多功能CSN的方法。
本公开还整体涉及化学还原CO2的方法。根据一些方面,该方法可包括提供电化学电池,该电化学电池包括阳极、阴极和液体电解质,其中阴极包含电催化组分,该电催化组分包含至少一种根据本公开的CSN;提供CO2源;以及还原CO2。
附图说明
图1a为示出根据本公开的各方面的CSN的示例性实心催化芯组件的剖面图。
图1b为示出根据本公开的各方面的具有涂层的CSN的示例性实心催化芯组件的剖面图。
图1c为示出根据本公开的各方面的CSN的示例性中空催化芯组件的剖面图。
图2为示出根据本公开的各方面的多功能CSN的剖面图。
图3a为示出根据本公开的各方面的具有完全地覆盖催化芯组件的壳的多功能CSN的剖面图。
图3b为示出根据本公开的各方面的具有部分地覆盖催化芯组件的壳的多功能CSN的剖面图。
图4为示出根据本公开的各方面的电化学电池的剖面图。
图5示出了紧接合成和分离后(“按原样制得的”),不具有壳的比较例1的分离的铜纳米颗粒的XRD谱。
图6示出了按原样制得的和在暴露于空气4天和9天之后,不具有壳的比较例1的分离的铜纳米颗粒的堆叠XRD谱。
图7示出了如本公开的一个方面合成的实验例1的Cu-LaF3 CSN的XRD谱。
图8示出了在暴露于空气9天、16天和23天之后的实验例1的Cu-LaF3 CSN的堆叠XRD谱。
图9A和图9B为按原样制得的实验例1的Cu-LaF3 CSN的透射电子显微镜(TEM)图像。
图10A示出了实验例1的Cu-LaF3 CSN的高分辨率TEM图像,其指示Cu(芯)区域和LaF3(壳)区域。图10B和图10C示出了相同纳米颗粒的缩放图像。
图11示出了如本公开的一个方面合成的实验例2的Cu-Cu2O-LaF3 CSN的XRD谱。
图12示出了如本公开的一个方面合成的实验例3的Cu2O-LaF3 CSN的XRD谱。
图13示出了合成的比较例2的纳米颗粒的XRD谱。
图14示出了在暴露于空气8天、15天和22天之后的比较例2的纳米颗粒的堆叠XRD谱。
图15为比较例2的纳米颗粒的TEM图像,其示出了铜纳米颗粒被LaF3不均匀的局部覆盖,以及不与铜纳米颗粒缔合的LaF3。
图16为比较例3的纳米颗粒的TEM图像,其示出Cu纳米颗粒被分解成较小的Cu纳米颗粒,并且芯壳结构未形成。
图17示出了实验例4的CSN的电流密度。
图18A示出了实验例4的CSN的CO2吸附。
图18B示出了实验例4的CSN的CO2吸附。
图19A示出了由实验例4中研究的催化剂制得的气体产物。
图19B示出了由实验例4中研究的催化剂制得的醇产物。
图20示出了实验例5的CSN的电流密度。
图21A示出了实验例5的CSN的CO2吸附。
图21B示出了实验例5的CSN的CO2吸附。
图22示出了由实验例5中研究的催化剂制得的醇产物。
具体实施方式
本公开整体涉及可用于电化学电池,具体地用作电催化剂材料的多功能CSN。根据本公开的多功能CSN可包含由一个或多个外壳包围的催化芯组件。本公开还整体涉及电化学电池电极和电化学电池,该电化学电池电极和电化学电池将二氧化碳电化学转化为其他产物,并且其包含本文所述的多功能CSN。
本公开还整体涉及制备本文所述的多功能CSN的方法。
如本文所用,术语“CSN”是指具有由一个或多个壳包围的催化芯组件的纳米级颗粒。本公开的多功能CSN可有利地在改善电催化电池中二氧化碳的电催化还原的效果和/或效率方面具有多功能作用。例如,本公开的多功能CSN可通过提供具有高水平的催化活性、产物选择性和/或稳定性的含催化剂的电极来改善二氧化碳的电催化还原的效果和/或效率。
根据本公开的多功能CSN包含由一个或多个外壳包围的催化芯组件,其中催化芯组件包含一种或多种催化材料。如本文所用,“催化材料”是指可用于导致或加速(即,“催化”)化学反应的材料。例如,催化材料可以是至少部分地催化二氧化碳转化为例如有用的燃料或其他产物的材料。
根据本公开可用的催化材料的示例包括但不限于金属(例如,铜、钴、铁、镍、铅和锡)和/或它们的合金和/或氧化物。
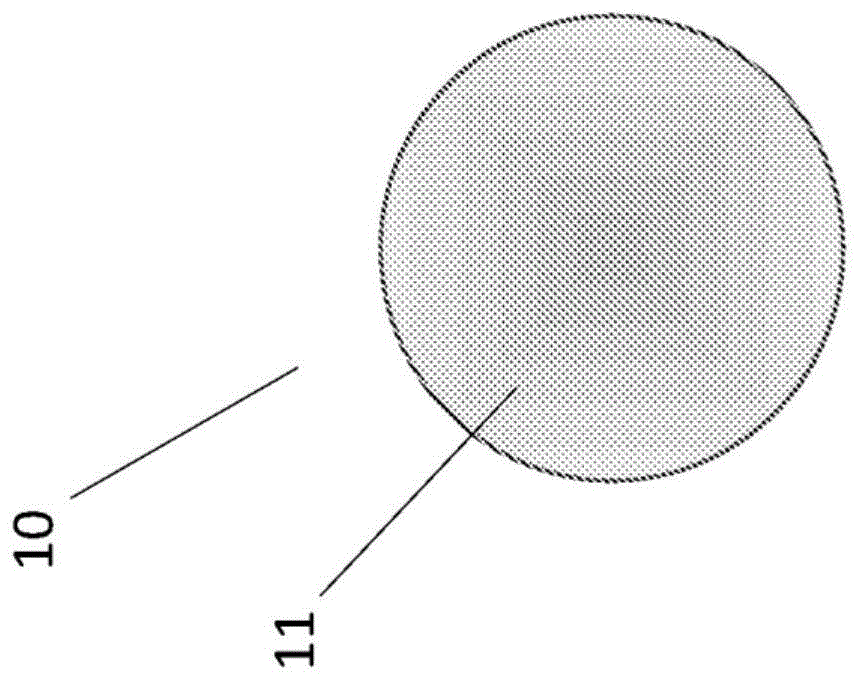
如本文所用,术语“催化芯组件”是指CSN的内部部分。根据一些方面,催化芯组件可以为实芯组件。如本文所用,术语“实心”意指非中空的。如图1a所示,实心芯组件10可包含一种或多种催化材料11。例如,实心芯组件可包含第一催化材料,诸如金属。
如图1b所示,实心芯组件10还可包含涂覆第一催化材料11的第二催化材料12。例如,涂层可包含金属氧化物。根据一些方面,涂层可通过在空气中加热第一催化材料,电化学氧化第一催化材料的外层,和/或将第二催化材料沉积在第一催化材料上形成。该涂层可提供第一催化材料的完全覆盖(即,覆盖100%的第一催化材料的表面区域)或可提供第一催化材料的部分覆盖(即,覆盖小于100%的第一催化材料的表面区域)。
根据一些方面,催化芯组件不是实心的。例如,催化芯组件可以为中空的,诸如中空球体。如图1c所示,中空芯组件14可包含一种或多种催化材料13。例如,中空芯组件可包含金属氧化物。
根据一些方面,催化芯组件可由一个或多个外壳包围。如图2所示,CSN 20可包括外壳23,该外壳包围催化芯组件21,催化芯组件可以为如本文所述的催化芯组件中的任一种。
外壳可提供CSN的完全覆盖(即,覆盖100%的催化芯组件的表面区域)。例如,如图3a所示,CSN 30可包含实心催化芯组件以及壳33,实心催化芯组件具有第一催化材料31和第二催化材料涂层32,壳覆盖催化芯组件的整个表面区域。
另选地,外壳可提供CSN的部分覆盖(即,覆盖小于100%的催化芯组件的表面区域)。例如,如图3b所示,CSN 30可包含实心催化芯组件以及覆盖催化芯组件的一部分的壳34,该实心催化芯组件具有第一催化材料31与第二催化材料涂层32,覆盖的部分在本文中被称为壳覆盖百分比。
外壳可覆盖至少90%的催化芯组件的表面区域(即,CSN可具有至少90%的壳覆盖率),至少80%的催化芯组件的表面区域,至少70%的催化芯组件的表面区域,至少60%的催化芯组件的表面区域,至少50%的催化芯组件的表面区域,至少40%的催化芯组件的表面区域,至少30%的催化芯组件的表面区域,至少20%的催化芯组件的表面区域,或至少10%的催化芯组件的表面区域。
根据一些方面,可选择壳覆盖百分比以提供最佳性能。如本文所用,术语“最佳性能”是指为或接近CSN的针对所选性能参数的容量的性能。例如,根据一些方面,可选择壳覆盖百分比以提供最佳电流密度。附加地或另选地,可选择壳覆盖百分比以提供最佳催化活性,例如,最佳的CO2吸附和/或CO2向某些气体和/或醇产物(包括但不限于,乙醇、正丙醇、以及它们的组合)的选择性转化率。应当理解,提供最佳性能所需的壳覆盖百分比可基于CSN的某些特性(例如,催化芯组件和/或壳的性质)而变化。
根据一些方面,包含LaF3壳的CSN的壳覆盖百分比可为约25%至45%,任选地约30%至40%,任选地约31%至37%,任选地约32%至36%,任选地约33%至36%%,和任选地约34%。
根据一些方面,包含La(OH)3壳的CSN的壳覆盖百分比可以为约1%至20%,任选地约5%至15%,任选地约6%至14%,任选地约6%至13%,任选地约8%至12%,任选地约9%至11%,以及任选地约10%。
根据一些方面,壳覆盖百分比可对应于CSN合成方法中的一个或多个步骤。例如,根据一些方面,壳覆盖百分比可至少部分地对应于用于提供壳的原料的量和/或浓度。
例如,在包含LaF3壳的CSN中,壳覆盖百分比可至少部分地对应于用于提供LaF3壳的La(NO3)3-6H2O和/或NaF的浓度。在一个非限制性示例中,约1mmol的La(NO3)3-6H2O和1mmol的NaF可提供约18%的壳覆盖率。在另一个非限制性示例中,约2mmol的La(NO3)3-6H2O和2mmol的NaF可提供约34%的壳覆盖率。在另一个非限制性示例中,约4mmol的La(NO3)3-6H2O和4mmol的NaF可提供约50%的壳覆盖率。
在另一示例中,在包含La(OH)3壳的CSN中,壳覆盖百分比可至少部分地对应于用于提供La(OH)3壳的La(NO3)3-6H2O和/或肼水合物的浓度。在一个非限制性示例中,约0.1mmol的La(NO3)3-6H2O和约1.5mL的肼水溶液(水的体积被调节成等于总共30mL)可提供约10%的壳覆盖率。在另一个非限制性示例中,约1mmol的La(NO3)3-6H2O和约2mL的肼水溶液(水的体积被调节成等于总共30mL)可提供约24%的壳覆盖率。在另一个非限制性示例中,约2mmol的La(NO3)3-6H2O和约3mL的肼水溶液(水的体积被调节成等于总共30mL)可提供约47%的壳覆盖率。
应当理解,本文所述的壳覆盖百分比值中的一个或多个可对应于评估。根据一些方面,该评估可使用模型获得,其中该模型至少部分地基于CSN和/或其组件的形状、尺寸和/或厚度。例如,可使用模型评估全壳覆盖率(即,100%壳覆盖率),然后将评估的全壳覆盖率与由CSN构成的壳材料(或其部分)的量进行比较来确定壳覆盖百分比,其中壳材料(或其部分)的量使用本领域已知的一种或多种测量装置和/或技术,诸如电感耦合等离子体(ICP)技术和/或能量色散X-射线光谱(EDS)技术来测定。
外壳可包含具有某些期望特性的壳材料,具体地讲当用于将二氧化碳电化学转化成燃料、聚合物和/或其他产物的电化学电池中时。壳材料的一个期望的特性可以为其与二氧化碳和/或碳酸根离子的相互作用。例如,壳材料可与碳相互作用,使得二氧化碳和/或碳酸根离子经由强化学键吸收和/或化学吸附到CSN表面上。这种相互作用还可在CSN表面上提供单一的单层类型的二氧化碳和/或碳酸根离子。例如,不具有壳材料的纳米颗粒催化剂可表现出与二氧化碳和/或碳酸根离子的一系列结合模式(例如,弯曲结合、线性结合、氧结合和/或碳结合到催化表面),然而根据本公开的CSN可表现出单一结合模式。该特性至少部分地可增加CSN表面上的二氧化碳和/或碳酸根离子的局部浓度和/或当与不具有壳材料的纳米颗粒相比时,二氧化碳和/或碳酸根离子吸附和/或化学吸附在CSN表面上的时间量(因此,增加可用于被催化芯组件催化的二氧化碳和/或碳酸根离子的浓度)。该特性还可有助于提高反应产物特异性。因此,壳材料可例如有助于克服与二氧化碳在含水电解质中的较差溶解度相关的问题,并且增强由这种类型的电化学电池产生的反应产物的催化活性和特异性。
壳材料的另一个期望的特性可为其调节CSN的表面的pH。例如,壳材料可调节CSN表面的碱度。此类pH调节可例如影响CSN的表面上的二氧化碳和/或碳酸根离子的吸附和/或化学吸附(因此,可影响可用于被催化芯组件催化的二氧化碳/碳酸根离子的浓度)。
壳材料的另一个期望的特性可以为降低反应中间体与CSN的结合能。例如,由具有高结合能的反应中间体的催化剂催化的反应通常比具有较低结合能的催化剂催化的反应需要更多的能量。通过降低反应中间体的结合能,壳材料可因此通过减少反应所需能量的量来改善催化芯组件的催化活性。
壳材料的另一个期望的特性可以为其对电子反转的影响。例如,壳材料可包含有利于快速电子反转的组分,与不具有壳材料的催化剂纳米颗粒相比,这可提高催化芯组件对二氧化碳的转化率。
壳材料可具有上述特性中的一些或全部。
壳材料可包含卤素。卤素可例如能够与碳形成强化学键。根据一些方面,卤素可由卤化物和/或三元化合物的阴离子构成。例如,壳材料可包含氟化物和/或氟氧化物。
壳材料可包含氧。根据一些方面,氧原子可由阴离子,例如氧化物、氢氧化物和/或氟氧化物的阴离子构成。
壳材料还可包含金属。例如,金属能够提供氧化还原对,其有利于在二氧化碳还原期间快速电子反转。根据一些方面,金属可由卤化物、氧化物、氢氧化物和/或三元化合物的阳离子构成。可用于壳材料中的金属的示例包括但不限于镧、钙、铈、镁和锰。
壳材料可包含有机分子。如本文所用,术语“有机分子”是指在环和/或链中包含一个或多个碳原子连同与其键合的一个或多个其他原子(例如氢、氧和氮)的分子。
根据本公开有用的壳材料的示例包括但不限于,LaF3、La(OH)3、CeF3、CaF2、MgF2、MeF3、LaOF、CeOF、La2O3、CeO2、有机分子(包括,例如,包含一个或多个胺(NH2)基团的有机分子)、以及它们的组合。
本公开的各方面还整体涉及包含本文所述的多功能CSN的电化学电池和电化学电池电极。具体地讲,如图4所示,本公开的电化学电池40可至少包括包含多功能CSN 42的阴极41、阳极43、和液体电解质44,并且可在电池通电时将二氧化碳转化成有用的产物(例如燃料、聚合物等)。例如,电化学电池可将二氧化碳还原成一氧化碳、C2-C3烷烃、C2-C3烯烃、C2-C3醇、C2-C3羧酸、C2-C3醛、或它们的组合。根据一些方面,电化学电池被通电但不产生任何附加的二氧化碳。
电化学电池可包括电极(例如,阴极),电极包括电催化剂,具体地讲包含如本文所述的CSN的电催化剂。本公开的电极表现出优于先前已知电极的某些区别特性。例如,与本领域已知的其他电极相比,根据本发明的电极可表现出较高的催化活性、稳定性和选择性。这些区别特性可至少部分地由CSN的催化芯组件与一个或多个外壳的组合导致。
例如,本公开的各方面的电极可表现出比已知电极高的稳定性,这至少部分地是由于CSN的外壳。例如,外壳可保护催化芯组件免受电解质溶液的腐蚀和/或抑制析氢反应。外壳还可减少或抑制来自电解质中的杂质的碳沉积和/或金属沉积,这可随时间推移而降低催化性能。本公开的电极还可表现出较高的催化活性和/或选择性,这至少部分地是由于如本文所述的壳材料的期望特性。
根据一些方面并且如上所述,CSN的某些特性可由例如外壳在催化芯组件上的覆盖量(即,壳覆盖百分比)导致。
例如,如果外壳覆盖100%的催化芯组件的表面区域,则CSN可表现出高稳定性(即,最大化保护催化材料免受失活或中毒),这是由于最大化化学吸附/吸附位点的高化学吸附/吸附,以及大量氧化还原反应位点。如果外壳部分地覆盖催化芯组件的表面区域,则与完全覆盖相比,可存在更多的暴露的催化活性位点(因此,可存在能够催化二氧化碳还原的更多的催化活性位点)。
本公开的各方面还涉及制备本文所述的组件的方法,以及使用本文所述的CSN、电极和/或电化学电池将二氧化碳电化学转化成有用产物的方法。
例如,用于制备CSN的方法可包括将催化材料纳米颗粒、还原剂、金属盐和氟化物盐混合,以围绕包含催化材料纳米颗粒的芯形成包含金属卤化物壳或金属卤氧化物壳的涂覆的金属纳米颗粒。
催化材料可包含一种或多种金属。用于形成芯的金属可通过将金属前体溶液与还原剂混合以形成金属纳米颗粒来合成。
在一些实施方案中,用于形成芯的金属纳米颗粒可以在稳定剂的存在下合成,稳定剂在合成期间防止或以其他方式抑制金属纳米颗粒的氧化,并且在其上形成金属卤化物壳或金属卤氧化物壳之前易于从金属纳米颗粒去除。例如,在金属纳米颗粒合成期间使用的本体聚合物诸如聚乙烯吡咯烷酮(分子量为55,000g/mol)抑制金属纳米颗粒的氧化。然而,此类稳定剂在合成后不易从金属纳米颗粒去除。不受任何特定理论的限制,残余稳定剂可在由金属纳米颗粒形成的芯与金属卤化物壳或金属卤氧化物壳之间形成附加层,这降低了所需系统中的CSN的性能。
因此,稳定剂可用于合成用于形成芯的金属纳米颗粒,稳定剂易于从芯中去除,以在其上直接形成金属卤化物壳或金属卤氧化物壳之前使芯的表面上的稳定剂的量最小化。在一个非限制性示例中,一种或多种稳定剂可用于合成金属纳米颗粒,稳定剂包括小于1000g/mol,任选地小于500g/mol,任选地小于375g/mol,并且任选地小于350g/mol的分子量(单独分子量或重均分子量)。示例性示例包括分子量为364g/mol的十六烷基三甲基溴化铵(CTAB)、分子量为192g/mol的柠檬酸、以及它们的混合物。
可通过将用于形成芯的分离的金属纳米颗粒与例如进行反应以将金属卤化物壳直接沉积到芯上的金属盐溶液和卤化物盐溶液混合来形成CSN的壳。壳可完全围绕芯或其可仅部分地覆盖芯。在一些实施方案中,用于形成壳的金属盐选自碱金属盐、碱土金属盐和过渡金属盐。在某些实施方案中,用于形成壳的金属盐为过渡金属盐。在某些实施方案中,用于形成壳的金属盐选自镧盐、铈盐和镁盐。在某些实施方案中,用于形成壳的金属盐选自镧盐和铈盐。在某些实施方案中,金属盐为镧盐。在一个优选的实施方案中,镧盐为硝酸镧。在一些实施方案中,卤化物盐为氟化钠。
在其他实施方案中,本公开涉及包含本文所公开的CSN的电极。关于CSN及其制备方法进行描述的所有方面和实施方案均同样适用于电极。在一个非限制性示例中,电极为用于将二氧化碳转化成有机原料的电化学电池中的阴极。“惰性气氛”是指气体混合物,其包含很少或不包含氧并且包含一种或多种惰性气体或非反应性气体,在它们反应之前具有高阈值。惰性气氛可以是但不限于分子氮或惰性气体,诸如氩气,或它们的混合物。
“还原剂”是在其自身被氧化的同时导致另一种物质还原的物质。还原是指化学物质对电子的增益,氧化是指化学物质对电子的损失。
“金属盐”为离子络合物,其中阳离子为带正电的金属离子,并且阴离子为带负电的离子。“阳离子”是指带正电的离子,并且“阴离子”是指带负电的离子。在根据本公开的“金属盐”中,阴离子可以为任何带负电的化学物质。根据本公开的金属盐中的金属可包括但不限于碱金属盐、碱土金属盐、过渡金属盐、铝盐或后过渡金属盐、以及它们的水合物。
“碱金属盐”为金属盐,其中金属离子为碱金属离子、或元素周期表的第I族中的金属,诸如锂、钠、钾、铷、铯或钫。
“碱土金属盐”为金属盐,其中金属离子为碱土金属离子,或元素周期表的第II族中的金属,诸如铍、镁、钙、锶、钡或镭。
“过渡金属盐”为金属盐,其中金属离子为过渡金属离子,或元素周期表的d区中的金属,包括镧系元素和锕系元素。过渡金属盐包括但不限于下列金属的盐:钪、钛、钒、铬、锰、铁、钴、镍、铜、锌、钇、锆、铌、钼、锝、钌、铑、钯、银、镉、镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥、铪、钽、钨、铼、锇、铱、铂、金、汞、锕、钍、镤、铀、镎、钚、镅、锔、锫、锎、锿、镄、钔、锘和铹。
“后过渡金属盐”是金属盐,其中金属离子为后过渡金属离子,诸如镓、铟、锡、铊、铅、铋或钋。
“氟化物盐”是其中阴离子为氟离子的离子络合物。根据本公开,氟化物盐的阳离子可以为任何带正电的化学物质。
“金属氟化物”是其中阳离子为金属离子并且阴离子为氟离子的离子络合物。根据本公开,金属盐和氟化物盐反应以围绕金属纳米颗粒芯产生金属氟化物壳。
术语“电化学电池”是指通过引入电能而有利于化学反应的装置和/或装置部件。电化学电池具有两个或更多个电极(例如,正极和负极)和电解质。
虽然已经结合上述各示例性方面描述了本文所述的各方面,但各种另选方案、修改、变型、改善和/或基本等同形式(无论是已知的还是目前不可预见的或可能不可预见的)对于至少本领域普通技术人员而言可变得显而易见。因此,如上所示,各示例性方面旨在是示例性的而不是限制性的。在不脱离本公开的实质和范围的情况下可进行各种改变。因此,本公开旨在涵盖所有已知或以后开发的另选方案、修改、变型、改善和/或基本等同形式。
因此,权利要求并不旨在限于本文所示的各方面,而是赋予符合权利要求书的语言的全部范围,其中除非特别指明,以单数形式提及要素不旨在表示“一个且仅一个”,而是“一个或多个”。本领域的普通技术人员已知或以后将认识到的本公开中所述的各方面的要素的所有结构和功能等同形式均明确地以引用方式并入本文,并且旨在由权利要求书涵盖。此外,本文所公开的任何内容均不旨在对公众专用,无论在权利要求书中是否明确地叙述了此类公开内容。除非使用短语“意指”明确列举了所述要素,否则任何权利要求要素均不可理解为方式加功能。
此外,单词“示例”在本文中用于表示“用作示例、实例或例证”。本文描述为“示例”的任何方面均不必被理解为比其他方面优选或有利。除非另外特别说明,否则术语“一些”是指一个或多个。组合诸如“A、B或C中的至少一种”,“A、B和C中的至少一种”和“A、B、C、或它们的任何组合”包括A、B和/或C的任何组合,并且可包括A的倍数、B的倍数或C的倍数。具体地讲,组合诸如“A、B或C中的至少一种”、“A,B和C中的至少一种”和“A、B、C、或它们的任何组合”可以仅为A、仅为B、仅为C、A和B、A和C、B和C,或者A和B和C,其中任一种此类组合可包含A、B或C中的一个或多个成员。本文所公开的任何内容均不旨在对公众专用,无论在权利要求书中是否明确地叙述了此类公开内容。
示出以下实施例以便向本领域的普通技术人员提供如何制造和使用本发明的完整公开和说明,并且不旨在限制本发明人视作其发明的范围,也不旨在示出以下实验是全部或唯一进行的实验。已经努力确保使用的数(例如,量、尺寸等)的准确性,但应当考虑一些实验误差和偏差。
I.包含金属芯和金属卤化物壳或金属卤氧化物壳的CSN
在一个实施方案中,提供了CSN,其包括至少部分地被金属卤化物壳或金属卤氧化物壳围绕的金属芯。
在一个示例性示例中,提供了卤化物壳,其被定制为保护金属芯纳米颗粒免受电极环境的影响,同时保持金属纳米颗粒的期望性能。在一个非限制性示例中,芯可包含铜金属,并且壳可包含LaF3。
制备CSN的方法可包括提供包含金属纳米颗粒和还原剂的第一混合物,以及将第一混合物与包含金属盐和卤化物盐的溶液混合以在金属纳米颗粒上形成金属卤化物壳或金属卤氧化物壳。
I(a).金属芯的合成和分离
一般来讲,用作金属芯的金属纳米颗粒可通过在一种或多种稳定剂的存在下使金属盐溶液与还原剂反应来合成。在一个示例性示例中,金属盐溶液包含作为金属盐的硝酸铜(II)半五水合物(Cu(NO3)2·2.5H2O)。将金属盐与CTAB和水混合,并且混合物的pH可用例如铵或氢氧化钠调节至约10至11的pH。
在将还原剂加入金属盐溶液中之前,可将还原剂与一种或多种稳定剂和水混合,并且在与金属盐溶液混合之前混合一段时间,诸如二十分钟。还原剂选自:肼、硼氢化钠、氰基硼氢化钠、连二硫磺酸钠、二亚硫酸钠、硫酸铁(II)、氯化锡(II)、碘化钾、草酸、甲酸、抗坏血酸、硫代硫酸盐、二硫代硫酸盐、磷酸、亚磷酸盐和次磷酸盐。在一个优选的实施方案中,还原剂为肼。
将金属盐溶液和还原剂混合以形成金属纳米颗粒。金属纳米颗粒的合成在不含氧的气氛中进行。不含氧的气氛的示例性示例包括但不限于氮气、氩气、氦气、氢气、以及它们的混合物。合成后,将金属纳米颗粒与合成溶液分离。应当理解,分离金属纳米颗粒的方法不受限制,并且可包括一种或多种技术,诸如过滤、滗析和离心。金属纳米颗粒可用溶剂诸如乙醇洗涤一次或多次,以从其表面除去任何残余的稳定剂或其他有机材料。
I(b)壳形成
一般来讲,可将分离的金属纳米颗粒在不含氧的气氛下再分散于包含附加还原剂的水溶液中。然后在不含氧的气氛下,将包含分离的金属纳米颗粒和还原剂的混合物与用于在金属纳米颗粒芯上形成金属卤化物壳的金属盐溶液和卤化物盐溶液混合。可将用于形成壳的金属盐溶液和氟化物盐溶液依次加入纳米颗粒混合物中,或将用于形成壳的金属盐溶液和氟化物盐溶液同时加入纳米颗粒混合物中。
I(c)比较例1和实验例1
在比较例1中,制备不具有壳的铜纳米颗粒并进行分析。首先,在室温下将2mmol的Cu(NO3)2·2.5H2O和1.87mmol的CTAB溶于75ml水中,并且添加0.5ml NH4OH(28重量%至30重量%的NH3的水溶液,14.8M)以将pH调节至约10至11。在氩气下制备包含肼(3ml的50%至60%试剂级)、CTAB(1.87mmol)和柠檬酸(0.38mmol)的水(75ml)溶液并且混合约20分钟,然后添加硝酸铜溶液。将反应混合物搅拌1.5小时,以使铜纳米颗粒生长最大化。分离并洗涤所得的铜纳米颗粒(~50nm)。具体地讲,将反应合成混合物离心、滗析、与乙醇混合并超声处理。图5示出了原样制得的铜纳米颗粒的X射线衍射(XRD)谱。可观察到三个峰,全部均对应于Cu(°2θ):43.0、50.5和74.0。然而,当暴露于空气时,Cu氧化成Cu2O,其至少早在4天的时候就开始形成,并且是9天后的主要产物。这在图6示出,其示出了在29.5、42.3、61.3和73.5°2θ处新的峰的外观,其对应于Cu2O。
在实验例1中,根据本公开制备了CSN,其包括芯,芯包含涂覆有包含氟化镧(Cu/LaF3)的壳的铜纳米颗粒。使用与比较例1相同的方法制备~50nm铜纳米颗粒,但是在分析并洗涤铜纳米颗粒之后,在氩气气氛下再分散于水和3ml的肼(3ml的50%-60%试剂级)中。向水、铜纳米颗粒和肼的混合物中添加La(NO3)3·6H2O的溶液(在15ml H2O中1mmol)和NaF的溶液(在15ml H2O中1mmol)。将反应混合物搅拌10分钟,并且然后离心。
沉淀通过离心分离,并且通过XRD分析。合成的CSN的XRD谱示于图7中。XRD谱示出5个峰(°2θ):25.0(LaF3),28.0(LaF3),43.5(Cu),50.4(Cu),74.0(Cu)。图8示出了在暴露于空气9天、16天和23天时CSN的堆叠XRD谱。与比较例1相比,未观察到图谱变化。图9A和图9B示出合成的CSN的TEM图像。如图所示,铜纳米颗粒芯被LaF3壳覆盖。壳具有约0.30纳米的厚度。图10A至图10C示出合成的CSN的高分辨率TEM图像。中心黑色区域对应于铜芯,并且外周黑色和白色区域对应于LaF3壳。附图示出了铜芯被LaF3壳均匀覆盖。
因此,实验例1中合成的CSN提供了能够保护下面的金属芯的壳。此类CSN可用于其中操作条件可溶解、氧化或换句话讲污染金属芯的应用。示例性示例包括CSN作为与电化学电池的阴极一起用于将CO2转化成有机原料的催化剂的用途。
II.包含改性的金属芯和覆盖改性的芯的金属卤化物壳或金属卤氧化物壳的CSN
在一些应用中,期望该芯包含金属氧化物。在一个实施方案中,提供了CSN,其包括芯和壳,芯包含涂覆有金属纳米颗粒的氧化物的金属纳米颗粒,壳包含至少部分地围绕金属芯的金属氧化物层的金属卤化物或金属卤氧化物。
在一个示例性示例中,可在电化学电池的电极中包含CSN以用于将二氧化碳转化成有机原料。不受任何具体理论的限制,在金属芯的外表面上形成金属氧化物层可改善芯壳催化剂在电化学电池中的选择性和催化活性。可在纳米颗粒芯和/或壳的合成期间控制金属氧化物层的形成和氧化物的状态以产生期望的催化剂特性。
制备CSN的方法可包括在金属纳米颗粒上形成金属氧化物层,以及用金属卤化物或金属卤氧化物壳涂覆金属氧化物层,金属卤化物或金属卤氧化物壳由包含金属盐的溶液和包含卤化物盐的溶液形成。金属氧化物层可在卤化物壳或卤氧化物壳形成之前或期间形成。
II(a)用于形成芯的金属纳米颗粒的合成和分离
可以与I(a)中所述相同的方式制备和分离用于形成壳-芯颗粒的芯的金属纳米颗粒。
II(b)壳形成
分离的金属纳米颗粒在不含氧的气氛下再分散于水溶液中。与I(a)不同,该水溶液不含还原剂。然后在不含氧的气氛下,将包含分离的金属纳米颗粒的混合物与用于在纳米颗粒芯上形成金属卤化物壳的金属盐和卤化物盐混合。应当理解,在金属纳米颗粒上形成的金属氧化物层可在合成其上的壳之前或期间形成,以制备CSN,CSN包括包含涂覆有金属氧化物层的金属颗粒的芯和涂覆该芯的金属氧化物层的壳。
在一些实施方案中,金属盐选自碱金属盐、碱土金属盐和过渡金属盐。在某些实施方案中,金属盐选自镧盐、铈盐和镁盐。
用于芯的示例性金属包括但不限于铁、钴、镍、铜和铅。在一个非限制性示例中,芯由涂覆有铜氧化物(CuOx)的铜金属构成。在一个非限制性示例中,CuOx为CuO2。用于壳的示例性化合物包括CeF3、CeOF、LaF3和LaOF。
II(c)实验例2
合成CSN,CSN包括包含涂覆有氧化铜层的铜纳米颗粒的芯和包含覆盖铜氧化物层的氟化镧的壳(Cu/CuOx/LaF3)。实验例2与实验例1相同地进行,不同的是将~50nm铜纳米颗粒在不具有还原剂的情况下并且在氩气氛下再分散于水中。在壳形成步骤期间不存在还原剂的情况下,在壳与图3B中所示类似地形成时,铜纳米颗粒的外表面转化成铜氧化物层。
如图11中所示,实验例2中合成的CSN的XRD谱示出6个峰(°2θ):36.5(Cu2O)、42.3(Cu2O)、43.5(Cu)、50.4(Cu)、61.5(Cu2O)、74.0(Cu2O)。
包括包含涂覆有Cu2O层的Cu纳米颗粒的芯和包含涂覆Cu2O层的LaF3的壳的所得芯-壳颗粒可用作催化剂,并且可被包括作为用于将二氧化碳转化成有机原料的电化学电池的阴极的一部分。LaF3壳能够保护芯的活性催化剂位点,同时增加可用于转化的CO2的局部浓度。
III.包含改性金属芯和金属卤化物壳或金属卤氧化物壳的CSN
在一个实施方案中,提供了CSN,其包括包含金属氧化物纳米颗粒的芯和至少部分地涂覆芯的壳。壳包括金属卤化物壳或金属卤氧化物壳。
在一个示例性示例中,可在电化学电池的电极中包含CSN以用于将二氧化碳转化成有机原料。不受任何具体理论的限制,金属氧化物的形成可改善芯-壳催化剂在电化学电池中的选择性和催化活性。可在纳米颗粒芯和/或壳的合成期间控制金属氧化物的形成以产生期望的催化剂特性。
CSN可通过将金属纳米颗粒转化为金属氧化物纳米颗粒,并且通过在包含金属盐的溶液和包含卤化物盐的溶液中混合,在金属氧化物颗粒上形成壳来形成。金属纳米颗粒可在与金属盐和在其上形成壳的卤化物盐混合之前和/或之后转化成氧化物。
III(a)改性金属芯的合成和分离
可以与I(a)和II(a)中所述相同的方式制备和分离用于形成壳-芯颗粒的芯的金属纳米颗粒。然后,将分离的金属纳米颗粒改性以将金属纳米颗粒转化为金属氧化物纳米颗粒。在一个非限制性示例中,可通过将金属纳米颗粒再分散在不含还原剂的水溶液中并使混合物暴露于含氧气氛中,将金属纳米颗粒至少部分地转化成金属氧化物纳米颗粒。
III(b)壳形成
除此之外或另选地,通过在金属卤化物壳或金属卤氧化物壳的形成期间将金属纳米颗粒暴露于含氧气氛中,可将分离的金属纳米颗粒转化成金属氧化物纳米颗粒。例如,可将分离的金属纳米颗粒与包含金属盐的溶液和包含卤化物盐的溶液在含氧气氛下混合,以将金属纳米颗粒转化为金属氧化物纳米颗粒并在金属氧化物纳米颗粒芯上形成金属卤化物壳或金属卤氧化物壳。应当理解,芯壳结构的氧化芯可以是单个颗粒,或者其可以是较小的金属氧化物纳米颗粒的附聚物。还应当理解,金属氧化物芯可以为中空的,如图1C所示。
用于芯的示例性金属包括但不限于铁、钴、镍、铜和铅。在一个非限制性示例中,芯由氧化铜(CuOx)构成。在一个非限制性示例中,CuOx为CuO2。用于壳的示例性化合物包括CeF3、CeOF、LaF3和LaOF。
III(c)实验例3
合成CSN,CSN包含氧化铜纳米颗粒芯和氟化镧壳。首先,在室温下将2mmol的Cu(NO3)2·2.5H2O和1.87mmol CTAB溶于75ml水中,并且添加0.5ml NH4OH(28重量%至30重量%的NH3水溶液,14.8M)以将pH调节至约10至11。在氩气下将硝酸铜溶液倾注到包含肼(3ml的50%至60%试剂级)、CTAB(1.87mmol)和柠檬酸(0.38mmol)的水(75ml)溶液中。将反应混合物搅拌1.5小时,以使铜纳米颗粒生长最大化。分离并洗涤所得的铜纳米颗粒(~50nm)。具体地讲,将反应合成混合物离心、滗析、与乙醇混合并超声处理。将这些步骤再重复两次,并且在开放空气下将铜纳米颗粒重新分散于150ml水中。
向水和铜纳米颗粒的混合物中添加La(NO3)3·6H2O(在15ml H2O中1mmol)和NaF(在15ml H2O中1mmol)。将反应混合物搅拌10分钟,并且然后离心。沉淀通过离心分离,并且通过XRD分析。如图12所示,合成的纳米颗粒的XRD谱示出4个峰(°2θ):36.5、42.3、61.5和73.5,全部均对应于Cu2O。
包括Cu2O芯和LaF3壳的所得芯-壳颗粒可用作催化剂,并且可被包括作为用于将二氧化碳转化成有机原料的电化学电池的阴极的一部分。LaF3壳可保护芯的活性催化剂位点,同时增加可用于转化的CO2的局部浓度。
IV.包含金属芯和金属卤化物壳的CSN
IV(a)金属芯的合成和分离
可以与I(a)和II(a)中所述相同的方式制备和分离用于形成CSN的芯的金属纳米颗粒。用于芯的示例性金属包括但不限于铁、钴、镍、铜和铅。在该示例中,芯包含铜。
IV(b)壳形成
在不含氧的气氛下,将来自IV(a)的分离的金属纳米颗粒的一个样品(样品1)再分散于水溶液(300mL)中。向该水溶液中,同时加入包含La(NO3)3-6H2O(1mmol)的水(60mL)溶液,并且在氩气下搅拌60分钟。然后分离样品,弃去上清液,并且然后将样品再分散于水(300mL)中。以6mL/min注射NaF(1mmol)的水溶液(60mL)。将溶液搅拌60分钟,并且然后分离并用EtOH洗涤两次。
在不含氧的气氛下,将来自IV(a)的分离的金属纳米颗粒的另一个样品(样品2)再分散于水溶液(300mL)中。向该水溶液中,同时加入包含La(NO3)3-6H2O(2mmol)的水(60mL)溶液,并且在氩气下搅拌60分钟。然后分离样品,弃去上清液,并且然后将样品再分散于水(300mL)中。以6mL/min注射NaF(2mmol)的水(60mL)溶液。将溶液搅拌60分钟,并且然后分离并用EtOH洗涤两次。
在不含氧的气氛下,将来自IV(a)的分离的金属纳米颗粒的另一个样品(样品3)再分散于水溶液(300mL)中。向该水溶液中,同时加入包含La(NO3)3-6H2O(4mmol)的水(60mL)溶液,并且在氩气下搅拌60分钟。然后分离样品,弃去上清液,并且然后将样品再分散于水中(300mL)。以6mL/min注射NaF(4mmol)的水(60mL)溶液。将溶液搅拌60分钟,并且然后分离并用EtOH洗涤两次。
IV(c)实验例4
首先,使用ICP和EDS分析根据IV(b)制备的样品1、样品2和样品3(即具有铜芯和LaF3壳的CSN)以用于评估壳覆盖率。
为评估壳覆盖率,首先基于如下模型评估全壳覆盖率(即,100%壳覆盖率),其中假设CSN的形状为球体,假设芯的尺寸为约50nm,并且假设LaF3壳的厚度为约3nm至5nm。基于该模型,确定每个样品的经评估的全壳覆盖率对应于约12重量%至17重量%的LaF3。
然后,使用ICP和EDS测量由三个样品中的每一个包含的LaF3的按重量计的量。基于这些测量结果,确定样品1包含约2.1重量%的LaF3,样品2包含约3.6重量%的LaF3,并且样品3包含约5.7重量%的LaF3。通过将这些值与对应于经评估的全壳覆盖率的LaF3的量进行比较,确定样品1包含约18%的壳覆盖率,样品2包含约34%的壳覆盖率,并且样品3包含约50%的壳覆盖率。
在评估每个样品的壳覆盖百分比后,研究并比较每个样品的CO2吸附和催化活性。还将样品与包含裸铜纳米颗粒(即,具有0%壳覆盖率)的对照进行比较。
首先,测量每个样品的电流密度,并且然后与对照进行比较。就这些测量而言,制备电池,该电池具有玻璃碳电极和包含0.1M KHCO3的电解质。相对于RHE使用1.1V的电势。这些测量的结果在图17中示出。如可由图17所示,具有约34%壳覆盖率(即,样品2)的样品预料不到地提供了最高电流密度,这显著高于由具有约50%壳覆盖率(即,样品3)的样品提供的电流密度。
还测量了由样品吸附的CO2的量(以mg/g为单位)。如可在图18A和图18B中所见,CSN的吸附行为似乎与其测得的电流密度相关。具体地讲,对应于较高的CO2吸附的增加的壳覆盖百分比最高至约34%壳覆盖率,此后其看起来显著降低。此外,据观察,与对照相比,样品CSN示出最多两倍至三倍多的CO2吸附。
最后,将样品的固有催化活性与本领域中用于CO2缩合的其他催化剂活性进行比较。具体地讲,将由样品提供的CO2缩合产物与由对照提供的那些产物连同由铜立方体(44nm和63nm两者)和铜箔(如Loiudice、Anna等人“在电化学CO2还原中针对C2产物定制铜纳米晶体。”《应用化学国际版》,第55卷,第19期,2016年5月,第5789至5792页(Loiudice,Anna,et al.“Tailoring Copper Nanocrystals towards C2 Products in Electrochemical CO2Reduction.”Angewandte Chemie International Edition,vol.55,no.19,May 2016,pp.5789-5792))以及由铜膜(具有3.6μm厚度,如Ren、Dan等人所述,“氧化铜(I)催化剂上二氧化碳选择性电化学还原成乙烯和乙醇”。《美国化学学会催化杂志》,第5卷,第5期,2015年,第2814至2821页(Ren,Dan,et al.“Selective Electrochemical Reduction of Carbon Dioxide to Ethylene and Ethanol on Copper(I)Oxide Catalysts.ACS Catalysis,vol.5,no.5,2015,pp.2814-2821”))提供的那些进行比较。使用气相色谱法(GC)测量由每种催化剂产生的气体产物,并且使用高效液相色谱法(HPLC)测量由每种催化剂产生的醇的量,如分别由图19A和图19B示出的。如可在图19A和19B中所见,与本领域已知的其他催化剂相比,样品CSN产生增加量的醇产物并且表现出增强的固有催化活性。还应当注意,样品CSN产生乙醇和正丙醇的组合,然而本领域已知的催化剂产生乙醇、甲醇、丙醇和烯丙醇的组合。该数据指示样品CSN提供比本领域已知的其他催化剂高的产物选择性。
V.包含金属芯和金属氢氧化物壳的CSN
V(a)金属芯的合成和分离
可以与I(a)、II(a)和IV(a)中所述相同的方式制备和分离用于形成CSN的芯的金属纳米颗粒。用于芯的示例性金属包括但不限于铁、钴、镍、铜和铅。在该示例中,芯包含铜。
IV(b)壳形成
在不含氧的气氛下,将来自V(a)的分离的金属纳米颗粒的一个样品(样品1)再分散于水溶液(300mL)中。向该水溶液中,同时加入包含La(NO3)3-6H2O(0.1mmol)的水(60mL)溶液,并且在氩气下搅拌60分钟。然后分离样品,弃去上清液,并且然后将样品再分散于水(300mL)中。以3mL/min注射水合肼(1.5mL)的水溶液(其中将水的体积调节至等于总共30mL)。将溶液搅拌60分钟,并且然后分离并用EtOH洗涤两次。
在不含氧的气氛下,将来自V(a)的分离的金属纳米颗粒的另一个样品(样品2)再分散于水溶液(300mL)中。向该水溶液中,同时加入包含La(NO3)3-6H2O(1.0mmol)的水(60mL)溶液,并且在氩气下搅拌60分钟。然后分离样品,弃去上清液,并且然后将样品再分散于水(300mL)中。以3mL/min注射水合肼(2mL)的水溶液(其中将水的体积调节至等于总共30mL)。将溶液搅拌60分钟,并且然后分离并用EtOH洗涤两次。
在不含氧的气氛下,将来自V(a)的分离的金属纳米颗粒的另一个样品(样品3)再分散于水溶液(300mL)中。向该水溶液中,同时加入包含La(NO3)3-6H2O(2mmol)的水(60mL)溶液,并且在氩气下搅拌60分钟。然后分离样品,弃去上清液,并且然后将样品再分散于水(300mL)中。以3mL/min注射水合肼(3mL)的水溶液(其中将水的体积调节至等于总共30mL)。将溶液搅拌60分钟,并且然后分离并用EtOH洗涤两次。
V(c)实验例5
首先,以IV(c)中所述的方式分析根据IV(b)制备的样品1、样品2和样品3(即,具有铜芯和La(OH)3壳的CSN)以用于评估壳覆盖率。据测定,样品1构成约10%壳覆盖率,样品2构成约24%壳覆盖率,并且样品3构成约47%壳覆盖率。
在评估每个样品的壳覆盖百分比后,以IV(c)中所述的方式研究并比较每个样品的CO2吸附和催化活性。
如可由图20所见,具有约10%的壳覆盖率(即,样品1)的样品预料不到地提供了最高电流密度,这显著高于由对照、具有约24%的壳覆盖率的样品(即,样品2)、和具有约47%的壳覆盖率的样品(即,样品3)提供的电流密度。
还测量了由样品吸附的CO2的量(以mg/g为单位)。如可由图21A和图21B所见,CSN的吸附行为似乎与其测得的电流密度类似。具体地讲,对应于较高的CO2吸附的增加的壳覆盖百分比最高达约10%壳覆盖率,此后其降低。然而,由具有约24%壳覆盖率的CSN提供的CO2吸附仍然大于由裸铜纳米颗粒(即,对照)提供的CO2吸附。
最后,以IV(c)中所述的方式测量由样品提供的CO2转化产物。具体地讲,如可在图22中所见,具有La(OH)3壳的样品CSN产生一定量的醇产物(即,乙醇和正丙醇),其类似于IV中所述的CSN产生的量(即,具有LaF3壳,如图19B中所示)。因此,确定类似于具有LaF3壳的CSN,与本领域已知的其他催化剂相比,具有La(OH)3壳的CSN还提供了增加量的醇产物并且表现出增强的固有催化活性。
比较例2
试图制备包括芯的CSN,芯包含涂覆有包含氟化镧的壳的铜纳米颗粒(Cu/LaF3)。比较例2与实验例1相同地进行,不同的是使用1mmolLaCl3·7H2O代替La(NO3)3·6H2O。
在比较例2中合成的纳米颗粒的XRD谱示于图13中。XRD谱示出5个峰(°2θ):24.5(LaF3)、27.6(LaF3)、43.6(Cu)、50.5(Cu)、74.1(Cu)。因此,Cu在LaCl3和NaF的反应过程中保留。
然而,在比较例2的CSN暴露之后,Cu的氧化指示壳未适当地形成。图14示出了在暴露于空气8天、15天和22天后,比较例2中合成的纳米颗粒的堆叠XRD谱。在第8天开始观察到附加的峰(°2θ):35.4、36.4、38.8、42.5、44.8、48.7、52.3、61.5、73.5。至少在36.4、42.5、61.5和73.5°2θ处的峰符合Cu2O形成。符合Cu的在43.6、50.5和74.1°2θ处的峰的强度也减弱。如图15所示,TEM图像示出了Cu纳米颗粒被LaF3不均匀地局部覆盖,以及不与Cu纳米颗粒缔合的LaF3。因此,用LaCl3·7H2O制备的壳不产生期望的芯-壳组合物,因为其将使Cu芯暴露于电化学电池的环境中。此外,不与Cu纳米颗粒缔合的LaF3将降低掺入该混合物中的任何体系的总体效率。
比较例3
试图制备包括芯的CSN,芯包含涂覆有包含氟化镧的壳的铜氧化物纳米颗粒(CuOx/LaF3)。比较例3以与比较例2相同的方式进行,不同的是在与肼、CTAB和柠檬酸搅拌1.5小时后,铜纳米颗粒不与合成混合物分离,并且将1mmol的LaCl3.7H2O加入铜纳米颗粒合成混合物中。如图16所示,TEM图像示出铜纳米颗粒被分解成较小的铜纳米颗粒,并且芯壳结构未形成。因此,用LaCl3·7H2O制备的壳不产生期望的芯-壳组合物。
本文地址:https://www.jishuxx.com/zhuanli/20240726/121365.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表