GL-V9的两种晶型及其制备方法
- 国知局
- 2024-11-12 14:08:36
本发明属于药物化学领域,具体涉及两种gl-v9的晶型及其制备方法。
背景技术:
1、gl-v9属于黄酮类化合物汉黄芩素的衍生物,分子式为c24h27no5,化学名称为5-羟基-7-(4-吡咯-1-基)丁氧基-8-甲氧基黄酮,其结构式如式(i)所示。
2、
3、研究表明,gl-v9具有广泛的药理活性,目前,已于2024年4月递交临床研究审批(ind),有望成为一种新型的白血病治疗药物,为临床治疗提供新的选择。
4、同一药物的不同晶型往往会导致药物溶解度的差异,从而影响药物的溶出度和生物利用度,这进而会影响药物在体内的吸收利用,导致药物疗效的不同。因此,晶型是药物开发中剂型选择时必须关注的首要问题之一,也是药物能否有效吸收的关键因素之一。此外,通过研究药物的晶型特点,可以优化制剂工艺,改善固体药物制剂的性能,有效保证生产过程中不同批次药物的等效性。因此,筛选合适的晶型对后续药物开发至关重要。
5、申请公布号为cn115785048a的中国发明专利公开了一种gl-v9晶型及其制备方法,其报道gl-v9的晶型ⅰ,性质较为稳定,但生物利用度有待优化。
技术实现思路
1、本发明的目的在于解决现有技术中的不足,提供gl-v9的两种晶型及其制备方法。
2、本发明的晶型稳定性好、纯度、无引湿性,溶解度、引湿性符合药用要求,且制备方法简单,成本低廉,适用于工业大规模生产,对于该药物的研发生产具有重要价值;发明了gl-v9的两种新晶型固体物质的制备方法;涉及使用两种新晶型固体物质测定生物利用度,相较于先前报道的晶型生物利用度更高。
3、为了达到上述目的,本发明是通过以下技术方案实现的:
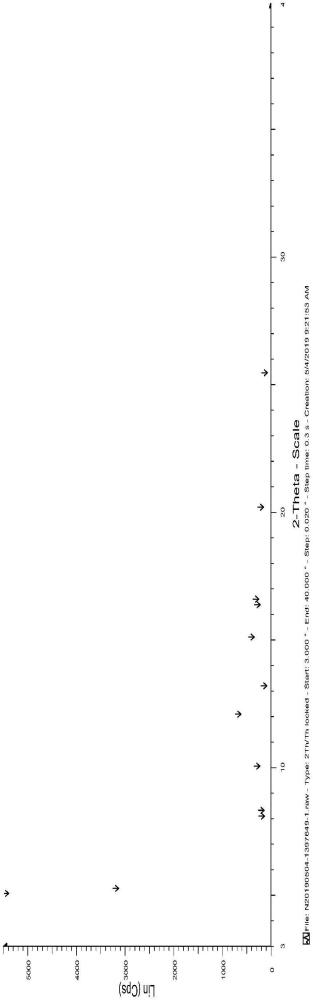
4、第一方面,本发明提供一种gl-v9晶型,为晶型ⅱ,使用cu-kα辐射检测的x射线粉末衍射光谱中,2θ值在:5.023°、5.220°、8.058°、8.284°、10.016°、12.056°、13.169°、15.084°、16.354°、16.574°、20.186°、25.463°处有衍射峰,2θ值精确度为±0.2°。
5、晶型ⅱ加热至143.8℃开始出现吸热峰,出现吸热峰前无重量损失,为无水物且是非溶剂合物。
6、另外,提供其制备方法,所述方法如下:
7、将gl-v9加热溶于溶剂a中;加热条件下,缓慢滴加溶剂b,保温搅拌;缓慢降温,析出固体,过滤干燥,得到gl-v9晶型ⅱ;其中,所述溶剂a选自95%乙醇、dmso、dmf、nmp或dma中的一种或两种以上的混合,溶剂b选自水、异丙醚或甲基叔丁基醚中的一种或两种以上的混合;
8、或,
9、将gl-v9加热溶于溶剂c中,保温搅拌;缓慢降温,析出固体,过滤干燥得到gl-v9晶型ⅱ;其中,所述溶剂c选自95%乙醇、dmso、dmf、nmp或dma中的一种或两种以上的混合。
10、优选的,溶剂a与溶剂b的体积比为1:1-10,gl-v9与溶剂a的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶时间为1~5小时。
11、优选的,gl-v9与溶剂c的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶时间为1~5小时。
12、第二方面,本发明提供另一种gl-v9晶型,为晶型ⅲ,使用cu-kα辐射检测的x射线粉末衍射光谱中,2θ值在:5.087°、6.557°、8.033°、8.370°、10.069°、11.807°、12.136°、13.026°、13.825°、15.078°、16.216°、16.656°、20.126°处有衍射峰,2θ值精确度为±0.2°。
13、晶型ⅲ加热至143.2℃开始出现吸热峰,出现吸热峰前无重量损失,为无水物且是非溶剂合物。
14、另外,提供其制备方法,所述方法如下:
15、将gl-v9加热溶于溶剂d中;加热条件下,缓慢滴加溶剂e,保温搅拌;缓慢降温,析出固体,过滤干燥,得到gl-v9晶型ⅲ;其中,所述溶剂d选自四氢呋喃、二氧六环、正丁醇或乙酸乙酯中的一种或两种以上的混合,溶剂e选自水、异丙醚或甲基叔丁基醚中的一种或两种以上的混合;
16、或,
17、将gl-v9加热溶于溶剂f中,保温搅拌;缓慢降温,析出固体,过滤干燥得到gl-v9晶型ⅲ;其中,所述溶剂f选自四氢呋喃、二氧六环、正丁醇或乙酸乙酯中的一种两种以上的混合。
18、优选的,溶剂d与溶剂e的体积比为1:1-10,gl-v9与溶剂d的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶搅拌时间为1~5小时。
19、优选的,gl-v9与溶剂f的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶搅拌时间为1~5小时。
20、本发明具有以下有益效果:(1)本发明与现有技术不同是发现了新的gl-v9的晶型固体物质。以gl-v9的固体物质存在状态为基础,结合晶型筛选技术,在药物有效成分的原料层面上开发gl-v9的不同晶型的存在种类与状态特征,将晶型研究与药效学研究相结合,为开发具有最佳临床疗效的gl-v9的晶型固体药物提供基础。
21、(2)本发明提供的晶型稳定性好,能很好地避免药物储存以及开发过程中发生转晶,从而避免生物利用度以及药效的改变。本发明提供的晶型几乎无引湿性,满足生物利用度和药效要求,对储存条件要求不苛刻,便于长期贮存。相较于已报道的晶型ⅰ,具有更好的生物利用度,有很高的市场价值。
技术特征:1.一种gl-v9晶型,为晶型ⅱ,使用cu-kα辐射检测的x射线粉末衍射光谱中,2θ值在:5.023°、5.220°、8.058°、8.284°、10.016°、12.056°、13.169°、15.084°、16.354°、16.574°、20.186°、25.463°处有衍射峰,2θ值精确度为±0.2°。
2.根据权利要求1所述的gl-v9晶型,其特征在于,晶型ⅱ加热至143.8℃开始出现吸热峰,出现吸热峰前无重量损失,为无水物且是非溶剂合物。
3.权利要求1或2所述的gl-v9晶型的制备方法,其特征在于,所述方法如下:
4.根据权利要求3所述的gl-v9晶型的制备方法,其特征在于,溶剂a与溶剂b的体积比为1:1-10,gl-v9与溶剂a的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶时间为1~5小时。
5.根据权利要求3所述的制备方法,其特征在于,gl-v9与溶剂c的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶时间为1~5小时。
6.一种gl-v9晶型,为晶型ⅲ,使用cu-kα辐射检测的x射线粉末衍射光谱中,2θ值在:5.087°、6.557°、8.033°、8.370°、10.069°、11.807°、12.136°、13.026°、13.825°、15.078°、16.216°、16.656°、20.126°处有衍射峰,2θ值精确度为±0.2°。
7.根据权利要求6所述的gl-v9晶型,其特征在于,晶型ⅲ加热至143.2℃开始出现吸热峰,出现吸热峰前无重量损失,为无水物且是非溶剂合物。
8.权利要求6或7所述的gl-v9晶型的制备方法,其特征在于,所述方法如下:
9.根据权利要求8所述的gl-v9晶型的制备方法,其特征在于,溶剂d与溶剂e的体积比为1:1-10,gl-v9与溶剂d的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶搅拌时间为1~5小时。
10.根据权利要求8所述的gl-v9晶型的制备方法,其特征在于,gl-v9与溶剂f的质量体积比为5:100-300,单位,g/ml;加热温度为35~100℃,析晶温度为-20~60℃,析晶搅拌时间为1~5小时。
技术总结本发明属于药物化学领域,具体涉及两种GL‑V9的晶型及其制备方法;两种GL‑V9的晶型分别晶型Ⅱ、晶型Ⅲ;两种GL‑V9的晶型稳定性好,溶解度、引湿性符合药用要求,且制备方法简单,成本低廉,对于该药物的研发生产具有重要价值;相较于现有技术中晶型生物利用度更高。技术研发人员:王举波,余思弦,张睿,李志裕,吴柒,张千华受保护的技术使用者:中国药科大学技术研发日:技术公布日:2024/11/7本文地址:https://www.jishuxx.com/zhuanli/20241112/327447.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。