沙丙蝶呤制剂的制作方法
- 国知局
- 2024-11-25 15:21:32
背景技术:
1、苯丙酮尿症(phenylketonuria,pku)和高苯丙氨酸血症(hyperphenylalaninemia,hpa)是影响身体如何分解氨基酸苯丙氨酸的病症。患有pku和hpa的患者不能分解苯丙氨酸,导致血液和脑中的氨基酸水平升高。这会导致脑损伤。pku是儿科医学邻域的一个相当大的问题,其在出生后不久通过足跟刺血测试(heel prickblood test)被诊断出来。
2、苯丙酮尿症(pku)和高苯丙氨酸血症(hpa)是由苯丙氨酸羟化酶基因的突变引起的病症,产生肝酶苯丙氨酸-4-羟化酶(phenylalanine-4-hydroxylase,pah)的非功能性酶[erlandsen 2004],这导致不能分解苯丙氨酸,并且进而导致血液和脑中的苯丙氨酸(phe)浓度升高。高苯丙氨酸血症(hpa)也可由缺乏四氢生物蝶呤(tetrahydrobiopterin,bh4),即一种pah的辅因子(bh4缺乏)引起。phe是一种必需氨基酸,其不是从头合成的,并且必须通过饮食获得。pah将phe转化为酪氨酸,其是儿茶酚胺和三聚氰胺的重要前体。pku是由pah基因突变引起的遗传性常染色体隐性疾病。
3、以前,pku的主要治疗方案涉及对患者实行限制的低phe饮食。最近,建议将沙丙蝶呤(bh4的生物活性6r-非对映异构体的合成二盐酸盐制剂[blau 2010])用于治疗pku和hpa以恢复苯丙氨酸羟化酶的活性。除了作为pah的辅因子和共底物之外,四氢生物蝶呤也是几种酶的辅因子,这些酶诸如是酪氨酸羟化酶、色氨酸羟化酶、甘油醚单加氧酶和氧化氮合酶。其涉及单胺神经递质的合成,包括去甲肾上腺素(降肾上腺素)、多巴胺和5-羟色胺(五羟色胺)以及自由基氧化氮,并且缺乏bh4的患者可能显示出由这些神经递质的产生受损而引起的神经学症状[blau 2010]。
4、沙丙蝶呤的结构,即式i,如下所示。
5、
6、沙丙蝶呤目前的处方是片剂或粉末。(配制的沙丙蝶呤)可以100mg片剂和用于再悬浮的100mg或500mg粉末小药囊形式自拜玛林(biomarin)购得。在片剂(100mg等同于77mg沙丙蝶呤)的情况下,制剂含有抗坏血酸、聚乙烯吡咯烷酮、无水磷酸氢钙、甘露糖醇、核黄素和延胡索酸硬脂酰钠;抗坏血酸保护活性化合物免受氧化[blau 2010]。科望(kuvan)片剂可以被整体吞咽或溶解于水或苹果汁中[kuvan 2016]。后者导致白色不溶性颗粒残留在悬浮液中,这可能是由于片剂制剂的组分,包括聚乙烯吡咯烷酮、延胡索酸硬脂酰钠和二碱式磷酸钙未溶解。
7、不应允许儿童咀嚼沙丙蝶呤片剂。由于二盐酸盐的酸性性质,咀嚼沙丙蝶呤片剂可能引起口腔或咽喉受刺激。如果将压碎的沙丙蝶呤片剂于苹果酱或代乳品中施用,则应当用水或其它液体冲洗口腔以防止口腔受刺激。[striepeke 2009]根据对治疗的反应,剂量可以在每天5mg/kg至20mg/kg的范围内调节,这通过测量血液phe来监测[kuvan 2015]。
8、当以20mg/ml(62mm)悬浮于各种食物和水中时,两种制剂(粉末和片剂)均相当稳定。无论食物的ph如何,一小时后仅3%-7%的沙丙蝶呤降解[jurecki 2009]。低降解速率可能是由于至少三个因素:
9、●高浓度:高浓度下的再悬浮降低了氧化速率
10、●制剂中的抗坏血酸充当氧化的临时牺牲底物
11、●食物抗氧化剂:大多数食物将包含内源性抗氧化剂。
12、尽管沙丙蝶呤在短时间暴露于食物和水时表现出适当的稳定性,但对于长时间暴露而言情况并非如此。在环境温度下,沙丙蝶呤在分子氧存在下不稳定。自氧化经由自由基链反应机制进行,其中引发步骤经由电子从沙丙蝶呤转移到氧进行。沙丙蝶呤与氧之间的直接反应起到引发反应的作用,使由此形成的超氧化物与沙丙蝶呤进一步快速反应,从而建立了涉及通过中间四氢生物蝶呤自由基来还原分子氧的链反应过程。
13、因此,长时间储存沙丙蝶呤会经由上述氧化过程导致降解。
14、沙丙蝶呤易溶于水并且具有酸性:1mm水溶液的ph是3.0,并且1m溶液的ph是0.45。
15、沙丙蝶呤与氧之间的反应在中性和碱性溶液中更强。由于氧化,沙丙蝶呤溶液变成黄色。
16、在室温下开放1小时后,0.1mm沙丙蝶呤的水溶液降解约25%,而1mm溶液仅降解2%。3小时后,0.1mm溶液降解超过60%,1mm溶液仅降解10%。ph也是降解速率的关键决定因素:在0.1m磷酸盐缓冲液(ph6.8)中,沙丙蝶呤的半衰期在室温下为约16分钟,并且在90分钟内完全破坏。然而,在0.1n hcl中的溶液在-20℃下稳定数周[sigma datasheet]。湿气也是氧化的驱动因素,在干燥条件下可获得最佳稳定性[jurecki 2009]。有趣的是,氧化副产物的性质取决于其中溶有沙丙蝶呤的缓冲液的ph、温度和组成[davis 1988]。
17、稳定剂(例如dte和抗坏血酸)可以减少溶液中的氧化。然而,这些化合物只能减缓而不是阻止沙丙蝶呤的降解[fiege 2004]。
18、由于沙丙蝶呤在溶液中氧化,因此不可能制备沙丙蝶呤的液体制剂。这给儿童服用沙丙蝶呤带来了巨大困难。如上所述,目前必须通过压碎片剂或使用小药囊,然后与食品或饮料混合来向儿童给药。此外,含有高浓度沙丙蝶呤的饮料或食品在给药后可能存在需要进一步考虑的事项,诸如需要用水或另一种饮料冲洗儿童的口腔以除去任何潜在的沙丙蝶呤残余物,从而避免可能由残余沙丙蝶呤引起的刺激。
19、因此,需要一种能够以液体形式施用的沙丙蝶呤制剂。此外,需要一种避免沙丙蝶呤在长期储存后降解的液体制剂。还需要一种无需施用后的进一步操作即可施用的液体制剂。本公开的实施方案寻求解决这些问题中的一个或多个问题。
技术实现思路
1、本公开涉及一种储存稳定的液体沙丙蝶呤制剂。在一些实施方案中,该制剂包含分散在油中的沙丙蝶呤的固体悬浮液。在一些实施方案中,该制剂可包含:
2、油中的粒状沙丙蝶呤,其中沙丙蝶呤以约1%w/v至约50%w/v的量存在。
3、在一些实施方案中,沙丙蝶呤可以下述量存在:约1%w/v至约30%w/v、约1%w/v至约25%w/v、约1%w/v至约20%w/v、约5%w/v至约50%w/v、约5%w/v至约30%w/v、约5%w/v至约25%w/v、约5%w/v至约20%w/v或约5%w/v至约15%w/v。%w/v的表达涉及g/ml。例如,油中10%w/v的沙丙蝶呤等同于1ml油中0.1g的沙丙蝶呤。在一些实施方案中,沙丙蝶呤可以约7.5%至约12.5%的量存在。在一些实施方案中,沙丙蝶呤可以约10%w/v的量存在。
4、在一些实施方案中,该制剂可包含:
5、油中的粒状沙丙蝶呤,其中沙丙蝶呤以约0.01g/ml油至约0.5g/ml油的量存在。
6、在一些实施方案中,沙丙蝶呤可以下述量存在:约0.01g/ml油至约0.3g/ml油、约0.01g/ml油至约0.25g/ml油、约0.01g/ml油至约0.2g/ml油、约0.05g/ml油至约0.50g/ml油、约0.05g/ml油至约0.30g/ml油、约0.05g/ml油至约0.25g/ml油、约0.05g/ml油至约0.20g/ml油或约0.05g/ml油至约0.15g/ml油。在一些实施方案中,沙丙蝶呤可以约0.1g/ml油的量存在。
7、在一些实施方案中,本公开的制剂可以是液体。在一些实施方案中,本公开的制剂可用于口服给药。
8、在一些实施方案中,本公开提供了一种口服制剂,该口服制剂包含:
9、液体油中的粒状沙丙蝶呤,其中沙丙蝶呤以约1%w/v至约50%w/v的量存在。
10、在一些实施方案中,本公开提供了一种口服制剂,该口服制剂可包含:
11、液体油中的粒状沙丙蝶呤,其中沙丙蝶呤以约0.01g/ml油至约0.5g/ml油的量存在。
12、在一些实施方案中,粒状沙丙蝶呤可具有约170μm至约400μm的dv90。在一些实施方案中,粒状沙丙蝶呤可具有约200μm至约400μm的dv90。在一些实施方案中,dv90可以是约250μm至约350μm。
13、在一些实施方案中,制剂中的粒状沙丙蝶呤可具有约70μm至约170μm的dv50。在一些实施方案中,制剂中的粒状沙丙蝶呤可具有约10μm至约60μm的dv10。
14、在一些实施方案中,粒状沙丙蝶呤可以分散在油中。对本领域的技术人员显而易见的是,粒状沙丙蝶呤可能不均匀地分散在整个油中。在储存时,沙丙蝶呤有可能可以沉淀到储存制剂的容器的底部。希望尽可能长时间地保持分散体。因此,在一些实施方案中,可选择油以使得粒状沙丙蝶呤均匀地分散在整个油中。在搅拌制剂时可形成沙丙蝶呤的均匀分散体。例如,可以通过摇动装有制剂的容器来引起搅拌。
15、在一些实施方案中,分散粒状沙丙蝶呤的能力可通过油的粘度或组合物的粘度来控制。在一些实施方案中,油可具有约10mpa.s至约500mpa.s,例如约10mpa.s至约100mpa.s或约20mpa.s至约50mpa.s的粘度。除非另外指明,本文的所有粘度测量均根据下文实施例8中所描述的程序获得。
16、在一些实施方案中,制剂的粘度可仅归因于油。在一些实施方案中,可通过附加的赋形剂改变制剂的粘度。
17、在一些实施方案中,制剂还可包含增稠剂。增稠剂可选自能够降低粒状沙丙蝶呤的沉淀速率的任何已知的增稠剂。在一些实施方案中,制剂可包含约1%w/v至约10%w/v的增稠剂。在一些实施方案中,增稠剂可以是胶态二氧化硅。在一些实施方案中,制剂可包含约1%w/v至约10%w/v的胶态二氧化硅。
18、在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,制剂的粘度可以是约150mpa.s至约750mpa.s。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,制剂的粘度可以是约150mpa.s至约750mpa.s。
19、当例如通过注射器从制剂中提取一定体积或将其提取到投配匙上时,可基于给定体积内的沙丙蝶呤的量来测量制剂的均匀性。从容器中取出的制剂的提取体积将具有预期的剂量,即预期存在于提取体积中的沙丙蝶呤的量。例如,制剂可具有在1ml中0.1g沙丙蝶呤或在5ml中0.5g沙丙蝶呤的预期剂量。预期剂量也可以%w/v形式给出。在一些实施方案中,制剂提供的剂量含有可为预期剂量的75%至125%的量的沙丙蝶呤。在一些实施方案中,制剂提供的剂量含有可为预期剂量的80%-120%或85%-115%的量的沙丙蝶呤。当以%w/v的值提供时,预期剂量可与制剂中存在的沙丙蝶呤的量相同。
20、在一些实施方案中,制剂任选地包含油可混溶的赋形剂。在一些实施方案中,制剂可包含油和油可混溶的赋形剂的混合物。例如,油可混溶的赋形剂可以是醇(诸如乙醇)、甘油、聚丙二醇或聚乙二醇。油可混溶的赋形剂可以是减粘剂。
21、在一些实施方案中,油可包含脂肪酸、脂肪酸甘油酯、多元醇、聚乙二醇、聚丙二醇、矿物油、植物来源的油、甘油单酯、甘油二酯、甘油三酯或它们的组合。
22、在一些实施方案中,油可包含橄榄油、葵花油、油菜籽油、米糠油、癸酸甘油三酯和辛酸甘油三酯的组合(例如812)或它们的组合。在一些实施方案中,油可包含约50%至约80%辛酸甘油三酯(c8)和约20%至约50%癸酸甘油三酯(c10)。
23、在一些实施方案中,制剂还可包含调味剂。调味剂可以是任何药学上可接受的调味剂。在一些实施方案中,调味剂可选自由橘子、柠檬、胡椒薄荷、草莓、树莓和水果蜜饯(tutti frutti)组成的组。
24、在一些实施方案中,制剂可以不含不期望的赋形剂。其中不期望的赋形剂被定义为禁止包括在口服制剂中的那些赋形剂。在一些实施方案中,制剂可以不含禁止包括在儿科口服制剂中的赋形剂。并且例如,在一些实施方案中,制剂不包括苯扎氯铵(alkoniumchloride)、苯甲酸和苯甲酸盐、苄醇、乙醇、十六烷基三甲基溴化铵(cetrimoniumbromide,ctab)、对苯甲酸盐以及它们的盐,或任何前述物质的任何组合。
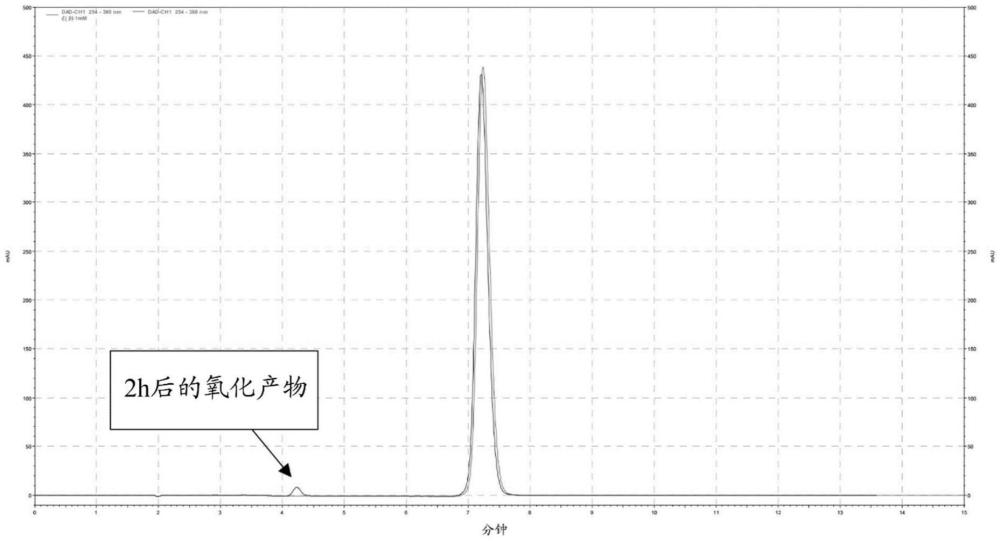
25、在一些实施方案中,制剂在1个月的时段内基本上避免了沙丙蝶呤的降解。在一些实施方案中,制剂在3个月、6个月、9个月或12个月的时段内基本上避免了沙丙蝶呤的降解。可以几种方式监测降解的避免情况。最简单的方式是监测制剂的颜色变化。当沙丙蝶呤经历氧化降解时,液体介质中的黄色脱色变得明显。然而,hplc表示一种更稳健的监测沙丙蝶呤降解的方法。在实施例中提供了监测沙丙蝶呤降解的hplc程序。
26、在一些实施方案中,制剂可具有1个月的保质期。在一些实施方案中,制剂可具有3个月的保质期。在一些实施方案中,制剂可具有6个月的保质期。在一些实施方案中,制剂可具有9个月的保质期。在一些实施方案中,制剂可具有12个月、15个月、18个月、21个月或24个月的保质期。
27、在一些实施方案中,制剂在1个月后、3个月后、6个月后、9个月后、12个月后、15个月后、18个月后、21个月后或24个月后可基本上不包含沙丙蝶呤的降解产物。在一些实施方案中,上述1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月和24个月的时间段是指将本公开的制剂在可控温度和相对湿度下储存指定的时间段。在一些实施方案中,温度可以是25℃或40℃。在一些实施方案中,相对湿度可以是60%或75%。在一些实施方案中,制剂可以在25℃和60%相对湿度下储存。在一些实施方案中,制剂可以在40℃和75%相对湿度下储存。
28、在一些实施方案中,沙丙蝶呤的降解产物是以下所示的化合物1(也称为杂质b)、化合物2(也称为杂质c)或两者。在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物1,但不超过约0.5%的化合物1。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物1,但不超过约0.5%的化合物1。在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物2,但不超过约0.5%的化合物2。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物2,但不超过约0.5%的化合物2。在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物1和化合物2,但不超过约1%的化合物1和化合物2。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物1和化合物2,但不超过约1%的化合物1和化合物2。在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,化合物1和化合物2一起可以小于沙丙蝶呤的量的0.15w/w%的总可检测量存在。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,化合物1和化合物2一起可以小于沙丙蝶呤的量的0.15w/w%的总可检测量存在。
29、
30、在一些实施方案中,制剂可包含可检测量的如下所示的化合物3(也称为杂质h)。在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物3,但不超过约0.2%的化合物3。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的化合物3,但不超过约0.2%的化合物3。
31、
32、在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,除了化合物1、2和3之外,制剂可包含总计不超过约0.2%的其它杂质。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,除了化合物1、2和3之外,制剂可包含总计不超过约0.2%的其它杂质。在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,制剂可包含量小于沙丙蝶呤的量的0.1%的任何沙丙蝶呤的降解产物(包括但不限于化合物1和化合物2)。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,制剂可包含量小于沙丙蝶呤的量的0.1%的任何沙丙蝶呤的降解产物(包括但不限于化合物1和化合物2)。
33、在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的杂质,但不超过约1.5%的总杂质。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,通过hplc测量,相对于沙丙蝶呤的峰面积,制剂可包含可检测量的杂质,但不超过约1.5%的总杂质。在一些实施方案中,在25℃和60%相对湿度下储存1个月、3个月、6个月、9个月、12个月、15个月、18个月、21个月或24个月后,制剂可包含量小于沙丙蝶呤的量的0.5%的总沙丙蝶呤的降解产物。在一些实施方案中,在40℃和75%相对湿度下储存1个月、3个月或6个月后,制剂可包含量小于沙丙蝶呤的量的0.5%的总沙丙蝶呤的降解产物。
34、本文还描述了治疗苯丙酮尿症或高苯丙氨酸血症的方法,其中该方法包括向有需要的患者施用治疗有效量的本公开的制剂。
35、在一些实施方案中,本公开的制剂可用于治疗苯丙酮尿症或高苯丙氨酸血症的方法中。
36、在一些实施方案中,苯丙酮尿症和高苯丙氨酸血症可以是儿科苯丙酮尿症或儿科高苯丙氨酸血症。
本文地址:https://www.jishuxx.com/zhuanli/20241125/337452.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
上一篇
医用转运架的制作方法
下一篇
返回列表