纳米酶微电极的制备方法及纳米酶微电极
- 国知局
- 2025-01-10 13:14:10
本发明涉及电化学检测,尤其是一种纳米酶微电极的制备方法及纳米酶微电极。
背景技术:
1、传统的金属神经电极在记录神经信号时具有很高的稳定性。然而,受限于它们固有的高阻抗特性,在长期植入过程中,无法检测到微弱信号。同时,传统金属电极由于其表面性质与生物体系相差较大,材质的生物相容性不佳,可能会导致导致周围神经组织对异物产生排斥,从而诱发慢性神经炎症。相关技术中,通过应用最先进的纳米技术来提高灵敏度和生物相容性。然而,现有的纳米技术产品有限,无法实现多类型的信号检测。
技术实现思路
1、本发明的目的在于至少一定程度上解决现有技术中存在的技术问题之一。
2、为此,本发明的目的在于提供一种高灵敏度的纳米酶微电极的制备方法及纳米酶微电极。
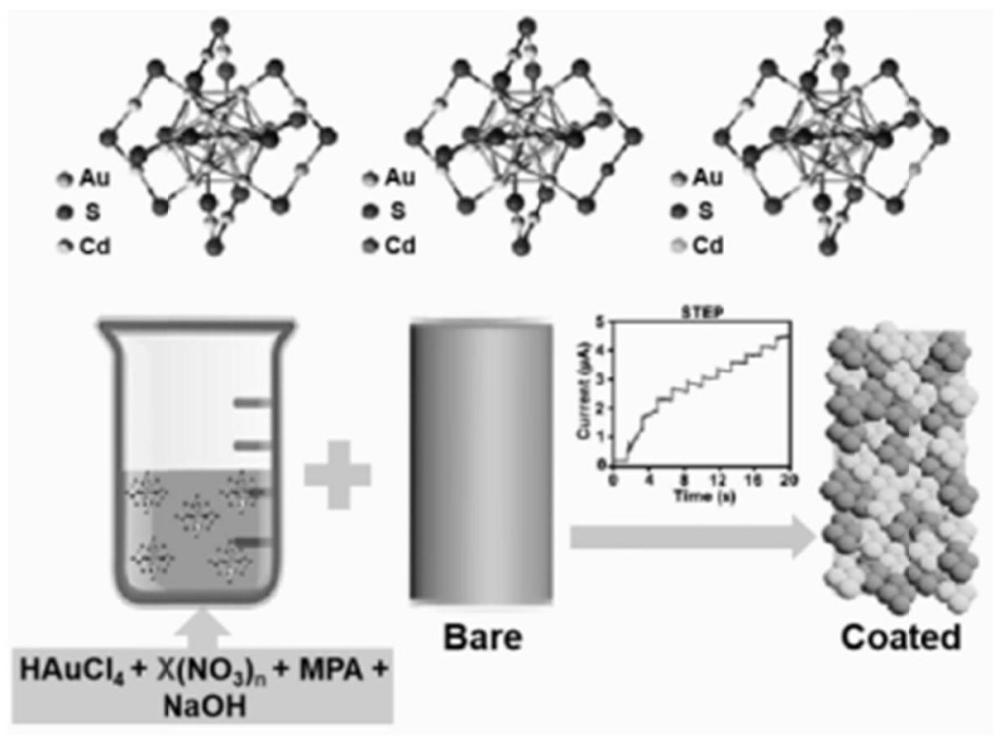
3、为了实现上述技术目的,本发明实施例的一方面,提供了一种纳米酶微电极的制备方法,包括以下步骤:提供一基底,去除所述基底的表面杂质;其中,所述基底包括银丝、金丝或纯净的ecogme;取纳米酶的固态粉末与去离子水按照预设比例充分混合,得到纳米酶溶液;所述纳米酶包括au24cd1纳米酶、au24er1纳米酶或au25纳米酶;将ag/agcl电极作为参比电极,铂片电极作为对电极,所述基底作为工作电极,通过电化学工作站,在所述纳米酶溶液中,基于通过多电位阶跃法进行纳米酶沉积处理;将所述纳米酶沉积于所述基底表面,得到纳米酶微电极;对所述纳米酶微电极进行绝缘处理,得到部分区域暴露的纳米酶微电极;其中,暴露部分作为电极的传感区域。本技术实施例通过电化学工作站,在所述纳米酶溶液中,基于通过多电位阶跃法,实现多种人工纳米酶修饰多种电极,利用纳米酶自身的催化活性来降低电极固有的高电化学阻抗,同时,这种金基聚簇纳米酶还具有较高的抗氧化活性,从而有效减少了神经炎症的诱发几率。本技术实施例能够实现多种纳米酶微电极的制备,有利于提升微电极的林敏度和生物相容性。
4、在一些实施例中,本发明实施例的纳米酶微电极的制备方法,所述基于通过多电位阶跃法进行纳米酶沉积处理,包括:
5、若所述基底为银丝,设置电沉积参数,在0.2至2v电压区间内设置若干个电位,电位之间的阶跃幅度为0.1至0.2v;并设置每个电位的持续时间;
6、设置沉积电流为0.3至0.5ma;开启电沉积处理;
7、或者,若所述基底为金丝或纯净的ecogme,设置电沉积参数,在1.7至3.4v电压区间内设置若干个电位,电位之间的阶跃幅度为0.1至0.2v;并设置每个电位的持续时间;
8、设置沉积电流为0.3至0.5ma;开启电沉积处理。
9、在一些实施例中,在本发明的一个实施例中,所述提供一基底,去除所述基底的表面杂质,包括:
10、提供一银丝,通过砂纸打磨后,将所述银丝置于蒸馏水中进行超声去杂质处理;
11、或者,提供一金丝,通过砂纸打磨后,将所述金丝置于蒸馏水中进行超声去杂质处理;
12、或者,提供一基板,通过预设掩模板在所述基板上进行图案化的磁控溅射,并依次沉积cr和au,得到纯净的ecogme。
13、在一些实施例中,在本发明的一个实施例中,所述au24cd1纳米酶通过以下步骤制备得到:
14、在第一容积的超纯水中加入haucl4水溶液、cd(no3)2水溶液和mpa水溶液,并不断搅拌;其中,加入的haucl4水溶液、cd(no3)2水溶液和mpa水溶液分别对应预设密度和预设容积;
15、滴加naoh水溶液至反应溶液的ph值为12;加入第二容积的nabh溶液;
16、通入饱和co,密闭处理;所述密闭处理的时长为第一时长;
17、搅拌第二时长后,将得到的棕色溶液进行冻干处理,获得纯净的au24cd1纳米酶,置于-18至-22℃环境保存。
18、在一些实施例中,在本发明的一个实施例中,微电极通过以下步骤进行表征:
19、将ag/agcl作为参比电极,铂电极作为对电极,测试电极作为工作电极进行测试;
20、在测试过程中,更换测试溶液以改变溶液浓度;所述测试电极包括微电极和纳米酶微电极,所述微电极包括agme微电极、aume微电极和ecogme微电极;所述纳米酶微电极包括纳米酶修饰的agme微电极、纳米酶修饰的aume微电极、和纳米酶修饰的ecogme微电极;
21、若更换溶液,暂停测试;并在继续测试之前将所述测试溶液静置第三时长。
22、在一些实施例中,在本发明的一个实施例中,所述方法包括:
23、基于cv、eis法对微电极进行测试,使用磷酸盐缓冲溶液作为工作溶液,搭建测试环境,并设置测试参数后,开始测试;
24、或者,通过dpv、swv、npv、lsv法测试不同浓度的da溶液;所述da溶液的浓度范围包括1μm至200um;
25、或者,通过dpv、swv、npv、lsv法测试不同浓度的aa溶液;所述aa溶液的浓度范围为200μm至1200um。
26、在一些实施例中,在本发明的一个实施例中,所述测试参数通过以下步骤进行设置:
27、若为cv测试,设置测试电压为-0.4至0.6v,设置扫描速率为0.05至0.15v/s;
28、若为eis测试,设置初始电压为0v,设置频率范围为1至105hz。
29、在一些实施例中,在本发明的一个实施例中,所述测试参数通过以下步骤进行设置:
30、若为dpv测试,设置测试电压为-0.3至0.6v,设置脉冲宽度为0.03至0.06s,设置采样宽度为0.01至0.03s,设置脉冲周期为0.4至0.6s;
31、若为swv测试,设置测试电压为-0.3至0.6v,设置频率为8至12hz;
32、若为lsv测试,设置扫描速率为0.08至0.12v/s,设置采样间隔为0.001v;
33、若为npv测试,设置脉冲宽度为0.04至0.06s,设置采样宽度为0.01至0.03s,设置脉冲周期为0.4至0.6s。
34、在一些实施例中,在本发明的一个实施例中,所述aa溶液通过下列步骤制备:
35、取第一重量的da粉末充分溶于第三容积的pbs溶液中,得到50mm的aa溶液;所述第一重量与所述第三容积的比例为第一预设值;
36、取第四容积50mm的da溶液溶于第五容积的pbs溶液中,充分混合后得到10mm的da溶液;所述第四容积与所述第五容积的比例为第二预设值;
37、取第六容积10mm的da溶液溶于第七容积的pbs溶液中,得到1mm的da溶液;所述第六容积与所述第七容积的比例为第三预设值;
38、将第八容积1mm的da溶液溶于第九容积的pbs溶液中,得到100nm的da溶液;所述第八容积与所述第九容积的比例为第四预设值;
39、取第二重量的aa粉末,充分溶于第十容积的pbs溶液中,得到10mm的aa溶液;所述第二重量与所述第十容积的比例为第五预设值。
40、另一方面,本发明实施例提供了一种纳米酶微电极,通过如上述的纳米酶微电极的制备方法制备得到。
41、本技术实施例至少包括以下有益效果:本发明实施例提供的方法包括:提供一基底,去除所述基底的表面杂质;其中,所述基底包括银丝、金丝或纯净的ecogme;取纳米酶的固态粉末与去离子水按照预设比例充分混合,得到纳米酶溶液;所述纳米酶包括au24cd1纳米酶、au24er1纳米酶或au25纳米酶;将ag/agcl电极作为参比电极,铂片电极作为对电极,所述基底作为工作电极,通过电化学工作站,在所述纳米酶溶液中,基于通过多电位阶跃法进行纳米酶沉积处理;将所述纳米酶沉积于所述基底表面,得到纳米酶微电极;对所述纳米酶微电极进行绝缘处理,得到部分区域暴露的纳米酶微电极;其中,暴露部分作为电极的传感区域。本技术实施例通过电化学工作站,在所述纳米酶溶液中,基于通过多电位阶跃法,实现多种人工纳米酶修饰多种电极,利用纳米酶自身的催化活性来降低电极固有的高电化学阻抗,同时,这种金基聚簇纳米酶还具有较高的抗氧化活性,从而有效减少了神经炎症的诱发几率。本技术实施例能够实现多种纳米酶微电极的制备,有利于提升微电极的林敏度和生物相容性。
本文地址:https://www.jishuxx.com/zhuanli/20250110/351795.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。