一种(r)-2-(2-氯苯基)环氧乙烷的生物制备方法
技术领域
1.本发明属于医药制备领域,具体地,涉及一种(r)-2-(2-氯苯基)环氧乙烷的生物制备方法。
背景技术:
2.癫痫是一种影响中枢神经系统的慢性脑部疾病,其特征是由脑神经元异常放电导致反复痫性发作或异常的行为、感觉,有时还会丧失意识。它可造成神经、认知、心理和社会后果,占世界疾病负担的很大一部分。全球癫痫患者(包括突发性或继发性)约有4500万人,而我国的癫痫患者已超过900万,同时每年新发患病人数约70万。药物cenobamate由韩国sk生物制药公司,该药于2019年11月fda批准上市,为治疗癫痫部分性发作提供了新的选择。
[0003][0004]
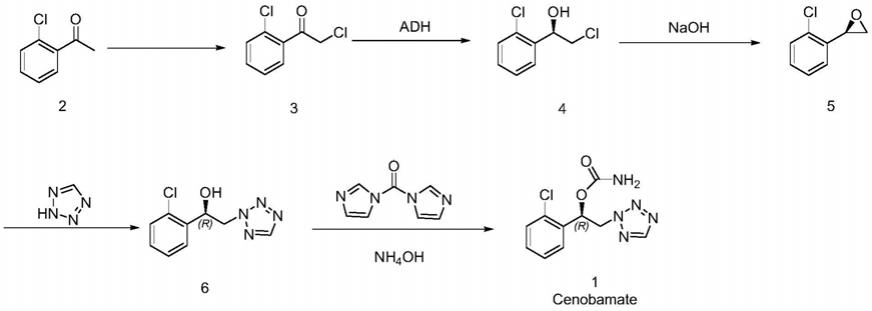
合成路线由原研公司sk在专利us2006258718中报道,以邻氯苯乙酮(2)为起始原料,经氯代得2-氯-1-(2-氯苯基)乙-1-酮(3),经过羰基还原酶选择性地得到目标构型的(r)-2-氯-1-(2-氯苯基)乙-1-醇(4),在氢氧化钠的作用下环合为(r)-2-(2-氯苯基)环氧乙烷(5),在碱性条件下与四氮唑缩合为(r)-1-(2-氯苯基)-2-(2h-四唑-2-基)乙-1-醇(6),最后与n,n-羰基二咪唑缩合,之后经氨水作用生成(r)-1-(2-氯苯基)-2-(2h-四唑-2-基)氨基甲酸乙酯(1)。
[0005][0006]
该合成路线的关键是通过催化还原化合物3制备高手性纯度的手性醇即化合物4,然后再经关环制得化合物5。
[0007]
在专利cn101184742中报道了一种催化还原的方法,使用来源于u短乳杆菌或红球菌属的醇脱氢酶对2-氯-1-(2-氯苯基)乙酮进行还原,该催化体系存在不足之处是使用野生菌进行还原,含有杂酶会影响产物纯度,反应时间64h,影响生产效率。其次,生物反应体系中加入有机溶剂二异丙基醚,不适应工业化生产。
[0008]
因此,本领域迫切需要开发环境友好、高效、高立体选择性、更适合产业生产的制备(r)-2-(2-氯苯基)环氧乙烷的方法。
技术实现要素:
[0009]
本发明的目的在于提供一种高效、高立体选择性的(r)-2-(2-氯苯基)环氧乙烷制备方法,所述方法能够显著提高(r)-2-(2-氯苯基)环氧乙烷的ee值、转化率,缩短反应时间。
[0010]
本发明第一方面,提供一种式ⅵ化合物的制备方法,包括步骤:
[0011][0012]
(a)在辅酶存在下,在羰基还原酶催化下,使底物化合物iv发生还原反应,从而形成式
ⅴ
化合物;和
[0013]
(b)对所述式
ⅴ
化合物进行关环反应,从而制得式ⅵ化合物;
[0014]
式中,x为溴或氯。
[0015]
在另一优选例中,在步骤(b)中,在液态反应体系中进行酶促的还原反应。
[0016]
在另一优选例中,在步骤(b)中,在碱性条件下进行关环反应。
[0017]
在另一优选例中,所述的步骤(a)还任选地包括步骤(a-1):从所述反应后的反应体系中分离出式
ⅴ
化合物。
[0018]
在另一优选例中,在步骤(a)或步骤(a-1)中,所述反应后的反应体系中,式
ⅴ
化合物的ee值≥90%,较佳地≥95%,更佳地≥99%。
[0019]
在另一优选例中,在步骤(a)或步骤(a-1)中,所述反应后的反应体系中,≥80%(较佳地≥85%,更佳地≥90%)式iv化合物被转化为式
ⅴ
化合物。
[0020]
在另一优选例中,在步骤(a)或步骤(a-1)中,所述反应后的反应体系中,式
ⅴ
化合物的浓度50~1000g/l。
[0021]
在另一优选例中,在步骤(a-1)中,所述的分离包括:加入异丙醇、离心菌体、部分浓缩、甲叔醚萃取、浓缩有机层。
[0022]
在另一优选例中,所述的步骤(b)还任选地包括步骤(b-1):从所述反应后的反应体系中分离出式ⅵ化合物。
[0023]
在另一优选例中,步骤(a)中,所述式iv化合物的浓度为50~1000g/l。
[0024]
在另一优选例中,步骤(a)中,所述式iv化合物的浓度为60~700g/l。
[0025]
在另一优选例中,步骤(a)中,所述式iv化合物的浓度为80~600g/l。
[0026]
在另一优选例中,步骤(a)中,所述式iv化合物的浓度为20~500g/l。
[0027]
在另一优选例中,步骤(a)中,所述式iv化合物的浓度为50~200g/l。
[0028]
在另一优选例中,步骤(a)中,所述式iv化合物的浓度为100~150g/l。
[0029]
在另一优选例中,步骤(a)中,温度为10℃-50℃,较佳地20℃-40℃,更佳地25℃-35℃。
[0030]
在另一优选例中,步骤(a)中,时间为0.1-240小时,较佳地0.5-120小时,更佳地1-72小时,又更佳地3-10小时。
[0031]
在另一优选例中,步骤(a)中,ph为6-9,较佳地6.5-8.5,更佳地7.0-7.5。
[0032]
在另一优选例中,步骤(a)中,所述的反应体系为缓冲液体系,优选地为磷酸缓冲盐体系。
[0033]
在另一优选例中,步骤(a)中,所述的反应体系还含有助溶剂。
[0034]
在另一优选例中,所述的助溶剂选自下组:二甲基亚砜、甲醇、乙醇、异丙醇、乙腈、甲苯、丙酮、或其组合。
[0035]
在另一优选例中,所述助溶剂的用量为缓冲液体积的5~30%(v/v),优选地为10-25%,更优选地为15-20%。
[0036]
在另一优选例中,步骤(a)中,所述羰基还原酶选自下组:
[0037]
(i)其氨基酸序列如seq id no.2所示;或
[0038]
(ii)对seq id no.2所示的氨基酸序列在保持酶活性范围内,进行一个或多个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。
[0039]
在另一优选例中,所述的羰基还原酶为游离形式的酶、固定化酶、或菌体形式的酶。
[0040]
在另一优选例中,步骤(a)中,所述的羰基还原酶的编码基因序列选自下组:
[0041]
(a)seq id no.1所示的序列;
[0042]
(b)与(a)限定的序列互补的多核苷酸;或
[0043]
(c)与(a)限定的序列具有至少70%(优选至少75%、80%、85%、90%,更优选至少95%、96%、97%、98%、99%)以上的序列一致性的任一多核苷酸或互补序列。
[0044]
在另一优选例中,步骤(a)中,所述的辅酶选自:还原性辅酶、氧化性辅酶,或其组合。
[0045]
在另一优选例中,步骤(a)中,还存在共底物异丙醇。
[0046]
在另一优选例中,所述的共底物的质量浓度为5-30%。
[0047]
在另一优选例中,所述的碱为碳酸钾、碳酸钠、氢氧化钠、氢氧化钾中的一种或多种组合。
[0048]
本发明第二方面,提供一种式
ⅴ
化合物的制备方法,包括步骤:
[0049]
(a)在辅酶存在下,在羰基还原酶催化下,使底物化合物iv发生还原反应,从而形成式
ⅴ
化合物;
[0050][0051]
其中,x为cl或br。
[0052]
本发明第三方面,提供一种具有不对称催化活性的羰基还原酶,所述羰基还原酶的氨基酸序列如seq id no.:2所示。
[0053]
本发明第四方面,提供一种多核苷酸,所述多核苷酸编码如第三方面所述的羰基
还原酶,优选地,所述的多核苷酸的序列如seq id no.:1所示。
[0054]
本发明第五方面,提供一种式
ⅴ
化合物生产菌株,所述菌株表达外源的第三方面所述的多肽,并用于催化以下不对称反应:
[0055][0056]
其中,x为cl或br。
[0057]
在另一优选例中,所述菌株表达以下多肽:
[0058]
(i)其氨基酸序列如seq id no.2所示;或
[0059]
(ii)对seq id no.2所示的氨基酸序列在保持酶活性范围内,进行一个或多个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。
[0060]
在另一优选例中,所述生产菌株为细菌。
[0061]
在另一优选例中,所述细菌大肠杆菌。
[0062]
在另一优选例中,所述大肠杆菌为大肠杆菌bl21。
[0063]
本发明第六方面,提供一种生产菌株的构建方法,所述方法包括:
[0064]
使得所述菌株包含表达以下多肽的表达载体或使得所述菌株的基因组中整合有表达以下多肽的基因,所述多肽是:
[0065]
(i)其氨基酸序列如seq id no.2所示;或
[0066]
(ii)对seq id no.2所示的氨基酸序列在保持酶活性范围内,进行一个或多个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。
[0067]
在另一优选例中,所述基因序列选自下组:
[0068]
(a)seq id no.1所示的序列;
[0069]
(b)与(a)限定的序列互补的多核苷酸;或
[0070]
(c)与(a)限定的序列具有至少70%(优选至少75%、80%、85%、90%,更优选至少95%、96%、97%、98%、99%)以上的序列一致性的任一多核苷酸或互补序列。
[0071]
在另一优选例中,所述基因构建在表达载体上。
[0072]
本发明第七方面,提供一种第三方面所述的羰基还原酶或如第五方面所述的生产菌株的用途,用于制备一酶制剂,所述制剂用于催化以下不对称反应:
[0073][0074]
其中,x为cl或br。
[0075]
在另一优选例中,所述的羰基还原酶或所述的生产菌株用于生产式v化合物或以式v化合物为前体的下游产物(如cenobamate)。
[0076]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具
体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0077]
图1示出了化合物(
ⅴ
)的消旋体的手性图谱。
[0078]
图2示出了羰基还原酶催化所得化合物(
ⅴ
)的ee值。
[0079]
图3示出了lk01与lk08的氨基酸序列比较。
具体实施方式
[0080]
本发明人经过广泛而深入的研究,首次意外地开发了一种(r)-2-(2-氯苯基)环氧乙烷的生物催化的制备方法,该方法为新颖的立体有择的合成方法。具体地,本发明将现有(r)-2-(2-氯苯基)环氧乙烷制备方法中的关键的羰基还原反应改进为羰基还原酶催化还原,即在羰基还原酶和辅酶的存在下,将式iv化合物立体选择性地还原为式
ⅴ
化合物(即使在高浓度的底物,如50~1000g/l条件下,也能够非常高效地制备获得具有立体构象的式
ⅴ
化合物)。然后以式
ⅴ
化合物为底物,进行后续反应。本发明仅需萃取操作,操作简单,成本低廉,绿色环保,更适合工业化生产具有高化学纯度和高光学纯度式
ⅴ
化合物,然后进一步进行后续关环反应,以用于cenobamate等药品的制备。在此基础上完成了本发明。
[0081]
具体地,本发明人发现利用来源于开菲尔乳杆菌(lactobacillus kefir)的羰基还原酶的突变体(lk01)作为代表性的羰基还原酶时,可以显著提高反应体系对有机溶剂、底物的耐受性,从而可以大幅提高底物浓度,也能够非常高效地制备获得具有立体构象的式
ⅴ
化合物(ee值≥98%、99%、或99.9%),从而极大地提高生产效率,降低生产成本。此外,本发明方法大幅简化了后续处理,而且与化学合成法相比,显著减少或消除了各类污染性化学品的使用,从而显著降低了环境污染风险。
[0082]
式
ⅴ
化合物及其下游产物的制备方法
[0083]
本发明中,提供了式v化合物及其下游产物(如式vi化合物)的制备方法,所述方法使用本发明所述的羰基还原酶或生产菌株,优选地,所述方法包括:
[0084]
(a)在液态反应体系中,在辅酶存在下,在羰基还原酶催化下,底物化合物iv发生还原反应,得到式
ⅴ
化合物;
[0085][0086]
其中,x为卤素,优选地为cl或br。
[0087]
(r)-2-(2-氯苯基)环氧乙烷的生物合成方法
[0088]
本发明中,还提供了(r)-2-(2-氯苯基)环氧乙烷(式ⅵ化合物)的制备方法,优选地,所述方法包括步骤:
[0089][0090]
(a)在液态反应体系中,在辅酶存在下,在羰基还原酶催化下,底物化合物iv发生还原反应,得到式
ⅴ
化合物;
[0091]
(b)在碱性条件下,式
ⅴ
化合物关环反应制得式ⅵ化合物;
[0092]
式中,x为卤素,优选地为cl或br。
[0093]
优选地,所述的步骤(a)中还任选地包括步骤(a-1):从所述反应后的反应体系中分离出式
ⅴ
化合物,其中,所述的分离包括:加入异丙醇、离心菌体、部分浓缩,甲叔醚萃取,浓缩有机层,优选地,所述反应后的反应体系中,式
ⅴ
化合物的ee值≥90%,较佳地≥95%,更佳地≥99%。
[0094]
优选地,在步骤(a-1)中,所述反应后的反应体系中,≥80%(较佳地≥85%,更佳地≥90%)式iv化合物被转化为式
ⅴ
化合物。
[0095]
优选地,在步骤(a-1)中,所述反应后的反应体系中,式
ⅴ
化合物的浓度50~1000g/l。
[0096]
优选地,所述的步骤(b)还任选地包括步骤(b-1):从所述反应后的反应体系中分离出式ⅵ化合物。
[0097]
优选地,步骤(a)中,所述式iv化合物的浓度为50~1000g/l,较佳地为60~700g/l较佳地为80~600g/l,更佳地为20~500g/l,更佳地为50~200g/l,更佳地为100~150g/l。
[0098]
优选地,步骤(a)中,温度为10℃-50℃,较佳地20℃-40℃,更佳地25℃-35℃。
[0099]
优选地,步骤(a)中,时间为0.1-240小时,较佳地0.5-120小时,更佳地1-72小时,又更佳地3-10小时。
[0100]
优选地,步骤(a)中,所述的反应体系为磷酸缓冲盐体系,ph为6-9,较佳地6.5-8.5,更佳地7.0-7.5。
[0101]
优选地,步骤(a)中,所述的反应体系还含有助溶剂,所述的助溶剂选自下组:二甲基亚砜、甲醇、乙醇、异丙醇、乙腈、甲苯、丙酮、或其组合,其中,所述助溶剂的用量为缓冲液体积的5~30%(v/v),优选地为10-25%,更优选地为15-20%。
[0102]
羰基还原酶
[0103]
本发明中,“羰基还原酶”是能够立体选择性催化手性酮不对称还原得到手性醇的酶。
[0104]
在本发明中,所述的羰基还原酶可以是野生型的或突变型的,优选突变型的lk01。此外,所述的羰基还原酶可以是分离的,也可以是重组的。
[0105]
可用于本发明的羰基还原酶可以来自不同物种。例如,来自乳杆菌属,更佳地来自开菲尔乳杆菌lactobacillus kefir的羰基还原酶。此外,与上述羰基还原酶有类似活性或同源性(如≥80%,较佳地≥90%,更佳地较佳地≥95%)的酶(包括来自其他物种的酶)也在本发明范围之内。
[0106]
优选地,本发明所述的羰基还原酶的氨基酸序列如seq id no.:2所示。
[0107]
mtdrlkgkvalvtggtlgiglaiadkfveegakvvitgrhadvgekaaksiggtdvirfvqhdvsdeagwtklfditeeafgpvttvvnnagivqlksledttteewrkllsvnldgvffgtrlgiqrmknkglgasiinmssiagiigdpamgaynatkgavrimsksaaldcalkdydvrvntvhpggiktpgvadlpgfeemcsqrtktpmghigepndiawicvylasdeskfatgaefvvdggftaq(seq id no.:2)。
[0108]
由于密码子的简并性,编码seq id no.2所示的氨基酸序列的碱基序列不仅仅局限于seq id no.1。本领域技术人员可以通过适当引入替换、缺失、改变、插入或增加来获得该碱基序列的同系物,本发明涵盖这些同系物,只要其表达的重组酶保持对式iv化合物的催化还原活性即可。本发明中多聚核苷酸的同系物可以通过对碱基序列seq id no.1的一个或多个碱基在保持酶活性范围内进行替换、缺失或增加来制得。
[0109]
本发明的羰基还原酶还包括对seq id no.2所示的氨基酸序列在保持酶活性范围内,进行一个或多个,优选1-20个、更优选1-15个、更优选1-10个、更优选1-8个、更优选1-3个、最优选1个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。这些保守性变异的突变体可根据,例如下表所示进行氨基酸替换而产生。
[0110]
表a
[0111][0112]
本发明还提供了编码本发明羰基还原酶的多核苷酸(基因)。术语“编码羰基还原酶的多核苷酸”可以是包括编码此羰基还原酶的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸,在具体的实施方式中,所述同源性或序列相同性可以是80%以上,优选90%以上,更优选95%-98%,最优选99%以上。
[0113]
本领域普通技术人员公知的测定序列同源性或相同性的方法包括但不限于:计算机分子生物学(computational molecular biology),lesk,a.m.编,牛津大学出版社,纽约,1988;生物计算:信息学和基因组项目(biocomputing:informatics and genome projects),smith,d.w.编,学术出版社,纽约,1993;序列数据的计算机分析(computer analysis of sequence data),第一部分,griffin,a.m.和griffin,h.g.编,humana press,新泽西,1994;分子生物学中的序列分析(sequence analysis in molecular biology),von heinje,g.,学术出版社,1987和序列分析引物(sequence analysis primer),gribskov,m.与devereux,j.编m stockton press,纽约,1991和carillo,h.与lipman,d.,siam j.applied math.,48:1073(1988)。测定相同性的优选方法要在测试的序
列之间得到最大的匹配。测定相同性的方法编译在公众可获得的计算机程序中。优选的测定两条序列之间相同性的计算机程序方法包括但不限于:gcg程序包(devereux,j.等,1984)、blastp、blastn和fasta(altschul,s,f.等,1990)。公众可从ncbi和其它来源得到blastx程序(blast手册,altschul,s.等,ncbi nlm nih bethesda,md.20894;altschul,s.等,1990)。熟知的smith waterman算法也可用于测定相同性。
[0114]
优选地,本发明中羰基还原酶的多核苷酸如seq id no.:1所示。
[0115]
atgactgatcgtctgaagggcaaagtagccctggtaaccggcgggacgctgggtatcggtttggcaatcgccgataaatttgtagaggagggtgcgaaagtagttattactggtcgtcacgcggatgtaggtgaaaaggccgccaaatcaatcggcggcactgatgttattcgctttgtccagcacgatgtatccgatgaggcaggctggacgaaactgttcgacatcaccgaggaggcattcggcccggttacgaccgtcgtgaacaatgcagggattgtacagctgaaaagccttgaagacactaccacggaggaatggcgtaaactgctgtccgttaatctggatggtgtttttttcggcacccgtctgggcattcagcgcatgaaaaataaaggcttgggcgctagcatcatcaatatgagcagtattgcggggatcatcggcgatccggcaatgggggcatacaacgctaccaagggggcggtacgtatcatgtcgaaaagcgcagcgctggattgcgcactgaaggactacgatgtgcgtgtcaacacagtacatccgggcggtatcaagaccccgggcgtcgcagatctgccgggttttgaggaaatgtgttcacagcgtacgaaaacccctatgggccacattggcgaaccgaatgacatcgcatggatctgtgtgtacctggcatctgacgaatcgaaatttgcgacgggtgcagaatttgtggtcgacggcgggtttaccgcacagtaa(seq id no.:1)。
[0116]
根据本领域的一般常识,反应体系中可以使用上述羰基还原酶构建的重组酶包括静息细胞、湿菌体、粗酶液、纯酶或者粗酶粉等。为获得较高的转化效率,优选使用粗酶液(即菌体)。优选粗酶液(即菌体)用量与反应溶剂的体积比率优选为1%~6%(w/v),更优选地为1.5%-5%,更优选地为2%-4%。优选使用纯酶时,酶与底物的质量比为0.025%-1.25%(w/w),优选地为0.1%-1%(w/w),更优选地为0.5%-0.8%(w/w)-或者静息细胞质量与底物质量比率为10-100%(w/w)。
[0117]
式
ⅴ
化合物生产菌株
[0118]
本发明中,式
ⅴ
化合物生产菌株表达多肽,所述多肽为外源的如上所述的羰基还原酶,并用于催化以下不对称反应:
[0119][0120]
优选地,所述菌株表达以下多肽:
[0121]
(i)其氨基酸序列如seq id no.2所示;或
[0122]
(ii)对seq id no.2所示的氨基酸序列在保持酶活性范围内,进行一个或多个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。
[0123]
优选地,所述生产菌株为原核或真核的菌株,较佳地为细菌,更佳地为大肠杆菌(如大肠杆菌bl21)。
[0124]
生产菌株的构建方法
[0125]
本发明中,生产菌株的构建方法包括:
[0126]
使得所述菌株包含表达以下多肽的表达载体或使得所述菌株的基因组中整合有表达以下多肽的基因,所述多肽是:
[0127]
(i)其氨基酸序列如seq id no.2所示;或
[0128]
(ii)对seq id no.2所示的氨基酸序列在保持酶活性范围内,进行一个或多个氨基酸的替换、缺失、改变、插入或增加,所得到的氨基酸序列。
[0129]
优选地,所述基因序列选自下组:
[0130]
(a)seq id no.1所示的序列;
[0131]
(b)与(a)限定的序列互补的多核苷酸;或
[0132]
(c)与(a)限定的序列具有至少70%(优选至少75%、80%、85%、90%,更优选至少95%、96%、97%、98%、99%)以上的序列一致性的任一多核苷酸或互补序列。
[0133]
优选地,所述基因构建在表达载体上。
[0134]
本发明羰基还原酶或生产菌株的用途
[0135]
本发明中,所述的羰基还原酶或所述的生产菌株的用途,用于制备一酶制剂,所述制剂用于催化以下不对称反应:
[0136][0137]
其中,x为卤素,优选地为cl或br。
[0138]
在另一优选例中,所述的制剂包含磷酸缓冲盐体系,ph为6-9,较佳地6.5-8.5,更佳地7.0-7.5。
[0139]
优选地,所述的羰基还原酶或所述的生产菌株用于生产式v化合物或以式v化合物为前体的下游产物(如cenobamate)。
[0140]
辅酶
[0141]
本发明中,“辅酶”是指能够实现氧化还原反应中电子传递的辅酶。
[0142]
典型地,本发明的辅酶为还原性辅酶nadh、nadph或氧化性辅酶nad
、nadp
。由于还原性辅酶的价格成本昂贵,优选选择氧化性辅酶nad
、nadp
。
[0143]
氧化性辅酶nad
用量与底物用量比率为0.001%~1%,优选地为0.01%~0.5%(w/w)。缓冲体系为0.1mol/l磷酸缓冲盐。缓冲液的ph为7.0-7.3。
[0144]
共底物
[0145]
本发明中,使用辅酶nad
时,所需的共底物为异丙醇,异丙醇用量为缓冲液体积的1%-50%(v/v),优选地为5%-40%(v/v),更优选地为15%-30%(v/v)。其中,本发明中的共底物可作为溶剂或溶剂的一部分。
[0146]
助溶剂
[0147]
本发明中,可以在反应体系中添加或不添加助溶剂。
[0148]
如本文所用,术语“助溶剂”是指难溶性物质与加入的第三种物质在溶剂中形成可溶性分子间的络合物、缔合物或复盐等,以增加难溶性物质在溶剂中的溶解度。这种第三种物质称为助溶剂。
[0149]
本发明中,底物化合物(iv)难溶于水,当底物浓度增大时,严重影响反应转化率。因此,可通过加入助溶剂提高底物溶解性,以改善反应转化情况。本发明中,可选的助溶剂包括:二甲基亚砜、甲醇、乙醇、异丙醇、乙腈、甲苯、丙酮,或其组合,浓度优选为缓冲液体积的5-30%(v/v),优选为二甲基亚砜、甲醇、乙醇、异丙醇。
[0150]
本发明的主要优点在于:
[0151]
(1)本发明构建了一种新型的羰基还原酶,利用羰基还原酶的新型催化反应体系,通过生物催化还原高效进行生产(r)-2-(2-氯苯基)环氧乙烷。
[0152]
(2)本发明适合工业化生产具有高化学纯度和高光学纯度的式
ⅴ
化合物,然后进一步进行后续反应,生产cenobamate的关键中间体(r)-2-(2-氯苯基)环氧乙烷,使得反应整体收率大大提升。
[0153]
(3)本发明方法和反应体系具有高立体选择性、专一性、高催化活性、以及对有机溶剂的高耐受性、对底物的耐受性,从而可以在较高的底物浓度下,进行大规模生产。
[0154]
(4)本发明极大地提高生产效率,降低生产成本。
[0155]
(5)本发明方法大幅简化了后续处理,后处理仅需萃取操作,操作简单。
[0156]
(6)绿色环保,与化学合成法相比,本发明显著减少或消除了各类污染性化学品的使用,从而显著降低了环境污染风险。
[0157]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。本发明中所涉及的实验材料如无特殊说明均可从市售渠道获得。
[0158]
材料
[0159]
化合物(iv),消旋体外购自上海翰鸿化工有限公司,基因全合成由上海百利格完成。
[0160]
来源于lactobacillus kefir的羰基还原酶的突变体(lk01),通过商业化的全基因合成得到编码基因,然后将编码基因构建入表达载体,导入宿主菌,诱导表达得到。
[0161]
方法
[0162]
1.酶的制备方法
[0163]
通过本领域常规技术,将目的基因构建在同一质粒pet28a( )载体上,然后导入表达宿主大肠杆菌,通过诱导表达,获得含有目的酶的菌体。可直接使用离心获得菌体,也可将其破壁获得粗酶液,粗酶粉用于后续的生物转化反应。
[0164]
2.生物催化还原化合物(iv)制备化合物(
ⅴ
)的方法
[0165]
本发明提供了一种羰基还原酶催化还原化合物(iv)制备化合物(
ⅴ
)的方法。反应式如下:
[0166]
[0167]
其中,所述的生物催化体系包括有羰基还原酶、辅酶。本发明中所述的羰基还原酶编码基因序列为seq id no.1,羰基还原酶的氨基酸序列为seq id no.2。根据本领域一般常识,上述羰基还原酶基因可通过商业化的全基因合成得到。
[0168]
根据上述优选体系,所述制备方法的实施过程如下:将底物充分溶解在助溶剂,如二甲基亚砜或异丙醇,然后加入到磷酸缓冲液中,搅拌均匀后,加入菌体、粗酶液、粗酶粉或纯酶,和辅酶(如nad
),共底物(如异丙醇),维持在20℃~40℃,tlc或hplc监控,至原料剩余《2%,终止反应。向反应液中加入异丙醇,离心或过陶瓷膜,除去菌体,取上清液,上清液用有机溶剂萃取,有机溶剂可选为甲基叔丁基醚、甲苯、乙酸乙酯、乙酸异丙脂、二氯甲烷、2-甲基四氢呋喃、正丁醇。萃取水层2-3次,合并有机相;用饱和食盐水洗涤2~3次,浓缩后得到浅黄色油状物。
[0169]
体系中底物化合物(iv)的终浓度为50-200g/l,优选为100-150g/l,满足工业要求(底物浓度》100g/l)。反应温度为20-40℃,转速为200rpm/min,反应时间约3-10h,根据底物浓度而有所变化或通过hplc监控原料转化情况,当原料剩余《2%,终止反应。
[0170]
3.(r)-2-氯-(2-氯苯基)乙醇的手性正相监测方法:
[0171]
hplc条件:daicel ib-3(250
×
4.6mm,3μm);流速0.8ml/min;流动相:正己烷:异丙醇=99:1;紫外检测波长260nm;柱温25℃;样品溶于甲醇,浓度10mg/ml;进样体积2μl。
[0172]
4.(r)-2-氯-(2-氯苯基)乙醇的反相监测方法:
[0173]
hplc条件:phenomenex gemini 5u c18 110a,250
×
4.6mm,5μm;流速:1ml/min;流动相梯度如下表;紫外检测波长:260nm;柱温:30℃;样品浓度:10mg/ml;进样体积10μl。s-39的保留时间为12.3min。
[0174]
流动相梯度:
[0175]
时间(min)h2o-0.1%tfa(%)acn-0.1%tfa(%)0802015208035208035.18020402080
[0176]
实施例1羰基还原酶工程菌的构建
[0177]
将lk01目的基因委托商业化公司进行全基因合成,序列如seq id no:1所示,然后将seq id no:1所示的序列克隆入pet28a( )载体,转入大肠杆菌dh5α感受态细胞,平板培养,挑取阳性转化子单菌落并提取质粒测序确定后,提取重组质粒,导入bl21(de3)菌株中,lb培养,获得可以诱导表达重组羰基还原酶的基因工程菌。
[0178]
seq id no:1所编码的氨基酸序列如seq id no:2所示。
[0179]
实施例2重组羰基还原酶的制备
[0180]
将实施例1制备的的基因工程菌(保存于甘油中),接种到含卡那霉素的lb液体培养基中,37℃,220rpm,培养13h,得到种子培养基,将种子培养液按1.5%的比例接种到含50ug/ml卡那霉素抗性的液体培养基上,然后37℃,220rmp培养至od
600
值》2.0,加入终浓度为1.0%乳糖,降温至25℃,继续培养3h,加入终浓度为0.5%的乳糖,培养20h,放罐,离心得lk01菌体,为生物催化做准备。
[0181]
发酵配方如下:
[0182]
原材料质量含量(%)酵母提取物2.4大豆蛋白胨1.2氯化钠0.3甘油0.5磷酸氢二钾0.2七水硫酸镁0.05
[0183]
实施例3(r)-2-溴-(2-氯苯基)乙醇(化合物v-1)的生物催化制备
[0184][0185]
取化合物iv-1(20g),溶解于异丙醇(120ml)中,加入0.1m的磷酸盐缓冲液(400ml),加入nad
(0.2g),加入实施例2制备的lk01菌体(10g),25℃,220rpm,摇床反应,hplc监控反应转化率》98%时,终止反应。
[0186]
加入异丙醇(100ml),离心,取上清液,部分浓缩异丙醇,甲叔醚(400ml)萃取,有机溶剂(100ml
×
2)萃取水层,合并有机层,饱和食盐水洗,无水硫酸钠干燥,过滤,浓缩得浅黄色油状物18.8g,收率93.0%,ee值100%。
[0187]
实施例4(r)-2-氯-(2-氯苯基)乙醇(化合物
ⅴ-
2)的生物催化制备
[0188][0189]
取化合物(iv-2)(20g),溶解于异丙醇(120ml)中,加入0.1m的磷酸盐缓冲液(400ml),加入nad
(0.2g),加入实施例2制备的lk01菌体(10g),25℃,220rpm,摇床反应,hplc监控反应转化率》98%时,终止反应。
[0190]
加入异丙醇(100ml),离心,取上清液,部分浓缩异丙醇,甲叔醚(400ml)萃取,有机溶剂(100ml
×
2)萃取水层,合并有机层,饱和食盐水洗,无水硫酸钠干燥,过滤,浓缩得浅黄色油状物18.8g,收率93.0%,ee值100%。
[0191]
实施例5其他羰基还原酶催化合成(r)-2-氯-(2-氯苯基)乙醇的转化率和ee值检测
[0192]
(r)-2-氯-(2-氯苯基)乙醇的合成步骤与方法参见实施例3,分别用不同的菌体替换实施例3中的lk01菌体。实验结果如表1所示
[0193]
表1
[0194][0195]
表中,
“-”
表示未检测到产物
[0196]
酶编号为736、774、1184、1500的氧化还原酶均购自湖州颐辉生物科技有限公司;酶编号ea的登录号为ck342003;lk01与lk08为同一野生菌的突变体,两者序列比对两者同源性91.3%,如图3所示。其中,lk08的氨基酸序列为:mtdrlkgkvaivtggtlgiglaiadkfveegakvvitgrhadvgekaaksiggtdvirfvqhdasdeagwtklfdtteeafgpvttvvnnagitvsksvedttteewrkllsvnldgvffgtrlgiqrmknkglgasiinmssieglvgdptlgaynaskgavrimsksaaldcalkdydvrvntvhpgyiktplvddhegleemmsqrtktpmghigepndiawicvylasdeskfatgaefvvdggytaq(seq id no.3)。
[0197]
本实验结果表明:与结构类似的羰基还原酶相比,lk01的转化率和ee值均优于其他羰基还原酶。
[0198]
对比实施例:lk01还原结构类似物。
[0199][0200]
取化合物(ⅵi)(1g),溶解于异丙醇(12ml)中,加入0.1m的磷酸盐缓冲液(40ml),加入nad
(0.1g),加入上述发酵所得lk01的菌体(0.5g),25℃,220rpm,摇床反应,反应24h,hplc监控反应转化率50%,ee值85.68%。
[0201]
结果表明,相较于结构类似的vii化合物,lk01对式iv化合物具有更好的专一性和选择性,其转化率和ee值均有显著提高。
[0202]
实施例6(r)-2-(2-氯苯基)环氧乙烷(化合物ⅵ)的制备
[0203]
[0204]
取实施例3制备的化合物v-1(15g),溶解于甲苯(100ml)中,0-5℃条件下,缓慢滴加氢氧化钠(3.1g)的水溶液(50ml),滴毕升至室温反应5h,hplc检测转化率》99%,停止反应,分出甲苯层,甲苯(30ml)萃取水层一次,合并甲苯层,水(10ml)洗一次,无水硫酸钠干燥,过滤浓缩得淡黄色油状物9.06g,收率92%。
[0205]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
