可存活胰岛样细胞结构及其制备方法
1.本发明涉及干细胞分化领域。特别地,本发明涉及用于将干细胞分化成胰岛样细胞结构(pancreatic islet-like cell structure)的方法,并且涉及由此获得的胰岛样细胞结构。
2.1型糖尿病(type 1 diabete,t1dm)是具有重要社会经济影响的疾病,其由胰腺胰岛素产生细胞(β细胞)的自身免疫性破坏引起,并与使人衰弱的微血管和大血管并发症的发生相关。用外源性胰岛素治疗以实现血糖控制并未完全预防长期并发症。胰腺移植和胰岛移植二者均使胰岛功能恢复并可能降低长期糖尿病并发症,但被供体短缺和需要免疫抑制二者限制。β细胞替代是在患有糖尿病的患者中实现血糖正常的有吸引力的治疗,并且数项研究集中于人β细胞的产生。具有其无限的自我更新能力的多能干细胞可代表胰岛素产生细胞的可扩展的来源。β样细胞己从人诱导多能干细胞(human induced pluripotent stem cell,hipcs)和人胚胎干细胞(human embryonic stem cell,hesc)中分化出来。然而,目前大多数方法是复杂的并且需要病毒诱导的转染或遗传改造方法。从多能干细胞产生β细胞的挑战面临着数个低效率的问题,包括分化速率、产生不成熟的胰岛素产生细胞、伦理问题、肿瘤形成或未能维持高血糖的持续校正。最近,许多努力集中于鉴定功能性β细胞的替代的且丰富的细胞来源。在自然界中,胰岛包含不同的内分泌细胞:α、β、γ、ε和pp细胞,其分别分泌胰高血糖素、胰岛素、生长抑素、食欲刺激素(ghrelin)和胰多肽。胰岛的特征性构象对于胰岛功能的精细调节是重要的。特别地,已经证明胰岛细胞之间的旁分泌细胞相互作用有助于调节激素分泌以及调节正常的β细胞功能。已经描述了数种多步骤方案以将人胚胎或诱导多能干细胞分化成胰祖细胞(pancreatic progenitor),这些胰祖细胞能够经历体内成熟,并产生能够在小鼠中逆转糖尿病的葡萄糖敏感胰岛素分泌细胞。体外成熟内分泌细胞的产生将有利于糖尿病的逆转。然而,体外产生的祖细胞不成熟,并且该方案主要产生同时表达胰岛素、胰高血糖素和生长抑素的多激素细胞。rezania,a.,et al.,maturation of human embryonic stem cell-derived pancreatic progenitors into functional islets capable of treating pre-existing diabetes in mice.(2012)diabetes,61(8):2016-2029最近描述了从人胚胎干细胞产生葡萄糖响应性胰岛素分泌细胞的七阶段方案。这些细胞即使未完全成熟,也能够迅速逆转糖尿病。
3.胰岛素产生细胞也可从胰祖细胞产生。尽管未成熟表型具有多激素表达,但该细胞能够在小鼠中逆转或预防糖尿病。胰岛素产生细胞还通过成体干细胞(例如在不存在血清和有适当混合的因子的情况下培养的胰岛来源的间充质干细胞,以及在模拟糖尿病小生境(niche)的条件下的骨髓间充质干细胞)的转分化来获得。另一些方法集中于通过诱导表观遗传变化来重编程胰细胞类型,例如导管细胞、腺泡细胞或α细胞。
4.肝和胰腺二者共用共同的胚胎起源,并且已显示发育中的肝表现出与成体胰腺类似的转录特征。胰岛素产生细胞也通过重编程肝细胞诱导pdx1和毒蜥外泌肽-4的过表达以强制增殖和分化来产生。然而,使用人肝脏肝细胞的限制是其在体外的低增殖潜力。herrera,m.b.et al.isolation and characterization of a stem cell population from adult human liver.(2006)stem cells.24,2840-2850描述了通过培养策略从成体
人肝中的分离,该培养策略导致被定义为成体人肝干细胞样细胞(human liver stem-like cell,hlsc)的具有高增殖能力的细胞群的成熟肝细胞的死亡。hlsc是克隆形成的并且表达间充质干细胞和未成熟肝细胞二者的标志物。此外,hlsc表达数种干细胞和胚胎标志物,例如nanog、oct4、sox2和ssea4,并且能够经历多种分化,包括胰岛样表型。然而,分化方案被非常低的效率限制,并且未表明葡萄糖控制下的胰岛素分泌。
5.wo2015091493公开了通过基于由添加至细胞培养基的聚阳离子物质促进的电荷依赖性聚集的方案,从分离的成体干细胞在体外产生胰岛素产生3d球状结构。特别地,wo2015091493教导了,在存在聚阳离子物质的情况下在第一分化细胞培养基中培养分离的成体干细胞之后,为了获得部分成熟的胰岛样细胞结构,需要通过用不包含聚阳离子物质的第二分化细胞培养基替代第一细胞培养基来进行的第二培养步骤。
6.本发明人提供了制备球状胰岛样细胞结构的新方法,该方法在所附权利要求书中限定。权利要求书的内容构成说明书的组成部分。
7.根据本发明的方法由以下发现引起:在存在聚阳离子物质的情况下,以单次培养传代(single culturing passage)在不更换细胞培养基的情况下培养分离的成体干细胞能够获得胰岛样结构,其几乎在功能上完全成熟以及其在细胞数目和结构数目两个方面均提高。与现有技术相比,根据本发明的方法不仅更简单、更快和更有效,而且还导致胰岛的生存力改善。
8.因此,在第一方面中,本发明提供了制备人工培养的球状胰岛样细胞结构(artificially grown spheroid pancreatic islet-like cell structure)的群体的方法,其包括在有氧条件下在包含聚阳离子物质的分化液体细胞培养基中培养成体干细胞5至21天时间,并随后阻断培养,其中所述培养以单次培养传代进行而不更换分化液体细胞培养基。
9.根据本发明的方法的其他特征和优点在形成说明书的组成部分的所附权利要求书中限定。
10.如wo2015091493中所述,在液体细胞培养基中在存在聚阳离子物质的情况下培养时,分离的成体干细胞聚集并分化成球状胰岛样细胞结构。
11.在给定浓度下能够促进成体干细胞聚集和分化成胰岛细胞并且在该浓度下对细胞无细胞毒性的任何聚阳离子物质均可用于本发明的方法中。适合于在本发明的方法中使用的聚阳离子物质的一些说明性的非限制性实例是鱼精蛋白、聚赖氨酸和阳离子右旋糖酐。
12.鱼精蛋白,优选盐的形式,例如鱼精蛋白硫酸盐或鱼精蛋白盐酸盐,因为其适合于临床应用是优选的正聚阳离子,并且其以优选范围为5至50μg/ml、更优选10至30μg/ml、甚至更优选15至25μg/ml的浓度添加至培养基。最优选的鱼精蛋白形式是鱼精蛋白盐酸盐。
13.在本发明的方法中使用的成体干细胞优选为成体哺乳动物干细胞。因此,任何能够维持哺乳动物细胞生长的液体细胞培养基均适合于在本发明的方法中使用。在一个实施方案中,液体细胞培养基是富含血清的细胞培养基。富含血清的dmem或rpmi作为非限制性实例被提及。细胞培养基中的血清浓度优选地为5至20%。优选地,液体细胞培养基还包含一种或更多种碳源,例如葡萄糖和谷氨酰胺。优选的葡萄糖浓度为6至25mm。优选的谷氨酰胺浓度为0.5至3mm。
14.在另一个实施方案中,液体细胞培养基不含血清并且血清被替代物(例如提供白蛋白以及α和β-球蛋白的有益生长促进活性的蛋白质替代物)替代。用于本发明的方法的最合适的血清替代物的选择落入本领域技术人员的知识范围内。
15.在本说明书的上下文中,表述“成体干细胞”旨在意指从成体组织分离的干细胞,与从胚泡的内细胞群分离的“胚胎干细胞”相反。成体干细胞也被称为“体细胞干细胞”。
16.根据本发明的方法,在5至21天,优选5至13天时间,更优选5至11天时间,甚至更优选5至9天时间的培养期之后,阻断球状胰岛样细胞簇的培养。例如,根据本发明的球状胰岛样细胞簇的培养期为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天。例如,可通过收获胰岛样结构,例如通过收集包含悬浮的胰岛的上清培养基并回收黏附至培养基质的胰岛样结构来进行培养的阻断。应理解,如本领域已知的,在本发明的范围内可使用在体外阻断胰岛培养的其他方法。
17.如上所述,本发明的方法的一个关键要素是胰岛样细胞结构的培养在整个培养期内进行而不更换分化液体细胞培养基。就此而言,应理解术语“更换分化液体细胞培养基”旨在涵盖用新鲜批次的相同液体培养基替代分化液体细胞培养基,以及用不同的液体培养基替代分化液体细胞培养基。不希望受任何理论的束缚,发明人认为观察到的用本发明的方法获得的在胰岛数目和生存力方面的提高可能是由于在其分化期间形成结构缺乏机械干扰以及由于培养基中由细胞分泌的旁分泌因子的积累。
18.在本发明的方法中,胰岛样细胞结构的培养在有氧条件下进行。如本领域已知的,气体交换,特别是氧的供应和恒定氧水平的维持,是细胞培养系统中的基本方面,以维持培养生存力。实际上,在体外培养中,细胞生长水平的微环境的氧条件,即所谓的细胞周围条件,可显著影响细胞代谢和信号传导。
19.titus k.et al,“closed system cell culture protocol using hyperstack vessels with gas permeable material technology”,j vis exp.2010;(45):2499在图1中描述了在标准细胞培养容器中在3天内培养基中细胞周围氧浓度的耗竭。出于本发明的目的,细胞周围氧浓度优选为至少5mg/l。
20.因此,在本发明的一个优选实施方案中,成体干细胞在固体支持物上培养,并且固体支持物的表面上分化液体细胞培养基中的氧浓度为至少5mg/l。
21.本文中使用的术语“表面”意指固体支持物的细胞生长表面。
22.可选择细胞固体支持物以具有任何合适的形状,并且细胞固体支持物由能够维持哺乳动物细胞生长的任何合适的材料制成。一些合适的实例可包括固体支持物,包括例如玻璃、塑料、硝酸纤维素或琼脂糖。在一个实施方案中,固体支持物可采用玻璃或塑料板或载片或膜的形式。在另一些实施方案中,固体支持物可以是玻璃或塑料多孔板,例如微量滴定板。在一个实施方案中,固体支持物可采用细胞培养瓶或滚瓶的形式。用于本发明的方法的最合适的固体支持物的选择落入本领域技术人员的知识和技能范围内。
23.在本发明的一个实施方案中,在培养期期间分化液体细胞培养基中的氧浓度为初始氧浓度的100%至80%,优选100%至90%,更优选100%至95%。
24.如上所述,在体外培养中精确控制向细胞递送氧对于维持适当的细胞周围氧条件是重要的。因此,在本发明的方法的一个优选实施方案中,用于细胞培养的固体支持物是透气的。该实施方案基于以下事实:可渗透的支持物允许氧从支持物的底部直接扩散,而绕过
由细胞上方的培养基产生的扩散屏障。
25.优选地,细胞培养支持物是透气膜。透气膜材料可由任何合适的透气材料制成,只要其提供气体例如氧和二氧化碳通过固体支持物的自由通道即可。合适的透气材料的一些非限制性实例包括聚苯乙烯、聚乙烯、聚碳酸酯、聚烯烃、乙烯乙酸乙烯酯、聚丙烯、聚砜、聚四氟乙烯(ptfe)或相容的含氟聚合物、硅橡胶或共聚物、聚(苯乙烯-丁二烯-苯乙烯)或者这些材料的组合。
26.在本发明的一个优选实施方案中,用作细胞培养支持物的透气膜的厚度为25μm至250μm,更优选25μm至125μm。
27.聚合物材料中气体的渗透率可根据材料特性和渗透物而变化。优选地,在根据本发明的方法中,透气膜的渗透率为如以克/平方米/天表示的至少1000(g 25μ/m2/24小时)。
28.在本发明的方法的另一个实施方案中,固体支持物由聚合物材料制成,所述聚合物材料经修饰以便细胞对它的附着与未经修饰的聚合物材料相比显著增强。
29.本文中使用的术语“显著”意指如通过将统计学显著性水平设置为0.05(p值<0.05)来评估的固体支持物的经修饰的聚合物材料与未经修饰的聚合物材料之间的细胞黏附能力存在统计学显著差异。在此背景下,通过使用现有技术中已知的任何已知合适的统计学方法,例如anova和t检验来进行统计学分析。
30.适合于在本发明中使用的一些示例性聚合物材料包括但不限于聚丙烯酸酯、聚甲基丙烯酸酯、聚碳酸酯、聚苯乙烯、聚砜、多羟基酸、聚酸酐、聚原酸酯、聚磷腈、聚磷酸酯、聚酯、尼龙或其混合物。
31.举例来说,固体支持物的聚合物材料可以是经聚苯乙烯修饰的,以便提高聚苯乙烯主链的含氧官能团,从而提供优异的润湿性、亲水性和ecm蛋白与表面的黏附性。
32.在本发明的一个更优选的实施方案中,成体干细胞在包含多个分层细胞培养固体支持物(layered cell culture solid support)的培养容器中进行培养。
33.在该实施方案中,将细胞培养固体支持物,优选透气膜的多层排列组装到单一容器中以为细胞生长提供显著提高的表面积,从而允许显著提高用本发明的方法可获得的胰岛样细胞簇的产率。
34.细胞培养容器可以是例如其中多个透气膜以堆叠排列的方式设置的瓶,例如聚苯乙烯瓶。可通过一个或更多个通气帽或直接通过整体空气空间的薄表面将氧引入多层容器。在本发明的一些实施方案中使用的细胞培养支持物可能够进行气体交换,以在整个细胞培养容器中实现均匀的气体分布。一些示例性细胞培养多层容器在us 8,178,345和us 7,745,209中描述,其内容通过引用整体并入本文。
35.根据本发明的另一个优选实施方案,分化成胰岛样细胞结构的成体干细胞是成体人肝干细胞(hlsc)。优选的人肝干细胞是在wo 2006/126219中公开的表达间充质和胚胎干细胞二者的标志物的人非卵圆肝干细胞(hlsc)。该细胞系的特别特征在于其是从成体组织中分离的非卵圆人肝多能祖细胞系,其表达肝细胞标志物并且具有多能分化能力和再生特性。更特别地,该细胞系能够分化成成熟肝细胞、胰岛素产生细胞、成骨细胞和上皮细胞。根据一个优选的实施方案,其表达选自白蛋白、甲胎蛋白、ck18、cd44、cd29、cd73、cd146、cd105、cd90及其任意组合的一种或更多种标志物,并且其不表达选自cd 133、cd117、ck19、cd34、细胞色素p450的标志物。
36.wo 2006/126236中公开的人非卵圆肝多能祖细胞/干细胞显示出经历分化成多种组织细胞类型(即,成熟肝细胞、上皮细胞、胰岛素产生细胞和成骨细胞)并发挥器官再生作用。这样的细胞来源于表达肝细胞标志物的非卵圆人肝多能祖细胞系。这样的细胞通过包括以下步骤的方法分离:
37.(i)在细胞培养基中培养成体肝来源的人成熟肝细胞直至成熟肝细胞死亡并选择具有上皮样形态的存活细胞的群体;
38.(ii)通过在补充有hegf(人上皮生长因子)和bfgf(碱性成纤维细胞生长因子)并包含哺乳动物细胞生长所需要的常用无机盐、氨基酸和维生素的含血清、含葡萄糖的培养基中培养来扩增具有上皮样形态的存活细胞的群体,并且特别地其中成熟肝细胞在存在冷冻保护剂的情况下在含血清培养基中冷冻,然后在根据步骤(i)培养之前解冻。
39.在wo 2006/126236中公开的人非卵圆肝干/祖细胞的表征及其制备方法通过引用完全并入本文。
40.出于以下多个原因在本发明中使用hlsc是优选的:1)其相对容易分离和扩增,2)其特征在于允许提供合适数目的细胞用于治疗用途的增殖程度,3)其可自体使用,以及4)其避免了伦理问题。此外,肝和胰腺共用共同的胚胎起源,并且已显示发育中的肝表现出与成体胰腺类似的转录特征(bose b et al.cell biol int.2012;36(11):1013-20)。然而,由于设想聚阳离子物质应有效促进除hlsc之外的其他成体干细胞的聚集和分化,因此本发明的范围不仅限于使用hlsc,还包括使用任何成体干细胞类型。
41.如上所述,通过本发明的方法可获得的胰岛样细胞结构的特征在于高生存力和体外功能特性的独特组合。因此,本发明的范围还包括组合物,其包含如所附权利要求书中限定的人工培养的球状胰岛样细胞结构的群体。
42.如以下实验部分中进一步说明的,通过用荧光素二乙酸酯(fluorescein diacetate,fda)和碘化丙啶(propidium iodide,pi)双重染色进行的生存力评估揭示了在根据本发明体外培养数天之后,胰岛样结构仍有超过93%的生存力(图3)。
43.因此,根据本发明的球状胰岛样结构的群体的有利特征在于如通过荧光素二乙酸盐(fda)和碘化丙啶(pi)测定法测量的生存力高于93%。在本发明的一个优选实施方案中,球状胰岛样结构的群体显示出生存力高于95%、更优选高于97%、甚至更优选高于98%。
44.根据本发明的球状胰岛样结构的特征还在于增强的葡萄糖响应性,其如在静态或动态条件二者下通过响应于高葡萄糖(high glucose,hg)刺激而以响应于低葡萄糖(low glucose,lg)刺激而分泌的量的至少1.5倍的量分泌c肽的能力来测量。例如,由球状胰岛样结构在静态或动态条件二者下响应于hg刺激而分泌的c肽的量是响应于lg刺激而分泌的量的至少1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍或更多。
45.在本发明的一个优选实施方案中,响应于高葡萄糖(hg)刺激而分泌的c肽的量为至少50pg/ml/400ieq,优选至少80pg/ml/400ieq,更优选至少95pg/ml/400ieq,甚至更优选至少100pg/ml/400ieq。
46.在本说明书的上下文中,术语“高葡萄糖”旨在指28mm葡萄糖的刺激物,而术语“低葡萄糖”旨在指高至2.8mm葡萄糖的刺激物,其不包括0值,例如0.1mm高至2.8mm葡萄糖。
47.在本发明的一个优选实施方案中,群体中的球状胰岛样细胞结构的至少50%的直径为小于150μm,优选等于或小于100μm,更优选51至100μm。
48.根据本发明的另一个优选实施方案,球状胰岛样细胞结构的群体的平均直径小于100。
49.根据本发明,球状胰岛样结构在蛋白质水平上表达通常由人胰岛产生的胰腺激素(即,胰岛素、胰高血糖素、胰多肽、生长抑素和食欲刺激素)。
50.在本发明的一个优选实施方案中,根据本发明的胰岛样结构表达胰β-细胞发育和/或功能的一种或更多种另外的标志物,例如β-细胞转录因子nkx6.1、nkx6.3、mafa和mafb,内分泌特异性标志物嗜铬粒蛋白a(cga)和ngn3,以及外分泌胰标志物pdx1和突触素(synaptophysin),及其任意组合。
51.在本说明书的上下文中,ieq/100ils是相对于100胰岛(ils)归一化的平均直径为150μιη的胰岛当量(ieq)。根据常规方案,从胰腺分离并用于移植的胰岛的ieq如下来确定。从胰腺分离的悬浮胰岛在数目和尺寸(直径)两个方面进行评价,以确定总胰岛当量(即总胰岛体积)。胰岛直径评估考虑了51μm至>350μm的50μm直径范围增量,而未考虑对总体积未提供显著贡献的<50μm的直径。相对转换系数通常用于将总胰岛数目转换为平均直径为150μm的胰岛当量(ieq)。
52.根据上述形态、功能和生存力特性,根据本发明的胰岛样结构特别适合于在临床应用和体外应用二者中使用,所述临床应用例如通过胰岛移植治疗糖尿病的方法,所述体外应用例如用于鉴定能够促进由胰岛细胞表达一种或更多种胰腺激素的物质或者用于鉴定能够对胰岛细胞施加细胞毒性作用的物质的筛选方法。
53.以下实验部分仅作为说明提供,并不旨在限制如所附权利要求书中限定的本发明的范围。在以下实验部分中,参考了附图,其中:
54.图1:hlsc体外分化成胰岛样结构(hlsc-ils)。示出了在体外培养第7天(a)在从hyperflask收集之前和(b、c)在从hyperflask收集之后的hlsc-ils的一些代表性显微照片。(b)4x显微照片;(c)10x显微照片。(d、e)示出了作为hlsc-ils(d)或ieq(e)的总数目测量的效力分析的结果的图。数据显示为9个独立实验的平均值
±
sd。
55.图2:示出了在体外培养(4、7、11和14天)期间来源于hlsc的胰岛样结构的尺寸分布的图。数据作为相对频率表示。
56.图3:示出了如通过fda/pi染色测量的在体外培养中从第4天至第14天的hlsc-ils的生存力的图。可存活(viable)胰岛的百分比以存活百分比(fda)/死亡百分比(pi)计算。
57.图4:示出了通过免疫荧光表征的胰岛样结构的一些代表性图片。针对(a)胰岛素、pdx-1、胰高血糖素、c肽、食欲刺激素、生长抑素(stt)、胰多肽(pp)和(b)cgn3、mafa、nkx6.1、ngn3,胰岛样结构呈阳性染色。阴性对照:阴性对照488和阴性对照texred。
58.图5:由hlsc-ils在静态和动态条件下响应于低葡萄糖(lg)和高葡萄糖(hg)刺激而在体外分泌的人c肽(hc肽)。
59.(a)示出了在第7天hlsc-ils(400ieq)在葡萄糖(lg)的基础条件下分泌hc肽,并且对高葡萄糖刺激(hg)的响应进一步提高的图。n=3个独立实验。(b)示出了由hlsc-ils在高葡萄糖单脉冲刺激之后在体外培养的第14天动态分泌hc肽的图。
实施例
60.1.人肝干细胞(hlsc)的分离、表征和培养
61.hlsc是从获自lonza bioscience(basel,switzerland)的人的冷冻保存的正常肝细胞中分离的,并且如前所述进行培养和表征(herrera,m.b.et al.,isolation and characterization of a stem cell population from adult human liver.(2006)stem cells.24:2840-2850.)。用作对照的尸体的人胰岛获自tebu-bio(magenta,italy)。
62.2.hlsc体外分化成胰岛样结构(hlsc-ils)
63.细胞解冻和扩增
64.将包含hlsc(p7至9)的冷冻管在37℃下在水浴中解冻。将细胞悬液转移到包含10ml的补充有l-谷氨酰胺(5mm)、50iu/ml青霉素/50μg/ml链霉素和10%fbs的rpmi 1650(rpmi 10%fbs)的15ml管中。将细胞在1200rpm下离心5分钟,弃去上清液,计数总细胞并将10
×
106个细胞/hyperflask(corning ref:10034)平板接种在560ml的具有以下组成的gmp样基础hlsc培养基中:
[0065]-500mlα-极限必需培养基(α-mem;lonza.ref.be12-169f)
[0066]-50ml的去补体fbs
[0067]-各250μl的fgf2-egf(250mg/ml-250mg/ml)
[0068]-l-谷氨酰胺(5mm)
[0069]-青霉素(50iu/ml)、链霉素(50μg/ml)。
[0070]
将平板接种的细胞在湿润的5%co2培养箱中在37℃下孵育,并维持在培养物中直至≈70%至80%的汇合。
[0071]
细胞分离
[0072]
当细胞约≈80%汇合时,弃去上清液并用pbs 1x将细胞洗涤两次以消除培养基残留物。添加总560ml的在pbs 1x中稀释的triple(gibco.ref.12563-029)(1∶5),并将细胞在培养箱中在37℃下孵育5分钟。轻且手动地摇动瓶直至所有细胞均分离,并且将细胞悬液转移到无菌瓶中。用200ml的rpmi-1640洗涤hyperflask。
[0073]
将细胞悬液分装在50ml管中并在1200rpm下高加速/高减速地离心5分钟。在弃去上清液之后,将细胞沉淀用剩余液体重悬,并一起转移到单个10ml管中。
[0074]
如下量化细胞的总体积和总数目:90μl的亚甲基蓝(1∶10) 10μl的细胞悬液。
[0075]
hlsc-ils的分化
[0076]
为了促进细胞分化,发明人使用了rfg培养基(每个hyperflask为560ml):补充有11.6mm葡萄糖(5.8ml的1m葡萄糖溶液)的rpmi 10%fbs。将约70至80
×
106hlsc重悬在280ml的rfg培养基中。将细胞溶液转移到hyperflask中以避免形成气泡,并将封闭的hyperflask水平放置,以便在所有十个层中均匀地分配体积。然后,将hyperflask垂直放置并用剩余的rfg溶液(280ml)填满。将1ml的鱼精蛋白溶液(10mg/ml)添加至终浓度为18μg/ml,并手动轻轻摇动hyperflask以分散鱼精蛋白溶液。将hyperflask在湿润的5%co2培养箱中在37℃下孵育7天,而不更换培养基。
[0077]
hlsc-ils的形成通常在最初的12至48小时之后开始,并且为了获得成功的聚集,细胞在刺激之后的接下来4天期间不应被干扰。实际上,任何机械应力均可干扰产生的hlsc-ils的尺寸均匀性和数目。
[0078]
hlsc-ils的收集
[0079]
在刺激之后第4至14天,通过手动且轻轻地摇动hyperflask以将胰岛从壁表面分
离来收集hlsc-ils。将来自hyperflask的全部体积直接转移到无菌瓶中。然后,将该体积分装在50ml管中并放置10分钟以获得hlsc-ils的无应力沉淀。将管在1000rpm下离心5分钟,通过使用10或25ml移液管吸出上清液,留下约2ml的液体,将其轻轻重悬以获得均匀的hlsc-ils悬液。
[0080]
3.透射电子显微术
[0081]
透射电子显微术是根据标准程序,在经卡尔诺夫斯基固定(kamovsky’s-fixed)、四氧化锇后固定组织并嵌入环氧树脂上进行的。将超薄切片用乙酸铀酰和柠檬酸铅进行染色,并用jeol jem 1010电子显微镜(jeol)进行检查。通过透射电子显微术,在体外培养期间在3d球状结构中观察到人胰岛的典型内分泌颗粒。观察到三种主要类型的电子致密颗粒:包含晶体的颗粒、具有弥漫性灰白色核心的颗粒和具有致密核心的颗粒。
[0082]
4.效力评估
[0083]
对于每种hlsc-ils制剂,本发明人确定了效力,即根据本发明的方法产生的hlsc-ils/批次的数目(图1d)和胰岛当量(ieq)/hlsc-ils(图1e)二者。
[0084]
为了评估制剂的效力,在培养时间结束时,将hlsc-ils机械分离(轻轻摇动),并且将由此获得的悬液分装在50ml管中并在1000rpm下离心5分钟。然后,弃去上清液,并将hlsc-ils收集在单独的管中。测量hlsc-ils悬液的总体积(μl)以及50至100μl样品中hlsc-ils的数目,并如下计算效力:
[0085]
效力=样品中hlsc-ils的总数目
×
hlsc-ils悬液的总体积/样品体积。
[0086]
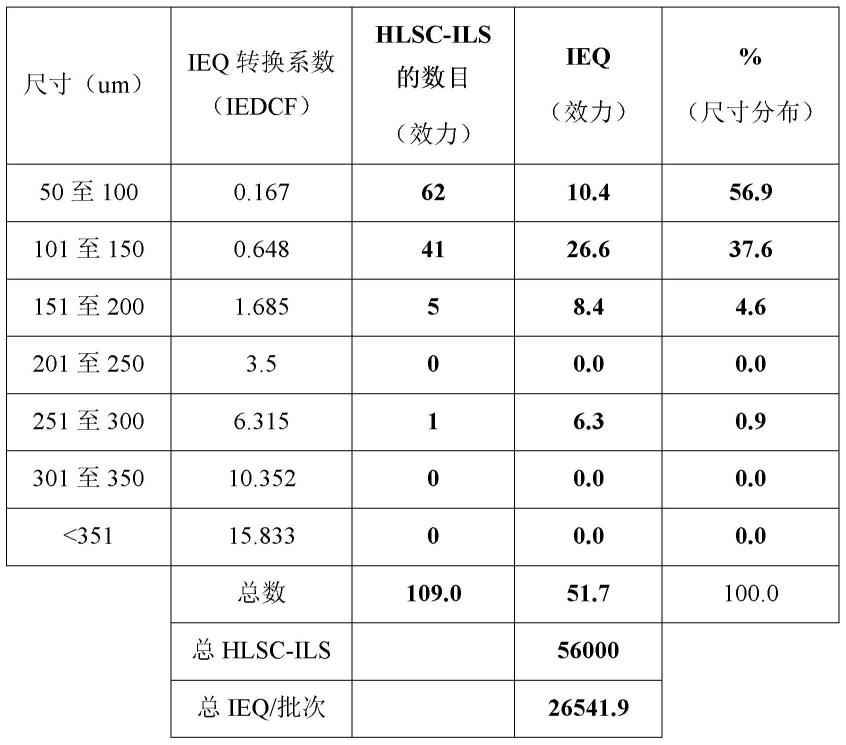
为了评估胰岛当量(ieq)/hlsc-ils,在样品中存在的每个单个hlsc-ils中确定了单个最大直径(约100hlsc-ils/制剂)。然后,将hlsc-ils根据尺寸范围以组进行分布。然后通过将每个亚群中hlsc-ils的总数目乘以已建立的当量因子来计算样品中的胰岛当量(ieq)的数目。此外,通过计算每个群体的百分比来获得尺寸分布(图2)。上述计算的一个实例在下表1中示出:
[0087][0088]
5.尺寸频率分布
[0089]
使用cell observer sd-apotome激光扫描系统(carl zeiss international,jena,germany)使用10x物镜获得显微照片。从四个不同实验中的每个中随机选择近500个hlsc-ils,并如ricordi,c.,et al.(1990).“islet isolation assessment in man and large animals”,acta diabetologica latina,27:185-195中所述测量每个结构的大直径。此后,使用axiovision软件rel3.4(zeiss,germany)计算直径的尺寸频率分布。如图2中所示,在第4、7、11和14天的体外培养中,超过50%的hlsc-ils的直径为50至100μm。
[0090]
6.生存力测定
[0091]
对于生存力评估,制备了碘化丙啶(pi)(pbs 1x中1mg/ml)和荧光素二乙酸酯(fda)(丙酮中1mg/ml)的储备溶液。然后通过在pbs 1x中1∶20的稀释ip储备溶液并在pbs 1x中1∶100的稀释fda储备溶液来制备工作稀释液,并且在30分钟内使用稀释液。
[0092]
将hlsc-ils在1000rpm下离心5分钟,并且将胰岛沉淀接种在具有200μl的pbs 1x的24孔板中。随后将胰岛与20μl经稀释的fda和20μl经稀释的pi溶液一起孵育30秒,并拍摄显微照片。死细胞被染成红色,而可存活细胞被染成绿色。然后将hlsc-ils分配到以下类别:
[0093]
类别0:极少/n
°
绿色细胞(不可存活)
[0094]
类别1:75%红色细胞(25%生存力)
[0095]
类别2:50%红色细胞(50%生存力)
[0096]
类别3:25%红色细胞(75%生存力)
[0097]
类别4:极少/n
°
红色细胞(100%生存力)。
[0098]
然后如下计算总可存活胰岛:(0.25
×n°
.类别1) (0.5
×n°
.类别2) (0.75
×n°
.类别3) n
°
.类别4。如下计算总胰岛数目:n
°
.类别0 n
°
.类别1 n
°
.类别2 n
°
.类别3 n
°
.类别4。n
°
对应于每个类别中hlsc-ils的数目。通过应用以下公式来确定生存力的百分比:总可存活hlsc-ils
×
100/hlsc-ils的总n
°
。
[0099]
如图2中所示,产生的最高比例的hlsc-ils的直径为50μm至150μm。小的胰岛的群体的直径在151μm至250μm内,以及极少数的结构的直径>250μm。
[0100]
7.免疫细胞化学
[0101]
在培养期间,通过免疫荧光在hlsc-ils中评估胰标志物的表达。在实验结束时,收集hlsc-ils并将其接种在带正电荷的玻璃载片中,并在培养箱中孵育60分钟以促进其附着。然后在4%的多聚甲醛(paf,在4
°
下过夜)中固定。简言之,将样品首先用pbs 1
×
洗涤两次,在4℃下用包含20mmol/l hepe、50mmol/l nacl、300mmol/l蔗糖、3mmol/l magcl2、0.5%tritonx-100,ph 7.4的可渗透溶液孵育5分钟。在用pbs洗涤之后,将切片用添加有3%牛白蛋白的pbs封闭液在室温下孵育1小时,并在4℃下孵育过夜,用pbs 1
×
洗涤两次,每次持续5分钟,用包含pbs 1
×
、吐温(0.1%)和0.1%牛血清白蛋白(重量/体积)的封闭液孵育20分钟,在室温下持续30分钟,然后与特异性一抗或不相关的同种型对照一起孵育过夜。将切片与以下抗人蛋白一抗一起孵育过夜:pdx1(1∶500)、ngn3(1∶50)、mafb(2μg/ml)、nkx6.1(1∶50)、nkx6.3(2μg/ml)、嗜铬粒蛋白a(cga)(2μg/ml)、c肽(2μg/ml)、胰高血糖素(1∶50)、生长抑素(2μg/ml)、胰多肽(3μg/ml)和食欲刺激素(3μg/ml)(1∶200)(abcam,cambridge,ma);胰岛素(1∶200,dako,copenhagen,denmark);glut-2(1∶200,santacruz,santacruz,tx)。使用适当的同位素不相关抗体(abcam)作为对照。在用pbs-吐温溶液洗涤之后,将切片与适当的二抗1∶1000(用于pdx1和pp的alexa fluor 488驴抗山羊igg;用于cga、c肽、食欲刺激素的山羊抗小鼠igg;用于mafb、nkx6.1、nkx6.3、glut-2、胰高血糖素、生长抑素的山羊抗兔igg,用于胰岛素的山羊抗豚鼠igg;用于ngn3的德克萨斯红山羊抗小鼠igg(invitrogen,carlsbad,ca)一起在室温下孵育一小时,用pbs-吐温溶液洗涤并用dapi(dako)孵育10分钟。在用pbs洗涤步骤之后,用fluoromount(sigma)封固玻璃载片。通过省略一抗或通过用非免疫同位素对照替代来验证识别人标志物的一抗的特异性。使用zeiss lsm 5pascal model共聚焦显微镜(carl zeiss international)进行共聚焦显微术分析。
[0102]
如图4中所示,免疫荧光分析揭示了hlsc-ils在分化14天时表达β细胞转录因子nkx6.1和内分泌特异性标志物ngn3。此外,在相同时间点,hlsc-ils表达外分泌胰标志物pdx1和人胰岛特异性激素,包括胰岛素/c肽、胰高血糖素、生长抑素和食欲刺激素。所有同种型对照均为阴性。
[0103]
8.体外葡萄糖刺激的静态测定
[0104]
为了检查由根据本发明的胰岛样结构响应于葡萄糖而分泌的静态hc肽,本发明人在静态条件下对胰岛样结构进行孵育。简言之,将hlsc-ils最初用基础浓度的葡萄糖(2.8mm;lg1)刺激1小时,然后将胰岛用高葡萄糖(28mm;hg)刺激2小时随后用高钾(50mm;kcl)刺激1小时。葡萄糖和氯化钾刺激步骤二者均通过与低葡萄糖(lg2)孵育1小时来分开。用经2.8mm葡萄糖(lg3)刺激1小时来终止静态测定。
[0105]
9.体外动态葡萄糖刺激的分泌
[0106]
为了研究根据本发明的胰岛样结构的葡萄糖刺激的hc肽分泌响应的动力学,本发明人采用了动态灌注系统,更具体地为微流体动态灌注装置(dynamic perfusion device,dpd)。简言之,通过在培养的第7天和第14天用单脉冲葡萄糖刺激和钾或者用恒定的高葡萄糖刺激来诱导hlsc-ils分泌c肽。
[0107]
在单脉冲方案中,用于刺激的溶液浓度如下:2.8mm葡萄糖(基础葡萄糖,lg)、28mm葡萄糖(高葡萄糖,hg)和50mm氯化钾(kcl)。流量设置为30μl/分钟。应用了以下刺激顺序:
[0108]
1.使用lg(lg1)20分钟
[0109]
2.lg至hg转变15分钟
[0110]
3.使用hg 30分钟
[0111]
4.hg至lg转变15分钟
[0112]
5.使用lg 10分钟
[0113]
6.lg至kcl转变15分钟
[0114]
7.使用kcl 15分钟
[0115]
8.kcl至lg转变20分钟
[0116]
9.使用lg 10分钟。
[0117]
在恒定的高葡萄糖刺激方案中,用于刺激的溶液浓度如下:2.8mm葡萄糖(基础葡萄糖,lg)和17mm葡萄糖(高葡萄糖,hg)。流量设置为30μl/分钟。通过应用以下步骤顺序来刺激hlsc-ils:
[0118]
1.使用lg 20分钟
[0119]
2.使用hg 65分钟
[0120]
10.c肽的定量确定
[0121]
对于灌注液中c肽的定量测定,发明人使用了alpco kit elisa(alpco diagnosis,windham,nh)。简言之,将25μl的各标准、对照和样品与50μl的专有测定缓冲液一起添加至用对c肽具有特异性的单克隆抗体包被的96孔微孔板中。然后将微孔板在室温下在微孔板振动器上在700至900rpm下孵育1小时。在第一次孵育完成之后,将孔用每孔200μl的工作强度洗涤缓冲液洗涤6次并吸干。然后向每个孔中添加总100μl的工作强度缀合物,并且将微孔板在微孔板振动器上在700至900rpm下第二次孵育1小时,洗涤(用350μl的工作强度洗涤缓冲液洗涤6次),并吸干。向每个孔中添加tmb底物(100μl),并将微孔板在室温下在微孔板振动器上在700至900rpm下第三次孵育15分钟。一旦第三次孵育完成,向每个孔中添加100μl的终止液,并通过分光光度计在450nm处测量光密度(optical density,od)。产生的颜色的强度与样品中c肽的量成正比。
[0122]
11.统计学分析
[0123]
图例中报道了实验的数目。所有数据均使用graphpad prisma软件进行分析并以平均值
±
标准偏差(standard deviation,sd)表示。student’s t检验用于两组之间的比较。当研究超过两组时,通过anova分析数据,并且如果显著的话,则在适当时使用newman-keuls或dunnet或kruskal-wallis多重比较检验。p值<0.05被认为具有统计学意义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。