1.本发明涉及一种细胞培养片,更详细地,涉及一种适合大量生产细胞的细胞培养片及包括其的大容量细胞培养箱。
背景技术:
2.近年来,随着培养细胞在疾病治疗中的用途扩大,对于细胞培养的关注及研究正在增加。细胞培养为从生物体收集细胞并在体外培养的技术,培养的细胞可通过分化为皮肤、器官、神经等身体的各种组织来移植到人体或以分化之前的状态移植到人体,由此同时进行植入及分化,从而可用于治疗各种疾病。
3.需要以超出实验室水平的量培养靶细胞的数,来向人体移植为了治疗疾病而培养的细胞。因此,正在积极地开发能够以超出实验室水平的大容量培养细胞的培养装置或系统。
4.但是,由于细胞难以在三维上增殖,因此存在需要通过二维增殖来获得细胞的难点。为了通过二维增殖培养大量的细胞,需要增加细胞培养片的面积,然而,当考虑细胞培养装置具有有限的体积时,不断增加细胞培养片的面积也是受限的。
5.另外,根据培养细胞的种类不同,培养方法也不同,有些细胞是通过使培养基循环来培养,以适当维持二氧化碳的浓度,由于在培养基的循环过程中产生的流体流动可以使接种(seeding)到细胞培养片上的细胞脱离,当细胞培养片与培养的细胞之间的附着力弱时,存在细胞培养效率显著降低的问题。
6.另一方面,当提高细胞与细胞培养片之间的附着力时,虽然细胞培养良好,但在培养过程后回收培养的细胞时,可能会出现回收不良的问题。此外,当细胞不容易从片脱离时,需要更高水平的物理外力或化学处理,在该过程中,可能会对培养的细胞造成损伤。
7.另外,培养的细胞需要分离为单个细胞并回收,而根据细胞培养片,培养后的细胞会培养为与胶原蛋白等各种物质结合形成薄膜状态,在回收时也以薄膜回收,很难从回收的细胞团薄膜分离成单个细胞,并且还存在薄膜状态的细胞团难以用于研究的问题。
8.因此,急需开发一种用于解决这些问题并适用于大容量细胞培养系统或细胞培养装置的细胞培养片。
技术实现要素:
9.技术问题
10.鉴于此,提出了本发明,本发明的目的在于,提供一种细胞培养片,上述细胞培养片能够在细胞培养片上高度集聚地培养细胞,同时,能够在细胞不形成薄膜等的聚集的情况下进行培养和回收。
11.另外,本发明的另一目的在于提供一种细胞培养片,上述细胞培养片由于细胞附着力优秀,能够稳定地支撑附着的细胞,因此,即使在存在培养基的循环流动这样的外力和由此引起的细胞培养片的摇晃的培养环境下,也能够实现高效培养细胞。
12.另外,本发明的另一目的在于提供一种细胞培养片,上述细胞培养片与通过常规培养而培养的细胞相比,能够使大容量培养箱中培养的细胞更新鲜、健康且没有细胞转化。
13.此外,本发明的另一目的在于提供一种大容量细胞培养箱,上述大容量细胞培养箱使用根据本发明的细胞培养片,能够稳定地培养和回收大量的目标细胞,尤其是干细胞。
14.解决问题的手段
15.为了解决上述问题,本发明提供一种细胞培养片,上述细胞培养片包括:纤维网,具有由平均直径为1.5μm以下的支撑纤维累积形成的三维网状结构,克重为1至15g/m2;以及功能性涂层,至少覆盖在暴露于上述纤维网的一个表面的支撑纤维上,并且具有促进细胞的附着、迁移、增殖和分化中的一种以上的功能。
16.根据本发明的一实施例,上述细胞培养片的面积可以为100cm2以上。
17.并且,上述细胞培养片可以用于培养干细胞。这种情况下,上述干细胞可以是选自由人类多功能干细胞(hipsc)、人心脏干细胞(hcsc)、间充质干细胞(msc)、小鼠胚胎干细胞(mescs)及成骨细胞组成的组中的一种以上。
18.并且,相对于接种的细胞数量,在下述培养条件1下培养后回收的细胞数量可以为每单位面积(cm2)9倍以上;
19.培养条件1:
20.将60张单张宽度、长度为25cm
×
25cm的细胞培养片隔开,使细胞培养片之间具有上下1mm的间隔,将其固定于外壳内部后,将混合有干细胞的培养基注入到外壳内部,然后密封外壳使其不受到外部空气影响,在37℃的温度条件下培养4天。
21.并且,相对于接种的细胞数量,在下述培养条件2下培养后回收的细胞数量可以为每单位面积(cm2)25倍以上;
22.培养条件2:
23.将100张单张宽度、长度为25cm
×
25cm的细胞培养片隔开,使细胞培养片之间有上下1mm的间隔,将其固定于外壳内部后,将混合有干细胞的培养基注入至外壳内部,然后密封外壳使其不受到外部空气影响,在37℃的温度条件下培养5天,在接种细胞经过24小时后,利用不含有干细胞的相同的培养基更换一次培养基培养。
24.并且,上述支撑纤维可以包含聚偏二氟乙烯(pvdf)。
25.并且,形成有功能性涂层的上述纤维网的一面的中心线平均粗糙度(ra)可以为0.15至1.0μm,界面扩展面积比(sdr)可以为1.3至3.0。
26.并且,上述细胞培养片用于培养干细胞,支撑纤维的平均直径可以为200至600nm,形成有功能性涂层的上述纤维网的一面的中心线平均粗糙度(ra)可以为0.15至0.6μm,界面扩展面积比(sdr)可以为1.3至2.3。
27.并且,上述细胞培养片用于培养干细胞,上述细胞培养片的支撑纤维的平均直径可以为500至600nm,上述纤维网的克重可以为3至12g/m2,空气透过率可以为4.5cfm至8.0cfm。。
28.并且,还可以包括支撑膜,上述支撑膜固定于上述纤维网的一面。在这种情况下,在上述支撑膜与纤维网之间还可以包括硅类粘结层。
29.并且,在培养条件1或培养条件2下培养后回收的干细胞的平均直径可以与比接种的干细胞的平均直径相比小15%以上。如一例,上述培养后回收的干细胞的平均直径可以
为18μm以下。
30.并且,上述功能性涂层可以包括功能肽和粘附蛋白之间的融合蛋白。
31.并且,本发明提供一种大容量细胞培养箱,上述大容量培养箱包括:外壳;以及根据本发明的细胞培养片,在上述外壳内部设置有多片,并沿一个方向以预定间隔排列成多层。
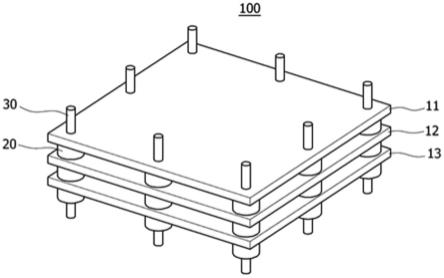
32.并且,本发明提供一种大容量细胞培养系统,上述大容量细胞培养系统包括:根据本发明的大容量细胞培养箱;培养基供给装置,向上述大容量细胞培养箱的一侧供给细胞培养时所需要的培养基;以及泵,用于使上述培养基循环。
33.以下,说明在本发明中使用的术语。
34.本发明的“细胞外基质(extracellular matrix,ecm)”为包围细胞的外部的基质,占据细胞与细胞之间,具有主要由蛋白质和多糖组成的网状结构。
35.本发明的“基序”为如下的包含氨基酸序列的肽,即,包含于在细胞的附着、迁移、分化等中起到重要作用的细胞外基质中的蛋白质、糖蛋白等,由此,以与贯通细胞薄膜的表面或膜的方式形成的受体在结构上/功能上相互作用,包括从细胞中分离或者通过基因克隆(gene cloning)技术人工生成的肽。
36.发明的效果
37.根据本发明的细胞培养片由于实现了适合细胞培养的表面形态,因此能够在以优秀的效率使接种细胞增殖的同时,防止细胞形成薄膜等的聚集的发生,从而增殖细胞的回收率优秀。另外,考虑到细胞大小、种类而合适地实现的细胞培养片的表面形态提高了细胞附着性,能够稳定地支撑附着的细胞,因此,即使在存在培养基的循环流动这样的外力和由此引起的细胞培养片的摇晃的培养环境下,也能够达到高的细胞培养效率。从而,相对于常规的培养细胞,与接种时的细胞大小相比,获得小尺寸的细胞,当采用了培养基循环的大容量培养箱时,由于获得了尺寸更小的细胞,因此非常有利于增殖更新鲜、健康且没有细胞转化的细胞。进而,在将干细胞分化为脂肪细胞、骨细胞等时,有利于通过优秀的分化来分化为目标细胞。由此,本发明的细胞培养片能够大量且稳定地将目标细胞、特别是干细胞培养、回收,进而能够广泛地应用于分化为特定的目标细胞的大容量培养箱等。
附图说明
38.图1为用于评价根据培养条件1的细胞培养片的细胞培养效率而示例的细胞培养片层叠体的立体图,
39.图2为显示用于评价细胞培养片的细胞培养效率而使用的一示例的外壳和安装在外壳上的细胞培养片的照片,
40.图3和图4分别是观察根据实施例1和比较例2的在使用细胞培养片培养干细胞后,干细胞是否聚集形成薄膜的照片,
41.图5和图6分别是根据实施例1和比较例2的使用细胞培养片使干细胞分化为骨细胞的结果照片,以及
42.图7和图8分别是根据实施例1和比较例2的使用细胞培养片使干细胞分化为脂肪细胞的结果照片,以及
43.图9和图10分别是根据实施例1、实施例4的纤维网表面的afm照片,在照片上可以
确认形成有连接在纤维之间的功能性涂层的膜。
具体实施方式
44.以下,参照附图详细说明本发明的实施例,使得本发明所属技术领域的普通技术人员能够容易地实施。本发明能够以各种不同形式实现,并不限定于在此说明的实施例。在附图中,为了明确说明本发明,省略了与说明无关的部分,在说明书全文中,对相同或相似的结构要素赋予相同的附图标记。
45.根据本发明的一实施例的细胞培养片实现为包括纤维网和功能性涂层,上述纤维网具有由平均直径为1.5μm以下的支撑纤维累积形成的三维网状结构,克重为1至15g/m2;上述功能性涂层至少覆盖在暴露于上述纤维网的一个表面的支撑纤维上,并且具有促进细胞的附着、迁移、增殖和分化中的一种以上的功能。
46.上述纤维网形成为由支撑纤维累积的三维网状结构,具体而言,各个支撑纤维独立地折叠和/或不确定纤维长度方向分别排列,通过它们的层叠,可以在结构上更加复杂,形成各种三维网状结构。如此形成的复杂、多样的内部结构能够作为含有细胞增殖所需的营养成分的培养溶液的流路,可以容易地向与纤维网表面接触的细胞附着面供给营养成分,防止细胞死亡,提高细胞增殖。
47.此时,可能在单股支撑纤维中的不同表面之间和/或不同支撑纤维的表面之间发生粘结或融合,由此,三维网络结构可以在结构上更加稳定。
48.并且,由支撑纤维随机排列并累积形成的纤维网的表面可以通过表面形态来诱导细胞的三维培养。作为表面形态的一例,纤维网的表面可以形成不平坦的、粗糙的表面,并且表面粗糙度可以大。例如,纤维网的表面形状粗糙是指包括多个凹部和/或凸部,除了有细胞的三维生长的效果以外,还具有如下的优点:可以将细胞更容易且牢固地放置在凸部之间的空间或凹部的槽中,从而可以减少在细胞培养片上放置后脱离的细胞的数量。
49.如上所述,形成有功能性涂层的纤维网的表面形态,根据在形成功能性涂层之前构成纤维网的纤维的直径分布、纤维的排列、纺丝后是否有热压接、热压接的程度、热压接时的温度、纤维网的克重、厚度等而表现出各种形态,也可以根据功能性涂层的形成程度而不同。最终,表面形态可通过如下因素来定义:形成有功能性涂层的纤维网中纤维的直径、纤维网的空气透过率、形成有功能性涂层的纤维网表面的表面粗糙度、孔径、气孔率等。本发明的发明人在研究根据上述因素的变化而引起的表面形态的各种变化对细胞培养产生的影响时,发现根据形成有功能性涂层的纤维网表面的形态对改善细胞的增殖具有出乎意料的水平的效果,并且可以防止培养的细胞在细胞培养片中形成薄膜,从而提高增殖的细胞的分离、回收性,尤其当接种的细胞为干细胞时,在没有细胞转化的情况下,与接种时的细胞大小相比,可以获得培养、增殖后细胞大小更小的细胞,并且可以提高当干细胞分化为脂肪细胞、骨细胞及软骨细胞等时的效率。另一方面,与接种时的细胞大小相比,培养、增殖后的细胞大小更小意味着衰老最小化,从而培养的细胞非常新鲜,细胞状态优秀。尽管在如培养条件1或2的不更换培养基的培养条件下也表现出这些特征,但在如培养条件3的在接种后更换一次、以预定的更换周期或者连续更换培养基的其他培养条件下,可以更显著地表现出这些特征。如一例,可以培养直径具有与接种时的细胞直径相比小15%以上、甚至30%左右的细胞,如一例,当接种细胞为干细胞时,可获得18μm以下的细胞。可预测,这些特
征受到了细胞培养片表面形态的影响。
50.同时,具有上述优秀的细胞培养效率的本发明的细胞培养片包含的纤维网,为了实现适合于培养细胞的表面形态,构成上述纤维网的支撑纤维的平均直径可以为1.5μm以下。优选地,支撑纤维的平均直径可以为10nm至1.0μm。并且,纤维网的克重为1g/m2至15g/m2。若纤维的平均直径小于10nm,则机械强度差,并难以制备纤维网。若纤维的平均直径大于1.5μm,则纤维网的密度(克重)减少,当进行热压接时,具有纤维网的表面部分熔融的忧虑。并且,若克重小于1g/m2,则当制备纤维网时,具有不易操作的忧虑,若克重大于15g/m2,则纤维网可在压接辊熔融。并且,在不满足这些支撑纤维直径和克重条件的情况下,难以实现适合于培养细胞的表面形态,并难以达到本发明所目的的水平的细胞培养效率等。根据本发明的一实施例,形成有功能性涂层的上述纤维网的一面的中心线平均粗糙度(ra)可以为0.15至1.0μm,界面扩展面积比(sdr)可以为1.3至3.0,更优选地,可以为1.3至2.6,当在具有上述表面粗糙度的纤维网上培养时,可能更有利于实现本发明的目的。其中,界面扩展面积比(sdr,developed surface area ratio)是指三维中要测量粗糙度的区域内的实际表面积与上述区域面积的比,界面扩展面积比为1是指测量的区域是平滑的平面,并且该比率越大,意味着比表面积越大。若中心线平均粗糙度小于0.15和/或界面扩展面积比小于1.3,则增殖的细胞聚集,具有分离回收率降低的忧虑。并且,由于功能性涂层而阻塞的表面气孔数量多,因此难以向附着在纤维网表面的接种细胞的下部供应足够的营养,也具有细胞培养效率降低的忧虑。并且,若中心线平均粗糙度大于1.0μm和/或界面扩展面积比大于3.0,则培养的干细胞的平均直径可能以与接种时的平均直径相似的水平培养,因此可能难以获得新鲜且衰老较少的细胞。并且,由于培养后纤维网与培养细胞之间的附着程度增高,培养的细胞可能不容易分离,因此具有分离时分离回收率降低或者对培养细胞产生损伤的忧虑。并且,将培养的干细胞分化为特定细胞时,分化效率可能降低。
51.同时,根据本发明的细胞培养片可以非常适合用于培养干细胞,如一例,上述干细胞可包括选自由人类多功能干细胞(hipsc)、人心脏干细胞(hcsc)、间充质干细胞(msc)、小鼠胚胎干细胞(mesc)及成骨细胞组成的组中的一种以上。在这种情况下,在细胞培养片的纤维网中具有的支撑纤维的平均直径可以为200nm至600nm,形成有功能性涂层的上述纤维网的一面的中心线平均粗糙度(ra)可以为0.15μm至0.6μm,并且界面扩展面积比(sdr)可以为1.3至2.3。具有这些因素的纤维网的表面形态的干细胞增殖效率非常优秀。此外,由于培养的干细胞不形成膜并且可回收单个细胞,因此具有可以增加分离回收的细胞数的优点。并且,可以回收培养的干细胞的平均直径与接种时的平均直径相比减少15%以上的干细胞,换句话说,可以回收不衰老或衰老较少的、具有优秀细胞状态的干细胞。此外,在干细胞分化到这样的细胞培养片上的情况下,当其分化为脂肪细胞、骨细胞、软骨细胞等时,与具有不同表面形态的纤维网或平板相比,可以改善分化效率。
52.根据本发明的一实施例,细胞培养片可以包括纤维网,上述纤维网具有平均直径为500nm至600nm的支撑纤维,克重为3g/m2至12g/m2,空气透过率为4.5cfm至8.0cfm,更优选地,克重可以实现为3g/m2至10g/m2,如一例,4.0g/m2至5.5g/m2。并且,这种情况下,纤维网的厚度可以为3μm至6μm,更优选地,可以为5μm至6μm。通过具有这种表面形态的纤维网,由于有利于实现提高干细胞的分化效率的效果,因此可以用作用于分化干细胞的细胞培养片。
53.并且,上述支撑纤维可以包括用于培养细胞的常规材料,如一例,聚碳酸酯(pc)、聚丙烯腈(pan)、聚苯乙烯(ps)、聚醚砜(pes)和氟系化合物中的一种以上。然而,考虑到细胞的增殖和回收性两者,支撑纤维可以包括氟系化合物,其中,也可以包括聚偏二氟乙烯(pvdf)。当支撑纤维为pvdf时,不仅具有优秀的细胞回收特性,而且可以有利于实现培养的细胞具有比接种时小的细胞直径。
54.在上述纤维网的表面具有功能性涂层,上述功能性涂层具有诱导或促进细胞附着、迁移、增殖和分化中的一种以上的功能。当形成有上述功能性涂层的纤维网上的表面形态满足根据本发明的条件时,与平滑的薄膜上的细胞培养片上组合相同的功能性涂层的情况相比,可以实现提高的细胞培养效率,可以更有利于实现本发明的目的。
55.上述功能性涂层可以包括选自由单胺、氨基酸、肽、糖(saccharide)、脂质(lipid)、蛋白质、糖蛋白(glucoprotein)、糖脂(glucolipid)、蛋白聚糖、黏多糖(mucopolysaccharide)及核酸(nucleic acid)组成的组中的一种以上的化合物及细胞中的一种以上的生理活性成分。具体地,这种生理活性物质可以为存在于细胞外基质的物质或以与其相同或相似的方式人工制备的物质。
56.并且,上述生理活性成分可包含基序。上述基序可以为包含位于选自生长因子(growth factor)或细胞外基质(extracellular matrix)中所包含的蛋白质、糖蛋白及蛋白聚糖中的一种以上的预定氨基酸序列的天然肽或重组肽。具体地,上述基序可包含选自由肾上腺髓质素(adrenomedullin)、血管生成素(angiopoietin)、骨成型蛋白(bmp)、脑源性神经营养因子(bdnf)、表皮生长因子(egf)、红细胞生成素(erythropoietin)、成纤维细胞生长因子(fibroblast growth factor)、神经胶质细胞源性的神经营养因子(gdnf)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,g-csf)、粒细胞巨噬细胞刺激因子(granulocyte macrophage colony-stimulating factor,gm-csf)、生长分化因子-9(growth differentiation factor-9,gdf9)、肝细胞生长因子(hgf)、肝癌衍生生长因子(hepatoma-derived growth factor,hdgf)、胰岛素样生长因子(insulin-like growth factor,igf)、角质细胞生长因子(keratinocyte growth factor,kgf)、迁移刺激因子(migration-stimulating factor,msf)、肌生成抑制蛋白(myostatin,gdf-8)、神经生长因子(nerve growth factor,ngf)、血小板源性生长因子(platelet-derived growth factor,pdgf)、促血小板生成素(thrombopoietin,tpo)、t-细胞生长因子(t-cell growth factor,tcgf)、神经毡蛋白、转化生长因子-α(tgf-α)、转化生长因子-β(tgf-β)、肿瘤坏死因子-α(tnf-α)、血管内皮生长因子(vegf)、白细胞介素-1(il-1)、白细胞介素-2(il-2)、白细胞介素-3(il-3)、白细胞介素-4(il-4)、白细胞介素-5(il-5)、白细胞介素-6(il-6)及白细胞介素-7(il-7)组成的组中的一种以上的生长因子(gf)中所包含的预定的氨基酸序列。或者,可包含选自由透明质酸、硫酸乙酰肝素、硫酸软骨素、硫酸皮肤素、硫酸角质素、海藻酸盐、纤维蛋白、纤维蛋白原、胶原蛋包、弹性蛋白、纤连蛋白、玻连蛋白、钙黏蛋白及层粘连蛋白组成的组中的一种以上的细胞外基质(extracellular matrix)中所包含的预定的氨基酸序列。
57.并且,上述基序可都包含生长因子中所包含的预定的氨基酸序列及上述细胞外基质中所包含的预定的氨基酸序列两者。更优选地,上述基序可包含选自由包含seq id no:9至seq id no:30的氨基酸序列来形成的蛋白质及这些蛋白质中的至少两个融合的蛋白质
组成的组中的一种以上,但并不限于此。
58.另一方面,上述细胞培养片还可具有提高粘结性的生理活性成分。这种成分在初期将培养细胞固定在细胞培养片上,可以防止添加至培养溶液上的细胞悬浮。并且,将没有粘结性或者粘结性弱的生理活性成分固定在细胞培养片上,可以执行防止在细胞培养过程中生理活性成分从细胞培养片脱离的功能。
59.并且,为了增强细胞的附着性,这种粘结成分可包含公知的贻贝蛋白或贻贝蛋白中的特定结构域或基序。上述粘结成分在具有常规生物相容性而不生成细胞毒性的公知的粘结成分的情况下,可无限制地使用,优选地,可包含选自由seq id no:1至seq id no:8的氨基酸序列反复1次至20次来形成的蛋白质及这些蛋白质中的至少两个融合的蛋白质组成的组中的一种以上,由此,具有如下的优点,即,细胞毒性显著降低,与其他种类的生理活性成分的粘结力优秀,同时,在细胞培养的过程中,由于粘结成分不溶解在培养溶液,从而可以防止发生其他种类的生理活性成分脱离或细胞分离。
60.并且,显示粘结性的蛋白质或者对应于其部分的基序可与表现生理活性的其他种类的基序共价结合来实现一体型。即,可以包含具有促进细胞的附着、迁移、增殖和分化中的一种以上的功能的功能肽和粘附蛋白之间的融合蛋白。如一例,可以将上述的生长因子等基序直接共价结合到显示粘结性的蛋白质的n-末端和/或c-末端,或者通过介入异源肽或多肽来共价结合,在此情况下,可更坚固地在细胞培养片附着不同种类的生理活性成分,进一步提高细胞培养效率。更具体的一例,作为由粘附蛋白和生长因子融合而成的蛋白质可以使用具有seq id no:8的氨基酸序列的粘附蛋白与具有seq id no:30的氨基酸序列的蛋白质之间的融合蛋白。
61.并且,上述纤维网可通过纺粘法、熔喷法等的公知方法以网状体现,或者可通过利用溶解或熔融的纺丝溶液的电纺丝形成。但是,考虑构成纤维网的纤维的平均直径等时,可以通过电纺丝制备。此时,通过电纺丝制备纤维网的方法可以适当地采用公知的方法。
62.并且,上述的功能性涂层可通过公知的方法提供至纤维网的表面上。如一例,上述生理活性成分可通过涂敷工序涂敷到纤维网.此时,可以涂敷到形成纤维网的纤维的表面上。或者,上述生理活性物质与形成纤维网的高分子化合物一同混合自从用于制备纤维网的粗液制备步骤开始使用。在此情况下,具有如下的优点,即,没有额外的涂敷工序或用于固定生理活性物质的额外的粘结成分也可以容易将生理活性物质提供至所制备的纤维网或薄膜的外部面。
63.同时,为具有相同的平均直径,对于电纺丝纤网,通过改变如下条件:电纺丝时是否将空气与纺丝溶液一同纺丝、施加的空气的压力、气隙的距离、纺丝溶液中的纤维形成成分的种类、纺丝后热压接时的温度、压力、时间等,可以将纤维网的表面形态适当地改变为预期的水平。
64.并且,上述细胞培养片的每张可以由一张或多张层叠压合的纤维网构成。或者,上述细胞培养片可以是纤维网与一张或多张支撑膜结合的层叠体。此时,当纤维网与支撑膜结合时,可以通过由诸如硅材料等粘合剂形成的硅类粘结层结合,或者可以通过支撑膜和/或纤维网的部分熔融而不使用粘合剂结合。
65.由于这种纤维网的结构特征,相对于接种的细胞数量,下述培养条件1下培养后回收的细胞数量可以增殖每单位面积(cm2)9倍以上,优选地,增殖15倍以上,更优选地,增殖
20倍以上,进一步更优选地,增殖30倍以上,从而具有非常高的细胞培养效率。
66.此时,培养条件1为如下:将共60张的单张宽度、长度为25cm
×
25cm的细胞培养片隔开,使细胞培养片之间具有上下1mm的间隔,将其固定于外壳内部后,将混合有干细胞的培养基注入到外壳内部,然后密封外壳使其不受到外部空气影响,在37℃的温度条件下培养4天。培养条件1是不更换培养基培养4天的条件。
67.在此情况下,细胞培养片固定设置以使培养细胞的有效表面的上表面和下表面不与外壳的内壁接触。参照图1描述细胞培养片固定于外壳的一例,沿着细胞培养片11、12、13的边缘隔着预定间隔穿孔,将支柱30贯穿上述孔后,可以设置间隔件20,使外壳的上表面/下表面和细胞培养片11、12、13之间隔开以不接触,通过细胞培养片11、12、13之间隔开的间隔被调整的细胞培养片堆叠体100固定于外壳。或者,如另一例,细胞培养片可以以插入的方式嵌入到形成在外壳的内表面上的槽中,并且可以通过固定细胞培养片的两个侧端、三个侧端或四个侧端固定于外壳。此时,能够通过槽的间隔调节隔开细胞培养片之间的间隔。
68.在这种情况下,上述外壳可以是用于培养细胞的常规材料。并且,可以设置有流入口以便要接种的细胞和培养基流入。并且,可以是能够密封以使外壳的内部和外部之间没有外部空气流动的结构。并且,用于培养条件1的细胞培养片采用厚度为0.5mm的层压的聚碳酸酯(pc)薄膜,以便防止单独使用纤维网时发生的下垂,并且由此将细胞培养片之间的隔开间隔保持为1mm。
69.另一方面,要说明一下根据在培养条件1中以1mm间隔将60张细胞培养片多层排列的效果,则为:即使在外壳内填充培养细胞所需的培养基,但是随着时间的经过,根据细胞的增殖,也可能引起各个位置的培养基成分的浓度差异或ph差异,从而可以导致细胞增殖效率降低或者细胞培养片各个位置的细胞增殖的程度相差悬殊,但是根据本发明的细胞培养片即使在以非常狭窄的间隔隔开设置多张的情况下,由于每单位面积的细胞增殖效率非常大,因此具有在不更换培养基以大容量培养细胞的条件下,也能够以优秀的效率培养细胞的优点。并且,培养的细胞不会由于胶原蛋白等在细胞增殖时所产生的物质相互缠结而形成膜或聚集地培养,因此具有可以完整地使用回收的细胞的优点。并且,当如培养条件1将细胞培养片层叠成多层以使片之间的间隔为1mm来培养细胞时,若细胞培养片的面积增大,则由于各个位置可能不均匀的培养基成分、ph,细胞培养效率可能会进一步显著降低,但是在将根据本发明的一实施例的细胞培养片的面积扩大为100cm2以上、200cm2以上、或者400cm2以上的大面积的情况下,也可以得到优秀的细胞培养效率。
70.并且,根据本发明的一实施例的细胞培养片在如下述的培养条件2设置更多数量的细胞培养片来培养细胞时,相对于接种的细胞数量,培养后回收的细胞数量可以每单位面积增殖25倍以上,更优选地,可以增殖30倍以上。培养条件2为如下:将100张的单张宽度、长度为25cm
×
25cm的细胞培养片隔开,使细胞培养片之间具有上下1mm的间隔,将其固定于外壳内部后,将混合有干细胞的培养基注入到外壳内部,然后密封外壳使其不受到外部空气影响,在37℃的温度条件下培养5天,在接种干细胞经过24小时后,更换一次培养基培养。在更换一次培养基更加活跃地实现细胞增殖的条件下,以1mm的间隔层叠100张细胞培养片时,也具有可以使细胞相对于接种时的细胞数量增殖25倍、更优选地,35倍以上的优点。同时,用于培养条件2的细胞培养片采用厚度为0.5mm的层压的聚碳酸酯(pc)薄膜,以便防止单独使用纤维网时发生的下垂,并且由此将细胞培养片之间的隔开间隔保持为1mm。
71.一方面,在培养条件1和2下培养预定天数后,可以使用本领域的常规方法来回收增殖的细胞并对细胞数量进行计数。如一例,从外壳去除培养基后,向外壳内部注入将温度调节为37℃的0.05%至0.25%的胰蛋白酶-乙二胺四乙酸(trypsin-edta)溶液,经过预定时间之后,再注入培养基使从细胞培养片分离的细胞悬浮并回收,然后使用离心机将细胞沉淀并去除上清液,之后,以1∶1的比例混合所提取的细胞溶液与台盼蓝(trypan blue)溶液,对于所混合的溶液,可以利用细胞计数器(cell counter)计数细胞数量。
72.并且,用于上述培养条件1和2的培养基根据干细胞的种类可以使用公知的合适的培养基。如一例,当培养间充质干细胞(msc)时,可以使用如下的细胞培养基:在500ml的kbs-3basal medium(b1001)混合2ml的ksb-3supplyments(s2901)的培养基,投入胎牛血清(fbs,fetal bovine serum)来使其占培养基总重量的10%,包括青霉素(penicillin)/链霉素(streptomycin)来使其成为培养基总体积的1/100。
73.本发明可以具有上述的细胞培养片来实现大容量细胞培养箱。上述大容量细胞培养箱可以体现为包括外壳以及在上述外壳内部设置有多张片并沿一个方向以预定间隔排列成多层的细胞培养片。并且,本发明可利用上述大容量细胞培养箱来体现大容量细胞培养系统。上述大容量细胞培养系统可以体现为包括大容量细胞培养箱、向上述大容量培养箱的一侧供给细胞培养时所需的培养基的培养基供给装置以及用于使上述培养基循环的泵。
74.构成大容量细胞培养箱的外壳、培养基供给装置、泵可适当采用、变更在本技术领域中通常以大容量培养细胞时使用的结构,因此,将省略对其的具体说明。或者,设置有上述大容量培养箱、培养基供给装置及泵的大容量细胞培养系统可参照由本发明的申请人发明的韩国专利申请号第10-2018-0140008号,在该专利文献中采用本发明的细胞培养片时,可有利于更显著地大量培养并能获得大小比较小、新鲜、健康的细胞。
75.在下表1中示出了上述的功能性涂层中具有的生理活性成分的氨基酸序列。
76.【表1】
77.78.[0079][0080]
本发明的实施方式
[0081]
以下,通过实施例进一步详细说明本发明,但下述实施例不限制本发明的范围,其应当被解释为用于帮助理解本发明。
[0082]
《实施例1》
[0083]
首先,为了制备纺丝溶液,作为纤维形成成分,使用磁棒6小时在80℃的温度下将二甲基乙酰胺和丙酮以70:30重量比混合的混合溶剂88g中,溶解聚偏二氟乙烯(阿克玛(arkema)公司,kynar761)12g,从而配制了混合溶液。使用电纺丝装置,以电压25kv、集电体与纺丝口之间的距离25cm、排出量0.05ml/hole的条件,在rh65%、30℃的环境下对所配制的纺丝溶液进行电纺丝。并且,此时,向与排出口相邻并与纺丝口的方向垂直地施加空气。最终实现的纤维网为纤维平均直径为500nm、克重为5.0g/m2、厚度为5μm、中心线平均粗糙度(ra)为0.374μm、界面扩展面积比为1.873。
[0084]
在一面具有硅类粘结剂且厚度为500μm的聚碳酸酯(pc)薄膜的具有上述硅类粘结剂的一面上接触并层压制备的纤维网后,在常温下利用涂敷机(digital-3500plus)制备了粘附为一体化的层叠体状的细胞培养片。然后,在纤维网的暴露表面上形成了功能性涂层。具体地,将纤维网部分浸渍在下述的制备例1所制备的细胞培养涂覆组合物中,然后在30℃恒温培养箱中反应1小时,在纤维网的表面上形成了功能性涂层。然后,用三重蒸馏水每次5分钟洗涤3次,,然后在净化工作台内打开平板盖,使其在空气中干燥,从而制造细胞培养片。
[0085]
*制备例1-制备细胞培养涂覆组合物
[0086]
生理活性成分作为融合蛋白,在具有seq id no:8的氨基酸序列的粘附蛋白的羧基末端将具有seq id no:30的氨基酸序列的功能肽结合到氨基酸末端来制备。此时,融合蛋白以利用大肠杆菌的重组蛋白质生产方法来制备。
[0087]
一方面,为了制备活性溶液,首先制备溶解在三重蒸馏水中的naoac、nahco3和2-吗啉乙磺酸(2-(n-morpholino)ethanesulfonic acid)溶液,然后将分别放入分注有edc和硫代琥珀酰亚胺(sulfo-nhs)试剂的每个微管中以制备edc溶液和sulfo-nhs溶液。
[0088]
为了制备细胞培养涂覆组合物,将edc溶液投入到锥形管中后,放入硫代琥珀酰亚胺(sulfo-nhs)溶液,在搅拌下将用于培养细胞的融合蛋白投入到制备的活性溶液中,经过搅拌制备了细胞培养涂覆组合物。此时,此时,相对于用于培养细胞的融合蛋白100重量份,细胞培养涂覆组合物包含edc1重量份,将edc和硫代琥珀酰亚胺(sulfo-nhs)以1:2重量比进行混合,并且相对于edc100重量份,涂覆组合物中含有的naoac包含为100重量份。此时,细胞培养涂覆组合物中用于培养细胞的融合蛋白的浓度为0.1mg/ml。
[0089]
《实施例2至3》
[0090]
以与实施例1相同的方式实施并制备,将制备例1的融合蛋白中seq id no:30的功能肽变更为seq id no:28和seq id no:29的融合蛋白,从而制备如下表2所示的细胞培养片。
[0091]
《比较例1》
[0092]
以与实施例1相同的方式实施并制备,改变纺丝时的电压、排出量、气隙,制备支撑纤维平均直径为1.65μm、克重为16.4g/m2、厚度为5μm、中心线平均粗糙度(ra)为1.469μm、界面扩展面积比为3.087的纤维网,由此制备了细胞培养片。
[0093]
《比较例2》
[0094]
以与实施例1相同的方式实施并制备,在没有纤维网的表面上单独使用经等离子处理后的厚度为500μm的聚碳酸酯薄膜作为细胞培养片,在薄膜的一面相同地处理根据制备例1的细胞培养涂覆组合物,使其具有生理活性成分。
[0095]
《实验例1》
[0096]
分别将制备的细胞培养片以25cm、25cm的宽度、长度冲裁之后,对应于图2右侧的大容量培养箱外壳内部的支柱,将细胞培养片进行冲孔。之后,以5kgy的强度向所准备的细胞培养片照射γ-射线(γ-ray),由此,对细胞培养片进行灭菌。
[0097]
之后,使厚度为1mm且对应于上述支柱的直径被冲孔的间隔件通过大容量培养箱外壳内部的支柱。接着,在大容量培养箱的内部安装一张细胞培养片,使得冲孔的孔通过上述支柱。之后,再次使厚度为1mm的间隔件通过支柱,并通过再次安装一张细胞培养片的方
式实现共60张的细胞培养片以1mm的垂直距离隔开形成的细胞培养片组件。然后,密封大容量培养箱外壳来使其不受到外部空气影响后,通过设置于一侧面的细胞培养液流入管投入混合有间充质干细胞的细胞培养液,并在37℃的温度条件下培养4天。
[0098]
在此情况下,上述细胞培养液使用如下的细胞培养液;在500ml的kbs-3basal medium(b1001)混合2ml的ksb-3supplyments(s2901)的培养基,投入胎牛血清(fbs,fetal bovine serum)来使其占培养基总重量的10%,包含青霉素(penicillin)/链霉素(streptomycin)来使其成为培养基总体积的1/100,并且,在通过上述方式制备的细胞培养液包含间充质干细胞(msc)来使每细胞培养片单位面积的数量成为8000个/cm2。
[0099]
之后,回收通过培养增殖的细胞并对细胞数量进行计数。具体地,在大容量培养箱去除培养基后,向外壳内部注入将温度调节为37℃的0.15%的胰蛋白酶-乙二胺四乙酸(trypsin-edta)溶液,从细胞培养片分离悬浮通过放置预定时间来培养的细胞后,为了中和胰蛋白酶成分,再次注入相同的细胞培养溶液并回收其。
[0100]
接着,通过使用离心分离机将所回收的溶液中的细胞沉淀并去除上清液,之后,以1∶1的比例混合所提取的细胞溶液与台盼蓝(trypan blue)溶液,对于所混合的溶液,利用细胞计数器(cell counter)计数细胞数量,在下表2中示出了按比例计算相对于所接种的细胞数量的增殖后回收的细胞数量的细胞增殖回收率。
[0101]
《实验例2》
[0102]
制备与实验例1相同的大容量培养箱。之后,投入混合有间充质干细胞的细胞培养液,在37℃温度条件下培养,在接种细胞经过24小时后,利用不含有间充质干细胞的相同的培养液更换一次培养基培液,共培养5天。
[0103]
在此情况下,上述混合有间充质干细胞的细胞培养液使用如下的细胞培养液;在500ml的kbs-3basal medium(b1001)混合2ml的ksb-3supplyments(s2901)的培养基,投入胎牛血清(fbs,fetal bovine serum)来使其占培养基总重量的10%,包含青霉素(penicillin)/链霉素(streptomycin)来使其成为培养基总体积的1/100,并且,在通过上述方式制备的细胞培养液包含间充质干细胞(msc)来使每细胞培养片单位面积的数量成为4000个/cm2。
[0104]
《实验例3》
[0105]
在实验例2中培养细胞后观察了大容量培养箱,用肉眼观察增殖的细胞是否聚集形成薄膜,结果未形成薄膜时以x标记,形成薄膜时以〇标记。另外,在实施例1和比较例2中,培养5天后,拍摄大容量培养箱的照片,分别在图3和图4中示出其结果。
[0106]
通过图3可以确认,在实施例1的情况下,培养的细胞没有聚集,而在比较例2的情况下,如图4所示,可以看出形成了培养的细胞聚集而成的薄膜。
[0107]
【表2】
[0108]
[0109][0110]
通过表2可以确认,
[0111]
在根据实施例1制备的纤维网具有不同的生理活性成分的实施例1至实施例3的情况下,培养4天且不更换培养基时,可以看出增殖和回收的细胞数量相对于接种细胞数量具有9倍以上优秀的增殖效率。
[0112]
然而,在使用无孔膜的比较例2的情况下,培养4天且不更换培养基时,增殖和回收的细胞数量相对于接种的细胞仅为5.8倍,可以看出即使等离子处理后表面形态也不适合培养干细胞。并且,即使使用纤维网,在使用支撑纤维的平均直径大于1.5μm、克重大于15g/m2的纤维网的比较例1的情况下,培养4天且不更换培养基时,增殖和回收的细胞数量相对于接种的细胞数量仅为7.2倍,可以看出与实施例1相比,表面形态不适合培养干细胞。
[0113]
《实验例4》
[0114]
将实验例2中接种前的细胞的直径以及通过实验例2在实施例1和比较例2中回收的细胞的直径使用细胞计数器测量,并示出在下表3中。并且,相对于培养前接种的细胞,通
过实施例1和比较例2增殖、回收的细胞是否具有转化,通过利用cd标记的流式细胞仪(facs)进行了分析,并且其结果一同示出在下表3中。此时,在facs分析中,阳性对照大于95%并且阴性对照小于5%为标准。
[0115]
评价结果在实施例1的情况下,得出阳性对照为97~99%,阴性对照为0.07~2.9%,确认了在细胞增殖而没有转化。
[0116]
《实验例5》
[0117]
使用根据实施例1和比较例2的细胞培养片,将间充质干细胞分化为下述各细胞,分化结果示出在表3中。
[0118]
1.骨细胞分化
[0119]
作为分化时使用的生长培养基,使用dmem 10%fbs 1
×
glutamax p/s 5ng/ml bfgf的培养基,作为骨分化时的骨分化培养基,使用了常用的stemcell technologies的mesencult
tm
osteogenic differentiation kit(human)。并且,作为脂肪分化的培养基,使用了常用的stemcell technologies的mesencult
tm
osteogenic differentiation kit(human)。并且,作为软骨分化的培养基,使用了常用的dmem 0.3mm ascorbic acid 0.35mm proline 10-7m dexamethasone 1
×
its-3 10ng/ml tgf-β3。
[0120]
具体地,使用细胞解冻(cell thawing)和培养5天后的干细胞来尝试骨分化。具体地,对于细胞解冻和培养,将1
×
106cells/vial stock接种到两个75t烧瓶(flask)后,在次日更换培养基,然后在第3天和第5天更换培养基。此时,当t-烧瓶(flask)中细胞填满90%左右时,进行继代培养(subculture),具体来说,以4
×
103cells/cm2的浓度将细胞接种到细胞培养片上。
[0121]
1.骨分化
[0122]
之后,为了进行骨分化,将上述培养的干细胞以4
×
103cells/cm2接种到分别具有细胞培养片的12孔板(12well-plate)中。利用生长培养基培养细胞直至细胞填满孔板(well-plate),细胞填满孔板时,则除去生长培养基,用pbs洗涤一次后,向各孔中加入1ml的骨分化培养基,每隔3天更换骨分化的培养基,进行2周分化。分化结束后,除去细胞液的上清液,然后用pbs洗涤一次,加入3.7%的甲醛,在常温下固定10分钟。之后,除去甲醛,然后用pbs洗涤三次,除去pbs后,投入2%的茜素红s溶液(alizarin red s solution)1ml,然后染色10分钟。之后,除去茜素红s溶液(alizarin red s solution),用dw洗涤三次,用肉眼和显微镜观察茜素红s是否染色(相关照片为图5和图6)。
[0123]
之后,用10%的cpc(氯化十六烷吡啶)溶液稀释10倍,然后在562nm处测量吸光度。
[0124]
2.脂肪细胞分化
[0125]
之后,对于脂肪细胞分化,与骨分化相同的方式进行,但将培养基变更为脂肪细胞分化的培养基,并培养3.5周。之后,除去结束分化的细胞的上清液,然后用pbs洗涤一次,加入3.7%的甲醛,在常温下固定10分钟。之后,除去甲醛,然后用pbs洗涤三次,加入60%的异丙醇1ml后,反应5分钟。在反应过程期间,准备油红o工作溶液,此时使用以3:2的比率混合油红s储备溶液(oil red s stock solution)(sigma产品)和水。之后,除去pbs,然后投入油红o工作溶液1ml,进行染色20分钟,除去油红o工作溶液后,用水洗涤五次。之后,使用显微镜分析油红o是否染色(生成脂肪的部位染成红色),然后,加入60%的异丙醇1ml后,洗涤五分钟,再加入100%的异丙醇300μl,振荡五分钟,然后洗脱被染色的油红o,在492nm处测
量吸光度。
[0126]
3.软骨分化
[0127]
接着,对于分化为软骨组织,与骨分化相同地进行,但将培养基变更为软骨组织分化培养基,培养2周。之后,将结束分化的软骨组织转移到pbs中,洗涤后,除去沾在b.软骨组织表面pbs后,使用微量天平测定湿重(wet weigh)。
[0128]
【表3】
[0129][0130][0131]
通过表3可以确认,
[0132]
通过实施例1及比较例2的细胞培养片增殖、回收的细胞没有细胞转化的变化。但是,在实施例1的细胞培养片中增殖、回收的细胞的大小略小于在比较例2的细胞培养片中增殖、回收的细胞的大小,由此可知,所培养的细胞非常新鲜且细胞状态优秀。通过实施例1的细胞培养片增殖、回收的细胞的大小较小的原因在于,通过纤维网形态的拓扑结构效果和相对于薄膜的纤维网特性,可通过在本技术中记载的纤维网更加优秀的实现这种效果。
[0133]
《实施例4至实施例7》
[0134]
以与实施例1相同的方式实施并制备,改变气隙、排出量和空气强度,制备了下表4的细胞培养片。
[0135]
《实验例6》
[0136]
对于根据实施例1、4至7的细胞培养片,同样地实施实验例2、3、5,在下表4中示出了其结果。
[0137]
【表4】
[0138][0139][0140]
通过表4可以确认,
[0141]
相对于根据实施例的6至7的细胞培养片,可以看出根据实施例1、4、5的细胞培养片培养的细胞的分离回收率很优秀,在实施例1和实施例4的情况下,相对于不同种类,干细胞的分化效率非常优秀,尤其根据实施例1的细胞培养片优秀。
[0142]
以上,说明了本发明的一实施例,本发明的思想并不限于在本说明书中提出的实施例,理解本发明的思想的普通技术人员可在相同思想的范围内容易通过结构要素的附加、变更、删除、追加等提出其他实施例,这也属于本发明的思想范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
