1.本发明涉及一种包含依泽替米贝的治疗癌症的药物组合物。本发明特别涉及药物组合物和依泽替米贝在治疗过度表达mdm2的癌症中的应用。
背景技术:
2.依泽替米贝是美国食品和药物管理局(fda)批准的一种药物,可阻止肠道内胆固醇的摄取,从而降低其在体循环中的浓度。因此,它被用来治疗高胆固醇血症。经口服施用后,依泽替米贝迅速被葡萄糖醛酸化,并通过肠肝循环到其在肠内的靶点。据报道,该葡糖苷酸代谢物在抑制胆固醇摄取方面至少与依泽替米贝一样有效。这是基于使用初始药物先导sch48461进行的实验,发现其抑制胆固醇吸收70%,而代谢物抑制吸收95%以上。此外,代谢物留在肠壁上,大部分代谢物无法系统获得。
3.目前,已知的依泽替米贝靶点是在空肠肠细胞中发现的niemann-pick cl-like 1(npc1l1)。高达80%的依泽替米贝在肠道中通过尿苷5-二磷酸(udp)-葡萄糖醛酸转移酶(ugt)1a1、1a3和2b15迅速代谢为具有药理活性的葡萄苷酸代谢物(eze-gluc)。剩余的母体药物和葡萄糖醛酸代谢物随后通过门静脉排泄到胆汁中,并输送回肠道的作用部位,从而延长药物的半衰期。胆固醇吸收研究表明,葡糖苷酸似乎比依泽替米贝本身更有效,因为葡糖苷酸化的依泽替米贝更容易定位到肠道。依泽替米贝和/或葡糖苷酸代谢物通过粪便(90%)和尿液(10%)排出。
4.小鼠双微体蛋白(mdm2)是肿瘤抑制蛋白p53的典型的负调控因子,p53在正常生理条件下不活跃,仅在细胞处于应激状态或某些细胞功能受损时激活。在人类癌症中,经常发生肿瘤抑制基因p53的失活和/或癌基因mdm2的过度表达,并且与预后不良、疾病的晚期和化疗耐药性有关。因此,抗癌药物的开发旨在针对mdm2和p53之间的相互作用。nutlins是螺羟吲哚衍生的化合物,其作用机制是破坏这种相互作用,目前正在开发和临床试验中。在此,研究表明,依泽替米贝是一种可能靶向这种相互作用的候选药物,并且可能比nutlins具有更好的类药性。此外,依泽替米贝与化合物(如姜黄素)结合可能适合治疗结肠癌细胞,因为其可以防止依泽替米贝转化为eze-gluc。
技术实现要素:
5.根据本发明的第一方面,提供了依泽替米贝或其药学上可接受的盐或衍生物在制备用于治疗有需要患者癌症的药物组合物中的应用。
6.所述癌症的特征可以为mdm2的过度表达。
7.所述癌症可选自乳腺癌、宫颈癌、结直肠癌、输卵管癌、胃癌、胶质瘤、霍奇金淋巴瘤、白血病、肝癌、肺癌、黑色素瘤、非霍奇金淋巴瘤、口腔癌、卵巢癌、胰腺癌、肾细胞癌、甲状腺癌和其他癌症。
8.所述药物组合物可进一步包括医药上可接受的赋形剂、载体或稀释剂。
9.所述药物组合物用于对患者全身施用,以将所述药物组合物直接引入循环系统。
10.所述药物组合物可通过输注、植入、透皮或其他方式施用。
11.依泽替米贝可能通过结合mdm2的p53结合域,以促进p53的肿瘤抑制活性并通过诱导患者的癌细胞凋亡以治疗癌症。
12.根据本发明的第二方面,提供了依泽替米贝或其药学上可接受的盐或衍生物联合姜黄素在制备用于治疗有需要患者癌症的药物组合物中的应用。
13.所述癌症可以为mdm2过度表达的癌症,可以为结肠癌。
14.所述药物组合物可进一步包括药学上可接受的赋形剂、载体或稀释剂,并且可以用于患者口服。
15.根据本发明的第三方面,提供了一种治疗有需要患者癌症的药物组合物,包括依泽替米贝或其药学上可接受的盐或衍生物和姜黄素,尤其是治疗mdm2过度表达的癌症。
16.所述癌症可以选自实体癌,例如结肠癌或黑色素瘤。
17.所述药物组合物可进一步包括药学上可接受的赋形剂、载体或稀释剂,并且可以用于患者全身或口服施用。
18.所述药物组合物可以为配方产品、注射剂、片剂、胶囊或其他合适的施用形式。
19.根据本发明的第四方面,提供了一种本发明第一、第二或第三方面的药物组合物的制备方法。
20.根据本发明的第五方面,提供了依泽替米贝或其药学上可接受的盐或衍生物在制备用于治疗有需要患者癌症的药物组合物中的应用。
21.所述药物组合物可以和姜黄素一起施用。
22.所述癌症可以为mdm2过度表达的癌症,包括结肠癌。
23.所述药物组合物可配制成用于患者口服。
24.依泽替米贝或其药学上可接受的盐或衍生物可结合到mdm2的p53结合域,以促进p53的肿瘤抑制活性并诱导患者的癌细胞凋亡。
25.根据本发明的第六方面,提供了一种用于治疗有需要患者癌症的方法的药物组合物,其包括依泽替米贝或其药学上可接受的盐或衍生物,其中所述药物组合物可以和姜黄素一起施用。
26.所述癌症可以包括mdm2的过度表达,可以为实体癌,包括结肠癌或黑色素瘤。
27.所述药物组合物配制成用于患者全身或口服施用,并且可以为配方产品、注射剂、片剂或胶囊的形式。
28.根据本发明的第七方面,提供了依泽替米贝或其药学上可接受的盐或衍生物在治疗有需要患者的癌症中的应用,其中所述癌症的特征为mdm2的过度表达。
29.所述癌症可以选自乳腺癌、宫颈癌、结直肠癌、输卵管癌、胃癌、胶质瘤、霍奇金淋巴瘤、白血病、肝癌、肺癌、黑色素瘤、非霍奇金淋巴瘤、口腔癌、卵巢癌、胰腺癌、肾细胞癌、甲状腺癌和其他癌症。
30.所述依泽替米贝或其药学上可接受的盐或衍生物配制成用于对患者全身施用,以将依泽替米贝或其药学上可接受的盐或衍生物直接引入循环系统。
31.所述依泽替米贝或其药学上可接受的盐或衍生物可配制成通过输注、植入、透皮或其他方式施用。
32.所述依泽替米贝或其药学上可接受的盐或衍生物可结合到mdm2的p53结合域,以
促进p53的肿瘤抑制活性并诱导患者的癌细胞凋亡。
33.根据本发明的第八方面,提供了依泽替米贝或其药学上可接受的盐或衍生物联合姜黄素在治疗有需要患者的癌症(例如结肠癌)中的应用。所述癌症的特征可以为mdm2的过度表达。
34.所述依泽替米贝或其药学上可接受的盐或衍生物和姜黄素配制成用于患者口服。
35.所述依泽替米贝或其药学上可接受的盐或衍生物可结合到mdm2的p53结合域,以促进p53的肿瘤抑制活性并诱导患者的癌细胞凋亡。
36.以下将参考下面的实施例和附图更详细地描述本发明。
附图说明
37.在附图中
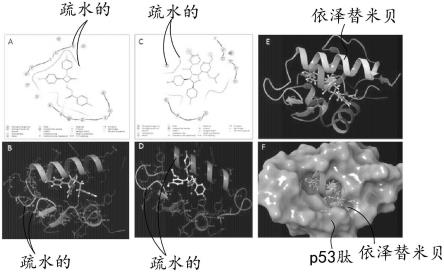
38.图1示出了实施例中mdm2分别与依泽替米贝(a和b)和nutlin3a(c和d)的分子相互作用,以及mdm2与依泽替米贝和nutlin3a(e和f)叠加的相互作用;
39.图2示出了实施例中采用mtt分析法对(a)用依泽替米贝处理的a375恶性黑色素瘤细胞、(b)用依泽替米贝处理的panc-1胰腺癌细胞和(c)用依泽替米贝处理的hek293人类胚胎肾细胞的毒性分析;
40.图3示出了实施例中姜黄素的作用机制;和
41.图4示出了(a)依泽替米贝和(b)依泽替米贝苯氧基葡糖苷酸的结构。
具体实施方式
42.材料和方法
43.细胞系
44.人类恶性黑色素瘤(a375)和人类胚胎肾(hek293)细胞系由南非比勒陀利亚大学的abimbolaaro博士捐赠,胰腺癌(panc-1)细胞系由南非威特沃特斯兰德大学的ekene nweke博士捐赠。
45.培养基和化学品
46.使用了以下试剂:dmem(lonza bioscience,美国);胎牛血清(fbs)(biowest,美国);青霉素链霉素(biowest,美国);磷酸盐缓冲盐水(pbs)(thermo fisher scientific,美国);胰蛋白酶edta(thermo fisher scientific,美国);依泽替米贝(sml1629 sigma-aldrich)含量大于98%(hplc)。目录号11465007001的细胞增殖试剂盒i(mtt)从瑞士roche公司购买。
47.细胞培养
48.在含有89%dmem、10%fbs和1%青霉素链霉素的培养基中培养a375人恶性黑色素瘤细胞、panc-1胰腺癌细胞和hek293人胚胎肾细胞。汇合后,用1
×
pbs清洗细胞三次,并通过在37℃下将细胞与2ml胰蛋白酶edta孵育5-10分钟从t75烧瓶中分离。向细胞中添加2ml dmem以停止胰蛋白酶-edta的作用。
49.蛋白质和药物数据库
50.使用了美国结构生物信息学联合研究所(rcsb)、蛋白质数据库(pdb)(berman等人,2000年)、zinc药物数据库(zdd)(sterling和irwin,2015年)、pubchem(kim等人,2019
年)和drugbank(wishart等人,2017年)数据库。zdd是一个由美国食品和药物管理局(fda)批准的药物组成的数据库,这些药物在全球范围内以纯化合物的形式提供。筛选时,共有2924个结构。mdm2蛋白结构以pdb格式(pdb id:1ycr)从pdb数据库下载,并在研究前,使用pymol进行分析,在pymol上去除p53肽。从zdd数据库中检索药物配体的2d结构。利用pubchem数据库获取nutlin-3a的结构,同时从drugbank数据库中以smile格式获取依泽替米贝的结构。
51.计算3d数据库筛选(药效团检索)
52.使用-maestro v10.7蛋白质制备向导将原始pdb蛋白质结构制备成完全制备的全原子模型,并将2924个2d结构转换为4909个maestro格式的最低能量的3d结构。使用内置epik程序在7.0
±
2的目标ph范围内生成配体的电离态。在x、y、z轴上分别生成至的不同尺寸的外部划线网格,以使外部网格与蛋白质活性位点的形状一致。生成配体中心框(内网格),以在侧点搜索期间定义可接受的配体中心位置,从而提供有效搜索空间大小的真实度量。
53.mdm2 p53结合域(mdm2-p53bd)用作maestro v10.7:glide sp(标准精度)应用程序的模板,用于筛选zdd数据库中的化合物。使用glide可以同时进行虚拟筛选和分子对接,将mdm2-p53bd结合口袋和zdd数据库中的关键残基作为输入。最后使用的对接算法是glide sp-算法,也称为标准精度。在对接过程中,mdm2-p53bd结构保持固定,使得羟基和巯基都不能旋转,并且所有对接配体都具有灵活性。这是通过配体制备向导实现的,该向导生成了zdd配体数据库的多个方向的集合。这产生了一组以不同对接分数对接到指定口袋中的先导化合物。
54.计算机模拟药物动力学
55.使用swissadme、admetsar和protox ii对依泽替米贝进行admet(吸收、分布、代谢和毒性)研究。采用tpsa(拓扑极性表面积)碎片化技术(将硫和磷视为极性原子)、亲脂性、水溶性、药代动力学和类药性计算物理化学性质,包括分子量(mw)、分子折射率(mr)、特定原子类型计数和极性表面积(psa)。
56.mtt法检测细胞活力
57.使用mtt法测定细胞活力,mtt法是一种比色法,取决于通过线粒体介导将黄色四氮唑盐(3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-四氮唑溴化物,或mtt)还原为可通过分光光度法测得的紫色甲赞。颜色的强度与细胞中代谢活动的状态成正比,因此与细胞活力的程度成正比。因此,mtt用来衡量药物的毒性程度。
58.将panc-1胰腺癌、a375恶性黑色素瘤和hek293人胚胎肾细胞系在cytoone t75通风细胞培养瓶(美国scientific)中培养至汇合。使用血细胞仪对细胞进行计数,并传代/接种到cytoone 96孔板(美国scientific)中。每200μl约接种5000个细胞。将培养板培养过夜,以便附着。培养过夜后移除培养基。然后用1-200μm的依泽替米贝处理细胞48小时。孵育48小时后,添加20μlmtt试剂并孵育4小时。向每个孔中添加约200μl溶解试剂,并孵育过夜。按照手册中的说明,使用细胞增殖试剂盒i(mtt)(roche,瑞士)进行mtt分析。使用96孔板读取器在570nm处测量吸光度。计算并比较经处理和未经处理的培养物中活细胞的百分比。
59.统计分析
60.所有统计分析均使用prism graphpad软件(圣地亚哥,加利福尼亚州92108,美国)进行。细胞活力数据表示为三个独立实验的平均值
±
标准差(sd)。ic
50
值是使用非线性回归测试计算的,该测试简要涉及将依泽替米贝浓度转换为对数值。对数值与其相应的细胞活力百分比相匹配。用单样本t-检验和wilcoxon符号秩检验确定处理细胞中细胞活力百分比之间的统计差异。p值小于0.05被视为具有统计学意义。
61.结果
62.依泽替米贝目前用于治疗胆固醇血症,口服,并在肠道被激活为具有药理活性的eze-gluc。结果表明,依泽替米贝的母体药物与p53的典型负调节因子mdm2结合。这里,依泽替米贝显示出抑制黑色素瘤细胞系的生长,但对正常人类胚胎肾细胞系无毒。这表明,当通过注射、输注、植入、透皮或其他方式进行胃肠外给药以绕过体前(pre-systemic)代谢时,依泽替米贝是一种抗癌治疗的候选药物。一种药物组合物,其包括用于口服的依泽替米贝和药物姜黄素组合,可防止依泽替米贝的体前清除,并提高其生物利用度和治疗结肠肿瘤的可行性。所述药物组合物可包括一种或多种药学上可接受的赋形剂、载体或稀释剂。
63.依泽替米贝与mdm2-p53结合域的分子对接
64.分子对接研究表明,依泽替米贝与nutlins结合到mdm2上的同一结合口袋。依泽替米贝属于以β-内酰胺环为特征的氮杂环丁酮类化合物(图1a)。nutlins是螺羟吲哚化合物,被开发为与mdm2相互作用的p53肽非肽类似物(图1b)。基于计算机模拟,依泽替米贝似乎与正在进行癌症治疗(通过重新激活p53)临床试验的螺羟吲哚衍生的nutlin3a在同一结合位点紧密结合。nutlins以p53的mdm2结合肽为模型,因此被开发为p53肽的非肽模拟物。
65.基于p53肽上的相互作用残基,有三个疏水口袋,即phel97、trp237和leu267,它们主要形成p53-mdm2相互作用的主要锚。三个依泽替米贝苯环适合这三个结合口袋。依泽替米贝与mdm2的val93形成氢键(图1a和b),因为p53肽中的trp23也与所述残基形成氢键,这种相互作用被认为是p53-mdm2结合的关键(zhao等人,2015年)。与体积庞大的nutlin3a诱导的口袋相比,依泽替米贝诱导的结合口袋要小得多。此外,在mdm2结合位点,将依泽替米贝与p53肽重叠显示出良好的匹配度,表明依泽替米贝可以作为p53的竞争性抑制剂(图1e和f)。重要的是,依泽替米贝似乎很适合p53肽的三个结合口袋,其中葡萄糖醛酸化位点位于phel9口袋,氢键位于trp23口袋。卤素键位于leu26口袋。对于葡萄糖醛酸化结构变型来说,这种拓扑重排在空间上是庞大的。
66.依泽替米贝、nutlins和姜黄素的药效学和药代动力学特性
67.如上所述,进行了依泽替米贝admet的计算机模拟研究,并与已知的nutlin3a药代动力学进行了比较(表1),以评估依泽替米贝的类药性。与nutlin3a(581494g/mol)相比,依泽替米贝的分子量较低,为409433g/mol。依泽替米贝有一条违反五规则,而nutlin3a有四条。依泽替米贝和nutlin3a具有相似的亲脂性,clogp值分别为4.33和4.56,很可能被体循环充分吸收。然而,由于体内前代谢,它们的生物利用度很低。根据里宾斯基五规则,口服药物的logp值应小于5。
68.为了严格评估mdm2抑制剂的作用机制和治疗潜力,其应该具有以下理想特性:(a)高结合亲和力和特异性;(b)野生型p53癌细胞的有效细胞活性和(c)非常理想的药代动力学特征(shangary和wang,2009年)。姜黄素的药代动力学已经过研究,在动物模型中没有毒性报告,在人类中几乎没有不良反应报告。然而,这可能是由于姜黄素的生物利用度较差所
致。根据vareed等人(2008年),口服姜黄素被吸收,并可在人体血浆中检测为葡萄糖醛酸和硫酸盐结合物,需要克剂量才能测得血液中的可检测水平。
69.表1依泽替米贝和nutlin-3a的分子和计算机模拟adme的比较图
[0070][0071][0072]
表2依泽替米贝和姜黄素的药效学和药代动力学比较
gluc)。如果依泽替米贝葡萄糖醛酸化,则udp-葡萄糖醛酸转移酶必须通过激酶磷酸化。由于姜黄素是一种有效的可逆激酶抑制剂,其将抑制依泽替米贝的转化,从而使其可用于结肠癌细胞。因此,口服姜黄素可可逆抑制小肠中的ugt和抑制葡萄糖醛酸化(basu等人,2007年)。因此,姜黄素可以在药物组合物中与依泽替米贝结合,并使用药学上可接受的赋形剂、载体或稀释剂靶向结肠癌。这些分子相互作用如图3所示。
[0081]
这种组合的另一个优点为,当母体药物被吸收到循环系统并到达身体的其他部位时,其也可用于治疗其他癌症,如乳腺癌、宫颈癌、结直肠癌、输卵管癌、胃癌、胶质瘤、霍奇金淋巴瘤、白血病、肝癌、肺癌、黑色素瘤、非霍奇金淋巴瘤、口腔癌、卵巢癌、胰腺癌、肾细胞癌、甲状腺癌等。
[0082]
关键的限定为,依泽替米贝和姜黄素都是高度不溶性的,生物利用度低(berginc等人2012年)。这可以通过针对不同癌症的药物组合物的配方来解决。
[0083]
讨论
[0084]
人们认为,依泽替米贝的原始形式与mdm2结合,mdm2作为癌基因以及肿瘤抑制因子p53的负调节因子在致癌过程中起着至关重要的作用。依泽替米贝可能与mdm2的p53结合域结合(图3),因此可能抑制癌变。
[0085]
与目前用于降低胆固醇水平的药物不同,依泽替米贝必须保持其原始的癌症治疗形式。本发明提供一种治疗结肠癌的药物组合物,包括依泽替米贝和姜黄素组合,可以避免依泽替米贝代谢为依泽替米贝葡糖苷酸。本发明还提供了一种包括依泽替米贝的药物组合物,用于治疗其他实体癌,包括乳腺癌、宫颈癌、结直肠癌、输卵管癌、胃癌、胶质瘤、霍奇金淋巴瘤、白血病、肝癌、肺癌、黑色素瘤、非霍奇金淋巴瘤、口腔癌、卵巢癌、胰腺癌、肾细胞癌、甲状腺癌等。
[0086]
参考文献
[0087]
basu nk,kole l,basu m,mcdonagh af and owens is 2007.targeted inhibition of glucuronidation markedly improves drug efficacy in mice-a model.biochem biophysres commun 360:7-13.
[0088]
berginc k,trontelj j,basnet ns and kristl a 2012.physiological barriers to the oral delivery of curcumin.die pharmazie-an international journal of pharmaceuticalsciences 67:518-524.
[0089]
berman hm,westbrook j,feng z,gilliland g,bhat tn,weissig h,shindyalov in and bourne pe 2000.the protein data bank nucleic acids res 28:235-242.
[0090]
davis hr and veltri ep 2007.zetia:inhibition of niemann-pick c1 like 1(npc1l1)to reduce intestinal cholesterol absorption and treat hyperlipidemia.journal of atherosclerosis and thrombosis 14:99-108.
[0091]
gembarska a,luciani f,fedele c,russell ea,dewaele m,villar s,zwolinska a,haupt s,de lange j,yip d et al.2012.mdm4 is a key therapeutic target in cutaneous melanoma.nat med 18:1239.
[0092]
kim s,chen j,cheng t,gindulyte a,he j,he s,li q,shoemaker ba,thiessen pa,yu b et al.2019.pubchem 2019 update:improved access to chemical data.nucleic acids res 47.
[0093]
kosoglou t,statkevich p,johnson-levonas a,paolini jf,bergman aj and alton kb.2005.ezetimibe.clin pharmacokinet 44:467-494.
[0094]
muthusamy v,hobbs c,nogueira c,cordon-cardo c,mckee ph,chin l and bosenberg mw 2006.amplification of cdk4 and mdm2 in malignant melanoma.genes chromosomes cancer 45:447-454.
[0095]
reddy s and aggarwal bb 1994.curcumin is a non-competitive and selective inhibitor of phosphorylase kinase.febslett 341:19-22.
[0096]
shangary s and wang s 2009.small-molecule inhibitors of the mdm2-p53protein-protein interaction to reactivate p53 function:a novel approach for cancer therapy.annu rev pharmacol toxicol 49:223-241.
[0097]
shangary s,ding k,qiu s,nikolovska-coleska z,bauer ja,liu m,wang g,lu y,mceachern d,bernard d,bradford cr,carey te and wang s 2008.reactivation of p53 by a specific mdm2 antagonist(mi-43)leads to p21-mediated cell cycle arrest and selective cell death in colon cancer.mol cancer ther 7(6):1533-1542.
[0098]
sterling t and irwin jj 2015.zinc 15
–
ligand discovery for everyone.j chem inf model 55:2324-2337.
[0099]
vareed sk,kakarala m,ruffin mt,crowell ja,normolle dp,djuric z and brenner de 2008.pharmacokinetics of curcumin conjugate metabolites in healthy human subjects.cancer epidemiology,biomarkers&prevention:a publication of the american association for cancer research,cosponsored by the american society of preventive oncology 17:1411-1417.
[0100]
warner wa,sanchez r,dawoodian a,li e and momand j 2012.identification of fda-approved drugs that computationally bind to mdm2.chem biol drugs des 80(4):631-637
[0101]
wishart ds,feunang yd,guo ac,lo ej,marcu a,grant jr,sajed t,johnson d,li c,sayeeda z et al.2017.drugbank 5.0:a major update to the drugbank database for 2018.nucleicacids res.46(d1):d1074-d1082
[0102]
zhao y,aguilar a,bernard d and wang s 2015.small-molecule inhibitors of the mdm2
–
p53 protein
–
protein interaction(mdm2 inhibitors)in clinical trials for cancer treatment.j med chem 58:1038-1052.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。