1.本发明属于生物技术领域,具体涉及一种天然多糖基化学-物理双交联水凝胶微粒。
背景技术:
2.国际糖尿病联盟(idf)在2021年底提供的调查数据显示,目前全球约有 5.37亿糖尿病成年患者(20-79岁),即10%的成年人罹患糖尿病。胰岛素对治疗糖尿病有着突出疗效而备受关注。胰岛素作为蛋白质多肽类药物,口服给药需要克服生理障碍、酶障碍、物理化学稳定性及体内生物利用度降低等问题。为了克服口服给药的障碍,制备新型药物载体保护、促进药物吸收很有必要。
3.水凝胶微粒是一种具有分子内交联网状结构且尺寸介于0.1~1000μm之间的水溶性聚合物胶体。它兼具均一性、稳定性和柔性等独特的性质。利用天然多糖为原材料制备水凝胶微粒结构,在一定程度上可避免物理化学作用的影响,促进药物吸收的作用。但目前现有研究中胰岛素缓释制剂体内作用时长较短,平均于8-16h,患者服药次数较为频繁。
技术实现要素:
4.本发明的目的在于提供一种天然多糖基化学-物理双交联水凝胶微粒,其溶胀性能和缓释性能良好,可应用于缓释制剂领域,以解决现有技术存在的问题。
5.一种天然多糖基化学-物理双交联水凝胶微粒的制备方法,包括以下步骤:
6.(1)将羧甲基-β-环糊精溶液(cmcd)与1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和n-羟基琥珀酰亚胺充分混合反应;
7.(2)然后加入羧甲基壳聚糖溶液(cmcs)混合,并在磁力搅拌器中充分搅拌反应,进行化学交联接枝,得到羧甲基-β环糊精接枝羧甲基壳聚糖产物溶液;
8.(3)再加入海藻酸钠溶液(sa)充分混匀,再加入葡萄酸内酯(gdl现配现用)溶液磁力搅拌混合反应,使海藻酸钠与羧甲基壳聚糖物理交联;
9.(4)冷冻干燥,过筛,收集获得天然多糖基化学-物理双交联水凝胶微粒。
10.本发明的葡萄酸内酯(gdl)需要现配现用。葡萄酸内酯在水下缓慢释放出氢离子,盐酸等,gdl放置一段时间后就类似于同ph下的盐酸溶液,滴加进去直接形成胶状物,不均匀。
11.本发明通过交联剂使羧甲基-β-环糊精接枝于羧甲基壳聚糖上,并通过离子键使羧甲基壳聚糖与海藻酸钠发生物理交联,具有三维网状多孔结构,属于非晶型结构。网状多孔结构有利于水分子/药物分子的贮存保留。
12.edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐):edc是个可溶于水的碳二亚胺,在酰胺合成中用作羧基的活化试剂,也用于活化磷酸酯基团、蛋白质与核酸的交联和免疫偶连物的制取。使用时的ph范围为4.0-6.0,常和n-羟基琥珀酰亚胺(nhs)或n-羟基硫代
琥珀酰亚胺连用,以提高偶联效率。
13.羧甲基环糊精(cmcd)凭借其独特的外亲水内疏水空腔化学结构,与多种小分子形成包埋物,可显著增加疏水性药物在水中的溶解度,减缓药物水解速率。
14.海藻酸钠(sa):海藻酸盐是一类带负电荷的天然酸性多糖,由褐藻和细菌产生的多糖家族,在碱性条件下可溶在酸性条件下不可溶,可保护药物通过胃酸环境,并在肠道碱性环境中释放,是最适合包埋材料的生物聚合物。β-d
‑ꢀ
甘露糖醛酸(β-d-mannuronic,m)和α-l-古洛糖醛酸(α-l-guluronic,g)按 (1
→
4)键连接而成的线性共聚物。钙离子与海藻酸盐中的g-单元有着特殊的相互作用,褐藻利用这种作用合成了具有不同凝胶性质的海藻酸盐,例如高g 海藻酸钠的高g-海藻酸钠形成一种刚性凝胶,以及同一物种复叶中的低g褐藻酸盐,使其更具灵活性。由poly-m多会产生免疫原性和poly-g组成的海藻酸盐之间的凝胶性能存在差异的原因是壳聚糖和聚m(4c1构象,双季糖苷键),之间的电荷距离匹配而g-嵌段(1c4构象,二轴糖苷键)的电荷距离较短,仅为8.7
°
。因此,ca
2
和壳聚糖低聚物可以为海藻酸盐提供交联剂,其中钙离子通过g-嵌段交联,壳聚糖低聚物通过m-嵌段最有效地交联。突然降低海藻酸钠水溶液的ph值可以得到海藻酸,当缓慢或者可控地释放出氢质子时可以得到海藻酸凝胶。
15.进一步的,步骤(2)中所述化学交联接枝的反应温度35-38℃,优选 37℃,反应ph为9.05-9.25。
16.进一步的,步骤(3)中反应温度为25-37℃。
17.进一步的,所述羧甲基-β-环糊精、羧甲基壳聚糖、海藻酸钠、1-乙基-(3
‑ꢀ
二甲基氨基丙基)碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和葡萄酸内酯的摩尔比为 0.9-1.1:0.9-1.1:0.015-0.025:9-11:2-3:45-55,或者质量比为13-15:130
‑ꢀ
150:65-75:3.5-4:0.7-1.2:15-20。本发明的edc/nhs攻击羧基形成中间产物,可与壳聚糖胺基反应形成酰胺键,较为稳定。高浓度的edc/nhs使羧甲基壳聚糖的胺基不剩余,因此需要调整交联剂摩尔浓度使部分胺基可与海藻酸钠形成离子相互作用从而发生物理交联。
18.进一步的,每毫升去离子水中含羧甲基-β-环糊精的质量为1.4mg,含羧甲基壳聚糖的质量为14mg,含海藻酸钠的质量为7mg,含1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐的质量为0.38mg,含n-羟基琥珀酰亚胺的质量为 0.09mg,含葡萄酸内酯的质量为2.1mg。
19.进一步的,所述羧甲基-β-环糊精溶液的制备方法为:取0.25-0.35g(优选 0.28g)羧甲基-β-环糊精溶解于4ml去离子水中。
20.进一步的,所述羧甲基壳聚糖溶液的制备方法为:取2.5-3.5g(优选 2.8g)羧甲基壳聚糖溶解于36ml去离子水中
21.进一步的,所述海藻酸钠溶液的制备方法为:取1-2g(优选1.4g)海藻酸钠溶解于156ml去离子水中。
22.进一步的,所述葡萄酸内酯溶液的制备方法为:取0.35-0.5g(优选 0.42g)葡萄酸内酯溶解于4ml去离子水中。
23.进一步的,所述羧甲基-β-环糊精纯度≥99.3%,mw约为7kda;所述羧甲基壳聚糖的羧化度≥80%m,mw约为70kda;所述海藻酸钠的纯度≥98%,mw 约为1750kda。
24.上述方法制备的天然多糖基化学-物理双交联水凝胶微粒,所述水凝胶微球直径为0.25-0.85mm。本发明的水凝胶微球溶胀性能良好;包埋胰岛素后,经模拟人体胃肠道环
境,载胰岛素水凝胶微粒具有良好的缓释性能,缓释时间可长达28h。不同浓度的水凝胶浸提液(0.5,1,1.5,2mg/ml)培养的细胞24h 与48h,其细胞存活率均达96%以上,无细胞毒性作用;糖尿病小鼠经口服载胰岛素凝胶微粒(25、50、75iu/kg),可维持长达26h的低血糖水平,载胰岛素水凝胶微粒对2型糖尿病小鼠模型具有良好且较持久的降血糖活性效果。
25.本发明借用生物相容性好的天然多糖载体材料制备胰岛素缓释制剂,不仅可避免胃酸及胃蛋白酶对胰岛素的破坏降解,提高胰岛素的生物利用度,还可以延缓胰岛素在体内的作用时间,减少给药次数。
26.与现有技术相比,本发明具有以下优势:
27.(1)本发明的羧甲基环糊精与edc/nhs混合活化羧甲基环糊精中的羧基后再加入羧甲基壳聚糖中,交联剂用量大大降低,使得羧甲基环糊精与羧甲基壳聚糖发生化学交联,减少羧甲基壳聚糖自身交联可能。羧甲基壳聚糖剩余的胺基还可与海藻酸钠形成物理交联。
28.(2)本发明的gdl溶于水后可以缓慢地释放出h
,海藻酸钠在gdl存在的情况下可以得到均匀的海藻酸凝胶。当海藻酸钠的水溶液中含有其它的聚阴离子时,聚阴离子和海藻酸钠之间的静电排斥作用会减缓凝胶的形成,聚阳离子可与海藻酸钠间离子相互作用促进凝胶形成。
29.(3)本发明采用的原料如羧甲基-β-环糊精、羧甲基壳聚糖和海藻酸钠均便宜易得,安全无毒,具有经济合理性,节约成本。且制备方法简单、安全。
30.(4)本发明的水凝胶微粒细胞相容性良好,可作为口服药物载体。体外载胰岛素水凝胶缓释实验中显示可长达34h的胰岛素缓释效果,体内动物实验中显示口服载胰岛素水凝胶微粒可长达26h的降血糖疗效,对比现有其他胰岛素缓释制剂仅8-16h的缓释时长,天然多糖基化学-物理双交联水凝胶微粒较大的提高口服胰岛素类蛋白药物的缓释时长及生物利用度。
附图说明
31.图1是本发明的天然多糖基化学-物理双交联水凝胶微粒制备工艺流程图;
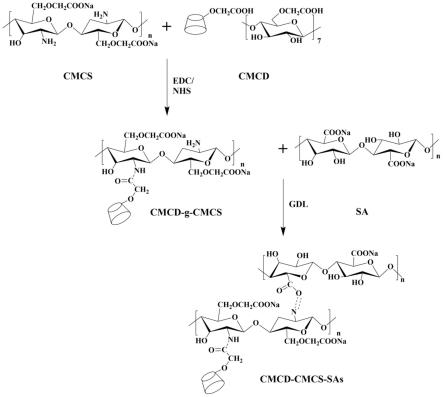
32.图2是本发明的天然多糖基化学-物理双交联水凝胶微粒制备机理图;
33.图3是本发明的天然多糖基化学-物理双交联水凝胶微粒的傅里叶红外分析图;
34.图4是本发明的天然多糖基化学-物理双交联水凝胶微粒的x射线单晶衍射图;
35.图5是本发明的天然多糖基化学-物理双交联水凝胶微粒的扫描电镜图;
36.图6是本发明的天然多糖基化学-物理双交联水凝胶微粒的溶胀率图;
37.图7是本发明的天然多糖基化学-物理双交联水凝胶微粒负载胰岛素后的累积释药曲线图;
38.图8是本发明的天然多糖基化学-物理双交联水凝胶微粒的细胞毒性图;
39.图9是本发明的天然多糖基化学-物理双交联水凝胶微粒负载胰岛素后的降血糖活性效果图;
40.图10是本发明的天然多糖基化学-物理双交联水凝胶在ph为7.5-8的外观状态图;
41.图11是本发明的天然多糖基化学-物理双交联水凝胶在ph为6.5-7.2的外观状态图;
42.图12是对比例1的水凝胶的冻干前和冻干后的外观状态图;
43.图13是对比例1的水凝胶的释药曲线图;
44.图14是对比例2的水凝胶的释药曲线图;
45.图15是对比例5的水凝胶外观状态图。
具体实施方式
46.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
47.实施例1
48.1、一种天然多糖基化学-物理双交联水凝胶微粒的制备
49.如图1所示,主要包括以下步骤:
50.(1)称取0.28g羧甲基-β-环糊精溶解于3ml去离子水中,快速搅拌形成均一的羧甲基-β-环糊精溶液;
51.(2)称取2.8g羧甲基壳聚糖溶解于36ml去离子水中,快速搅拌形成均一的羧甲基壳聚糖溶液;
52.(3)称取1.4g海藻酸钠溶解于160ml去离子水中,快速搅拌形成均一的海藻酸钠溶液;
53.(4)将羧甲基-β-环糊精溶液与0.0764g的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和0.0184g的n-羟基琥珀酰亚胺充分混合反应3h,再加入羧甲基壳聚糖溶液混合(此时ph值为9.85左右),并在37℃磁力搅拌器中充分搅拌反应 12h,进行化学交联接枝,得到羧甲基-β环糊精接枝羧甲基壳聚糖产物溶液 (此时ph值为ph9.05-9.25);加入海藻酸钠溶液充分混匀,再加入葡萄酸内酯溶液(0.42g溶于4ml去离子水中,现配现用)磁力搅拌混合反应12h,使海藻酸钠与羧甲基壳聚糖物理交联,从而得到天然多糖基物理-化学双交联水凝胶溶液 (此时ph7.5-8,若再加入更多葡萄酸内酯gdl,将形成块状物)。产物溶液冷冻干燥,过20目筛,收集获得固体颗粒状水凝胶。
54.2、结构表征测定
55.(1)衰减全反射-傅里叶红外光谱检测
56.分别将羧甲基-β-环糊精、羧甲基壳聚糖、海藻酸钠,实施例1制备的冷冻干燥后的凝胶样品进行衰减全反射-傅里叶红外光谱检测。如图3所示,峰值在 1085cm-1
和1027cm-1
对应于糖醛酸g和m的碳氧化合物的伸缩振动。对比羧甲基壳聚糖的红外谱图,水凝胶微粒存在947cm-1
处吸收峰,这是由于引入羧甲基-β-环糊精的α(1
→
4)糖苷键骨架振动产生的,且在3351cm-1
出现更强的吸收峰,这是由于引入羧甲基-β-环糊精的羟基基团增多而引起的吸收峰变化,对比于羧甲基-β-环糊精的红外谱图,水凝胶微粒中环糊精特征吸收峰944cm-1
蓝移至947cm-1
,且吸收峰1406cm-1
红移至1406cm-1
出现明显增强,以上结果可初步证明羧甲基环糊精与羧甲基壳聚糖接枝成功。相对于海藻酸钠的红外谱图,海藻酸钠与羧甲基壳聚糖络合后,水凝胶微粒谱图中古洛糖醛酸特征吸收峰从1085cm-1
红移至1062cm-1
,甘露糖醛酸的特征吸收峰在1027cm-1
蓝移至 1030cm-1
且吸收峰相对减少,这可归因于羧甲基壳聚糖上的氨基与海藻酸钠上甘露糖醛酸的羧基之间的离子相互作用,初步证明海藻酸钠与羧甲基壳聚糖交联成功。
57.(2)x射线单晶衍射仪检测
58.分别将羧甲基-β-环糊精、羧甲基壳聚糖、海藻酸钠与研碎的冷冻干燥凝胶样品粉末,置于样品池中,通过x射线单晶衍射仪检测。如图4所示,羧甲基壳聚糖特征峰出现在2θ=21.2
°
。羧甲基-β-环糊精的xrd谱图显示,在16
°
~23
°
范围内有特征强峰。海藻酸钠的xrd特征峰分别为13.1
°
和22
°
。而在水凝胶粉末中,并未显示出衍射峰的叠加,而是衍射峰位置及强度均发生明显变化,仅在 2θ=21.8
°
附近出现了一个新的宽单峰,且峰强度明显下降,这可能是羧甲基壳聚糖,羧甲基环糊精,海藻酸钠直接发生相互作用而使得水凝胶粉末原因。因此,羧甲基-β-环糊精和海藻酸钠的衍射峰消失,羧甲基壳聚糖的结晶度下降,表明羧甲基-β-环糊精被成功引入到羧甲基壳聚糖中,海藻酸钠和羧甲基壳聚糖之间发生了物理交联。初步验证了天然多糖基物理-化学双交联水凝胶微粒的形成。这一现象也进一步证实了ftir光谱的结果。
59.(3)扫描电镜检测
60.将天然多糖基化学-物理双交联水凝胶微粒进行冷冻干燥,冻干后的凝胶样品通过扫描电镜观察其截面微观结构。如图5所示,在100倍数下观察到凝胶截面有较多较大的孔隙。
61.3、理化性能测定指标评定
62.(1)溶胀实验
63.如图6所示,在不同的ph条件下水凝胶微粒的溶胀率均较高,且具有明显的ph响应特性:在ph1.2模拟胃液中的溶胀率为586%,在ph7.4模拟肠液中的溶胀率为1386%。由此可见,本发明的水凝胶微粒具备优良的溶胀性能,既可吸收大量的水分子,也利于药物的大量贮存。本发明制备的水凝胶球在生物医药工程、蛋白质及水溶性药物递送、保健食品等领域,具有良好的应用前景及潜在的应用价值。
64.(2)载药实验
65.取10mg冷冻水凝胶浸入到2ml7.5 mg/ml的胰岛素盐酸溶液中,于37℃、 150r/min条件下恒温振荡进行吸附载药,并通过bca法制备胰岛素标准曲线,计算水凝胶的载药量。
66.(3)体外释药性能测定
67.图7表明在前两小时模拟胃液环境内凝胶微粒没有明显的突释现象,释放率仅13%,这是由于海藻酸钠的羧基和羧甲基壳聚糖的氨基均质子化,从而形成氢键而导致高分子链收缩,且羧甲基环糊精的疏水性空腔结构与胰岛素形成更多氢键从而阻止胰岛素的释放,因此可能只有载体表面游离胰岛素释放出来。而在模拟肠道环境中羧甲基壳聚糖氨基去质子化失去正电荷,海藻酸钠羧酸基团完全电离,此时形成强静电斥力,水凝胶微粒逐渐崩解,且羧甲基环糊精与胰岛素间氢键减弱从而缓慢释放出带胰岛素,使得累计释放率逐渐增加至 98%。因此,水凝胶对胰岛素有良好的控释和缓释性能,可避免胰岛素受胃液的分解,而在肠道ph环境下释放时间更长、更稳定,有利于胰岛素被人体肠道吸收。
68.4、生物相容性测定指标评定
69.根据国家标准信息:体外细胞毒性试验标准指示进行实验,结果显示本发明的天然多糖基化学-物理双交联水凝胶微粒有良好的生物相容性,如图8所示,本发明的天然多糖基化学-物理双交联水凝胶混悬液(0.5、1、1.5、 2mg/ml)培养24h及48h后caco-2细胞细胞存活率均到达96%以上,表明本发明的天然多糖基化学-物理双交联水凝胶微粒无毒性,
生物相容性良好。
70.5、药理活性测定指标评定
71.小鼠降血糖水平检测。表1为动物实验模型造模及治疗的剂量情况。
72.表1动物实验模型造模及治疗的剂量情况
[0073][0074]
本发明的天然多糖基化学-物理双交联水凝胶微粒负载胰岛素后的降血糖活性效果如图9所示,口服灌胃载胰岛素水凝胶微粒在较高剂量及前期给药(50、 100、150iu/kg),缓释作用时长均达到28h以上,但有部分高剂量组 (150iu/kg)空腹血糖出现低血糖现象(≤3mmol/l),为提高胰岛素生物利用度,后续将降低为一半剂量后(25、50、75iu/kg)仍可达到较长时长的降血糖作用,在维持了接近6小时载体崩解区后,体内降糖效果仍持续了大约近20h。这符合体外载胰岛素水凝胶微粒释药时长达到接近34h的结果,因胰液分泌 (ph7.8-8.4)及肠道微生态环境等的作用,体内水凝胶微粒崩解速度加快,药物释放相对加速,但仍可达到20-30h的作用效果(低剂量组及高剂量组作用时长不同)。因此,水凝胶微粒包埋胰岛素后可实现缓释作用并对2型糖尿病小鼠模型具有更持久的降血糖活性效果。
[0075]
本实施例的水凝胶在ph为7.5-8之间外观状态如图10所示,为液体状;在ph 为6.5-7.2时的外观状态如图11所示,为凝胶状。最终选用ph范围为7.5-8间。
[0076]
对比例1
[0077]
羧甲基壳聚糖 羧甲基环糊精通过化学交联后与海藻酸钠混合,并通过 cacl2交联水凝胶的制备,主要包括:
[0078]
(1)0.2gcmcd 0.055gedc 0.0128gnhs 10ml蒸馏水混合2h,后混合 2gcmcs 90ml,37℃水浴搅拌反应12h。
[0079]
(2)0.5gsa溶于50ml蒸馏水,1.5gsa溶于50ml蒸馏水,取一定比例样品混合过夜,滴加于2%cacl2中,冻干。分为三组对比实验,三组对比实验中 cmcs、cmcd、edc、nhs的组分百分比为1%、0.10%、0.03%和 0.006%,sa含量分别为0.5%、1%、1.5%。反应得到的水凝胶冻干前状态如图 12的左边所示,及冻干后状态如图12的右边所示。释药率如图13的所示,对比例1中水凝胶虽然在肠液环境下有突释现象,但最高累计释放率仅为13%左右,其利用度过低。
[0080]
表2对比例1中各体系的组分质量及对应水凝胶性能
[0081][0082]
对比例2
[0083]
羧甲基壳聚糖 羧甲基环糊精 海藻酸钠通过edc/nhs交联,水凝胶的制备包括:
[0084]
1gcmcd 2gsa 210ml蒸馏水搅拌混合至均质,各取25ml加入不同浓度 edc、nhs,后混合3%cmcs 25ml(3gcmcs 100ml蒸馏水),37℃搅拌反应12h,冻干。反应得到的水凝胶释药率曲线如图14所示。对比例2的水凝胶虽然载药率较高,在肠液环境下有突释现象,但最高累计释放率仅为27%左右,且在胃酸环境下胰岛素释放率达到14%,不符合蛋白类药物吸收且药物释放率过低,生物利用度过低。
[0085]
表3对比例2中各体系的组分质量及对应水凝胶性能
[0086][0087]
对比例3
[0088]
羧甲基壳聚糖 羧甲基环糊精通过化学交联后与海藻酸钠混合,并通过 gdl交联水凝胶的制备,主要包括:
[0089]
(1)1.5gcmcd溶于100ml水后加入1.91gedc与1.15gnhs混匀,6gcmcs 溶于200ml水,2gsa溶于100ml水,1.5ggdl溶于100ml水;
[0090]
(2)cmcd cmcs于150rpm摇床反应24h,后加sa gdl于摇床反应 24h,冻干。
[0091]
表4对比例3中各体系的组分质量
[0092][0093]
实验发现cmcd加cmcs后直接出现絮状物沉淀。2,4全液态,3黏稠液态。8可以看出絮状物含cmcs,可与sa交联,但8中sa过量。10,11形成块状水凝胶,剩余大量液态。
[0094]
对比例4
[0095]
水凝胶的制备包括:将羧甲基-β-环糊精溶液与1-乙基-(3-二甲基氨基丙基) 碳二亚胺盐酸盐和n-羟基琥珀酰亚胺充分混合反应3h,再加入羧甲基壳聚糖溶液混合,并在37℃磁力搅拌器中充分搅拌反应12h,进行化学交联接枝,得到羧甲基-β环糊精接枝羧甲基壳聚糖产物溶液;加入海藻酸钠溶液充分混匀,再加入葡萄酸内酯溶液(现配现用)磁力搅拌混合反应12h,使海藻酸钠与羧甲基壳聚糖物理交联,从而得到天然多糖基物理-化学双交联水凝胶溶液。
[0096]
表5对比例4中各体系的组分百分比及对应水凝胶性能
[0097][0098][0099]
*为水,**比原材料稀(7.8%cmcs,0.875%sa)***黏稠液态,均一,比原材料稠,****流动性差,固态,*****可机械破坏,固态
[0100]
对比例5
[0101]
水凝胶的制备包括:将羧甲基-β-环糊精溶液与1-乙基-(3-二甲基氨基丙基) 碳二亚胺盐酸盐和n-羟基琥珀酰亚胺充分混合反应3h,再加入羧甲基壳聚糖溶液混合,并在37℃磁力搅拌器中充分搅拌反应12h,进行化学交联接枝,得到羧甲基-β环糊精接枝羧甲基壳聚糖产物溶液;加入海藻酸钠溶液充分混匀,再加入葡萄酸内酯溶液(现配现用)磁力搅拌混合反应12h,使海藻酸钠与羧甲基壳聚糖物理交联,从而得到天然多糖基物理-化学双交联水凝胶溶液。得到的水凝胶的外观状态图如图15所示。其中表6中4.4个材料比例为最佳水凝胶配方。
[0102]
表6对比例5中各体系的组分百分比及对应水凝胶性能
[0103][0104]
其中,*为水,**比原材料稀(7.8%cmcs,0.875%sa)***黏稠液态,均一,比原材料稠,****流动性差,固态,*****可机械破坏,固态。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。