基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统、平台和应用
- 国知局
- 2024-11-19 09:48:51
本发明属于农药分析检测,具体涉及一种基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统、平台和应用。
背景技术:
1、
2、目前,针对检测农产品和食品中这几种真菌毒素的研究已有大量报道,主要有高效液相色谱-质谱法联用,高效液相色谱气相色谱法等色谱法。虽然色谱及其联用技术能检测灵敏度高、重复性好,能够实现农产品和食品当中真菌毒素的准确分析,但是仪器分析需要专业技术人员的培训,复杂的样品前处理步骤以及昂贵的仪器设备,无法满足现场快速检测的需要。免疫分析法的基本原理是抗原抗体的特异性结合反应。当前免疫分析法中应用最广泛的是酶联免疫吸附测定法(elisa)和胶体金免疫层析法(gica)。但elisa方法需要借助光学仪器判读结果、抗原抗体孵育时间较长、操作步骤繁琐,限制了其在现场快速检测的应用。由于胶体金颗粒不具有自发光性能,所以需要大量颗粒聚集才能达到可视化水平,且该检测方法大多通量不高,很难实现同时检测多个样品,检测灵敏度和准确度不高,很多情况下仅仅能实现半定量检测。因此,开发一种快速准确、操作简单、成本低的检测方法,对同时存在的多种类型真菌毒素进行实时有效的检测是十分必要的。
技术实现思路
1、发明目的:针对现有技术中多种真菌毒素同时检测方法中存在的问题,本发明提供了基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统,本发明的系统中利用微流控自组装制备出大小均一、排列整齐、结构色一致的光子晶体微球,具有有序孔道结构、大比表面积、灵活的表面功能化且易于修饰等优点,并且其自身没有荧光干扰,因此其独特的结构被认为是理想的载体或生物分子筛选平台,其表面非常适合来包被人工抗原,再以抗体偶联的铕螯合物荧光纳米材料为荧光探针,以及目标物三者形成竞争免疫反应体系,再通过时间分辨荧光检测仪器收集荧光信号,根据荧光信号的变化得出线性关系,从而实现对真菌毒素的定量检测。该检测方法特异性和重复性良好、灵敏度高且线性范围宽,可实现准时、现场检测的目标。有效解决了现有技术中真菌毒素检测操作步骤繁琐,仪器设备昂贵,试剂消耗量大,无法同时检测且耗时长等问题。
2、本发明还提供了用于检测的检测卡、检测平台以及应用。
3、技术方案:为了实现上述目的,本发明所述一种基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统,所述系统包括表面固定真菌毒素人工抗原三维光子晶体微球、包裹了铕螯合物的ps荧光微球人工抗体标签;二者和目标毒素三者之间的免疫竞争;所述三维光子晶体微球其表面固定真菌毒素人工抗原;所述ps荧光微球人工抗体标签表面偶联与微球表面抗原对应的人工抗体,免疫竞争反应后根据光子晶体微球表面结合ps荧光微球的量引起的荧光信号的强弱变化得到与真菌毒素含量之间的线性关系。
4、其中,所述三维二氧化硅光子晶体微球直径约为600μm左右。
5、其中,所述真菌毒素人工抗原包括ota-bsa、don-bsa、afb1-bsa中的任意一种或者多种,所述对应的真菌毒素抗体包括ota-ab、don-ab、afb1-ab中的任意一种或者多种,其浓度为10μg/ml-20μg/ml。
6、作为优选,所述真菌毒素人工抗原的浓度为10μg/ml或20μg/ml,抗体浓度均为10μg/ml。
7、其中,所述铕螯合物的ps荧光微球人工抗体标签中微球固体含量为0.01%-0.06%。
8、作为优选,所述铕螯合物的ps荧光微球人工抗体标签中微球固体含量为0.03%。
9、本发明所述的基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统的制备方法,包括如下步骤:
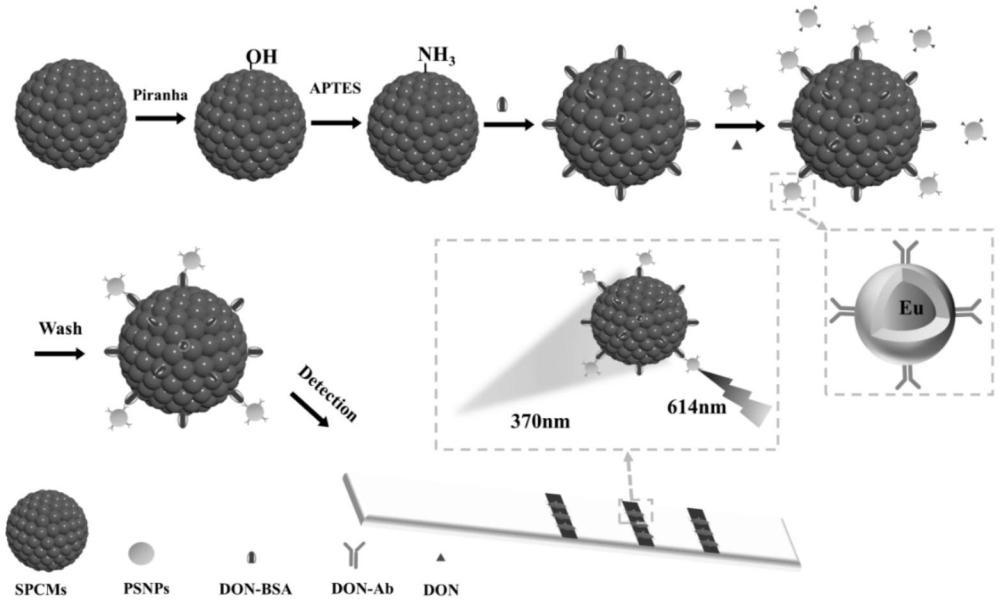
10、(1)制备三维二氧化硅光子晶体微球,采用双氧水与浓硫酸的混合液处理制备的光子晶体微球,再用3-氨丙基三乙氧基硅烷对微球表面进行氨基基团的修饰;
11、(2)将修饰后的光子晶体微球表面结合人工抗原;
12、(3)取ps荧光微球溶液,加入edc溶液和nhs溶液,超声分散均匀,进行活化后,加入缓冲液清洗,加入人工抗体进行偶联。
13、本发明所述检测卡包括一条便于稳定放置光子晶体微球的3d打印机卡槽,所述卡槽共均匀分布了有间隙,分别与试纸条的检测线吻合,每条间隙可以稳定固定住2-3颗光子晶体微球,所述卡槽采用的打印材料为植物基光敏树脂用于固定微球的间隙对应试纸条的检测线,间隙的长度对应检测线的长度,宽度和深度对应光子晶体微球的直径大小。
14、作为优选,所述检测卡包括一条便于稳定放置光子晶体微球的3d打印机卡槽,所述卡槽共均匀分布了三条间隙,分别与试纸条的三条检测线吻合,每条间隙可以稳定固定住3颗光子晶体微球,所述卡槽采用的打印材料为植物基光敏树脂,卡槽长18mm,宽3mm高2.5mm,该卡槽有三条用于固定微球的间隙长3mm,宽1mm,高1mm,分别对应试纸条的三条检测线,间隙的长度对应检测线的长度,宽度和深度对应光子晶体微球的直径大小。
15、其中,所述光子晶体微球排列在试纸卡的检测线上(其中任意一条都可以,三条都放即可一次性读出三个检测数值),再插入时间分辨荧光仪(激发波长371nm)采集微球表面的荧光信号,读取记录下荧光信号响应值。
16、本发明所述用于检测多种真菌毒素检测平台,所述检测平台包括所述基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统,以及所述的检测卡。
17、本发明所述的基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统或者所述的用于检测多种真菌毒素检测平台在特异性识别谷物中多种真菌毒素以及定性和定量检测谷物中多种真菌毒素中的应用。
18、其中,所述检测为系统中三维光子晶体微球以及铕螯合物的ps荧光微球人工抗体标签与样品中真菌毒素置于同一反应体系中,进行免疫竞争反应,反应后光子晶体微球表面经过洗涤后排列在试纸卡的检测线上,再插入时间分辨荧光仪采集微球表面的荧光信号,利用origin软件数据处理工具对试纸卡采集到的光子晶体微球表面的荧光信号进行定量分析,建立荧光信号和目标物分子浓度的线性关系,其中采用标签特征荧光信号的平均值作为指标进行定量。
19、其中,所述免疫竞争反应温度为30-37℃,反应时间为30-40min。
20、作为优选,所述免疫竞争反应的时间为30分钟,温度为37℃。
21、其中,本发明检测真菌毒素包括don、ota、afb1,三种毒素检测结果的线性范围分别为0.01-1000ng/ml,0.1-100 ng/ml,0.01-100ng/ml,检测限分别为0.016ng/ml,0.012ng/ml,0.016ng/ml。
22、进一步地,统计分析了在3种实际样品(大米、小麦和玉米)中运用该方法时的批内误差和批间误差,所述实际样品前三天的批内误差范围分别为2.60%~8.89%,5.79%~13.42%,2.08%~6.27%,整体批间误差范围小于15%。
23、进一步地,本发明制备的基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统,再构建试纸卡组成平台进行检测的步骤如下:
24、步骤一:三维二氧化硅光子晶体微球的制备;
25、步骤二:三维二氧化硅光子晶体微球表面的化学修饰,采用双氧水与浓硫酸的混合液处理步骤一制备的光子晶体微球,再用3-氨丙基三乙氧基硅烷对微球表面进行氨基基团的修饰;
26、步骤三:光子晶体微球表面结合目标物的人工抗原;
27、步骤四:铕螯合物的ps荧光微球人工抗体标签的制备;
28、步骤五:免疫竞争反应,采用步骤三所制备的光子晶体微球、步骤四所制备的标签和目标物三者之间进行免疫竞争反应;
29、步骤六:试纸卡的组装和检测,经过步骤五的光子晶体微球表面经过洗涤后排列在试纸卡的检测线上,再插入时间分辨荧光仪采集微球表面的荧光信号,利用origin软件数据处理工具对试纸卡采集到的光子晶体微球表面的荧光信号进行定量分析,建立荧光信号和目标物分子浓度的线性关系,其中采用标签特征荧光信号的平均值作为指标进行定量。
30、其中,步骤一制备光子晶体微球时,二氧化硅纳米乳液的配方为a液(氨水11.5ml、双蒸水23ml、无水乙醇15ml),b液(正硅酸乙酯4.9ml、无水乙醇45.1ml),制备光子晶体微球所需微流注射泵的参数为:油相8ml/h,乳相5ml/h,其中a液和b液合成乳液后,利用微流控注射系统进行组装合成。乳液作为乳相,甲基硅油作为油相。
31、其中,步骤二中取步骤一中制备好的二氧化硅光子晶体微球,加入食人鱼溶液(按双氧水与浓硫酸7:3配制),置于室温下180rpm反应6小时,采用双蒸水清洗3次,于100℃电热鼓风干燥箱中烘2-3小时,除去多余水分;再将光子晶体微球浸泡于5%的3-氨丙基三乙氧基硅烷中,置于60℃下180rpm反应6小时,对微球进行氨基基团的修饰,再依次采用甲苯、无水乙醇、双蒸水各清洗3次,于100℃电热鼓风干燥箱中烘2-3小时,除去多余水分。
32、其中,步骤三所述光子晶体微球表面结合目标物的人工抗原时,取已经修饰好氨基的光子晶体微球于离心管中,使用pb缓冲液将人工抗原分别配置成浓度为10-80ug/ml,并加入离心管中,置于摇床中以4℃,160rpm震荡反应过夜。反应结束后,使用pb缓冲溶液清洗3-4遍以除去多余的抗原。
33、作为优选,所述pb配置的don-bsa、ota-bsa、afb1-bsa的浓度分别为10μg/ml、20μg/ml、10μg/ml。
34、其中,步骤四所述铕螯合物的ps荧光微球人工抗体标签的制备时,取10-60ul固含量1%的荧光微球,用50mm硼酸缓冲液(ph=8.0)稀释,涡旋1min,再分别加入50ul的50mg/ml edc溶液和30mg/ml nhs溶液,使最终得到体积为1ml固体含量为0.01%-0.06%的荧光微球。随后超声10min使微球分散均匀,在摇床中以37℃、220rpm活化30min。活化结束后,采用10000rpm离心12分钟,去除上清液,再加入硼酸缓冲液清洗1-2遍。复溶后定容至0.5ml,超声分散均匀后加入0.5ml提前配好的10-80μg/ml的人工抗体,放入摇床中以37℃、160rpm偶联1.5h。偶联结束后,采用10000rpm离心12分钟,去除上清液,再加入硼酸缓冲液清洗1-2遍,最后用硼酸缓冲液复溶。
35、作为优选,所述ps荧光微球的固体含量为0.03%,pb配置的don-ab、ota-ab、afb1-ab的浓度均为10μg/ml。
36、其中,步骤五免疫竞争反应时,先将150ul标签和30ul不同浓度的don标准品分别加入200ul离心管中,放入摇床中以4℃-60℃,160rpm反应5min-45min,再加入光子晶体微球,放入摇床中以4℃-60℃,160rpm反应5min-45min。
37、作为优选,反应温度为37℃,反应时间为30min。
38、其中,步骤六试纸卡的组装和检测时,利用3d打印技术设计了一条便于稳定放置光子晶体微球的卡槽,该卡槽有三条用于固定微球的间隙,分别对应试纸条的三条检测线。将经过步骤五的光子晶体微球表面经过洗涤后排列在试纸卡的检测线上,再插入时间分辨荧光仪采集微球表面的荧光信号,读取记录下荧光信号响应值,再利用origin软件数据处理工具对试纸卡采集到的光子晶体微球表面的荧光信号进行定量分析。
39、作为优选,每条检测线上平行排列3个光子晶体微球,所用激发光的激发波长为370nm。
40、进一步地,所述光子晶体微球结合改造后的时间分辨荧光试纸条经过上述处理可以在较短时间内简单高效、特异性、快速地完成同时检测多种真菌毒素。
41、本发明利用微流控自组装制备出大小均一、排列整齐、结构色一致的光子晶体微球,并在其表面修饰上基团以固定真菌毒素人工抗原,将包裹好铕螯合物且表面修饰了羧基的纳米聚苯乙烯微球用edc、nhs法活化,并将真菌毒素抗体偶联到纳米聚苯乙烯微球表面。当二者与样品中真菌毒素置于同一反应体系中,即可进行免疫竞争反应,根据微球表面结合目标物抗体标签的荧光信号变化得出线性关系,从而实现对真菌毒素的定量检测(图1)。本发明结合了免疫竞争法和时间分辨荧光的特性,检测成本低、操作简单、灵敏度高、识别率高,所需样品量少,满足快速即时检测实际样品。
42、本发明构建了一种基于光子晶体微球的时间分辨荧光免疫检测谷物中多元真菌毒素的系统和平台,现有的试纸条检测相比,该方法整个免疫竞争反应过程在溶液中进行,分子之间相互接触和反应几率更大,不仅节约了人工抗体和抗原等昂贵试剂的使用量,还提高了检测的灵敏度。本发明利用3d打印技术改造了试纸条,将单个微球的检测路径转移到了试纸条模式中,不仅简化了原本微球级别检测技术路径上的操作步骤,提高了检测效率,还实现了检测工具的无纸化及可重复利用。
43、本发明针对现有真菌毒素检测操作步骤繁琐,仪器设备昂贵,试剂消耗量大,灵敏度不够且耗时长等问题,本发明在现有报道中利用光子晶体微球为载体的单个微球级别的检测基础上,结合时间分辨荧光纳米微球材料的特点,将单个微球的检测路径转移到简单易操作的试纸条模式中,来提高了检测效率,实现了检测工具的无纸化及可重复利用。
44、本发明首先利用微流控自组装制备出大小均一、排列整齐、结构色一致的光子晶体微球,该材料具有有序孔道结构、大比表面积、灵活的表面功能化且易于修饰等优点,并且其自身没有荧光干扰,因此其独特的结构被认为是理想的载体或生物分子筛选平台,其表面非常适合来包被人工抗原,再以抗体偶联的铕螯合物荧光纳米材料为荧光探针,以及目标物三者形成竞争免疫反应体系,再通过时间分辨荧光检测仪器收集荧光信号,根据荧光信号的变化得出线性关系,从而实现对真菌毒素的定量检测。
45、本发明中同时检测是指利用固定了不同人工抗原的光子晶体微球去检测不同的毒素,将针对不同种类毒素的光子晶体微球放在不同的检测线上可以实现多元真菌毒素的同时检测,从而达到提高检测效率的目的。由于固定不同人工抗原的光子晶体微球在外貌形态上并没有差别,无法肉眼区分,因此在检测过程中需要提前分组,而试纸条的三条检测线在同一个平面内,不利于球体的固定和摆放,因此,不得不通过人为方法进行微球的固定。而利用有粘性的胶水进行粘连,但是胶水和胶带等材料容易污染微球表面,干扰荧光信号的采集,且无法重复利用。本发明采用3d打印技术自行设计并打印出灵巧、坚固的器件,为光子晶体微球的固定提供一个载体,选用植物基光敏树脂作为原材料,机械强度高、安全且耐储存,再将其安装在传统的试纸条上即可实现微球的固定。
46、传统试纸条的纸层析免疫反应发生在在nc膜,一根试纸条只能反应一次,需要提前制备大量的试纸条,且制备需要的材料较多、工序繁琐、周期也比较长。本发明改造的试纸卡仅仅是一个固定微球的器件,因此可以无限制地重复多次利用,节约了材料地成本和制备时间,而且以光子晶体微球作为反应的载体,整个免疫竞争反应过程在溶液中进行,分子之间相互接触和反应几率更大,不仅节约了人工抗体和抗原等昂贵试剂的使用量,还提高了检测的灵敏度,目前don、ota、afb1三种毒素检测结果的线性范围分别为0.01-1000ng/ml,0.1-100 ng/ml,0.01-100ng/ml,检测限分别为0.016ng/ml,0.012ng/ml,0.016ng/ml,且该方法重复性良好,检测过程简单快捷。
47、本发明重点将单个微球的检测路径转移到了试纸条简单易操作的模式中,并对试纸卡进行改造,实现了检测工具的无纸化及可重复利用。相较于传统的试纸条利用纸作为基底材料固定人工抗原,本发明采用自组装得到的表面灵活、具有独特的有序孔道结构、较大的比表面积的光子晶体微球作为基底,且整个免疫竞争反应过程在溶液中进行,分子之间相互接触和反应几率更大,不仅节约了人工抗体和抗原等昂贵试剂的使用量,还提高了检测的灵敏度;目前改造的试纸卡卡槽有三条可以固定微球的间隙,可以同时检测三个样品,后续还可以根据需求灵活增加间隙的条数去打印新的卡槽,进一步提高检测效率,且检测所用的试纸卡不需要借助纸质材料,具有可重复利用的特点,体现了绿色环保的理念。
48、在先设计中并没有利用3d打印技术去打印卡槽,只是单纯地利用市面上现有的试纸条作为载体,将光子晶体微球摆放在检测线上去收集荧光信号,但实际操作过程中微球非常容易滚动或者产生静电,不便操作,为此本发明根据微球的尺寸大小对试纸条进行了改造,打印的卡槽可以覆盖试纸条地检测区域并将光子晶体微球固定住且不干扰荧光信号。此外,初步实验过程中由于微球地直径太小使得竞争反应后表面结合地标签量过少,相对于市面上地试纸条所产生的能被捕捉到地信号强度很低,为此对光子晶体微球地直径大小以及标签浓度以及排布方式进行了优化。
49、有益效果:与现有技术相比,本发明具有如下优点:
50、(1)相较于传统的试纸条利用纸作为基底材料固定人工抗原,本发明采用了自组装得到的表面灵活、具有独特的有序孔道结构、较大的比表面积的光子晶体微球作为基底,且整个免疫竞争反应过程在溶液中进行,分子之间相互接触和反应几率更大,不仅节约了人工抗体和抗原等昂贵试剂的使用量,还提高了检测的灵敏度;
51、(2)本发明所制备的ps荧光抗体标签具有发光时间长、斯托克斯位移大、信号稳定等优点,可以延迟时间,将所需信号与背景信号分离,消除光散射并有效提高灵敏;
52、(3)本发明将单个微球的检测路径转移到了试纸条简单易操作的模式中,不仅简化了原本微球级别检测技术路径上的操作步骤,而且3d打印的植物基光敏树脂卡槽不会对检测过程造成背景荧光的干扰,且具有机械强度高、低气味、耐储存等优点;
53、(4)检测过程操作简单安全,收集信号的速度快,利用微球的摆放灵活性可实现多个微球表面信号的同时检测,大大提高了检测效率。具有成本低、检测快速、操作简单等优点,
54、(5)时间分辨荧光仪收集荧光信号结合相机拍摄的荧光成像照片使得实验结果实现数字化,并根据特异性、准确性、精密度、灵敏度和线性范围评估其性能,得出该检测方法特异性和重复性良好、灵敏度高且线性范围宽,可实现准时、现场检测的目标,广泛应用于各行业。
55、(6)本发明检测方法不需要大量的试纸条,检测用的卡槽可重复利用,相对于现有的时间分辨荧光免疫试纸条检测方法更加环保,符合可持续发展的理念。
56、(7)本发明制备系统和平台可以利用固定了不同人工抗原的光子晶体微球去检测不同的毒素,将针对不同种类毒素的光子晶体微球放在不同的检测线上可以实现同时检测(即:固定don-bsa的光子晶体微球能检测don,固定ota-bsa的光子晶体微球能检测ota,固定afb1-bsa的光子晶体微球能检测afb1,将三种微球分别放在同一个试纸卡的三条检测线上并同时去检测,一次性可以得出三个荧光信号值),从而达到提高检测效率的目的,并且检测范围宽,灵敏度高、重复性好。
本文地址:https://www.jishuxx.com/zhuanli/20241118/330336.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。