S-LAM-PCR建库方法及其应用与流程
- 国知局
- 2024-12-26 16:11:26
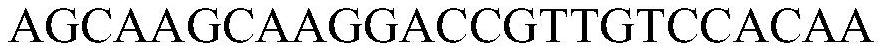
本发明涉及基因与细胞治疗产品领域,具体地,涉及s-lam-pcr建库方法及其应用。
背景技术:
1、慢病毒载体(lentivirus vector,lv)是目前在临床试验中应用较为广泛的基因治疗病毒载体之一。慢病毒是逆转录病毒的一个属,为二倍体rna病毒,因其潜伏期长而被称为慢病毒。研究表明,lv更倾向于整合到转录活跃基因的内含子中及下游区域;对转录活跃基因的转录单位有一定偏好性,但不包括转录起始单位(transcription start site,tss);lv整合位点的偏好性还会随着转导细胞的活性状态而变化,如lv均可整合在静息状态和激活状态的cd4+t细胞的活性转录单元中,但激活状态的cd4+t细胞的整合位点更常见于基因密集、cpg岛密集和g/c碱基富集的基因组区域;分裂和非分裂的啮齿动物细胞之间的整合也是有区别的,相较于非分裂细胞,自失活(self inactivating,sin)载体在分裂细胞中的整合优先发生在基因编码区域。lv在基因治疗方面表现出高效性和安全性,但半随机整合的特性仍会引发难以预料的插入突变。以慢病毒载体为递送载体的基因治疗产品,由于复杂的生物组成和特殊的作用机制,介导的遗传毒性区别于传统的遗传毒性,主要为整合插入导致细胞发生基因突变、基因失活/激活,或癌变的风险,因此其安全性评价不能完全采用化学药的传统毒理学方法。
2、整合位点分析(integration site analysis,isa)可以精确定位基因组中的插入,为评估纵向修饰基因和移植细胞群的克隆性提供了一种工具,该技术已成为整合载体系统以确定安全性和追踪整合位点的主要基准。最初病毒载体整合位点分析是经taqman实时荧光定量pcr分离扩增,用获得的扩增产物进行分子杂交实验来分析整合位点特征。由于pcr与测序技术的快速发展,操作复杂、灵敏度低的分子杂交技术逐渐被取代,下一代测序(next-generation sequencing,ngs)逐渐成为主流的整合位点分析技术。根据pcr技术路线的不同,主要有反向pcr、连接介导型(ligation-mediated,lm)pcr、线性扩增介导型(linear amplification mediated,lam)pcr。lm-pcr存在灵敏度低,面对复杂样本模板时容易丢失目标片段等缺点。
技术实现思路
1、本发明旨在建立一种高灵敏度慢病毒载体整合位点分析方法,与其他分析方法相比,实验周期缩短,灵敏度大幅度提高,能够分析复杂和微量样本。
2、本发明采用如下的技术方案:
3、本发明一方面提供一种慢病毒载体的整合位点分析方法,所述方法包括如下的步骤:
4、a)将宿主dna片段化得到线性核酸片段,所述宿主dna上包括至少一个待检测的插入位点;
5、b)将a)中所述线性核酸片段使用生物素标记引物进行线性扩增,获得线性扩增片段;
6、c)将b)中线性扩增片段捕获后进行第二链合成,得到双链合成产物;
7、d)将c)中得到的双链合成产物进行末端修复及加a并连接上接头,得到连接产物;
8、e)用一组引物和接头引物对d)中连接产物进行第一轮pcr,得到第一轮pcr产物;
9、f)用另一组引物和接头引物对第一轮pcr产物进行第二轮pcr,得到第二轮pcr产物,建立文库。
10、在一些实施方案中,所述方法还包括:
11、g)将f)中第二轮pcr产物添加特异性index,所述特异性index为p5和p7,使用与接头互补的引物进行第三轮pcr扩增,得到第三轮pcr产物,建立测序文库;所述第三轮pcr产物优选使用磁珠纯化。
12、在一些实施方案中,所述p5的核苷酸序列为aggcgaag。
13、在一些实施方案中,所述p7的核苷酸序列为caggacgt。
14、在一些实施方案中,a)中使用超声打断宿主dna。
15、在一些实施方案中,所述方法将宿主dna打断成200-500bp的片段。
16、在一些实施方案中,所述方法将宿主dna打断成200-300bp。
17、在一些实施方案中,b)中所述生物素标记引物为5-ltr1-r,所述5-ltr1-r具有如seq id no:2所示的核苷酸序列。
18、生物素标记引物是一种在分子生物学实验中常用的工具,可以用来检测、定位和分离特定的核酸或蛋白质。生物素标记引物的原理是利用生物素与亲生素之间的高度特异性结合。生物素(biotin)是一种小分子化合物,与维生素h同属于b族维生素。生物素标记引物通常是通过在引物的末端(例如5’端)或内部加入生物素分子,使得引物与生物素之间形成稳定的结合。
19、在一些实施方案中,所述线性扩增40-60个循环。
20、在一些实施方案中,所述线性扩增50个循环。
21、在一些实施方案中,c)中使用链霉亲和素磁珠对b)中的线性扩增片段进行捕获;和/或,第二链合成使用随机引物。
22、在一些实施方案中,d)中所述接头为y型不对称接头。市售y型接头都可实现。
23、在一些实施方案中,e)中所述引物为5-ltr1-r,所述5-ltr1-r具有如seq id no:2所示的核苷酸序列;和/或,
24、e)中所述接头引物为yn-4,所述yn-4具有seq id no:3所示的核苷酸序列。
25、在一些实施方案中,所述第一轮pcr扩增20-50个循环。
26、在一些实施方案中,所述第一轮pcr扩增35个循环。
27、在一些实施方案中,f)中所述引物为5-ltr2-r,所述5-ltr2-r具有如seq id no:4所示的核苷酸序列;和/或,
28、所述方法f)中所述接头引物为yn-5,所述yn-5具有如seq id no:5所示的核苷酸序列;和/或,
29、f)中所述第二轮pcr产物还包括使用磁珠纯化。
30、磁珠纯化:添加接头后的文库体系中含有聚合酶、连接酶等各种酶以及辅助物质,接头的添加也是过量的,而且由于末端的不稳定性,容易形成自连片段,鸟枪法打断的片段中也可能有大片段存在,所以需要特殊磁珠(ampure xp beads)纯化来去除大片段以及各种杂质,从而获得成功添加接头的文库片段。
31、在一些实施方案中,所述第二轮pcr扩增5-10个循环。
32、在一些实施方案中,所述第二轮pcr扩增8个循环。
33、在一些实施方案中,所述方法包括如下的步骤:
34、a)提取宿主基因组dna,使用超声打断仪将前述基因组dna打断成200~500bp的片段;
35、s200.以步骤s100的片段化基因组作为模板,使用线性扩增生物素化引物5-ltr1-r进行线性扩增,50个循环,第一次富集整合目标序列;
36、s300.使用链霉亲和素磁珠对步骤s200的线性扩增产物进行捕获,并使用随机引物进行第二链合成;
37、s400.对步骤s300的第二链合成产物进行末端修复及加a,连接y型不对称接头;
38、s500.以步骤s400的产物作为模板,使用第一轮生物素化引物5-ltr1-r、接头引物yn-4,第二次富集整合目标序列;
39、s600.以步骤s500的pcr产物作为模板,使用第二轮引物5-ltr2-r、接头引物yn-5,第三次富集整合目标序列;
40、s700.引入测序平台的测序引物结合序列;
41、s800.对步骤s700的pcr产物上机测序;
42、s900.根据测序数据判断慢病毒载体整合事件。
43、本发明另一方面提供一种慢病毒载体整合位点分析的方法,所述方法包括:
44、提供一种通过上述的方法得到的测序文库;
45、对所述测序文库进行高通量测序,得到测序数据;
46、将测序结果与宿主dna的原始序列进行比对,以确定经修饰核酸在宿主dna中的整合位点。
47、上述慢病毒载体的整合位点分析的应用,用于对以慢病毒载体为递送载体的基因与细胞治疗药物的安全性评价。
48、在一些实施方案中,所述高通量测序为将测序文库投入illumina测序仪进行高通量测序。
49、在一些实施方案中,根据确定的整合位点判断以慢病毒载体为递送载体的基因与细胞治疗药物的安全性。
50、判断标准如下:当整合到原癌基因上,判断为突变的风险大;当整合到该基因上或附近或外显子区域,判断为有整合风险。
51、在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
52、本发明所用试剂和原料均市售可得。
53、本发明的积极进步效果在于:
54、通过上述技术方案,本发明提供的整合位点分析方法,通过使用超声打断克服了酶切打断的偏好性,使用pcr扩增试剂盒及减少线性扩增循环数以缩短试验周期,线性扩增及两轮巢式pcr提高了本方法的灵敏度,并采用who的nibsc标准品对本方法进行了验证。
本文地址:https://www.jishuxx.com/zhuanli/20241216/348619.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。