1.本发明涉及一种类人胶原蛋白重组毕赤酵母工程菌的构建和蛋白快速纯化方法,属于生物技术和基因工程领域。
背景技术:
2.胶原蛋白是广泛分布于动物组织中的重要结构蛋白,广泛分布于动物的皮、骨、韧带、肌腱和血管等结缔组织中,具有支撑器官、保护机体等作用。胶原蛋白因其具有独特的结构特征,良好的物理性能、生物降解性和生物相容性,在医药、食品、化妆品、组织工程和材料工程等领域有广泛应用。胶原结构是均质三聚体,具有三螺旋结构,其中1/4是异源三聚体的形式存在,剩下的是同源三聚体的形式。其多肽链主要的氨基酸主要由甘氨酸gly(33%)、脯氨酸pro和羟脯氨酸hyp(22%)组成,大部分胶原蛋白的氨基酸特征为gly-xaa-yaa的重复氨基酸序列。这些链被卷成一个左旋螺旋,每一圈有三个氨基酸(二级结构)。这些链互相缠绕成三螺旋状,形成刚性结构(三级结构),其四级结构属于超级螺旋结构。由于相邻链上甘氨酸之间的分子内氢键,这种胶原蛋白结构非常稳定。
3.目前胶原蛋白主要从动物组织中提取和利用基因工程改造的微生物菌株表达两种途径获得。从畜禽动物组织及海洋生物(畜禽骨头、猪皮、东北林蛙皮、制革厂鞣前处理的皮边角料、海参、鱼鳞、鱼皮)中提取天然胶原蛋白及胶原肽,虽然过程简便,但是存在问题:1)提取效率较低,且提取的胶原蛋白纯度一般不高,含有较多杂质。2)受到提取工艺的限制,提取的胶原蛋白分子量在500da以上,再小的胶原蛋白很难提取出来。3)不同提取工艺尤其是酸法、碱法提取胶原蛋白时,会对环境造成污染,无法完全达到绿色提取。采用基于基因工程改造的微生物菌株生产重组胶原蛋白相较于传统的提取方法来说,具有很多优势:1)产品安全,生产过程可控。原料相对明确,成分清晰,减少了病毒感染等污染风险。2)产品质量稳定,批次重复性好。采用基因工程技术表达特定的胶原蛋白分子,其成分单一,且菌株稳定性好,生产批次间差异小,产品质量稳定。3)生物相容性好,减少不必要的免疫反应。以工程菌为基础生产得到的胶原蛋白进行后续的研究,发现其免疫排异行较强,不会带来动物提取所造成的潜在免疫反应。
4.目前,类人胶原蛋白大多采用大肠杆菌作为表达宿主进行异源表达,但是其表达量会受到限制,无论是胞内表达还是分泌到胞外表达,其蛋白组分复杂,纯化过程较久。并且胶原蛋白由于其三螺旋结构的特殊性,在具有生物功能的同时也更容易降解。因此如何保证纯化过程的快速,减少纯化步骤和总时长,对于维持胶原蛋白结构的完整性很重要,同时更容易满足工业需求。本研究从提高胶原蛋白表达量及简化纯化步骤出发,构建产生重组类人胶原蛋白的毕赤酵母重组工程菌,并利用硫酸铵和透析的方式除去大多数杂蛋白,以达到快速纯化的目的。
技术实现要素:
5.本发明的目的在于提供一株可以稳定产生重组类人胶原蛋白的毕赤酵母重组工程菌,并同时提供其高效的表达方法。
6.本发明的第一个目的是提供一种编码类人胶原蛋白的基因,包括seq id no.2所示的核苷酸序列。
7.本发明的第二个目的是提供一种重组载体,含有如seq id no.2所示的编码类人胶原蛋白的基因。
8.在本发明的一种实施方式中,所述载体包括ppic9k。
9.本发明的第三个目的是提供一种重组菌,含有如seq id no.2所示的编码类人胶原蛋白的基因或上述重组载体。
10.在本发明的一种实施方式中,所述重组菌的表达载体为ppic9k。
11.在本发明的一种实施方式中,所述重组菌的宿主为毕赤酵母gs115。
12.本发明的第四个目的是提供一种快速制备高纯度重组胶原蛋白的方法,所述方法为利用上述重组菌发酵制备发酵上清液,在发酵上清液中添加硫酸铵i处理,取上清再加入硫酸铵ii处理,离心收集沉淀并进行透析,取上清获得高纯度重组胶原蛋白。
13.在本发明的一种实施方式中,所述硫酸铵i的终浓度为15-25%,所述硫酸铵ii的终浓度为55-65%。
14.在本发明的一种实施方式中,所述硫酸铵i的终浓度为20%,所述硫酸铵ii的终浓度为60%。
15.在本发明的一种实施方式中,所述硫酸铵i处理的时间至少6h,所述硫酸铵ii处理的时间至少8h,
16.在本发明的一种实施方式中,所述透析的次数至少4次。
17.在本发明的一种实施方式中,所述透析的大小为8-10kda。
18.在本发明的一种实施方式中,所述透析的缓冲液为超纯水。
19.在本发明的一种实施方法中,所述硫酸铵处理和透析均在冰浴中进行。
20.在本发明的一种实施方式中,所述发酵为摇瓶发酵或发酵罐发酵。
21.在本发明的一种实施方式中,所述摇瓶发酵为先将上述重组菌接种于ypd培养基中活化,将活化后的菌液接种于bmgy培养基中培养获得菌液,离心收集菌体并重悬于bmmy培养基中,甲醇诱导培养获得发酵液。
22.在本发明的一种实施方式中,所述发酵罐发酵为将上述重组菌接种于初始培养基中活化,将活化后的菌液接种于含有发酵培养基的发酵罐中采用do-搅拌偶联模式进行发酵生产。
23.在本发明的一种实施方式中,将活化后的菌液以1-20%(v/v)的接种量接种于2l发酵培养基中。
24.在本发明的一种实施方式中,初始搅拌转速300rpm,通气量为1-3vvm,控制ph 5.0-5.5,生长期培养温度为30℃。
25.在本发明的一种实施方式中,当do快速上升时流加甘油,当湿菌体质量为180-210g/l时,饥饿培养2-3h开始流加甲醇,甲醇流加速度为1-7ml/l/h,通气量为2-3vvm,温度为20~24℃。
26.本发明还提供上述基因,或上述重组载体,或上述重组菌,或上述方法在医药、食品、化妆品、组织工程和材料工程领域中的应用。
27.本发明还提供上述基因,或上述重组载体,或上述重组菌,或上述方法在制备重组胶原蛋白或胶原蛋白水解肽所需的生物材料、化妆品或添加剂中的应用。
28.本发明的有益效果:
29.本发明构建了可以产重组胶原蛋白的重组毕赤酵母菌株,相较于现有的大肠杆菌表达菌株,其表达量更高,可以达到2.33g/l,并可以实现胞外表达。此外,本发明提供了一种快速大量纯化重组胶原蛋白的方法,通过不同浓度硫酸铵处理和透析结合的方法,简单快速且成本低廉,为重组胶原蛋白工业化生产和应用奠定了基础。本发明可以获得溶液状态和干粉状态的类人胶原蛋白,适用于不同的需求和研究。
附图说明
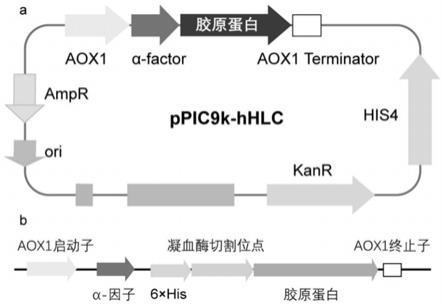
30.图1:重组表达载体的构建。a为重组表达载体ppic9k-hhlc质粒图谱;b为胶原蛋白在毕赤酵母中的表达框。
31.图2:重组毕赤酵母经诱导表达后发酵液的重组胶原蛋白sds-page检测结果。
32.图3:重组毕赤酵母在5-l发酵罐中发酵上清的重组胶原蛋白sds-page检测结果。
33.图4:重组胶原蛋白摇瓶发酵液经纯化后采用分子筛凝胶柱检测其纯度。
34.图5:重组胶原蛋白冻干粉末的水溶液的圆二色谱图。
35.图6:重组胶原蛋白sds-page检测结果;a为带n-端肽序列的重组类人胶原蛋白,b为去掉n-端肽序列的重组类人胶原蛋白。
36.图7:重组毕赤酵母km71在5-l发酵罐中发酵液上清的不含n-端肽的重组胶原蛋白及样品复溶后的sds-page检测结果。
具体实施方式
37.以下结合说明书附图和具体实施例来说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备均为本技术领域的常规试剂、方法和设备。
38.下述实施例中涉及到的培养基如下:
39.培养基均使用去离子水配制,配制完成后121℃灭菌15~20min。
40.lb培养基:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l。加入20g/l琼脂粉,以配制lb固体培养基。
41.ypd培养基:蛋白胨20g/l,酵母粉10g/l,葡萄糖20g/l。加入20g/l琼脂粉,以配制ypd固体培养基。
42.md培养基:去离子水798ml/l,加入20g/l琼脂粉;倒板前加入体积分数10%的10
×
ynb酵母基础氮源母液,体积分数10%的10
×
ynb酵母基础氮源母液,葡萄糖20g/l,以配制md固体培养基。
43.bmgy培养基:蛋白胨20g/l,酵母粉10g/l,甘油20g/l,50mmol/l的磷酸钾缓冲溶液,体积分数10%的10
×
ynb酵母基础氮源母液,生物素4
×
10-4
g/l。
44.bmmy培养基:蛋白胨20g/l,酵母粉10g/l,甲醇10g/l,50mmol/l的磷酸钾缓冲溶
液,体积分数10%的10
×
ynb酵母基础氮源母液,生物素4
×
10-4
g/l。
45.罐上培养基:85%h3po
4 26.7ml/l;caso4·
2h2o 1.175g/l;k2so
4 18.2g/l;mgso4·
7h2o 14.9g/l;koh 4.13g/l;甘油40.0g/l;ptm1 4.35ml/l。培养基灭菌后用氨水调ph至5.2;其中,ptm1为微量元素,每升溶液中含如下成分:cuso4·
5h2o 6.0g;nai 0.08g;mnso4·
h2o 3.0g;na2moo4·
2h2o 0.2g;硼酸0.02g;cocl
2 0.5g;zncl
2 20.0g;feso4·
7h2o 65.0g;生物素0.2g;硫酸5.0ml。补料流加50%甘油和分析纯甲醇。
46.实施例1 重组表达载体ppic9k-hhlc的构建
47.基于seq id no:1序列进行密码子优化,得到类人胶原蛋白的编码基因序列seq id no:2,回避saci和sali酶切位点,以免影响后续转化到毕赤酵母中。该序列含有过多重复序列,采用pcr扩增的方式不是很容易,故在序列两端设计了两套酶切位点(n端添加ecori和sacii酶切位点,c端添加paci和noti酶切位点)以便于将该序列构建到不同的表达载体上。委托苏州金唯智生物科技有限公司对seq id no:2序列进行全基因合成。
48.将所述合成的全基因序列seq id no:2通过ecori和noti两个酶切位点整合到ppic9k载体上,通过热激方法转化到宿主菌株e.coli top10中,以氨苄青霉素为抗性,筛选并挑取阳性克隆子,用含氨苄青霉素的lb液体培养基进行培养。采用质粒小提试剂盒提取质粒,得到重组表达载体ppic9k-hhlc(图1)。
49.实施例2 重组基因工程菌株的构建
50.通过saci限制性内切酶在37℃条件下切割1h线性化处理实施例1中的重组表达载体ppic9k-hhlc,并利用pcr纯化试剂盒对线性化片段进行纯化和回收得ppic9k-hhlc线性化片段。将纯化后的ppic9k-hhlc线性化片段转入毕赤酵母gs115感受态细胞,并涂布于md平板上,在30℃静置培养3-5天。挑选阳性克隆子到含不同浓度g418的ypd平板上,置于30℃培养3-5天,挑选在不同浓度均可生长的阳性克隆子进行诱导表达,获得多拷贝数的重组毕赤酵母工程菌。具体方法如下:
51.1)接种ypd平板活化的毕赤酵母gs115于25mlypd培养基/250ml三角瓶,30℃过夜培养;以体积比1%的接种量将培养液接种于50mlypd培养基/500ml三角瓶,培养菌体至菌体浓度od
600
为1.3~1.5;
52.2)5000rpm,4℃离心10min收集菌体,分别用50ml 1m d-山梨醇溶液悬浮细胞2-3次,并在5000rpm,4℃条件下离心10min,收集菌体;
53.3)使用500μl 1m d-山梨醇溶液悬浮上述细胞,每1.5ml ep管分装80μl,即制备完成用于电击转化的感受态细胞;
54.4)将20μlppic9k-hhlc线性化片段与上述80μl感受态细胞混合,冰上静置15min;
55.5)将混合物加入预冷的无菌电转化杯(1mm),在1800v、25f、200ω条件下电击,电击后立刻加入900μl冰上预冷的1m d-山梨醇溶液,置于30℃,220rpm复苏1h;
56.6)将复苏后的菌悬液在4000rpm,4℃离心10min,吸去上清液至100-150μl,重悬菌体并涂布于md固体平板上,30℃培养3-5天;
57.7)挑取md固体平板上的白色菌落,筛选正确的转化子。分别点种在含有1、2、3、4mg/ml g418的ypd平板中,挑选在4mg/ml g418的ypd平板中的单菌落用于250ml摇瓶发酵。
58.实施例3 重组毕赤酵母摇瓶发酵
59.挑取在4mg/ml g418的ypd平板中生长的高拷贝转化子gs115/ppic9k-hhlc,接种
于含有50mlypd的250ml三角瓶中,30℃,220rpm条件下培养16-20h,获得菌种活化液。取500μl菌种活化液加入到50mlbmgy培养基中,在30℃,220rpm条件下培养至菌悬液od
600
为2-6,5000rpm离心10min,收集菌体并重悬于bmmy培养基中,使其od稀释到1左右。将重悬后的菌悬液置于28℃,220rpm条件下进行诱导表达,每24h补充终浓度为0.5%(v/v)的甲醇以持续诱导。经甲醇诱导培养72h-96h后,5000rpm离心10min,并收集上清。用sds-page检测发酵上清中蛋白表达情况(图2),在28kda左右有明显条带,符合蛋白的预测分子量(26.02kda)。但是在诱导72h后,蛋白可能被发酵液中的蛋白酶水解掉,其含量减少。
60.实施例4 5-l发酵罐发酵
61.将gs115/ppic9k-hhlc单菌落接种于200ml ypd培养基中,30℃,220rpm条件下培养16-20h获得种子培养液。在5-l发酵罐上采用do-搅拌偶联模式进行发酵生产,将种子培养液按体积比10%接种于2l罐上培养基中进行培养,初始转速300rpm,进行do-搅拌偶联模式下进行,最高转速为800rpm;通气量为2vvm;生长期培养温度为30℃,菌株生长过程补加氨水维持发酵液ph稳定在5.2。当do快速上升时补加50%甘油,当湿菌体质量为180-210g/l时,停止流加甘油并使保持菌株饥饿状态2-3h后,将发酵罐温度调到22℃,进入甲醇诱导阶段,并维持到诱导表达结束。诱导过程中甲醇补充采用分阶段流加方式,从1ml/l/h低速开始流加甲醇,使其最终流速为6-7ml/l/h,do维持在20%左右,do-搅拌偶联模式,设置转速下限为300rpm,上限为800rpm,通气量为2.5vvm,温度下降至22℃,连续培养96-108h后,发酵液在5000rpm条件下离心30min,收集发酵上清液。
62.用sds-page检测上清中重组胶原蛋白的表达,结果如图3所示,在28kda附近有明显条带,且随着诱导时间的增加,条带逐渐变粗,蛋白含量逐渐增加,最终可达2.33g/l。
63.实施例5 胶原蛋白快速纯化
64.在冰浴条件下,加入终浓度为20%硫酸铵对实施例4中收集的发酵上清液沉淀6-8h后,在10000rpm条件下离心5min,取上清除去杂蛋白。再在上清中加入硫酸铵使其终浓度为60%,沉淀8-12h,10000rpm条件下离心5min,获得重组胶原蛋白的硫酸铵沉淀。
65.将重组蛋白硫酸铵沉淀溶于超纯水中,并加入8-10kda的透析袋中,在冰浴条件下于超纯水中进行透析,每4-6h换一次超纯水(透析液),共换4-6次以除去硫酸铵离子及小分子肽和化合物。
66.将透析好的重组胶原蛋白溶液置于室温条件下离心,以除去前面阶段的杂质(如细胞破碎物等)和不溶于水的杂蛋白等成分。将重组胶原蛋白溶液采用合适的容器置于超低温冰箱中进行预冻,并用冷冻干燥机获得冻干后的重组胶原蛋白样品。
67.将冻干粉末重新溶于超纯水中,通过akta蛋白纯化仪,采用hiload 26/600 superdex 200pg(prep grade)分子筛凝胶柱对蛋白纯度进行检测,结果如图4所示,通过该方法获得的蛋白纯度可达95%以上。
68.实施例6 胶原蛋白圆二色谱检测
69.圆二色谱可以检测胶原蛋白的三螺旋结构。将冻干后的重组胶原蛋白样品重新溶解到超纯水中,配制成浓度1mg/ml的溶液。采用圆二色谱仪对样品进行紫外区的扫描。将样品加入仪器专用比色皿中,进行全波长扫描,扫描范围190-260nm,每步间隔1nm,每个点停留时间约0.07s。每个样品重复扫描3次,得到重组胶原蛋白的全波长扫描图谱。经过去除基线、求平均值和光滑处理,结果如图5所示,在200nm以下,198nm处有曲线的最小峰值,表明
本发明中胶原蛋白样品具有三螺旋结构特征。
70.本发明可以快速制备获得纯度高的胶原蛋白样品,且能保持蛋白的三螺旋结构。
71.对比例1:
72.根据实施例1和实施例2的方法构建表达编码类人胶原蛋白的基因(核苷酸序列如seq id no.3)的重组菌株gs115/ppic9k-n。相比核苷酸序列如seq id no.2所示的编码类人胶蛋白基因,核苷酸序列如seq id no.3所示的编码类人胶原蛋白的基因n端缺少端肽序列(mhhhhhhlvprgs)。
73.根据实施例3的方法利用重组菌株gs115/ppic9k-n进行摇瓶发酵,收集在摇瓶发酵条件下不同诱导时间的发酵上清液,并进行sds-page,结果如图6所示,当表达不含n-端肽的类人胶原蛋白在诱导表达48h就发生降解,严重影响类人胶原蛋白的积累和产量。
74.对比例2:
75.利用实施例1和实施例2的方法,构建表达编码类人胶原蛋白的基因(核苷酸序列如seq id no.3)的重组质粒ppiczαa-hlc,并根据实施例2的方法将重组质粒转化到毕赤酵母km71中构建不含n-端肽的胶原蛋白的重组菌株km71/ppiczαa-hlc。根据实施例4的方法将重组菌株km71/ppiczαa-hlc接种至5-l发酵罐中进行发酵培养,区别在于在罐上培养基中补充组氨酸25g/l。根据实施例5的方法进行纯化。
76.根据检测,发酵罐发酵制备的发酵上清液中蛋白产量可达2.56g/l,但是通过硫酸铵沉淀、透析并冻干的样品再次复溶时发生降解。甲醇诱导发酵过程中上清液及最终样品复溶的sds-page蛋白电泳结果如图7所示。表明n-端肽(mhhhhhhlvprgs)对于维持重组胶原蛋白的稳定性有重要作用。
77.虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。