cd8结合剂及其用途
1.与相关申请的交叉参考本技术要求于2019年9月4日提交的美国临时申请no. 62/895,865的优先权,其内容整体引入本文作为参考。
2.在ascii文本文件上的序列表的提交以下在ascii文本文件上提交的内容整体引入本文作为参考:序列表的计算机可读形式(crf)(文件名:146392049240seqlist.txt,记录的日期:2020年8月19日,大小:14 kb)。
技术领域
3.本技术涉及基于抗-cd8 vhh结构域的cd8结合剂和使用这种cd8结合剂用于体内对cd8
t-细胞成像的方法。
背景技术:
4.肿瘤组织中免疫细胞的数目、类型和空间分布的表征可以提供有关癌症诊断、预后、疗法选择和对疗法的反应的关键信息。具体而言,cd8
细胞毒性淋巴细胞已一贯地被报道为在各种癌症中具有诊断和预后意义。目前检测cd8
细胞的方法需要从外周血或感兴趣的组织中分离细胞。这种取样方法容易出错,并且不提供反映体内cd8
细胞数目、定位和运动的动态信息。一种用于体内检测免疫细胞的示例性无损伤的方法是使用放射性标记的示踪物的正电子发射体层摄影术(pet)。然而,这种示踪物的使用受到放射性同位素半衰期和细胞分裂的限制,这导致体内探针稀释。因此,本领域仍然需要用于监控体内cd8
细胞的数量和时间分布的变化的方法和试剂。
技术实现要素:
5.本文提供了cd8结合剂,其包含重链抗体的重链的可变结构域(vhh结构域),其中所述cd8结合剂以约1nm或更小的kd特异性结合人cd8。在一些实施方案中,cd8结合剂以约500 pm或更小、约250 pm或更小或约100 pm或更小的kd特异性结合人cd8。在一些实施方案中,cd8结合剂以约132 pm或约50 pm的kd特异性结合人cd8。在一些实施方案中,cd8结合剂以约0.002/s或更小或约0.001/s或更小的k
off
结合人cd8。在一些实施方案中,cd8结合剂以约0.0018/s或约0.00085/s的k
off
结合人cd8。在一些实施方案中,cd8结合剂以约1 nm或更小的kd结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约500 pm或更小、约250 pm或更小或约150 pm或更小的kd结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约344 pm或约137 pm的kd结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约0.004/s或更小或约0.002/s或更小的k
off
结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约0.0037/s或约0.0019/s的k
off
结合食蟹猴cd8。在一些实施方案中,cd8结合剂具有至少约30分钟,例如至少约1小时、2小时或更长的cd8-结合半衰期(例如,在体外结合测定中)。在一些实施方案中,cd8结合剂以约1nm或更小的kd特异性结合恒河猴cd8。在一些实施方案中,cd8结合剂不结合小鼠或大
鼠cd8。
6.在根据(或如应用于)任何上述实施方案的一些实施方案中,cd8结合剂不刺激或抑制cd8
t细胞的活化。在一些实施方案中,cd8结合剂不诱导cd8
t细胞增殖。在一些实施方案中,cd8结合剂不结合cd4
t细胞。
7.在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域是骆驼科动物vhh,例如家羊驼vhh。在一些实施方案中,vhh结构域是嵌合的。在一些实施方案中,vhh是人源化的。在一些实施方案中,vhh是亲和力成熟的。
8.在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域特异性结合包含arg25、lys42、gln44、val45、leu46、leu47、ser48、pro50、thr51、ser52、gln75、arg93、leu94、gly95、asp96和thr97的人cd8α表位,其中氨基酸编号根据seq id no: 13。在一些实施方案中,人cd8α表位中的氨基酸残基在离与人cd8α结合的cd8结合剂或vhh结构域的晶体结构中的vhh结构域的一个或多个氨基酸残基约4.5
ꢀå
以内。
9.在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含包含seq id no: 6或7的氨基酸序列的互补性决定区(cdr)1;包含seq id no: 8或9的氨基酸序列的cdr2;以及包含seq id no: 10-12中任一项的氨基酸序列的cdr3。
10.在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 8的氨基酸序列的cdr2和包含seq id no: 10的氨基酸序列的cdr3。在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。
11.在根据(或如应用于)任何上述实施方案的一些实施方案中,其中vhh结构域包含l49a,其中编号根据kabat编号。在一些实施方案中,可以使用a蛋白亲和层析纯化cd8结合剂。
12.在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含一个或多个氨基酸修饰,其选自v89t取代、t110q取代、s112q取代和在位置114添加a(在下文中称为“a114添加”),其中编号根据kabat编号。在一些实施方案中,vhh结构域包含v89t取代、t110q取代、s112q取代和a114添加,其中编号根据kabat编号。在一些实施方案中,cd8结合剂不结合接受cd8结合剂的主体中预先存在的抗-vhh抗体。
13.在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含seq id no: 1的氨基酸序列。在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含seq id no: 2的氨基酸序列。在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含seq id no: 3的氨基酸序列。在根据(或如应用于)任何上述实施方案的一些实施方案中,vhh结构域包含seq id no: 4的氨基酸序列。
14.本文还提供了分离的核酸,其编码根据(或如应用于)任何上述实施方案的cd8结
合剂。在一些实施方案中,提供了表达载体,其包含根据(或如应用于)任何上述实施方案的核酸。在一些实施方案中,提供了包含根据(或如应用于)任何上述实施方案的核酸或表达载体的宿主细胞。在一些实施方案中,宿主细胞是真核细胞,例如哺乳动物细胞,例如cho细胞或expi293细胞。在一些实施方案中,宿主细胞是原核细胞,例如大肠杆菌(e. coli)细胞。
15.本文进一步提供了制备根据(或如应用于)任何上述实施方案的cd8结合剂的方法,所述方法包括:a)在其中产生试剂的条件下培养根据(或如应用于)任何上述实施方案的宿主细胞;和b)回收由宿主细胞产生的cd8结合剂。
16.在根据(或如应用于)任何上述实施方案的一些实施方案中,cd8结合剂包含标记。包含标记的cd8结合剂在本文中称为“标记的cd8结合剂”。
17.在一些实施方案中,提供了制备标记的cd8结合剂的方法,包括将螯合部分缀合至根据(或如应用于)任何上述实施方案的cd8结合剂的vhh结构域以提供缀合物,和使所述缀合物与包含
18
f的氟化铝复合物接触以提供标记的cd8结合剂,其中螯合部分是式(i)的化合物:。
18.在一些实施方案中,缀合物与氟化铝复合物在有一种或多种抗氧化剂化合物例如甲硫氨酸和/或n-乙酰-色氨酸的情况下接触。
19.本文提供了标记的cd8结合剂,其包含与标记缀合的根据(或如应用于)任何上述实施方案的抗-cd8 vhh结构域。在一些实施方案中,标记是荧光染料、放射性核素或酶。在根据(或如应用于)任何上述实施方案的一些实施方案中,标记是放射性核素。在一些实施方案中,放射性核素是
18
f、
89
zr、
99m
tc、
67
ga、
68
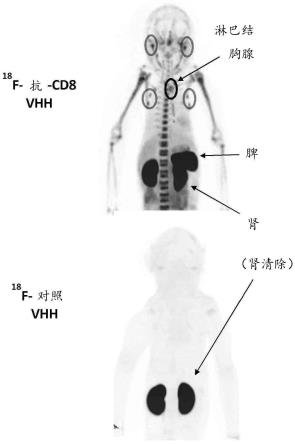
ga、
64
cu、
52
mn、
111
in或
124
i。在一些实施方案中,vhh结构域通过螯合部分与标记缀合。在一些实施方案中,螯合部分通过赖氨酸残基与vhh结构域共价连接。在一些实施方案中,标记与金属形成复合物,其中所述复合物被螯合部分螯合。在一些实施方案中,标记是
18
f并且金属是铝。在一些实施方案中,螯合部分是式(i)的化合物。
20.本文提供了标记的cd8结合剂,其包含抗-cd8 vhh结构域,所述结构域包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3,其中vhh结构域通过螯合部分与放射性核素(例如,
18
f)缀合。在一些实施方案中,螯合部分是式(i)的化合物,并且放射性核素是与铝复合的
18
f。在一些实施方案中,vhh结构域包含seq id no: 3的氨基酸序列。
21.本文提供了标记的cd8结合剂,其包含抗-cd8 vhh结构域,所述结构域包含包含
seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3,其中vhh结构域通过螯合部分与放射性核素(例如,
18
f)缀合。在一些实施方案中,螯合部分是式(i)的化合物,并且放射性核素是与铝复合的
18
f。在一些实施方案中,vhh结构域包含seq id no: 4的氨基酸序列。
22.本文还提供了药物组合物,其包含根据(或如应用于)任何上述实施方案的cd8结合剂(包括标记的cd8结合剂)和药学上可接受的载体。
23.本文进一步提供了根据(或如应用于)任何上述实施方案的cd8结合剂(包括标记的cd8结合剂)用于治疗或诊断主体的疾病或状况的用途,以及根据(或如应用于)任何上述实施方案的cd8结合剂(包括标记的cd8结合剂)在制备用于治疗或诊断主体的疾病或状况的药物中的用途。
24.本文进一步提供了药物制剂,其包含根据(或如应用于)任何上述实施方案的cd8结合剂(包括标记的cd8结合剂)和一种或多种抗氧化剂化合物。在一些实施方案中,一种或多种抗氧化剂化合物是甲硫氨酸和/或n-乙酰色氨酸。在一些实施方案中,药物制剂包含甲硫氨酸和n-乙酰色氨酸。在一些实施方案中,药物制剂进一步包含组氨酸和蔗糖。
25.本文提供了检测主体中cd8
细胞的方法,所述方法包括:a)向主体施用根据(或如应用于)任何上述实施方案的标记的cd8结合剂;和b)检测标记的cd8结合剂与主体中的cd8
细胞的结合,其中所述结合的检测表明存在cd8
细胞。在一些实施方案中,检测标记的cd8结合剂与主体中的cd8
细胞的结合包括对主体中的cd8
细胞进行成像。在一些实施方案中,对主体中的cd8
细胞进行成像包括对主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。在一些实施方案中,cd8
细胞是cd8
t细胞。在一些实施方案中,cd8
细胞是cd8 肿瘤细胞。在一些实施方案中,检测在施用后约1天或更短时间内(例如,约6小时、4小时、2小时、90分钟、1小时、30分钟或更短时间内)进行。在一些实施方案中,所述方法重复一次或多次,例如每年约1至4次。在一些实施方案中,在预先施用cd8结合剂后约1天后重复所述方法。在一些实施方案中,所述方法重复不止1年。在一些实施方案中,所述方法具有约1 nm至约30 nm的灵敏度。在一些实施方案中,主体是人或非人灵长类动物。在一些实施方案中,主体是食蟹猴或恒河猴。在一些实施方案中,主体是人。在一些实施方案中,主体患有癌症。在一些实施方案中,主体患有自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病。
26.本文提供了预测患有癌症的主体对免疫治疗剂、细胞治疗或癌症疫苗的反应性的方法,所述方法包括:a)向主体施用根据(或如应用于)任何上述实施方案的标记的cd8结合剂;和b)检测标记的cd8结合剂与主体中肿瘤组织中的cd8
t细胞的结合,其中所述结合的检测表明主体很可能对免疫治疗剂、细胞治疗或癌症疫苗有反应。在一些实施方案中,检测标记的cd8结合剂与主体中的cd8
细胞的结合包括对主体中的cd8
细胞进行成像。在一些实施方案中,对主体中的cd8
细胞进行成像包括对主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。在一些实施方案中,所述方法进一步包括以下步骤:(c)向在其中已检测到结合的主体施用治疗有效量的免疫治疗剂、细胞治疗或癌症疫苗。在一些实施方案中,检测在施用后约1天或更短时间内(例如,约6小时、4小时、2小时、90分钟、1小时、30分钟或更短时间内)进行。在一些实施方案中,所述方法重复一次或多次,例如每年约1至4次。在一些实施方案中,在预先施用cd8结合剂后至少1天
后重复所述方法。在一些实施方案中,所述方法重复不止1年。
27.本文还提供了监控患有癌症的主体的疾病进展的方法,所述方法包括:a)向主体施用根据(或如应用于)任何上述实施方案的标记的cd8结合剂,和b)在第一时间点和第二时间点检测标记的cd8结合剂与主体中肿瘤组织中cd8
t细胞的结合。在一些实施方案中,检测标记的cd8结合剂与主体中的cd8
细胞的结合包括对主体中的cd8
细胞进行成像。在一些实施方案中,对主体中的cd8
细胞进行成像包括对主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。在一些实施方案中,所述方法进一步包括以下步骤:(c)向主体施用治疗有效量的免疫治疗剂、细胞治疗或癌症疫苗,其中在第二时间点肿瘤组织中cd8
t细胞的水平高于在第一时间点肿瘤组织中cd8
t细胞的水平。在一些实施方案中,检测在施用后约1天或更短时间内(例如,约6小时、4小时、2小时、90分钟、1小时、30分钟或更短时间内)进行。在一些实施方案中,所述方法重复一次或多次,例如每年约1至4次。在一些实施方案中,在预先施用cd8结合剂后至少1天后重复所述方法。在一些实施方案中,对所述主体监控不止1年。
28.本文提供了监控患有癌症的主体中的治疗进展的方法,所述主体已经或正在接受免疫治疗剂、细胞治疗或癌症疫苗,所述方法包括:i)连同所述免疫治疗剂、细胞治疗或癌症疫苗一起向主体施用根据(或如应用于)任何上述实施方案的标记的cd8结合剂,和ii)在第一时间点和第二时间点检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。在一些实施方案中,检测标记的cd8结合剂与主体中的cd8
细胞的结合包括对主体中的cd8
细胞进行成像。在一些实施方案中,对主体中的cd8
细胞进行成像包括对主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。在一些实施方案中,标记的cd8结合剂在免疫治疗剂、细胞治疗或癌症疫苗之前施用,其中第一时间点在标记的cd8结合剂的施用之后和免疫治疗剂、细胞治疗或癌症疫苗的施用之前,并且其中第二时间点在免疫治疗剂、细胞治疗或癌症疫苗的施用之后。在一些实施方案中,在标记的cd8结合剂之前施用免疫治疗剂、细胞治疗或癌症疫苗,其中第一时间点在免疫治疗剂、细胞治疗或癌症疫苗的施用之后并且在标记的cd8结合剂的施用之后,并且其中第二时间点在第一时间点之后。在一些实施方案中,检测在施用后约1天或更短时间内(例如,约6小时、4小时、2小时、90分钟、1小时、30分钟或更短时间内)进行。在一些实施方案中,所述方法重复一次或多次,例如每年约1至4次。在一些实施方案中,在预先施用cd8结合剂后至少1天后重复所述方法。在一些实施方案中,对所述主体监控不止1年。
29.在根据(或如应用于)任何上述预测方法或监控方法的一些实施方案中,将免疫治疗剂施用于主体。在一些实施方案中,免疫治疗剂是抗-pdl1抗体、抗-pd1抗体、抗-tigit抗体、tigit拮抗剂、抗-csf-1r抗体、抗-csf-1r拮抗剂、抗-cea抗体、抗-cea拮抗剂、抗-ctla4抗体、ctla4拮抗剂、抗-ox40抗体或ox40激动剂。在一些实施方案中,免疫治疗剂是抗-pd-l1抗体。在一些实施方案中,抗-pd-l1抗体与一种或多种治疗剂组合施用。在一些实施方案中,一种或多种治疗剂是tarceva
®
(厄洛替尼(erlotinib))、zelboraf
®
(威罗菲尼(vemurafenib))、gazyva
®
(阿托珠单抗(obinutuzumab))、avastin
®
(贝伐珠单抗(bevacizumab))、cotellic
®
(考比替尼(cobimetinib))、zelboraf
®
(威罗菲尼)和cotellic
®
(考比替尼)、alecensa
®
(阿来替尼(alectinib))、kadcyla
®
(曲妥珠单抗美坦新偶联物(ado-trastuzumab emtansine))、herceptin
®
(曲妥珠单抗(trastuzumab))、perjeta
®
(帕
妥珠单抗(pertuzumab))、泊洛妥珠单抗(polatuzumab)、inf-α、抗-cd40剂、抗-ox40抗体、ox40激动剂、抗-csf-1r抗体、抗-cea抗体、ido抑制剂或抗-tigit抗体。在一些实施方案中,免疫治疗剂是细胞因子。在一些实施方案中,细胞因子是il2、人工改造的il2、il15或人工改造的il15。在一些实施方案中,免疫治疗剂是特异性结合cd3的双特异性抗原结合分子。在一些实施方案中,双特异性抗原结合分子是抗体或其抗原结合片段。在一些实施方案中,免疫治疗剂是特异性结合cd16的双特异性抗原结合分子。在一些实施方案中,双特异性抗原结合分子是抗体或其抗原结合片段。在一些实施方案中,双特异性抗原结合分子特异性结合cd16a。在一些实施方案中,免疫治疗剂是树突细胞调节剂,例如树突细胞激活剂或树突细胞生长因子。
30.在根据(或如应用于)任何上述预测方法或监控方法的一些实施方案中,将癌症疫苗施用于主体。在一些实施方案中,癌症疫苗是个性化癌症疫苗(pcv)。
31.在根据(或如应用于)任何上述预测方法或监控方法的一些实施方案中,将细胞治疗施用于主体。在一些实施方案中,细胞治疗是car-t。在一些实施方案中,细胞治疗是新抗原特异性t细胞。
32.本文提供了预测患有自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的主体对免疫治疗剂的反应性的方法,所述方法包括:a)向主体施用根据(或如应用于)任何上述实施方案的标记的cd8结合剂;和b)检测标记的cd8结合剂与主体中患病组织中的cd8
t细胞的结合,其中所述结合的检测表明主体很可能对免疫治疗剂有反应。在一些实施方案中,检测标记的cd8结合剂与主体中的cd8
细胞的结合包括对主体中的cd8
细胞进行成像。在一些实施方案中,对主体中的cd8
细胞进行成像包括对主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。在一些实施方案中,所述方法进一步包括以下步骤:(c)向在其中已检测到结合的主体施用治疗有效量的免疫治疗剂。在一些实施方案中,检测在施用后约1天或更短时间内(例如,约6小时、4小时、2小时、90分钟、1小时、30分钟或更短时间内)进行。在一些实施方案中,所述方法重复一次或多次,例如每年约1至4次。在一些实施方案中,在预先施用cd8结合剂后至少1天后重复所述方法。在一些实施方案中,所述方法重复不止1年。
33.本文还提供了监控患有自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的主体中的疾病进展的方法,所述方法包括:a)向主体施用根据(或如应用于)任何上述实施方案的标记的cd8结合剂,和b)在第一时间点和第二时间点检测标记的cd8结合剂与主体中患病组织中的cd8
t细胞的结合,其中来自第一时间点和第二时间点的cd8
t细胞中的增加表明自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病已经进展。在一些实施方案中,检测标记的cd8结合剂与主体中的cd8
细胞的结合包括对主体中的cd8
细胞进行成像。在一些实施方案中,对主体中的cd8
细胞进行成像包括对主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。在一些实施方案中,所述方法进一步包括以下步骤:(c)向主体施用治疗有效量的免疫治疗剂,其中在第二时间点患病组织中的cd8
t细胞水平低于在第一时间点患病组织中的cd8
t细胞水平。在一些实施方案中,检测在施用后约1天或更短时间内(例如,约6小时、4小时、2小时、90分钟、1小时、30分钟或更短时间内)进行。在一些实施方案中,所述方法重复一次或多次,例如每年约1至4次。在一些实施方案中,在预先施用cd8结合剂后至少1天后重复所述方法。在一
些实施方案中,对所述主体监控不止1年。
34.本文提供了监控患有自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的主体中的治疗进展的方法,所述主体已经或正在接受免疫治疗剂,所述方法包括:i)连同所述免疫治疗剂一起向主体施用根据(或如应用于)任何上述实施方案的标记的cd8结合剂,和ii)在第一时间点和第二时间点检测标记的cd8结合剂与患病组织中的cd8
t细胞的结合。在一些实施方案中,检测标记的cd8结合剂与主体中的cd8
细胞的结合包括对主体中的cd8
细胞进行成像。在一些实施方案中,对主体中的cd8
细胞进行成像包括对主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。在一些实施方案中,标记的cd8结合剂在免疫治疗剂之前施用,其中第一时间点在标记的cd8结合剂的施用之后和免疫治疗剂的施用之前,并且其中第二时间点在免疫治疗剂的施用之后。在一些实施方案中,在标记的cd8结合剂之前施用免疫治疗剂,其中第一时间点在免疫治疗剂的施用之后并且在标记的cd8结合剂的施用之后,并且其中第二时间点在第一时间点之后。在一些实施方案中,检测在施用后约1天或更短时间内(例如,约6小时、4小时、2小时、90分钟、1小时、30分钟或更短时间内)进行。在一些实施方案中,所述方法重复一次或多次,例如每年约1至4次。在一些实施方案中,在预先施用cd8结合剂后至少1天后重复所述方法。在一些实施方案中,对所述主体监控不止1年。
35.本文提供了鉴定与对用免疫治疗剂治疗的反应性有关的肠道微生物菌株的方法,所述方法包括:a)从患有癌症的主体群体获得肠道微生物组(microbiome)样品,所述群体包括对用免疫治疗剂治疗有反应的主体和对用免疫治疗剂治疗无反应的主体;b)分析对治疗有反应的主体的肠道微生物组样品和对治疗无反应的主体的肠道微生物组样品;和c)鉴定与对治疗有反应的主体有关的肠道微生物菌株;其中反应性通过检测根据(或如应用于)任何上述实施方案的标记的cd8结合剂与主体中肿瘤组织中的cd8
t细胞的结合来确定,并且其中结合的检测表明主体对免疫治疗剂有反应。在一些实施方案中,所述方法进一步包括制备基于微生物组的药物,所述药物包含与对免疫治疗剂的反应性有关的肠道微生物菌株。在一些实施方案中,免疫治疗剂是抗-pd-1抗体。在一些实施方案中,免疫治疗剂是抗-pd-l1抗体,例如阿替利珠单抗(atezolizumab)。
36.本文进一步提供了试剂盒和制品,其包括根据(或如应用于)任何上述实施方案的cd8结合剂,例如标记的cd8结合剂。在一些实施方案中,试剂盒或制品包括根据任何上述方法使用cd8结合剂的说明书。
附图说明
37.图1提供了示例性抗-cd8 vhh结构域的氨基酸序列的比对,包括家羊驼vhh wt2c8(seq id no: 1),人源化vhhs hu2c8v130(seq id no: 2)、hu2c8v142(seq id no: 3)和hu2c8v144(seq id no: 4),以及非结合对照2c8v145(seq id no: 5)。
38.图2提供了人cd8a(seq id no: 13)、食蟹猴cd8a(seq id no: 14)和恒河猴cd8a(seq id no: 15)的氨基酸序列的比对。
39.图3显示了为评估与okt8-fc相比vhh-fc变体的cd8 细胞特异性结合而进行的实验的结果。
40.图4显示了与2c8 vhh结合的来自健康志愿者的全血细胞样品的示例性染色结果。
okt8是抗-cd8 igg,充当阳性对照。3e8 vhh是非结合阴性对照。
41.图5显示了2c8 vhh的晶体结构的示意图。左侧的结构显示了与cd8α/8α同二聚体(黑色,表位以白色突出显示,经由晶体学对称性算子重构的二聚体)结合的2c8 vhh(浅灰色)。右侧的结构显示了2c8 vhh:cd8α/8α复合物(与左侧图片颜色相同)在具有cd8α/β异二聚体的mhc i类复合物的公开的结构(pdb id:3dmm,mhc i以浅灰色显示,且cd8β以中灰色显示)上的叠置。
42.图6显示了为了评估野生型2c8和2c8.v144 vhh与来自96名健康供体的血液样品中预先存在的抗-vhh抗体的结合而进行的实验的结果。
43.图7a提供了为了在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果。
44.图7b提供了为了在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估对经由抗-cd3和抗-cd28的多克隆t细胞刺激的cd8
t细胞蛋白酶释放反应进行的实验的结果。
45.图7c提供了为了在seb刺激后在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果。
46.图7d提供了为了在cef肽库(pool)刺激后在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果。
47.图7e提供了为了在lps刺激后在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果。
48.图8a提供了为了在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果,其中10%fbs用作培养基。
49.图8b提供了为了在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果,其中10%的自体供体血浆用作培养基。
50.图8c提供了为了在seb刺激后在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果,其中10%fbs用作培养基。
51.图8d提供了为了在seb刺激后在有2c8v130、lys2 vhh(非结合对照)或pbs(载体)的情况下评估cd8
t细胞增殖进行的实验的结果,其中10%的自体供体血浆用作培养基。
52.图9显示了为了评估由
18
f-抗-cd8 vhh在嵌合hpball/daudi肿瘤异种移植小鼠中的cd8成像能力而进行的实验的结果。
53.图10显示了tall1肿瘤异种移植的小鼠在注射
89
zr-oa mab对照或
89
zr-huokt8.v1-oa(左)(第0天)后第5天(即第6天)或注射
18
f-对照vhh或
18
f-抗-cd8 vhh(右)后90分钟后的pet mip。
54.图11显示了注射
18
f-抗-cd8 vhh(顶部)或
18
f-对照vhh(底部)后一小时恒河猴的pet mip图像。
具体实施方式
55.本文提供了包含vhh结构域的cd8结合剂(包括抗-cd8抗体或其抗原结合片段),其中所述cd8结合剂以高亲和力特异性结合人cd8但不刺激或抑制cd8
t细胞或诱导cd8
t细胞增殖。cd8结合剂能够以高亲和力结合非人灵长类动物如恒河猴和食蟹猴中的cd8。与基
于传统4-链抗体的cd8结合剂相比,本文所述的cd8结合剂具有更高的透性和更短的血清半衰期。因此,本文所述的cd8结合剂适合于检测给药后短时间范围内(例如,1天内,例如1小时内)的cd8
细胞(例如,cd8
t细胞)的存在、定位和/或量,从而允许同日读出、重复成像和与其他生物标志相结合的多重成像。另外,本文所述的cd8结合剂显示出对cd8的高灵敏度、在大动态范围内与cd8水平的线性相关性、由于对诸如透性的外来因素的降低的灵敏度所造成的高精度以及如在小鼠异种移植模型中高肿瘤与血液比所反映的高图像质量。
56.本文提供了体内检测cd8
t-细胞的方法中使用cd8结合剂的方法。还提供了在预测患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体对用免疫治疗剂治疗的反应性的方法中使用本文的cd8结合剂的方法。此外,提供了使用本文的cd8结合剂监控正在接受用免疫治疗剂的治疗的患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体中的疾病进展和/或治疗进展的方法。
57.定义本文中的术语“人cd8”指对应于人的分化簇(cluster of differentiation)8分子的蛋白、多肽或其部分。全长人cd8是跨膜糖蛋白,其充当t细胞受体的共同受体。人cd8蛋白是二聚体,由一对cd8链组成,包括cd8α和cd8β链。术语“人cd8”包括cd8α/cd8α同二聚体、cd8α/cd8β异二聚体、cd8α链、cd8β链或其部分,例如一个或多个细胞外结构域。“cd8a”和“cd8α”在本文中可互换使用,并且“cd8b”和“cd8β”在本文中可互换使用。人cd8α链的示例性序列示于图2。
58.本文中的术语“cd8结合剂”指任何cd8结合分子。cd8结合剂可以是与人cd8、食蟹猴cd8和/或其他非人cd8蛋白或肽结合的多肽,蛋白,抗体(包括4-链抗体或重链抗体),抗体片段(例如,vhh)或免疫缀合物。cd8结合剂还可以包含标记,例如小分子标记,例如,放射性核素。包含标记的cd8结合剂在本文中也称为“标记的cd8结合剂”。
59.本文中的术语“抗体”以最广泛的意义使用并且包括各种抗体结构,包括但不限于单克隆抗体、单价抗体(例如,单臂(one-armed)抗体)、4-链抗体(例如igg抗体)、重链抗体及其抗体片段,只要它们表现出所期望的抗原结合活性,即,结合cd8(例如人cd8、食蟹猴cd8和/或恒河猴cd8)。术语“4-链抗体”在本文中可互换使用,以指具有两条重链和两条轻链的抗体或抗原结合片段。
[0060]“抗体片段”包含抗体的一部分,优选抗体的抗原结合区或可变区。抗体片段的实例包括vhhs、单结构域抗体、fab、fab'、f(ab')2和fv片段;双抗体;线性抗体(参见美国专利no. 5,641,870,实施例2;zapata等人,protein eng. 8(10): 1057-1062 [1995]);单链抗体分子;以及由抗体片段形成的多特异性抗体。术语“恒定结构域”指免疫球蛋白分子的一部分,其相对于含有抗原结合部位的免疫球蛋白的其他部分可变结构域具有更保守的氨基酸序列。恒定结构域含有重链的 ch1、ch2和ch3结构域(统称为ch)和轻链的chl(或 c
l
)结构域。
[0061]
本文中的术语“fc区”或“可结晶段区”用于定义免疫球蛋白重链的c-末端区,包括天然序列fc区和变体fc区。尽管免疫球蛋白重链的fc区的边界可能不同,但人igg重链fc区通常被定义为从cys226或pro230位置的氨基酸残基延伸到其羧基末端。fc区的c-末端赖氨酸(根据eu编号系统的残基447)可以被去除,例如,在抗体的生产或纯化期间,或通过重组改造编码抗体重链的核酸。因此,完整抗体的组成可以包含去除了所有k447残基的抗体群
体、没有去除k447残基的抗体群体以及含有具有和不具有k447残基的抗体的混合物的抗体群体。供本文所述抗体之用的合适天然序列fc区包括人igg1、igg2(igg2a、igg2b)、igg3和igg4。
[0062]
如本文所用的术语“单克隆抗体”指从基本上均质的抗体群体获得的抗体,即,除了可能以少量存在的可能天然存在的突变和/或翻译后修饰(例如,异构化、酰胺化)之外,构成所述群体的个体抗体是相同的。单克隆抗体是高度特异性的,针对单个抗原位点。与一般包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相比,每种单克隆抗体都针对抗原上的单个决定簇。除了它们的特异性之外,单克隆抗体是有利的,这是因为它们是由杂交瘤培养物合成的,不受其他免疫球蛋白的污染。修饰语“单克隆”表示抗体从基本上均质的抗体群体获得的特征,并且不应解释为需要通过任何特定方法产生抗体。例如,根据本技术使用的单克隆抗体可以通过多种技术制备,包括,例如,杂交瘤方法(例如,kohler和milstein,nature,256:495-97 (1975);hongo等人,hybridoma,14 (3): 253-260 (1995),harlow等人,antibodies: a laboratory manual,(cold spring harbor laboratory press,第2版,1988);hammerling等人,在monoclonal antibodies and t-cell hybridomas 563-681 (elsevier, n.y., 1981)中)、重组dna方法(参见,例如,美国专利no. 4,816,567)、噬菌体展示技术(参见,例如,clackson等人,nature, 352: 624-628 (1991);marks等人,j. mol. biol. 222: 581-597 (1992);sidhu等人,j. mol. biol. 338(2): 299-310 (2004);lee等人,j. mol. biol. 340(5): 1073-1093 (2004);fellouse,proc. natl. acad. sci. usa 101(34): 12467-12472 (2004);和lee等人,j. immunol. methods 284(1-2): 119-132 (2004),以及在具有部分或全部编码人免疫球蛋白序列的人免疫球蛋白基因座或基因的动物中产生人或人样抗体的技术(参见,例如,wo 1998/24893;wo 1996/34096;wo 1996/33735;wo 1991/10741;jakobovits等人,proc. natl. acad. sci. usa 90: 2551 (1993);jakobovits等人,nature 362: 255-258 (1993);bruggemann等人,year in immunol. 7:33 (1993);美国专利nos. 5,545,807;5,545,806;5,569,825;5,625,126;5,633,425和5,661,016;marks等人,bio/technology 10: 779-783 (1992);lonberg等人,nature 368: 856-859 (1994);morrison,nature 368: 812-813 (1994);fishwild等人,nature biotechnol. 14: 845-851 (1996);neuberger,nature biotechnol. 14: 826 (1996);和lonberg和huszar,intern. rev. immunol. 13: 65-93 (1995)。
[0063]
术语“可变区”或“可变结构域”指与抗体与抗原结合有关的抗体重链或轻链的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)通常具有相似的结构,每个结构域包含四个保守的构架区(frs)和三个高变区(hvrs)。(参见,例如,kindt等人,kuby immunology,第6版,w.h. freeman and co.,第91页(2007))。单个vh或vl结构域可能足以赋予抗原结合特异性。此外,可以使用来自结合抗原的抗体的vh或vl结构域以分别筛选互补vl或vh结构域的文库来分离结合特定抗原的抗体。参见,例如,portolano等人,j. immunol. 150:880-887 (1993);clarkson等人,nature 352:624-628(1991)。
[0064]
术语“重链抗体”,也称为“仅重链抗体”或“hcab”,指一种功能性抗体,其包含两条重链,但缺乏通常在4-链抗体中发现的两条轻链。已知骆驼科动物(如骆驼、家羊驼或羊驼)产生hcabs。
[0065]
术语“单结构域抗体”或“sdab”指具有三个互补性决定区(cdrs)的单个抗原结合结构域。单独的sdab能够在不与相应的含cdr多肽配对的情况下结合抗原。在一些情况下,单结构域抗体是从骆驼科动物hcabs人工改造的,且被称为“vhhs”(在下文定义)。骆驼科动物sdab是最小的已知抗原结合抗体片段之一(参见,例如,hamers-casterman等人,nature 363:446-8 (1993);greenberg等人,nature 374:168-73 (1995);hassanzadeh-ghassabeh等人,nanomedicine (lond), 8:1013-26(2013))。
[0066]
术语“vhh”或“重链抗体的重链的可变结构域”指重链抗体的单个重链可变结构域。vhh分子可以衍生自骆驼科(camelidae)物种例如骆驼、家羊驼、小羊驼(vicuna)、单峰骆驼、羊驼和原驼(guanaco)中产生的抗体。基本vhh从n-末端到c-末端具有以下结构:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,其中fr1至fr4分别指构架区1至4,且其中cdr1至cdr3指互补性决定区1至3。
[0067]
如本文所用的术语“高变区”或“hvr”指抗体可变结构域的序列高变(“互补性决定区”或“cdrs”)和/或形成结构上确定的环(“高变环”)和/或含有抗原接触残基(“抗原接触”)的各个区域。通常,4-链抗体及其抗原结合抗体片段包含六个hvrs:三个在vh中(h1、h2、h3),且三个在vl中(l1、l2、l3)。通常,重链抗体包含三个hvrs(hvr1、hvr2、hvr3)。
[0068]
许多hvr描述正在使用中并且包括在本文中。本文的4-链抗体及其抗原结合抗体片段的示例性hvrs包括:(a)出现在氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)和 96-101(h3)的高变环(chothia和lesk,j. mol. biol. 196:901-917(1987));(b)出现在氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、31
ꢀ‑
35b(h1)、50-65(h2)和 95-102(h3)的cdrs(kabat等人,sequences of proteins of immunological interest,第5版,public health service, national institutes of health, bethesda, md(1991));(c)出现在氨基酸残基27c-36(l1)、46-55(l2)、89-96(l3)、30-35b(h1)、47-58(h2)和93-101(h3)的抗原接触(maccallum等人,j. mol. biol. 262: 732-745(1996));和(d)(a)、(b)和/或(c)的组合,包括hvr氨基酸残基46-56(l2)、47-56(l2)、48-56(l2)、49-56(l2)、26-35(h1)、26-35b(h1)、49-65(h2)、93-102(h3)和 94-102(h3)。
[0069]
除非另外指出,否则可变结构域中的hvr残基和其他残基(例如,fr残基)在本文中根据kabat等人,上文进行编号。
[0070]
单结构域抗体(如vhh)的氨基酸残基可以根据由kabat等人(“sequence of proteins of immunological interest”, us public health services, nih bethesda, md., publication no. 91)给出的vh结构域的通用编号进行编号,如在riechmann和muyldermans, j. immunol. methods 2000年6月23日; 240 (1-2): 185-195的文章中应用于来自骆驼科动物的vhh结构域的。根据所述编号,vhh的fr1包含在位置1-30的氨基酸残基,vhh的cdr1包含在位置31-35的氨基酸残基,vhh的fr2包含在位置36-49的氨基酸,vhh的cdr2包含在位置50-65的氨基酸残基,vhh的fr3包含在位置66-94的氨基酸残基,vhh的cdr3包含在位置95-102的氨基酸残基,并且vhh的fr4包含在位置103-113的氨基酸残基。在这方面,应该注意的是——正如本领域中对于vh结构域和vhh结构域所众所周知的——每个cdrs中的氨基酸残基总数目可能不同,并且可能不对应于通过kabat编号表示的氨基酸残基的总数目(即,根据kabat编号的一个或多个位置在实际序列中可能不被占据,或者实际序列可能包含比通过kabat编号允许的数目更多的氨基酸残基)。
[0071]“构架”或“fr”残基是那些不同于如本文所定义的hvr残基的可变结构域残基。
[0072]
术语“嵌合”抗体指一种抗体,其中一部分重链和/或轻链与特定来源或物种相同或衍生自特定来源或物种,而重链和/或轻链的剩余部分与不同的来源或物种相同或衍生自不同的来源或物种。
[0073]“人源化”抗体是含有衍生自非人抗体的最少序列的抗体。通常,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体高变区的残基被来自具有期望的抗体特异性、亲和力和能力的非人物种(供体抗体)如骆驼科动物、小鼠、大鼠、兔或非人灵长类动物的高变区的残基置换。在某些方面,“人源化”抗体指包含来自非人(例如,骆驼科动物)cdrs的氨基酸残基和来自人frs的氨基酸残基的嵌合抗体。在一些情况下,人免疫球蛋白的构架区(fr)残基被相应的非人残基置换。此外,人源化抗体可包含在受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步改进抗体性能。通常,人源化抗体将包含基本上所有的至少一个,且一般两个可变结构域,其中所有或基本上所有的高变环对应于非人免疫球蛋白的那些,并且所有或基本上所有的frs是人免疫球蛋白序列的那些。对于进一步的细节,参见jones等人,nature 321:522-525 (1986);riechmann等人,nature 332:323-329 (1988);和presta,curr. op. struct. biol. 2:593-596 (1992)。
[0074]“亲和力成熟的”抗体是与不具有那些一种或多种改变的亲本抗体相比,在其一个或多个cdrs中具有导致抗体对抗原的亲和力改进的一种或多种改变的抗体。在一些实施方案中,亲和力成熟的抗体对靶抗原具有纳摩尔或甚至皮摩尔的亲和力。通过本领域已知的程序产生亲和力成熟的抗体。例如,cdr和/或构架残基的随机诱变描述于,例如:barbas等人,proc nat. acad. sci. usa 91:3809-3813 (1994);schier等人,gene 169:147-155 (1995);yelton等人,j. immunol. 155:1994-2004 (1995);jackson等人,j. immunol. 154(7):3310-9 (1995);和hawkins等人,j. mol. biol. 226:889-896 (1992)。
[0075]
关于本文鉴定的多肽和抗体序列的“百分比(%)氨基酸序列同一性”或“同源性”定义为在将任何保守取代视为序列同一性的一部分的情况下比对序列后,候选序列中与被比较的多肽中的氨基酸残基相同的氨基酸残基的百分比。用于确定百分比氨基酸序列同一性目的的比对可以以本领域技术范围内的各种方式实现,例如,使用诸如blast、blast-2、align或megalign(dnastar)软件的公开可获得的计算机软件。本领域技术人员可以确定用于测量比对的适当参数,包括在被比较的序列的全长上实现最大比对所需的任何算法。然而,对本文来说,使用序列比较计算机程序align-2产生%氨基酸序列同一性值。align-2序列比较计算机程序由genentech, inc.编写,且源代码已与用户文档一起提交给美国版权局(u.s. copyright office),washington d.c., 20559,在那里其以美国版权登记号(u.s. copyright registration no.)txu510087登记。align-2程序可通过genentech, inc., south san francisco, california公开获得。align-2程序应为了在unix操作系统优选数字unix v4.0d上使用进行编译。所有序列比较参数均由align-2程序设置,且不发生变化。
[0076]
如本文所用的术语“特异性结合”或“特异性地结合”或“特异于”特定多肽或特定多肽靶上的表位可以例如通过具有至少约10-4 m、另一方面至少约10-5 m、另一方面至少约10-6 m、另一方面至少约10-7 m、另一方面至少约10-8 m、另一方面至少约10-9 m、另一方面至少约10-10 m、另一方面至少约10-11 m、另一方面至少约10-12 m或更大的对于靶的kd的分子
表现出来。在一些实施方案中,术语“特异性结合”指分子在基本上不结合任何其他多肽或多肽表位的情况下结合特定多肽或特定多肽上的表位的结合。kd可以通过本领域中已知的方法来确定,例如elisa、表面等离振子共振(spr)、荧光激活细胞分选术(facs)分析或放射免疫沉淀(ria)。例如,可以通过确定与对照分子的结合相比的分子的结合来测量特异性结合,所述对照分子通常是不具有结合活性的类似结构的分子。例如,特异性结合可以通过与类似于靶的对照分子的竞争来确定,例如,过量的未标记的靶。在这种情况下,如果标记的靶与探针的结合被过量的未标记的靶竞争性抑制,则表明特异性结合。
[0077]
如本文所用的,“治疗(treatment)”或“治疗(treating)”是用于获得有益或期望的结果包括临床结果的方法。对本技术来说,有益的或期望的临床结果包括,但不限于,以下一种或多种:减轻由疾病引起的一种或多种症状、减小疾病的程度、稳定疾病(例如,预防或延迟疾病的恶化)、预防或延迟疾病的扩散(例如,转移)、预防或延迟疾病的复发、延迟或减缓疾病的进展、改善疾病状态、提供疾病的缓和(部分或全部)、减少治疗疾病所需的一种或多种其他药疗法的剂量、延迟疾病的进展、增加或改善生活质量、增加重量增加(weight gain)和/或延长存活。“治疗”还包括减少癌症的病理后果(例如,如肿瘤体积)。本文提供的方法预期了这些治疗方面的任何一个或多个。
[0078]
如本文所公开的cd8结合剂或组合物的“有效量”是足以实现具体说明的目的的量,例如,用于体内使cd8
t-细胞成像。“有效量”可以根据经验以及通过与所说明的目的(例如体内使cd8
t-细胞成像)相关的已知方法确定。
[0079]
术语“治疗有效量”指有效“治疗”主体(例如,哺乳动物,例如人)中疾病或病症的例如免疫治疗剂(例如本文别处描述的免疫治疗剂)、细胞治疗或癌症疫苗的量。在癌症的情况下,免疫治疗剂、细胞治疗或癌症疫苗的治疗有效量可以减少癌细胞的数目;减小肿瘤大小或重量;抑制(例如,在一些程度上减慢并优选停止)癌细胞浸润到周围器官;抑制(例如,在一些程度上减慢并优选停止)肿瘤转移;在一些程度上抑制肿瘤生长;和/或在一些程度上减轻与癌症有关的一种或多种症状。就免疫治疗剂、细胞治疗或癌症疫苗可以防止生长和/或杀死现有癌细胞来说,它可以是抑制细胞和/或细胞毒性的。在一些实施方案中,治疗有效量是生长抑制量。在另一个实施方案中,治疗有效量是延长患者存活的量。在另一个实施方案中,治疗有效量是改进患者无进展存活的量。
[0080]“个体”或“主体”是哺乳动物。哺乳动物包括,但不限于,驯化的动物(例如,牛、羊、猫、狗和马)、灵长类动物(例如,人和非人灵长类动物,例如恒河猴和食蟹猴)、兔和啮齿类动物(例如,小鼠和大鼠)。在一些实施方案中,个体或主体是人。
[0081]
如本文所用的,“反应性”指当主体正在或已经经受用治疗剂(例如,免疫治疗剂)治疗时有利反应的产生。有利反应的例子是在用治疗剂(例如,免疫治疗剂)治疗期间或之后主体中的肿瘤生长的抑制,而不利的例子是在用治疗剂(例如,免疫治疗剂)治疗期间或之后主体中肿瘤的连续生长或加速生长。
[0082]
如本文所用的,“监控疾病进展”指在连续的时间间隔评估主体(例如,被诊断为患有癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的主体)以确定疾病症状是否已经恶化、稳定或改善(即,变得不太严重)。例如,在某些情况下,监控主体的癌症进展可以包括监控肿瘤的重量或大小(例如肿瘤消退或肿瘤生长)、进展时间、存活持续时间、无进展存活的长度、总反应率、反应持续时间、生活质量、疾病标志的表达和/或活性(例如,某
些基因和/或蛋白的表达)或本领域已知的其他标准中的变化。可以采用额外的方法以监控癌症患者中的疾病进展,包括例如通过成像技术测量对治疗的反应,这将在本文别处进一步详细描述。
[0083]
如本文所用的,“监控治疗进展”指在治疗期间或治疗后(例如,用免疫治疗剂治疗)在连续的时间间隔评估主体(例如,被诊断为患有癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的主体)以确定作为治疗的结果疾病症状是否已恶化、稳定或改善(即,变得不太严重)。例如,可以使用与用于监控疾病进展的那些相同的标准监控主体(例如,已经或正在接受用免疫治疗剂治疗的主体)中的治疗进展。
[0084]
如本文所用的,“药学上可接受的”或“药理学相容的”意指在生物学或其他方面不是不期望的材料,例如,所述材料可以在不引起任何显著的不期望的生物学效应或以有害的方式与包含它的组合物的任何其他组分相互作用的情况下并入施用给患者的药物组合物中。药学上可接受的载体或赋形剂优选满足毒理学和制造测试的要求的标准和/或包括在由美国食品药品监督管理局(u.s. food and drug administration)制定的非活性成分指南(inactive ingredient guide)中。
[0085]
如本文所用的,“连同
……
一起”指例如本文所述的cd8结合剂的施用相对于第二试剂例如免疫治疗剂或另一种诊断显像剂的施用的时间控制。例如,本文所述的cd8结合剂连同免疫治疗剂一起施用意指cd8结合剂可以在已经施用免疫治疗剂之前、已经施用免疫治疗剂之后、与免疫治疗剂的施用同时或与免疫治疗剂的施用同步施用。可以在施用cd8结合剂和免疫治疗剂之前或之后施用另外的试剂。另外或另一方面,可以在顺序施用cd8结合剂和免疫治疗剂之间施用其他试剂。
[0086]
术语“检测”意图包括确定物质的存在或不存在或定量物质(例如cd8)的量。因此,所述术语指使用本技术的材料、组合物和方法用于定性和定量测定。通常,用于检测的特定技术对于本技术中的方法的实践不是关键的。例如,根据本文所述的方法“检测”可以包括:观察cd8多肽的存在或不存在或cd8多肽水平的变化。在一些实施方案中,“检测”可以包括检测野生型cd8水平(例如,mrna或多肽水平)。当与对照相比时,检测可以包括定量10%和90%之间的任何值,或30%和60%之间的任何值,或超过100%的变化(增加或减少)。检测可包括定量2-倍至10-倍(连端点在内)或更多例如100-倍之间的任何值的变化。
[0087]
当在本文中使用时,词语“标记”指可检测的化合物或组合物,其直接或间接缀合至抗体(例如,vhh)。标记本身可以独立地检测(例如,放射性同位素标记或荧光标记),或者在酶促标记的情况下,可以催化可检测的底物化合物或组合物的化学变化。
[0088]
本文提及“约”值或参数指本技术领域的技术人员容易知道的相应值的通常误差范围。本文提及“约”值或参数包括(并描述)涉及所述值或参数本身的方面。例如,提及“约x”的描述包括“x”的描述。
[0089]
应当理解,本技术的方面和实施方案包括“包含”所述方面和实施方案、“由”所述方面和实施方案“组成”和“基本上由”所述方面和实施方案“组成”。
[0090]
如本文和所附权利要求中所使用的,单数形式“一个(a)”、“一种(an)”和“所述(the)”包括复数对象,除非上下文另外明确规定。
[0091]
如本文所用的术语“和/或”,诸如“a和/或b”的短语,意图包括a和b两者;a或b;a(单独);和 b(单独)。同样,如本文所用的术语“和/或”诸如“a、b和/或c”的短语,意图包括
以下实施方案中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);和 c(单独)。
[0092]
应当理解,为了清楚起见,在分开的实施方案的上下文中描述的本发明的某些特征也可以在单个实施方案中组合地提供。相反,为了简洁起见,在单个实施方案的上下文中描述的本发明的各种特征也可以单独地或以任何合适的子组合提供。与cd8结合剂及其使用方法有关的实施方案的所有组合都被本发明明确包含并在本文中公开,正如每一种组合在本文中单独且明确地公开一样。
[0093]
cd8结合剂a.功能特征本文提供的cd8结合剂包含vhh结构域(例如,骆驼科动物或人源化vhh)并且具有以下特征中的一种或多种:(a)cd8结合剂以约1nm或更小的kd特异性结合人cd8;(b)cd8结合剂以约0.002/s或更小(例如,约0.0018/s,或约0.00085/s)的k
off
结合人cd8;(c)cd8结合剂以约1nm或更小的kd结合食蟹猴cd8;(d)cd8结合剂以约0.004/s或更小(例如,约0.0037/s,或约0.0019/s)的k
off
结合食蟹猴cd8;(e)cd8结合剂不抑制或刺激cd8
t细胞的活化;(f)cd8结合剂不诱导cd8
t细胞增殖;和(g)cd8结合剂不结合cd4
细胞。在一些实施方案中,vhh结构域具有本文所述的cd8结合剂的一种或多种特征。在一些实施方案中,标记的vhh结构域(即,与可检测标记缀合的vhh结构域)具有本文所述的cd8结合剂的一种或多种特征。
[0094]
本文所述的cd8结合剂以高亲和力和特异性结合cd8。在一些实施方案中,cd8结合剂以约1nm、0.5 nm、0.4 nm、0.3 nm、0.25 nm、0.2 nm、0.15 nm、0.1nm、0.05 nm、0.02 nm、0.01 nm、0.001 nm或更小(例如,10-9 m或更小,例如10-9 m-10-13 m或10-10 m-10-12 m)的kd结合人cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以约1nm、0.5 nm、0.4 nm、0.3 nm、0.25 nm、0.2 nm、0.15 nm、0.1nm、0.05 nm、0.02 nm、0.01 nm、0.001 nm或更小(例如,10-9 m或更小,例如10-9 m-10-13 m或10-10 m-10-12 m)的kd结合恒河猴cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以1nm、0.5 nm、0.4 nm、0.3 nm、0.25 nm、0.2 nm、0.15 nm、0.1nm、0.05 nm、0.02 nm、0.01 nm、0.001 nm或更小(例如,10-9 m或更小,例如10-9 m-10-13 m或10-10 m-10-12 m)的kd结合食蟹猴cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂(a)以约1nm、0.5 nm、0.4 nm、0.3 nm、0.25 nm、0.2 nm、0.15 nm、0.1nm、0.05 nm、0.02 nm、0.01 nm、0.001 nm或更小(例如,10-9 m或更小,例如10-9 m-10-13 m或10-10 m-10-12 m)的kd结合人cd8,包括这些值之间的任何值或范围;(b)以约1nm、0.5 nm、0.4 nm、0.3 nm、0.25 nm、0.2 nm、0.15 nm、0.1nm、0.05 nm、0.02 nm、0.01 nm、0.001 nm或更小(例如,10-9 m或更小,例如10-9 m-10-13 m或10-10 m-10-12 m)的kd结合恒河猴cd8,包括这些值之间的任何值或范围,和(c)以约1nm、0.5 nm、0.4 nm、0.3 nm、0.25 nm、0.2 nm、0.15 nm、0.1nm、0.05 nm、0.02 nm、0.01 nm、0.001 nm或更小(例如,10-9 m或更小,例如10-9 m-10-13 m或10-10 m-10-12 m)的kd结合食蟹猴cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以约150 pm或更小的kd结合人cd8,并且cd8结合剂以约350 pm或更小的kd结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约132 pm的kd结合人cd8,并且cd8结合剂以约344 pm的kd结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约50 pm或更小的kd结合人cd8,并且cd8结合剂以约150 pm或更小的kd结合食蟹猴cd8。在一
些实施方案中,cd8结合剂以约50 pm的kd结合人cd8,并且cd8结合剂以约137 pm的kd结合食蟹猴cd8。在一些实施方案中,cd8是cd8α。在一些实施方案中,cd8是cd8α/cd8α同二聚体。在一些实施方案中,cd8是cd8α/cd8β异二聚体。
[0095]
在一些实施方案中,cd8结合剂以约0.01/s、0.005/s、0.004/s、0.003/s、0.002/s、0.0015/s、0.001/s、0.0005/s、0.0002/s、0.0001/s或更小(例如,10-2
/s或更小,例如10-5
/s-10-2
/s或10-4-10-3
/s)的k
off
结合人cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以约0.01/s、0.005/s、0.002/s、0.001/s、0.0005/s、0.004/s、0.003/s、0.002/s、0.0015/s、0.001/s、0.0005/s或更小(例如,10-2
/s或更小,例如10-5
/s
ꢀ‑
10-2
/s或10-4-10-3
/s)的k
off
结合恒河猴cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以约0.01/s、0.005/s、0.002/s、0.001/s、0.0005/s、0.004/s、0.003/s、0.002/s、0.0015/s、0.001/s、0.0005/s或更小(例如,10-2
/s或更小,例如10-5
/s
ꢀ‑
10-2
/s或10-4-10-3
/s)的k
off
结合食蟹猴cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂(a)以约0.01/s、0.005/s、0.004/s、0.003/s、0.002/s、0.0015/s、0.001/s、0.0005/s、0.0002/s、0.0001/s或更小(例如,10-2
/s或更小,例如10-5
/s-10-2
/s或10-4-10-3
/s)的k
off
结合人cd8,包括这些值之间的任何值或范围;(b)以约0.01/s、0.005/s、0.002/s、0.001/s、0.0005/s、0.004/s、0.003/s、0.002/s、0.0015/s、0.001/s、0.0005/s或更小(例如,10-2
/s或更小,例如10-5
/s
ꢀ‑
10-2
/s或10-4-10-3
/s)的k
off
结合恒河猴cd8,包括这些值之间的任何值或范围;(c)以约0.01/s、0.005/s、0.002/s、0.001/s、0.0005/s、0.004/s、0.003/s、0.002/s、0.0015/s、0.001/s、0.0005/s或更小(例如,10-2
/s或更小,例如10-5
/s
ꢀ‑
10-2
/s或10-4-10-3
/s)的k
off
结合食蟹猴cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以约0.002/s或更小的k
off
结合人cd8,并且cd8结合剂以约0.004/s或更小的k
off
结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约0.0018/s的k
off
结合人cd8,并且cd8结合剂以约0.0037/s的k
off
结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约0.001/s的k
off
结合人cd8,并且cd8结合剂以约0.002/s的k
off
结合食蟹猴cd8。在一些实施方案中,cd8结合剂以约0.00085/s的k
off
结合人cd8,并且cd8结合剂以约0.0019/s的k
off
结合食蟹猴cd8。在一些实施方案中,cd8是cd8α。在一些实施方案中,cd8是cd8α/cd8α同二聚体。在一些实施方案中,cd8是cd8α/cd8β异二聚体。
[0096]
在一些实施方案中,cd8结合剂以约30分钟、1小时、2小时、3小时、4小时或更长(例如,至少15分钟,例如15分钟-6小时或30分钟-2小时)的cd8-结合半衰期(例如,在体外结合测定中)结合人cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以约30分钟、1小时、2小时、3小时、4小时或更长(例如,至少15分钟,例如15分钟-6小时或30分钟-2小时)的cd8-结合半衰期结合恒河猴cd8,包括这些值之间的任何值或范围。在一些实施方案中,cd8结合剂以约30分钟、1小时、2小时、3小时、4小时或更长(例如,至少15分钟,例如15分钟-6小时或30分钟-2小时)的cd8-结合半衰期结合食蟹猴cd8,包括这些值之间的任何值或范围。
[0097]
本文提供的cd8结合剂对人cd8、恒河猴cd8和/或食蟹猴cd8的kd和k
off
可以通过本领域已知的任何方法测定,包括,但不限于,例如,elisa、荧光激活细胞分选术(facs)分析、放射免疫沉淀(ria)和表面等离振子共振(spr)。在一些实施方案中,本文提供的cd8结合剂对人cd8、恒河猴cd8和/或食蟹猴cd8的kd和/或k
off
通过spr测定。在一些实施方案中,本文
提供的cd8结合剂的kd和/或k
off
通过使用cd8α/cd8β-fc融合蛋白作为试剂的表面等离振子共振(spr)测定。在一些实施方案中,cd8α/cd8β-fc融合蛋白是单臂人cd8α/人cd8β-fc融合蛋白。在一些实施方案中,cd8α/cd8β-fc融合蛋白是单臂食蟹猴cd8α/食蟹猴cd8β-fc融合蛋白。在一些实施方案中,单臂cd8α/cd8β-fc融合蛋白包含包含人cd8α和人cd8β的单链多肽,其融合至fc的一条多肽链。在一些实施方案中,单臂cd8α/cd8β-fc融合蛋白包含包含食蟹猴cd8α和食蟹猴cd8β的单链多肽,其融合至fc的一条多肽链。在一些实施方案中,本文提供的cd8结合剂对人cd8、恒河猴cd8和/或食蟹猴cd8的kd通过facs测定。示例性的人、恒河猴和食蟹猴cd8α氨基酸序列显示在图2中。
[0098]
在一些实施方案中,本文提供的cd8结合剂不结合(例如,特异性结合)小鼠cd8。在一些实施方案中,cd8结合剂不结合(例如,特异性结合)大鼠cd8。在一些实施方案中,cd8结合剂不结合(例如,特异性结合)小鼠cd8或大鼠cd8,例如,如通过spr和/或facs所测定的。
[0099]
本文所述的cd8结合剂的特征可以使用众所周知的方法来评估,例如,在以下实施方案中使用的方法。在一些实施方案中,在有外周血单核细胞(pbmcs)和本文提供的cd8结合剂的情况下体外评估cd8
t细胞增殖。在一些实施方案中,在有在pbmcs、抗-cd3抗体、抗-cd28抗体和本文提供的cd8结合剂的情况下体外评估cd8
t细胞增殖。在一些实施方案中,在有用葡萄球菌属(staphylococcus)肠毒素b(seb)刺激的pbmcs和本文提供的cd8结合剂的情况下体外评估cd8
t细胞增殖。在一些实施方案中,在有用cef肽库刺激的pbmcs和本文提供的cd8结合剂的情况下体外评估cd8
t细胞增殖。在一些实施方案中,在有用脂多糖(lps)刺激的pbmcs和本文提供的cd8结合剂的情况下体外评估cd8
t细胞增殖。在一些实施方案中,使用10% fbs作为培养基进行体外测定。在一些实施方案中,使用10%自体供体血浆作为培养基进行体外测定,其中供体血浆和pbmcs获自相同供体。
[0100]
在一些实施方案中,本文提供的cd8结合剂不结合(例如,特异性结合)人cd4
t细胞。在一些实施方案中,本文提供的cd8结合剂不结合(例如,特异性结合)人cd3-细胞。在一些实施方案中,本文提供的cd8结合剂不结合(例如,特异性结合)人cd4
t细胞或人cd3-细胞。在一些实施方案中,通过荧光激活细胞分选术(facs)检测本文提供的cd8结合剂与人cd4 t细胞或人cd3-细胞缺乏特异性结合,如实施例中所讨论的。
[0101]
本文提供了具有上述一种或多种功能特征的示例性cd8结合剂(包括抗-cd8抗体及其抗体片段)。在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述结构域特异性结合包含arg25、lys42、gln44、val45、leu46、leu47、ser48、pro50、thr51、ser52、gln75、arg93、leu94、gly95、asp96和thr97的人cd8α表位,其中氨基酸编号根据seq id no: 13。还提供了包含arg25、lys42、gln44、val45、leu46、leu47、ser48、pro50、thr51、ser52、gln75、arg93、leu94、gly95、asp96和thr97的人cd8α表位,其中氨基酸编号根据seq id no: 13。在一些实施方案中,人cd8α表位中的氨基酸残基在离与人cd8α结合的cd8结合剂或vhh结构域的晶体结构中的vhh结构域的一个或多个氨基酸残基约4.5
ꢀå
以内。进一步提供了抗-cd8抗体,其竞争性地结合与本文所述的任何一种cd8结合剂(例如,抗-cd8 vhhs)相同的人cd8α表位。
[0102]
在一些实施方案中,本文提供的cd8结合剂包含特异性结合人cd8的骆驼科动物vhh结构域。在一些实施方案中,本文提供的cd8结合剂包含特异性结合人cd8的人源化vhh结构域。
[0103]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含 seq id no: 1、seq id no: 2、seq id no: 3 或seq id no: 4中所述的氨基酸序列中的至少一个、两个或三个cdrs。
[0104]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含至少一个、两个或三个选自下述的cdrs:(a)包含seq id no: 6或seq id no: 7中所述的氨基酸序列的cdr1;(b)包含seq id no: 8或seq id no: 9中所述的氨基酸序列的cdr2;和(c)包含 seq id no: 10、seq id no: 11或seq id no: 12中所述的氨基酸序列的cdr3。
[0105]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含包含seq id no: 6或seq id no: 7的氨基酸序列的cdr1;包含seq id no: 8或seq id no: 9的氨基酸序列的cdr2;以及包含seq id no: 10、seq id no: 11或seq id no: 12的氨基酸序列的cdr3。
[0106]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含seq id no: 1的氨基酸序列中的cdr1、cdr2和cdr3。
[0107]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含seq id no: 2的氨基酸序列中的cdr1、cdr2和cdr3。
[0108]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含seq id no: 3的氨基酸序列中的cdr1、cdr2和cdr3。
[0109]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含seq id no: 4的氨基酸序列中的cdr1、cdr2和cdr3。
[0110]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 8的氨基酸序列的cdr2和包含seq id no: 10的氨基酸序列的cdr3。
[0111]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。
[0112]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。
[0113]
在一些实施方案中,提供了包含vhh结构域的cd8结合剂,所述vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。
[0114]
示例性cdr序列显示在图1和下面的表1中。
[0115]
表1
在一些实施方案中,cd8结合剂包含包含l49a的vhh结构域,其中编号根据kabat编号。l49a突变的例子显示在图1中的seq id nos: 2-4中。在一些实施方案中,l49a突变允许使用a蛋白柱纯化cd8结合剂。在一些实施方案中,l49a突变使cd8结合剂的得率增加到至少约2倍、5倍、10倍或更多。
[0116]
在一些实施方案中,cd8结合剂包含vhh结构域,所述结构域包含降低vhh结构域的免疫原性的一种或多种构架突变,例如,降低cd8结合剂与接受cd8结合剂的主体中预先存在的抗-vhh抗体的结合。在一些实施方案中,cd8结合剂包含vhh结构域,所述结构域包含一种或多种选自v89t取代、t110q取代、s112q取代和a114添加的氨基酸修饰,其中编号根据kabat编号。在一些实施方案中,vhh结构域包含v89t取代、t110q取代、s112q取代和a114添加,其中编号根据kabat编号。这些突变的例子显示在图1中的seq id nos: 2-4中。在一些实施方案中,构架突变将cd8结合剂的免疫原性降低到至多约1/2、1/10、1/100、1/1000或更低。
[0117]
在一些实施方案中,cd8结合剂包含具有seq id no: 1的氨基酸序列的vhh结构域。在一些实施方案中,cd8结合剂包含具有seq id no: 2的氨基酸序列的vhh结构域。在一些实施方案中,cd8结合剂包含具有seq id no: 3的氨基酸序列的vhh结构域。在一些实施方案中,cd8结合剂包含具有seq id no: 4的氨基酸序列的vhh结构域。
[0118]
示例性vhh序列显示在图1中。
[0119]
在一些实施方案中,本文提供的cd8结合剂经肾(renally)清除。在一些实施方案中,本文提供的cd8结合剂被肾系统清除(例如主要清除)。
[0120]
在一些实施方案中,提供了抗-cd8抗体。在一些实施方案中,提供了包含本文所述的任一vhh结构域的抗-cd8重链抗体。在一些实施方案中,抗-cd8重链抗体包含fc区,例如骆驼科动物或人fc区。在一些实施方案中,抗-cd8重链抗体包含igg1、igg2、igg3或igg4的fc或其变体。在一些实施方案中,本文提供的抗-cd8抗体包含具有一些但不是全部效应子功能的fc变体,这使其成为体内抗体的半衰期是重要的然而某些效应子功能(例如补体和adcc)是不必要的或有害的应用的期望的候选物。
[0121]
在一些实施方案中,提供了抗-cd8抗体片段,例如抗-cd8单结构域抗体或抗-cd8 vhh。
[0122]
在一些实施方案中,cd8结合剂不包含fc区。
[0123]
在一些实施方案中,本文提供的cd8结合剂包含一种或多种非蛋白部分。适合于抗体衍生化的部分包括但不限于水溶性聚合物。水溶性聚合物的非限制性实例包括,但不限于,聚乙二醇(peg)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡
咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三氧杂环己烷、乙烯/马来酐共聚物、聚氨基酸(均聚物或无规共聚物)和葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、丙二醇(propropylene glycol)均聚物、聚环氧丙烷/环氧乙烷共聚物(prolypropylene oxide/ethylene oxide co-polymers)、聚氧乙烯化多元醇(例如,甘油)、聚乙烯醇及其混合物。聚乙二醇丙醛由于其在水中的稳定性而在制造中可能具有优点。聚合物可以具有任何分子量,并且可以是支链或无支链的。与抗体附着的聚合物数目可能有变化,且如果附着了不止一个聚合物,则它们可以是相同或不同的分子。通常,用于衍生化的聚合物的数目和/或类型可以基于包括但不限于要改进的抗体的特定性质或功能、抗体衍生物是否将用于规定条件下的治疗等的考虑确定。
[0124]
在一些实施方案中,cd8结合剂不包含增加所述试剂的血清半衰期的非蛋白部分。在一些实施方案中,cd8结合剂不包含可溶性聚合物,例如聚乙二醇(peg)。
[0125]
b.变体和修饰在一些实施方案中,预期本文所述的cd8结合剂(例如,抗-cd8抗体)的氨基酸序列变体。例如,可能期望改进cd8结合剂的结合亲和力和/或其他生物学性质。cd8结合剂的氨基酸序列变体可以通过将适当的修饰引入编码蛋白的核苷酸序列中,或通过肽合成来制备。这种修饰包括,例如,cd8结合剂的氨基酸序列内(例如在一个或多个cdrs和/或构架序列中或在vhh结构域中)的残基的缺失和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以得到最终构建体,只要最终构建体具有所期望的特征(例如,如本文别处所述的)。
[0126]“cd8结合剂变体”意指多肽,例如,具有本文所述的所期望的特征的cd8结合剂包含与本文所述的cd8结合剂的vhh具有至少约80%氨基酸序列同一性的vhh。这种cd8结合剂变体包括,例如,其中一个或多个氨基酸残基被添加到vhh结构域或从vhh结构域缺失的试剂。通常,cd8结合剂变体与本文所述的cd8结合剂将具有至少约80%的氨基酸序列同一性,另一方面至少约85%、90%、95%、96%、97%、98%或99%氨基酸序列同一性的任一种。任选地,变体cd8结合剂与本文提供的cd8结合剂序列相比将具有不多于一个保守氨基酸取代,另一方面与本文提供的cd8结合剂序列相比不多于约2、3、4、5、6、7、8、9或10个保守氨基酸取代的任一种。
[0127]
在一些实施方案中,提供了具有一个或多个氨基酸取代、插入和/或缺失的cd8结合剂变体。用于取代诱变的感兴趣的位点包括hvrs和frs。保守取代在表2中在“保守取代”标题下显示。更多实质性变化在表2中在“示例性取代”标题下提供,并如在下文中关于氨基酸侧链类别进一步描述的。可以将氨基酸取代引入感兴趣的抗体,并对产物进行期望的活性的筛选,例如,保留/改善的抗原结合、降低的免疫原性或改善的adcc或cdc。
[0128]
表2
cd8结合剂变体的生物学性质的实质性修饰可以通过选择在它们对维持下述的作用中显著不同的取代来完成:(a)取代区域中多肽主链的结构,例如,作为片层或螺旋构象,(b)分子在靶位点的电荷或疏水性,或(c)侧链的体积。氨基酸可以根据其侧链性质中的相似性进行分组(在a. l. lehninger, biochemistry第二版,第73-75页,worth publishers, new york(1975)中):(1)非极性:ala(a)、val(v)、leu(l)、ile(i)、pro(p)、phe(f)、trp(w)、met(m)(2)不带电荷的极性:gly(g)、ser(s)、thr(t)、cys(c)、tyr(y)、asn(n)、gln(q)(3)酸性:asp(d)、glu(e)(4)碱性:lys(k)、arg(r)、his(h)另一方面,可以基于共同的侧链性质将天然存在的残基分组:(1)疏水性:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr、asn、gln;(3)酸性:asp、glu;
(4)碱性:his、lys、arg;(5)影响链取向的残基:gly、pro;(6)芳族:trp、tyr、phe。
[0129]
非保守取代将需要将这些类别中的一个的成员交换为另一个类别。
[0130]
在一些实施方案中,本文提供的cd8结合剂包含vhh结构域,所述结构域包含与seq id no: 1的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,本文提供的cd8结合剂包含vhh结构域,所述结构域包含与seq id no: 2的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,本文提供的cd8结合剂包含vhh结构域,所述结构域包含与seq id no: 3的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,本文提供的cd8结合剂包含vhh结构域,所述结构域包含与seq id no: 4的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的vhh序列相对于参考序列含有取代(例如,保守取代)、插入或缺失,但包含所述序列的cd8结合剂保留结合cd8(例如,人cd8、恒河猴cd8和/或食蟹猴cd8)的能力。在一些实施方案中,在seq id no:1、seq id no:2、seq id no:3或seq id no:4中已取代、插入和/或缺失了总共1至10个氨基酸。在一些实施方案中,取代、插入或缺失发生在cdrs之外的区域中(即,在frs中)。在一些实施方案中,cd8结合剂包含seq id no: 1、seq id no: 2、seq id no: 3或seq id no: 4中所述的vhh序列,包括所述序列的翻译后修饰。
[0131]
一种类型的取代变体涉及取代亲本抗体(例如,家羊驼vhh或人源化vhh)的一个或多个高变区残基。通常,选择用于进一步研究的一种或多种所得到的变体相对于亲本抗体将在某些生物学性质中具有修饰(例如,改进)(例如,增加的亲和力、降低的免疫原性)和/或将基本上保留亲本抗体的某些生物学性质。示例性取代变体是亲和力成熟的抗体,其可以方便地产生,例如,使用基于噬菌体展示的亲和力成熟技术,例如本文所述的那些。简而言之,一个或多个hvr残基被突变,且变体抗体在噬菌体上展示并进行特定的生物活性(例如结合亲和力)的筛选。
[0132]
例如,可以在hvrs中进行改变(例如,取代),以提高抗体亲和力。这种改变可在hvr“热点”,即,由在体细胞成熟过程期间以高频率经历突变的密码子编码的残基(参见,例如,chowdhury, methods mol. biol. 207:179-196(2008))和/或sdrs(a-cdrs)中进行,而所得到的变体vhh进行结合亲和力的测试。已描述了通过构建第二文库和从第二文库重新选择(reselecting)的亲和力成熟,例如,在hoogenboom等人,methods in molecular biology 178:1-37(o’brien等人,编,human press, totowa, nj,(2001)中)。在亲和力成熟的一些实施方案中,通过多种方法中的任一种(例如,易错pcr、链改组或寡核苷酸指导的诱变),将多样性引入选择用于成熟的可变基因中。然后产生第二文库。然后筛选文库以鉴定具有所期望的亲和力的任何抗体变体。另一种引入多样性的方法涉及hvr-指导的方法,其中几个hvr残基(例如,一次4-6个残基)是随机化的。可以特异性鉴定与抗原结合有关的hvr残基,例如,使用丙氨酸分区诱变法或建模。特别地经常靶向cdr3。
[0133]
在一些实施方案中,取代、插入或缺失可在一个或多个cdrs内发生,只要这种改变
不显著降低cd8结合剂对cd8的能力。例如,可以在cdrs中进行不显著降低结合亲和力的保守改变(例如,如本文所提供的保守取代)。这种改变可能在cdr“热点”或sdrs之外。在上面提供的变体vhh序列的一些实施方案中,每个hvr或者是未改变的,或者包含不多于一个、两个或三个氨基酸取代。
[0134]
如cunningham和wells (1989) science, 244:1081-1085所述的,用于鉴定可被靶向用于诱变的抗体残基或区域的有用方法称为“丙氨酸分区诱变法”。在所述方法中,残基或靶残基的组(例如,带电荷的残基,例如arg、asp、his、lys和glu)被鉴定并被中性或带阴电的氨基酸(例如,丙氨酸或聚丙氨酸)置换,以确定抗体与抗原的相互作用是否受到影响。可以在显示对初始取代的功能敏感性的氨基酸位置处引入进一步的取代。另一方面或另外,抗原-抗体复合物的晶体结构以鉴定抗体和抗原之间的接触点。这种接触残基和邻近的残基可以作为取代的候选物被靶向或消除。可以筛选变体以确定它们是否含有所期望的性质。
[0135]
氨基酸序列插入包括长度从一个残基一直到含有一百个或更多残基的多肽的氨基和/或羧基末端融合,以及单个或多个氨基酸残基的序列内插入。末端插入的例子包括具有n-末端甲硫氨酰残基的抗体。抗体分子的其他插入变体包括抗体的n-或c-末端与酶(例如,对于adept)或增加抗体血清半衰期的多肽的融合。
[0136]
c.包含可检测标记的免疫缀合物在一些实施方案中,cd8结合剂是包含与可检测标记缀合的本文所述的任何一种抗-cd8抗体(例如,抗-cd8 vhh)的免疫缀合物。术语“标记”或“可检测标记”指可用于诊断、检测或显示/成像细胞、组织、器官等上的靶分子(例如cd8)的位置和/或量的原子、分子或化合物。可根据本文实施方案使用的可检测标记包括,但不限于,放射性物质(例如,放射性同位素、放射性核素、放射性标记或放射性示踪物)、染料(例如,吲哚菁绿(indocyanine green)(icg))、造影剂、荧光化合物或分子、生物发光化合物或分子、酶和增强剂(enhancing agent)(例如,顺磁离子)。此外,一些纳米颗粒,例如量子点(quantum dot)和金属纳米颗粒可以适合用作检测剂。
[0137]
根据本文实施方案可用作可检测标记的放射性物质包括,但不限于,
18
f、
32
p、
33
p、
45
ti、
47
sc、
52
fe、
59
fe、
62
cu、
64
cu、
67
cu、
67
ga、
68
ga、
75
sc、
77
as、
86
y、
89
sr、
89
zr、
90
y、
90
nb、
94
tc、
99
tc、
99
mtc、
99
mo、
105
pd、
105
rh、
111
ag、
111
in、
123
i、
124
i、
125
i、
131
i、
142
pr、
143
pr、
149
pm、
153
sm、
154-158
gd、
161
tb、
166
dy、
169
er、
175
lu、
177
lu、
186
re、
188
re、
189
re、
194
ir、
198
au、
199
au、
211
at、
211
pb、
212
bi、
212
pb、
213
bi、
223
ra和
225
ac。可用作可检测标记的示例性顺磁离子物质包括,但不限于,过渡金属和镧系金属的离子(例如,具有6-9、21-29、42-44或57-71的原子序数的金属)。这些金属包括cr、v、mn、fe、co、ni、cu、la、ce、pr、nd、pm、sm、eu、gd、tb、dy、ho、er、tm、yb和lu的离子。
[0138]
当可检测标记是放射性金属或顺磁离子时,在一些实施方案中,标记可以与具有长尾的试剂反应,而一个或多个螯合基团附着到所述长尾用于结合这些离子。长尾可以是聚合物,例如聚赖氨酸、多糖或其他具有可结合螯合基团(即,用于结合离子)的侧基的衍生的或可衍生的链。可根据本文实施方案使用的螯合基团的实例包括,但不限于,乙二胺四乙酸(edta)、二亚乙基三胺五乙酸(dtpa)、dota、noia、nogada、neta、noda、nota、去铁胺(dfo)、dfo*(即,dfo-星号)、dfo-方酰胺(squaramide)、卟啉、多胺、冠醚、双缩氨基硫脲、聚肟(polyoxime)和类似基团。螯合物可以通过允许在最小限度丧失免疫反应性和最小限度
聚集和/或内部交联的情况下与分子形成键的基团与本文提供的抗-cd8抗体(例如,抗-cd8 vhh)连接。当与本文所述的cd8结合剂一起使用时,相同的螯合物在与非放射性金属(例如,锰、铁和钆)复合时可用于磁共振成像(mri)。诸如noia、nogada、dota、noda、nota和teta的大环螯合物用于与多种金属和放射性金属一起使用,包括,但不限于,例如,镓、钇和铜的放射性核素。可以使用其他环型螯合物,例如大环聚醚,它们对于稳定结合放射性核素例如用于放射性碘治疗(rait)的镭-223是有意义的。在一些实施方案中,螯合部分可用于将正电子发射体层摄影术(pet)显像剂,例如铝-18
f复合物附着至本文提供的cd8结合剂以用于pet分析。铝-18
f复合物可以经由受约束螯合剂(restrained complexing agent)(resca)例如式(i)的化合物与vhh结构域缀合:。
[0139]
参见,例如,us20180273441a1和cleeren f.等人,nature protocols 13, 2330-2347(2018)。
[0140]
在一些实施方案中,提供了cd8结合剂,其包含与放射性核素标记如
18
f缀合的本文所述的任何一种抗-cd8 vhh结构域。在一些实施方案中,vhh结构域经由螯合部分与标记缀合。在一些实施方案中,螯合部分经由赖氨酸残基与vhh结构域共价连接。在一些实施方案中,放射性核素标记包含在金属复合物中。在一些实施方案中,放射性核素标记与金属形成复合物,其中所述复合物被螯合部分螯合。在一些实施方案中,cd8结合剂包含缀合至螯合部分的抗-cd8 vhh结构域,所述螯合部分螯合包含
18
f标记和铝的复合物。在一些实施方案中,螯合部分是式(i)的化合物。
[0141]
在一些实施方案中,提供了cd8结合剂,其包含经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的本文所述的任何一种抗-cd8 vhh结构域。
[0142]
在一些实施方案中,提供了cd8结合剂,其包含经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的vhh结构域,其中所述vhh结构域包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在一些实施方案中,vhh结构域包含seq id no: 3的氨基酸序列。
[0143]
在一些实施方案中,提供了cd8结合剂,其包含经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的vhh结构域,其中所述vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。在一些实施方案中,vhh结构域包含seq id no: 4的氨基酸序列。
[0144]
可用作根据本文的方法和组合物的实施方案的可检测标记的示例性造影剂包括,但不限于,钡、泛影酸盐、乙碘油、柠檬酸镓、碘卡酸、碘醋胺酸、碘酰胺、碘影酸、碘撒酸、碘
枸来米、碘海醇(iohexyl)、碘必乐、碘番酸、碘桂酸、碘西法酸、碘丝酸、碘砜葡胺、碘琥酸(iosemetic acid)、碘他苏、碘得酸、碘拉酸、碘托酸、碘格利酸、碘泛影酸、胺碘苯丙酸、葡甲胺、甲泛葡胺、甲泛影酸、丙碘酮、氯化亚铊或它们的组合。
[0145]
可用作根据本文的方法和组合物的可检测标记的生物发光和荧光化合物或分子和染料包括,但不限于,例如,荧光素、异硫氰酸荧光素(fitc)、oregon green
™
、罗丹明、德克萨斯红、irdye800cw、alexa fluor
® 647、四罗丹明异硫氰酸酯(tritc)、cy3、cy5等)、荧光标志(例如,绿色荧光蛋白(gfp)、藻红蛋白等)、由肿瘤相关蛋白酶活化的自猝灭的(autoquenched)荧光化合物、酶(例如,萤光素酶、辣根过氧化物酶、碱性磷酸酶等)、纳米颗粒、生物素、洋地黄毒苷或其组合。
[0146]
可用作根据本文的方法和组合物的可检测标记的酶包括,但不限于,例如,辣根过氧化物酶、碱性磷酸酶、酸性磷酸酶、葡糖氧化酶、β-半乳糖苷酶、β-葡糖苷酸酶(glucoronidase)或β-内酰胺酶。这种酶可与色原、致荧光(fluorogenic)化合物或致发光(luminogenic)化合物组合使用以产生可检测信号。
[0147]
在一些实施方案中,本文提供的cd8结合剂缀合至纳米颗粒,即,其尺寸按纳米量度的微观颗粒。例如,纳米颗粒是至少一个维度小于约100 nm的颗粒。纳米颗粒可以用作可检测物质,这是因为它们小到足以散射可见光而不是吸收可见光。例如,金纳米颗粒具有显著的可见光消光性质,且在溶液中显现深红色至黑色。因此,已与纳米颗粒缀合的本文提供的cd8结合剂可用于主体中体内t-细胞的成像。在尺寸范围的小端,纳米颗粒经常被称为簇。已经形成了金属、介电和半导体纳米颗粒,以及混合结构(例如芯-壳纳米颗粒)。纳米球(nanosphere)、纳米棒(nanorod)和纳米杯(nanocup)只是已经形成的几种形状。半导体量子点和纳米晶体(nanocrystal)是额外的类型的纳米颗粒的例子。当与本文提供的抗-cd8抗体(例如,抗-cd8 vhh)缀合时,这种纳米级(nanoscale)颗粒可用作显像剂用于如本文所述的体内t-细胞检测。
[0148]
可以使用多种双功能蛋白偶联剂制备抗体和标记的缀合物,例如n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、琥珀酰亚胺基-4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯(smcc)、亚氨基硫杂环戊烷(iminothiolane)(it)、亚氨酸酯的双功能衍生物(如己二亚氨酸二甲酯hcl)、活性酯(如辛二酸二琥珀酰亚胺酯)、醛(如戊二醛)、双叠氮化合物(如双(对叠氮基苯甲酰基)己二胺)、双重氮衍生物(如双-(对-重氮苯甲酰基)-乙二胺)、二异氰酸酯(如甲苯2,6-二异氰酸酯)和双活性氟化合物(如1,5-二氟-2,4-二硝基苯)。例如,可以如vitetta等人,science 238:1098(1987)中所述制备蓖麻毒蛋白免疫毒素。碳-14-标记的1-异硫氰基苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核素与抗体缀合的示例性螯合剂。参见wo94/11026。接头可以是促进细胞毒性药物在细胞中释放的“可切割接头”。例如,可以使用酸不稳定接头、肽酶敏感性接头、光不稳定接头、二甲基接头或含二硫键的接头(chari等人,cancer res. 52:127-131 (1992);美国专利no. 5,208,020)。本文的免疫缀合物包括,但不限于,用交联剂试剂制备的这种缀合物,包括但不限于可商购获得的bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc和磺基-smpb和svsb(琥珀酰亚胺基-(4-乙烯砜)苯甲酸酯)(例如,来自pierce biotechnology, inc., rockford, il., 美国)。在一些实施方案中,本文提供的cd8结合剂包含作为去铁胺化合物
的接头(参见,例如,vugts等人,(2017) eur j nucl med mol imaging. 44:286-295和rudd等人,(2016) chem commun. 52: 11859-12000)。在一些实施方案中,本文提供的cd8结合剂包含n-琥珀酰-去铁胺(dfo)接头。在一些实施方案中,本文提供的cd8结合剂包含通过去铁胺化合物(例如,n-琥珀酰-去铁胺)与放射性核素(例如,包括,但不限于
89
zr、
124
i或
18
f)缀合的抗-cd8 vhh。在一些实施方案中,标记以位点特异性方式缀合至抗-cd8 vhh结构域,例如使用酶,例如分选酶或转谷氨酰胺酶。
[0149]
在一些实施方案中,本文提供的cd8结合剂包含与可检测标记直接偶联的抗-cd8 vhh结构域(即,没有接头)。
[0150]
生产cd8结合剂的方法本文还提供了产生本文所述的cd8结合剂的方法,包括产生抗-cd8抗体(例如,抗-cd8 vhhs)的方法,以及产生标记的cd8结合剂的方法。
[0151]
本文所述的抗-cd8抗体(例如,抗-cd8 vhhs)可以使用重组方法和组合物产生,例如,如美国专利no. 6,015,695中所述的。在一些实施方案中,描述了编码本文所述的抗-cd8抗体(例如,抗-cd8 vhh)的分离的核酸。这种核酸可以编码包含抗-cd8 vhh结构域的氨基酸序列。在一些实施方案中,提供了编码抗-cd8 vhh结构域的分离的核酸,其中所述核酸包含与编码seq id no: 1、seq id no: 2、seq id no: 3或seq id no: 4的核酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的序列。
[0152]
在一些实施方案中,提供了包含本文所述的核酸的载体(例如,表达载体)。在一些实施方案中,提供了包含这种核酸或载体的宿主细胞。在一些实施方案中,宿主细胞是真核的,例如,中国仓鼠卵巢(cho)细胞、expi293细胞或淋巴样细胞(例如,y0、ns0、sp20细胞)。在一些实施方案中,宿主细胞是原核的,例如,大肠杆菌细胞。在一些实施方案中,提供了制备抗-cd8抗体(例如,抗-cd8 vhh)的方法,其中所述方法包括在适合于表达抗体的条件下培养如上所提供的包含编码抗体的核酸的宿主细胞,和任选地从所述宿主细胞(或宿主细胞培养基)回收抗体。
[0153]
进一步提供了制备标记的cd8结合剂的方法,包括将螯合部分缀合至本文所述的任何一种抗-cd8抗体(例如,抗-cd8 vhhs)以提供包含抗-cd8抗体和螯合部分的缀合物,并且使缀合物与包含
18
f的氟化铝复合物接触以提供标记的cd8结合剂,其中螯合部分是式(i)的化合物。在一些实施方案中,螯合部分与抗-cd8抗体的赖氨酸残基缀合。在一些实施方案中,缀合物在有一种或多种抗氧化剂化合物的情况下与氟化铝复合物接触。在一些实施方案中,一种或多种抗氧化剂化合物包括甲硫氨酸和/或n-乙酰-色氨酸。在一些实施方案中,缀合物在有甲硫氨酸和n-乙酰-色氨酸的情况下与氟化铝复合物接触。在一些实施方案中,方法包括通过脱盐柱从包含缀合物和氟化铝的反应混合物纯化标记的cd8结合剂。在一些实施方案中,脱盐柱用包含组氨酸、甲硫氨酸、n-乙酰色氨酸和/或蔗糖的缓冲液平衡。在一些实施方案中,脱盐柱用包含组氨酸、甲硫氨酸、n-乙酰色氨酸和蔗糖的缓冲液平衡。
[0154]
对于抗-cd8抗体(例如,抗-cd8 vhh)的重组生产,分离编码抗体的核酸,例如,如上文所述的,并将其插入载体中用于在宿主细胞中进一步克隆和/或表达。这种核酸可以使用常规程序(例如,通过使用能够特异性结合编码抗体重链和轻链的基因的寡核苷酸探针)容易地分离和测序。
[0155]
用于克隆或表达编码抗体的载体的合适宿主细胞包括本文所述的原核或真核细
胞。例如,可以在细菌中产生抗体,特别是当不需要糖基化和fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见,例如,美国专利nos. 5,648,237、5,789,199和5,840,523。(也参见charlton,methods in molecular biology,第248卷(b.k.c. lo, 编, humana press, totowa, nj, 2003),第245-254页,描述了抗体片段在大肠杆菌中的表达)。表达后,抗体可以以可溶性级分从细菌细胞糊分离,并可以进一步纯化。
[0156]
除原核生物外,诸如丝状真菌或酵母的真核微生物是用于编码抗体的载体的合适克隆或表达宿主,包括其糖基化途径已“人源化
”ꢀ
从而导致具有部分或完全人类糖基化模式的抗体生产的真菌和酵母菌株。参见gerngross,nat. biotech. 22:1409-1414 (2004)和li等人,nat. biotech. 24:210-215(2006)。
[0157]
用于表达糖基化抗体的合适宿主细胞也来源于多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的例子包括植物和昆虫细胞。已鉴定出许多杆状病毒毒株,它们可与昆虫细胞一起使用,特别是用于草地夜蛾(spodoptera frugiperda)细胞的转染。
[0158]
植物细胞培养物也可以用作宿主。参见,例如,美国专利nos. 5,959,177、6,040,498、6,420,548、7,125,978和6,417,429(描述了用于在转基因植物中产生抗体的plantibodies
tm
技术)。
[0159]
脊椎动物细胞也可以用作宿主。例如,适合于悬浮生长的哺乳动物细胞系可能是有用的。其他有用的哺乳动物宿主细胞系的例子是由 sv40转化的猴肾cv1系(cos-7);人胚肾系(293或293细胞,如例如在graham等人,j. gen virol. 36:59(1977)中所述的);幼仓鼠肾细胞(bhk);小鼠支持细胞(tm4细胞,如例如在mather,biol. reprod. 23:243-251(1980)中所述的);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck;布法罗大鼠肝细胞(buffalo rat liver cells)(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳癌(mmt 060562);tri细胞,如例如在mather等人,annals n.y. acad. sci. 383:44-68(1982)中所述的;mrc 5细胞;和fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr
‑ cho细胞(urlaub等人,proc. natl. acad. sci. usa 77:4216(1980));和骨髓瘤细胞系,例如y0、ns0和sp2/0。对于适合于抗体生产的某些哺乳动物宿主细胞系的综述,参见,例如,yazaki和wu,methods in molecular biology, 第248卷(b.k.c. lo, 编, humana press, totowa, nj),第255-268页(2003)。
[0160]
使用cd8结合剂检测、定位和/或成像cd8
细胞的方法本文提供了使用本文所述的任何一种cd8结合剂(例如,抗-cd8抗体或包含抗-cd8抗体和可检测标记的免疫缀合物)检测、定位和/或成像cd8
细胞的方法。在一些实施方案中,方法包括检测体外或先体外后体内样品中cd8的存在。在一些实施方案中,方法包括将cd8结合剂添加到体外或先体外后体内样品中。这种方法包括,但不限于,例如蛋白印迹、免疫组织化学分析、efisa测定等,任选地包括在向体外或先体外后体内样品中添加cd8结合剂之后进行洗涤。在一些实施方案中,检测cd8结合剂与cd8的结合包括检测与抗-cd8 vhh结构域附着的标记。在一些实施方案中,方法包括应用结合抗-cd8:cd8复合物的包含本文的可检测标记的第二试剂,并且检测cd8结合剂与cd8的结合包括检测第二试剂的可检测标记。本领域普通技术人员将容易理解,第二试剂不与cd8结合剂竞争结合cd8,或不与cd8竞争结合cd8结合剂。
[0161]
在一些实施方案中,方法包括检测、定位或成像体内cd8的存在。在一些实施方案
中,方法包括将本文所述的cd8结合剂施用于主体。在一些实施方案中,主体是人。在一些实施方案中,主体是非人哺乳动物,例如,大鼠、小鼠、豚鼠、仓鼠、兔、狗、猫、牛、马、山羊、绵羊、驴、猪、猴、猿或其他非人灵长类动物。在一些实施方案中,非人灵长类动物是恒河猴或食蟹猴。在一些实施方案中,将cd8结合剂口服、表面(topically)或局部施用于主体。在一些实施方案中,cd8结合剂经由输注(例如静脉内输注)施用于主体。在一些实施方案中,输注是腹膜内的。在一些实施方案中,cd8结合剂通过注射例如静脉内注射或皮下注射施用于主体。在一些实施方案中,方法包括向主体施用cd8结合剂并从主体取出样品用于分析(即,检测cd8结合剂与cd8的结合)。
[0162]
在一些实施方案中,体内进行cd8
细胞的检测、定位和/或成像,例如,使用本文别处进一步详细描述的技术。
[0163]
在一些实施方案中,体内检测cd8的存在包括将cd8(例如cd8
细胞)定位于器官或组织。在一些实施方案中,方法包括确定主体器官或组织(例如患病组织)中cd8
细胞的数目。在一些实施方案中,主体患有癌症,并且体内检测cd8的存在包括将cd8
细胞定位于肿瘤。在一些实施方案中,cd8
细胞是cd8
t细胞,例如,肿瘤浸润cd8
t细胞。在一些实施方案中,方法包括确定患有癌症的主体的肿瘤中cd8
t细胞的数目。在一些实施方案中,方法包括在多个连续时间点确定患有癌症的主体的肿瘤中cd8
t细胞的目。
[0164]
在一些实施方案中,cd8
细胞可以在施用cd8结合剂之后约1天或更短时间内被体内检测、定位或成像,例如约6小时、4小时、3小时、2小时、90分钟、1小时、30分钟或更短时间内(例如,约30分钟至约6小时、约30分钟至约4小时或约2小时至4小时),包括这些值之间的任何值或范围。
[0165]
在一些实施方案中,可以在不超过剂量确定法指南的情况下使用本文所述的任何方法体内检测、定位或成像cd8
细胞一次或多次,例如每年1、2、3、4、5次或更多次。在一些实施方案中,可以在第一次施用cd8结合剂后约7天、6天、5天、4天、3天、2天、1天或更短时间后重复所述方法。
[0166]
在一些实施方案中,标记的cd8结合剂可以与一种或多种额外的显像剂一起使用用于多重成像。在一些实施方案中,一种或多种额外的显像剂可以在施用标记的cd8结合剂后的短时间段内,例如,来自第一显像剂的放射性一减低,就施用于主体,例如,在约48小时、36小时、24小时、18小时、12小时、8小时、6小时、4小时、2小时、1小时或更短时间的任何一个内。在一些实施方案中,与长寿命显像试剂不同,本文所述的标记的cd8结合剂使cd8成像能够与标准治疗(standard of care)pet成像(例如,fdg-pet)或新型分子成像(例如,cd4、粒酶b、psma)组合,用于免疫应答的额外表征。在一些实施方案中,方法进一步包括在使用标记的cd8结合剂成像后约48小时内进行另一次成像扫描(例如,pet,例如fdg-pet、spect或闪烁照相术扫描)。
[0167]
在一些实施方案中,方法可用于在延长的时间段内体内检测、定位或成像cd8
细胞,例如至少约3个月、6个月、1年、2年、3年、4年、5年、10年或更长时间,包括这些值之间的任何值或范围。本文所述的cd8结合剂的低免疫原性允许重复和延长使用cd8结合剂用于体内成像和cd8检测。
[0168]
在一些实施方案中,方法具有约1 nm、2 nm、5 nm、10 nm、15 nm、20 nm、25 nm、30 nm、40 nm或50 nm(例如,至少约50 nm,例如,约1 nm-约50 nm或约1 nm-约30 nm)(包括这
些值之间的任何值或范围)的用于体内cd8检测的cd8的灵敏度。在一些实施方案中,方法在来自标记的信号和体内cd8水平之间具有线性相关性。在一些实施方案中,方法在小鼠cd8
肿瘤(例如,tall-1)异种移植模型中具有至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或更高的肿瘤:血液比。
[0169]
用于cd8的体内检测的技术在一些实施方案中,体内cd8结合剂与cd8(例如cd8
细胞,例如,cd8
t细胞)的结合经由以下至少一种检测:免疫pet(immuno pet)(正电子发射体层摄影术),spect(单光子发射计算机化断层显像),mri(磁共振成像),其也称为nmr(核磁共振),近红外(nir)或契仑科夫发光成像(cli)。在一些实施方案中,cd8结合剂与cd8的结合经由两种或更多种形式的成像来检测。在一些实施方案中,cd8结合剂与cd8的结合经由近红外(nir)和/或cli检测。在一些实施方案中,cd8结合剂与cd8的结合经由免疫spect和/或nir荧光检测。在一些实施方案中,cd8结合剂与cd8的结合经由免疫spect和计算机断层显像(computer tomography)检测。
[0170]
免疫-pet基于用发射正电子的放射性核素如
18
f、
64
cu、
68
ga、
76
br、
86
y、
89
zr和
124
i标记的抗体(如本文提供的抗-cd8抗体)或其片段的重合检测。用于标记抗-cd8抗体的合适放射性核素包括,但不限于,例如,
18
f、
64
cu、
68
ga、
76
br、
86
y、
88
y、
89
zr、
99m
tc、
111
in、
177 lu、
123
i、
124
i、
125
i和
131
i。取决于起始正电子能量和周围环境的密度,发射的正电子将行进最多几毫米的距离(例如,参见,guus等人,(2007) the oncologist, 12: 1379-1389中的表2)。在已失去其动能后,正电子与电子结合,从而导致所谓的湮灭过程,其产生两个光子,每个光子具有511 kev的能量。两个光子同时以相反的方向发射。发射正电子的放射性核素标记的抗-cd8抗体在患者中的分布可以通过用pet照相机检测湮灭光子对来监控。pet照相机由放置在患者身体周围的一圈检测器组成。如果在非常短的时间间隔(一般为5-15纳秒)内通过在身体对侧的检测器记录到两个光子,则假定沿着两个检测器之间的线的某处发生了湮灭事件。通过计算所有线的交叉,可以确定辐射源(放射性标记的抗体)的位置。对于定量,当进行适当的校正时,pet可以提供可靠的信息(参见verel等人,(2005) j nucl med, 46增刊1:164s-171s)。关于免疫pet的额外细节在,例如,van dongen等人,(2007) the oncologist, 12(12): 1379-1389;reddy等人,(2010) semin nucl med. 40(3): 182-189;boerman等人,(2011) j. nucl med. 52(8): 1171-1172;santangelo等人,(2015) nature methods, 12: 427-432中提供。
[0171]
免疫spect(immunospect)成像需要将用发射γ的放射性核素标记的抗体(例如本文提供的抗-cd8抗体)或其片段施用于主体,一般通过注射到血流中。发射γ的放射性核素的实例包括,但不限于,例如,
67
ga、
99m
tc、
111
in、
123
i、
131
i、
153
sm或
186
re。紧接着,使用γ照相机从多个角度获取多个2-d图像。然后使用计算机将断层照相重构算法应用于多个投影,从而产生3-d数据集。然后可以操纵所述数据集以显示沿身体的任何选择的轴的薄切片,类似于从其他断层照相技术获得的那些。为了获取spect图像,γ照相机围绕患者旋转。在旋转期间在限定的点处获取投影,一般每3-6度。在大多数情况下,使用全360-度旋转以获得最佳重构。获得每个投影所花费的时间也是可变的,但一般为15-20秒。这给出了15-20分钟的总扫描时间。在某些情况下,在图像进行共配准(coregistration)的情况下可以制造spect γ扫描仪以与常规ct扫描仪一起操作。这允许定位肿瘤或组织,其可以在spect闪烁照相术
上看到,但相对于其他解剖结构很难精确定位。关于免疫spect的额外细节可以在例如laverman等人,(2015) j nucl med, 56(5): 778-783;lutje等人,(2014) cancer res, 74(21): 6216-6223;muselaers等人,(2013) eur urology 64(4): 1101-1106等中找到。
[0172]
体内mri(磁共振成像),也称为nmr(核磁共振)的原理基于操纵存在于主体身体中的原子核中所含质子和中子(最常见地,在氢原子中发现的那些)的磁性质。这些核的运动产生小的磁矩。当主体的身体被放置在mri扫描仪的磁场中时,这些核的磁矩与磁场的方向对准。然后在扫描仪中将射频(rf)脉冲施加到主体的身体,其激发核,从而在较低和较高能量自旋状态之间存在跃迁。一旦给予rf脉冲,核就回到它们的平衡状态(称为弛豫的过程),从而释放它们吸收的额外能量并发射rf信号。所述信号由扫描仪的rf线圈检测,且然后用于生成身体组织的详细图像。通过使用mri造影剂,可以改进所述图像的对比以及特定身体结构的可见度。可经由mri检测的标记的例子包括,但不限于,例如,超顺磁性氧化铁(包括氧化铁纳米颗粒,例如molday ion罗丹明-b羧基(rhodamine-b carboxyl))、基于
19
f的探针、顺磁金属(例如,钆、锰、氧化锰、镝)、(u)spio、para(cest)、dia(cest)和pfcs。关于使用标记的抗体用于体内mri和/或可经由mri检测的标记的额外信息在,例如,srivastava (2015) dis model mech. 8(4): 323
–
336;zhou等人,(2013) wiley interdiscip rev nanomed nanobiotechnol. 5(1): 1
–
18;sohn等人,(2015) nanomedicine. 11(1): 127-135;bates等人,(2014) plos one 9(5): e97220;zhu等人,(2015) int. j. mol. sci. 16: 9573-9587;和zhang等人,(2014) int j. medicine. 9: 33-41中讨论。
[0173]
nir成像利用近红外光到活组织中的深光子穿透,以提供在《 1cm的深度的内源和/或外源对照的成像。在所述领域内,nir荧光成像集中于检测用发射700-900 nm的荧光的外源造影剂标记的抗体。典型的荧光成像系统已在别处详细描述(de grand等人,(2003) technol cancer res treat, 2:553
–
62;nakayama等人,(2002) mol imaging, 1:365
–
77;ntziachristos等人,(2003) eur radiol, 13:195
–
208;tanaka等人,(2006) ann surg oncol, 13:1671
–
81;themelis等人,(2009) j biomed opt, 4:064012;和troyan等人,(2009) ann surg oncol, 16:2943
–
52。简而言之,它由在混浊介质中激发荧光团的光谱分辨的光源(滤波的宽带光源(filtered broadband source)、发光二极管[led]或激光二极管)组成。然后将从所述荧光团发射的光成像到电荷耦合摄像装置(ccd)照相机上,而特别注意把强大的激发光滤出来。红外染料的例子包括,但不限于,tracy 652、tracy 645、罗丹明染料、花菁染料、cy7、cy7.5、alexa fluor
®
、cydye
®
、irdye
®
、dylight和atto。在约650-约950 nm的近红外(nir)波长的细胞和组织成像对于体内成像是有利的,这是因为所述区域中生物分子的低吸收。关于使用标记的抗体用于体内nir成像和用于体内nir成像的可检测标记的进一步细节在cillers等人,(2017) mol pharmaceuticals 14(5): 1623-1633;hilderbrand等人,(2010) curr opin chem biol. 14(1): 71-79;hong等人,(2017) nat biomed eng. 1, 0010 doi: 10.1038/s41551-016-0010;pansare等人,(2012) chem mater. 24(5): 812
–
827;hickson (2009) urol oncol semin orig invest. 27: 295-297;zhang等人,(2012) curr protoc cytom. 第12章: 单元12.7;quek等人,(2012) nanomaterials. 2: 92-112;luker等人,(2008) j nucl med 49:1-4;和liu等人,(2016) npg asia materials. 8, e295中提供。
[0174]
契仑科夫发光成像(cli)是分子光学成像技术,其基于对由正电子发射体层摄影
术(pet)显像剂(例如本文别处描述的那些)发射的光学契仑科夫光子的检测。其他cli显像剂包括,但不限于,例如,
131
i、
18
f和
90
y。契仑科夫辐射是当带电粒子以在介电介质(即,可以被电场极化的介质)中比光速更快的速度穿过所述介质时产生的。在传播时,带电粒子(带阳电的正电子或带阴电的电子)通过置换介质中原子的正和负电荷来诱导局部极化。参见,例如,grootendorst等人,(2016) clin transl imaging. 4(5): 353-36中的图 1)。当粒子的速度超过光速时,极化沿着粒子的径迹变得不对称,从而导致在离粒子更大的距离的偶极电场。当粒子通过时,原子的电子回到它们的基态,从而将转移的能量作为光学光子发射。cli图像可以通过使用超高灵敏度光学照相机如电子倍增电荷耦合摄像装置(emccd)照相机检测来自pet示踪物的契仑科夫光来获取。cli图像可以以光子辐射半定量地进行分析。cli和pet正相关,这是因为两种技术都测量发射正电子的放射性药物产生的光子;pet测量湮灭光子,而cli测量契仑科夫光子。几项研究已显示了对于体外、先体外后体内和体内不同放射性药物的cli和pet之间的强相关性,从而证明了cli用于活主体分子成像的可行性。关于cli或详述cli和pet之间相关性的出版物包括,例如,xu等人,(2012) j nucl med, 53(2):312
–
317;liu等人,(2010) plos one. 5(3):e9470;zhang等人,(2013) plos one. 8(4):e62007;hu等人,(2015) eur radiol. 25(6):1814
–
1822;robertson等人,(2011) j nucl med. 52(11):1764
–
1769;timmermand等人,(2015) j nucl med. 56(3):444
–
449;cao等人,(2014) biomed opt express. 5(10):3660
–
3670和thorek等人,(2014) j nucl med. 55(1):95
–
98。
[0175]
用于预测患有癌症的主体对免疫治疗的反应性的方法还提供了预测患有癌症的主体对用免疫治疗剂治疗的反应性的方法。在一些实施方案中,方法包括施用标记的cd8结合剂并检测标记的cd8结合剂与主体肿瘤组织中的cd8
t细胞的结合,其中结合的检测表明主体很可能对免疫治疗剂有反应。在一些实施方案中,方法包括施用本文所述的标记的cd8结合剂并检测标记的cd8结合剂与主体肿瘤组织中的cd8
t细胞的结合,其中结合的检测表明主体需要用免疫治疗剂进行治疗。在一些实施方案中,cd8结合剂用可检测标记(例如,
89
zr、
124
i、
18
f、
68
ga等)标记,并且标记的cd8结合剂与肿瘤组织中cd8
t细胞的结合经由pet或pet/ct检测。在一些实施方案中,cd8结合剂是与
18
f标记缀合的抗-cd8 vhh。在一些实施方案中,cd8结合剂是经由式(i)化合物与[
18
f]-氟化铝复合物缀合的抗-cd8 vhh。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含seq id no: 3的氨基酸序列。在一些实施方案中,抗-cd8 vhh包含seq id no: 4的氨基酸序列。
[0176]
在一些实施方案中,方法包括将治疗有效量的免疫治疗剂、细胞治疗或癌症疫苗(例如,个性化癌症疫苗或“pcv”)施用给主体,在所述主体中已检测到标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。
[0177]
在一些实施方案中,施用cd8结合剂达不止一次用于重复预测主体对免疫治疗剂的反应性。在一些实施方案中,在延长的时间段内重复所述方法,例如至少约6个月、1年、2年、3年、4年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0178]
在一些实施方案中,免疫治疗剂是免疫检查点抑制剂。在一些实施方案中,免疫检查点抑制剂是治疗用抗-ctla-4抗体,例如伊匹单抗(ipilimumab)(yervoy
®
)。在一些实施方案中,免疫检查点抑制剂是治疗用抗-pd-1抗体。在一些实施方案中,治疗用抗-pd-1 抗体是纳武单抗(nivolumab)(opdivo
®
)。在一些实施方案中,治疗用抗-pd-1 抗体是派姆单抗(pembrolizumab)(keytruda
®
)。在一些实施方案中,治疗用抗-pd-1抗体是匹地珠单抗(pidlizumab)。
[0179]
在一些实施方案中,免疫检查点抑制剂是治疗用抗-pd-l1抗体。在一些实施方案中,治疗用抗-pd-l1抗体是bms-936559。在一些实施方案中,治疗用抗-pd-l1抗体是阿维单抗(avelumab)(banvencio
®
)。在一些实施方案中,治疗用抗-pd-l1抗体是德瓦鲁单抗(durvalumab)(imfinzi
®
)。在一些实施方案中,治疗用抗-pd-l1抗体是阿替利珠单抗(tecentriq
®
)。
[0180]
关于治疗用免疫检查点抑制剂的进一步细节在,例如,byun等人,(2017) nat rev endocrinol. 13: 195-207;la-beck等人,(2015) pharmacotherapy. 35(10): 963-976;buchbinder等人,(2016) am j clin oncol. 39(1): 98-106;michot等人,(2016) eur j cancer. 54: 139-148和topalian等人,(2016) nat rev cancer. 16: 275-287中提供。
[0181]
在一些实施方案中,将免疫检查点抑制剂与一种或多种额外的治疗(例如化疗)剂组合施用于主体。在一些实施方案中,与一种或多种额外的治疗(例如化疗)剂组合施用于主体的免疫检查点抑制剂是抗-pd-l1抗体(例如阿替利珠单抗)。化疗剂的实例包括厄洛替尼(erlotinib)(tarceva
®
, genentech/osi pharm.),硼替佐米(bortezomib)(velcade
®
, millennium pharm.),双硫仑,没食子酸表没食子儿茶精,salinosporamide a,卡非佐米(carfilzomib),17-aag(格尔德霉素),根赤壳菌素,乳酸脱氢酶a(ldh-a),氟维司群(fulvestrant)(faslodex
®
, astrazeneca),苏尼替尼(sunitib)(sutent
®
, pfizer/sugen),来曲唑(femara
®
, novartis),甲磺酸伊马替尼(imatinib mesylate)(gleevec
®
, novartis),finasunate(vatalanib
®
, novartis),奥沙利铂(eloxatin
®
, sanofi),5-fu(5-氟尿嘧啶),亚叶酸,瑞帕霉素(西罗莫司,rapamune
®
, wyeth),拉帕替尼(lapatinib)(tykerb
®
, gsk572016, glaxo smith kline),洛那发尼(lonafamib)(sch 66336),索拉非尼(sorafenib)(nexavar
®
, bayer labs),吉非替尼(gefitinib)(iressa
®
, astrazeneca),ag1478,烷化剂如噻替哌和cytoxan
®
环磷酰胺;烷基磺酸盐,例如白消安、二丙胺磺酯和哌泊舒凡;氮丙啶类,例如苯多巴(benzodopa)、卡波醌、美妥多巴(meturedopa)和乌瑞多巴(uredopa);乙烯亚胺类和甲基蜜胺类(methylamelamines),包括六甲密胺、三乙撑密胺、三乙撑磷酰胺、乙胺硫磷和三甲醇密胺;acetogenins(尤其是布拉它辛(bullatacin)和布拉它辛酮(bullatacinone));喜树碱(包括拓扑替康和伊立替康);苔藓虫素;callystatin;cc-1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);cryptophycins(特别是cryptophycin 1和cryptophycin 8);肾上腺类固醇类(包括泼尼松和泼尼松龙);环丙孕酮;5α-还原酶,包括非那雄胺和度泰利特);伏立诺他(vorinostat),罗米地辛(romidepsin),帕比司他(panobinostat),丙戊酸,mocetinostat多拉司他汀(dolastatin);阿地流津,滑石倍癌霉素(包括合成类似物,kw-2189和cb1-tm1);软珊瑚醇(eleutherobin);pancratistatin;匍枝珊瑚醇(sarcodictyin);海绵抑制素(spongistatin);氮芥,例如苯丁酸氮芥、萘氮芥
(chlomaphazine)、氯磷酰胺(chlorophosphamide)、雌莫司汀、异环磷酰胺、氮芥、盐酸氧氮芥、美法仑、新氮芥、苯芥胆甾醇、松龙苯芥、三芥环磷酰胺、尿嘧啶氮芥;亚硝基脲类,例如卡莫司汀、氯脲霉素、福泰氮芥、罗氮芥、尼氮芥和雷诺氮芥;抗生素类,例如烯二炔(enediyne)抗生素类(例如,加利车霉素,尤其是加利车霉素γ1i和加利车霉素ω1i(angew chem. intl. ed. engl. 1994, 33:183-186);达内霉素(dynemicin),包括达内霉素a;二膦酸盐,例如氯屈膦酸二钠;埃斯波霉素;以及新制癌菌素发色团和相关的色蛋白烯二炔抗生素发色团),阿克拉霉素(aclacinomysins),放线菌素,安曲霉素(authramycin),氮丝氨酸,博来霉素,放线菌素c(cactinomycin),carabicin,caminomycin,嗜癌霉素,色霉素(chromomycinis),放线菌素d,柔红霉素,二乙氧醋酰阿霉素,6-重氮-5-氧-l-正亮氨酸,adriamycin
®
(阿霉素),吗啉代-阿霉素,氰基吗啉代-阿霉素,2-吡咯啉代-阿霉素和脱氧阿霉素),表阿霉素,去羟阿霉素,伊达比星,麻西罗霉素,丝裂霉素如丝裂霉素c,霉酚酸,诺加拉霉素,橄榄霉素,培来霉素,普福霉素(porfiromycin),嘌呤霉素,三铁阿霉素,罗多比星(rodorubicin),链黑霉素,链脲霉素,杀结核菌素,乌苯美司,新制癌菌素,佐柔比星;抗代谢物,例如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,例如二甲叶酸、甲氨蝶呤、蝶酰三谷氨酸、曲美沙特;嘌呤类似物,例如氟达拉滨、6-巯基嘌呤、硫唑鸟嘌呤、硫鸟嘌呤;嘧啶类似物,例如环胞苷、氮杂胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、多西氟尿啶、依诺他宾、氟尿苷;雄激素,例如卡鲁睾酮、羟甲雄酮丙酸酯、环硫雄醇、甲硫环甾烷、睾内酯;抗肾上腺素类,如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,如frolinic acid;乙酰葡醛酯;醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸;恩尿嘧啶(eniluracil);安吖啶;阿莫司汀(bestrabucil);必桑郡;依达曲沙;defofamine;秋水仙胺;地吖醌;elfomithine;醋酸羟哔咔唑;埃博霉素(epothilone);环氧甘醚;硝酸镓;羟基脲;香菇多糖;氟尼达明(lonidainine);美登木素生物碱,例如美登素和美坦西醇;丙米腙;米托蒽醌;蒙匹胺醇(mopidamnol);二胺硝吖啶(nitraerine);喷司他丁;苯来美特;吡柔比星;洛索蒽醌(losoxantrone);鬼臼酸;2-乙基酰肼;丙卡巴肼;psk
®
多糖复合物(jhs natural products, eugene, oreg.);丙亚胺;根霉素;裂裥多糖;螺锗;细格孢氮杂酸;三亚胺酮;2,2',2"-三氯三乙胺;单端孢霉烯类(trichothecenes)(尤其是t-2毒素、verracurin a、杆孢菌素a和蛇形菌素(anguidine));乌拉坦;长春地辛;达卡巴嗪;甘露醇氮芥;二溴甘露醇;二溴卫矛醇;派泊溴烷;gacytosine;阿糖胞苷(“ara-c”);环磷酰胺;噻替哌;紫杉烷类(taxoids),例如,taxol(紫杉醇;bristol-myers squibb oncology, princeton, n.j.)、abraxane
®
(不含聚氧乙烯蓖麻油(cremophor))、白蛋白人工改造的紫杉醇纳米颗粒制剂(american pharmaceutical partners, schaumberg, ill.)和taxotere
®
(多西紫杉、多西他赛(doxetaxel);sanofi-aventis);苯丁酸氮芥;gemzar
®
(吉西他滨);6-硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂类似物,例如顺铂和卡铂;长春碱;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新碱;navelbine
®
(长春烯碱);二羟蒽二酮;替尼泊苷;依达曲沙;柔红霉素;氨基蝶呤;卡培他滨(xeloda
®
);伊本膦酸钠;cpt-11;拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo);类视黄醇类,如视黄酸;以及上述任一种的药学上可接受的盐、酸和衍生物。
[0182]
化疗剂还包括(i)起调节或抑制对肿瘤的激素作用的抗激素剂,例如抗雌激素和选择性雌激素受体调节剂(serms),包括,例如,他莫昔芬(包括nolvadex
®
;枸橼酸他莫昔芬)、雷洛昔芬、屈洛西芬、艾多昔芬(iodoxyfene)、4-羟基他莫昔芬、曲奥昔芬、那洛西芬、
ly117018、奥那斯酮和fareston
®
(柠檬酸托瑞米芬);(ii)抑制酶芳化酶的芳化酶抑制剂,其调节肾上腺中的雌激素产生,如,例如,4(5)-咪唑、氨鲁米特、megase
®
(醋酸甲地孕酮)、aromasin
®
(依西美坦;pfizer)、福美司坦(formestanie)、法曲唑、rivisor
®
(伏罗唑)、femara
®
(来曲唑;novartis)和arimidex
®
(阿那曲唑;astrazeneca);(iii)抗雄激素,例如氟他胺、尼鲁米特、比卡鲁胺、利普安和性瑞林;布舍瑞林、曲普瑞林(tripterelin)、醋酸甲羟孕酮、己烯雌酚、妊马雌酮、氟甲睾酮、全反式视黄酸、维甲酰酚胺以及曲沙他滨(troxacitabine)(1,3-二氧戊环核苷胞嘧啶类似物);(iv)蛋白激酶抑制剂;(v)脂质激酶抑制剂;(vi)反义寡核苷酸,特别是抑制和异常细胞增殖牵涉的信号传导途径中基因表达的那些,如,例如,pkc-α、ralf和h-ras;(vii)核酶,例如vegf表达抑制剂(例如,angiozyme
®
)和her2表达抑制剂;(viii)疫苗,例如基因治疗疫苗,例如allovectin
®
、leuvectin
®
和vaxid
®
;proleukin
®
,ril-2;拓扑异构酶1抑制剂,例如lurtotecan
®
;abarelix
® rmrh;和(ix)上述任一种的药学上可接受的盐、酸和衍生物。
[0183]
化疗剂还包括抗体如阿仑单抗(alemtuzumab)(campath),贝伐珠单抗(bevacizumab)(avastin
®
, genentech);西妥昔单抗(cetuximab)(erbitux
®
, imclone);帕尼单抗(panitumumab)(vectibix
®
, amgen),利妥昔单抗(rituximab)(rituxan
®
, genentech/biogen idec),帕妥珠单抗(pertuzumab)(omnitarg
®
, 2c4, genentech),曲妥珠单抗(herceptin
®
, genentech),托西莫单抗(tositumomab)(bexxar, corixia)和抗体药物缀合物,吉妥珠单抗奥唑米星(gemtuzumab ozogamicin)(mylotarg
®
, wyeth)。具有作为与本技术的化合物组合的试剂的治疗潜力的额外的人源化单克隆抗体包括:阿泊珠单抗(apolizumab)、阿塞珠单抗(aselizumab)、atlizumab、巴匹组单抗(bapineuzumab)、莫比伐珠单抗(bivatuzumab mertansine)、莫坎妥珠单抗(cantuzumab mertansine)、西利珠单抗(cedelizumab)、培塞利珠单抗(certolizumab pegol)、cidfusituzumab、cidtuzumab、达利珠单抗(daclizumab)、依库珠单抗(eculizumab)、依法利珠单抗(efalizumab)、依帕珠单抗(epratuzumab)、厄利珠单抗(erlizumab)、泛维珠单抗(felvizumab)、 芳妥珠单抗(fontolizumab)、吉妥珠单抗奥唑米星、奥英妥珠单抗(inotuzumab ozogamicin)、伊匹单抗、拉贝珠单抗(labetuzumab)、林妥珠单抗(lintuzumab)、马妥珠单抗(matuzumab)、美泊利单抗(mepolizumab)、莫维珠单抗(motavizumab)、motovizumab、那他珠单抗(natalizumab)、尼妥珠单抗(nimotuzumab)、nolovizumab、numavizumab、奥瑞组单抗(ocrelizumab)、奥马珠单抗(omalizumab)、帕利珠单抗(palivizumab)、帕考珠单抗(pascolizumab)、pecfusituzumab、pectuzumab、培克珠单抗(pexelizumab)、ralivizumab、雷珠单抗(ranibizumab)、reslivizumab、瑞利珠单抗(reslizumab)、resyvizumab、罗维珠单抗(rovelizumab)、卢利珠单抗(ruplizumab)、西罗珠单抗(sibrotuzumab)、西利珠单抗(siplizumab)、索土珠单抗(sontuzumab)、替他珠单抗(tacatuzumab tetraxetan)、tadocizumab、他利珠单抗(talizumab)、替非组单抗 (tefibazumab)、 托珠单抗(tocilizumab)、托西珠单抗(toralizumab)、西莫白介素单抗(tucotuzumab celmoleukin)、tucusituzumab、umavizumab、乌珠单抗(urtoxazumab)、乌司奴单抗(ustekinumab)、维西珠单抗(visilizumab)和抗-白细胞介素-12(abt-874/j695, wyeth research and abbott laboratories),其是基因修饰以识别白细胞介素-12 p40蛋白的重组全人序列全长igg
1 λ抗体。
[0184]
化疗剂还包括“egfr抑制剂”,其指与egfr结合或以其他方式直接相互作用并阻止或降低其信号传导活性的化合物,且另一方面称为“egfr拮抗剂”。
”ꢀ
这种试剂的例子包括结合egfr的抗体和小分子。结合egfr的抗体的实例包括mab 579(atcc crl hb 8506),mab 455(atcc crl hb8507),mab 225(atcc crl 8508),mab 528(atcc crl 8509)(参见美国专利no. 4,943,533,mendelsohn等人)及其变体,例如嵌合的225(c225或西妥昔单抗;erbutix
®
)和重构的人225(h225)(参见wo 96/40210, imclone systems inc.);imc-11f8,完全人的靶向egfr的抗体(imclone);结合ii型突变egfr的抗体(美国专利no. 5,212,290);如美国专利no. 5,891,996中所述的结合egfr的人源化和嵌合抗体;和结合egfr的人抗体,例如abx-egf或帕尼单抗(参见wo98/50433, abgenix/amgen);emd 55900(stragliotto等人,eur. j. cancer 32a:636-640(1996));emd7200(马妥珠单抗)与egf和tgf-α两者竞争egfr结合的针对egfr的人源化egfr抗体(emd/merck);人egfr抗体,humax-egfr(genmab);称为e1.1、e2.4、e2.5、e6.2、e6.4、e2.11、e6. 3和e7.6. 3且描述于us 6,235,883中的完全人抗体;mdx-447(medarex inc);和mab 806或人源化mab 806(johns等人,j. biol. chem. 279(29):30375-30384(2004))。抗-egfr抗体可以与细胞毒剂缀合,从而产生免疫缀合物(参见,例如,ep659439a2, merck patent gmbh)。egfr拮抗剂包括小分子,例如在美国专利nos:5,616,582;5,457,105;5,475,001;5,654,307;5,679,683;6,084,095;6,265,410;6,455,534;6,521,620;6,596,726;6,713,484;5,770,599;6,140,332;5,866,572;6,399,602;6,344,459;6,602,863;6,391,874;6,344,455;5,760,041;6,002,008;和5,747,498;以及以下pct公开:wo 98/14451、wo 98/50038、wo 99/09016和wo 99/24037中描述的化合物。特定的小分子egfr拮抗剂包括osi-774(cp-358774,厄洛替尼,tarceva
® genentech/osi pharmaceuticals);pd 183805(ci 1033,2-丙烯酰胺, n-[4-[(3-氯-4-氟苯基)氨基]-7-[3-(4-吗啉基)丙氧基]-6-喹唑啉基]-, 二盐酸化物,pfizer inc.);zd1839,吉非替尼(iressa
®
)4-(3
’‑
氯-4
’‑
氟苯胺基)-7-甲氧基-6-(3-吗啉代丙氧基)喹唑啉,astrazeneca);zm 105180((6-氨基-4-(3-甲基苯基-氨基)-喹唑啉,zeneca);bibx-1382(n8-(3-氯-4-氟-苯基)-n2-(1-甲基-哌啶-4-基)-嘧啶并[5,4-d]嘧啶-2,8-二胺,boehringer ingelheim);pki-166((r)-4-[4-[(1-苯乙基)氨基]-1h-吡咯并[2,3-d]嘧啶-6-基]-酚);(r)-6-(4-羟基苯基)-4-[(1-苯乙基)氨基]-7h-吡咯并[2,3-d]嘧啶);cl-387785(n-[4-[(3-溴苯基)氨基]-6-喹唑啉基]-2-丁炔酰胺);ekb-569(n-[4-[(3-氯-4-氟苯基)氨基]-3-氰基-7-乙氧基-6-喹啉基]-4-(二甲氨基)-2-丁烯酰胺)(wyeth);ag1478(pfizer);ag1571(su 5271;pfizer);双重egfr/her2酪氨酸激酶抑制剂如拉帕替尼(tykerb
®
,gsk572016或n-[3-氯-4-[(3氟苯基)甲氧基]苯基]-6[5[[[2甲磺酰)乙基]氨基]甲基]-2-呋喃基]-4-氨基喹唑啉)。
[0185]
化疗剂还包括“酪氨酸激酶抑制剂”,包括前面段落中提到的egfr-靶向药物;可从takeda获得的小分子her2酪氨酸激酶抑制剂如tak165;cp-724,714,erbb2受体酪氨酸激酶的口服选择性抑制剂(pfizer和osi);双重-her抑制剂,例如ekb-569(可从wyeth获得),其优先结合egfr,但抑制her2和egfr-超表达细胞两者;拉帕替尼(gsk572016;可从glaxo-smithkline获得),口服her2和egfr酪氨酸激酶抑制剂;pki-166(可从novartis获得); pan-her抑制剂,例如卡奈替尼(canertinib)(ci-1033;pharmacia);raf-1抑制剂,例如可从isis pharmaceuticals获得的反义剂isis-5132,其抑制raf-1信号传导;非-her靶向tk
抑制剂,例如甲磺酸伊马替尼(gleevec
®
,可从glaxo smithkline获得);多靶向的酪氨酸激酶抑制剂,例如舒尼替尼(sunitinib)(sutent
®
,可从pfizer获得);vegf受体酪氨酸激酶抑制剂,例如瓦他拉尼 (vatalanib)(ptk787/zk222584,可从novartis/schering ag获得);mapk细胞外调节的激酶i抑制剂ci-1040(可从pharmacia获得);喹唑啉类,例如pd 153035,4-(3-氯苯胺基)喹唑啉;吡啶并嘧啶;嘧啶并嘧啶;吡咯并嘧啶,例如cgp 59326、cgp 60261和cgp 62706;吡唑并嘧啶,4-(苯基氨基)-7h-吡咯并[2,3-d]嘧啶;姜黄色素(二阿魏酰甲烷,4,5-双(4-氟苯胺基)邻苯二甲酰亚胺);含有硝基噻吩部分的酪氨酸磷酸化抑制剂;pd-0183805(warner-lambert);反义分子(例如结合编码her的酸的那些);喹喔啉类(美国专利no. 5,804,396);tryphostins(美国专利no. 5,804,396);zd6474(astra zeneca);ptk-787(novartis/schering ag);pan-her抑制剂,例如ci-1033(pfizer);affinitac(isis 3521;isis/lilly);甲磺酸伊马替尼(gleevec
®
);pki 166(novartis);gw2016(glaxo smithkline);ci-1033(pfizer);ekb-569(wyeth);司马沙尼(semaxinib)(pfizer);zd6474(astrazeneca);ptk-787(novartis/schering ag);inc-1c11(imclone)、瑞帕霉素(西罗莫司,rapamune
®
);或如以下专利公开的任一种所述的:美国专利no. 5,804,396;wo 1999/09016(american cyanamid);wo 1998/43960(american cyanamid);wo 1997/38983(warner lambert);wo 1999/06378(warner lambert);wo 1999/06396(warner lambert);wo 1996/30347(pfizer, inc);wo 1996/33978(zeneca);wo 1996/3397(zeneca)和 wo 1996/33980(zeneca)。
[0186]
化疗剂还包括地塞米松、干扰素、秋水仙碱、氯苯氨啶、环孢素、两性霉素、甲硝唑、阿仑单抗、阿利维甲酸(alitretinoin)、别嘌醇、氨磷丁、三氧化二砷、天冬酰胺酶、bcg活、贝伐珠单抗(bevacuzimab)、贝沙罗汀(bexarotene)、克拉屈滨、氯法拉滨(clofarabine)、阿法达贝泊汀(darbepoetin alfa)、denileukin、右丙亚胺、阿法依泊汀、elotinib、非格司亭、乙酸希司曲林、替伊莫单抗(ibritumomab)、干扰素α-2a、干扰素α-2b、来那度胺(lenalidomide)、左旋咪唑、美司钠、甲氧补骨脂素、诺龙、奈拉滨(nelarabine)、诺非单抗(nofetumomab)、奥普瑞白介素(oprelvekin)、帕利夫明(palifermin)、氨羟二磷酸二钠、培格脱氨酶(pegademase)、培加帕酶、聚乙二醇化非格司亭(pegfilgrastim)、培美曲塞二钠(pemetrexed disodium)、普卡霉素、卟吩姆钠、米帕林、拉布立酶(rasburicase)、沙格司亭、替莫唑胺、vm-26、6-tg、托瑞米芬、维甲酸、atra、戊柔比星、唑来膦酸盐(zoledronate)和唑来膦酸(zoledronic acid),及其药学上可接受的盐。
[0187]
化疗剂还包括氢化可的松、醋酸氢化可的松、醋酸可的松、特戊酸硫氢可的松、曲安奈德、去炎松醇、莫美达松、安西缩松、布地奈德、丙缩羟强龙、氟轻松、醋酸氟轻松、倍他米松、倍他米松磷酸酯钠、地塞米松、地塞米松磷酸钠、氟可龙、氢化可的松-17-丁酸酯、氢化可的松-17-戊酸酯、阿氯米松双丙酸酯(aclometasone dipropionate)、戊酸倍他米松、二丙酸倍他米松、泼尼卡松、氯倍他松-17-丁酸酯、氯倍他索-17-丙酸酯、己酸氟可龙、特戊酸氟可龙和醋酸氟甲叉龙;免疫选择性抗炎肽(imsaids),例如苯丙氨酸-谷氨酰胺-甘氨酸(feg)及其d-异构形式(feg)(imulan biotherapeutics, llc);抗风湿药如硫唑嘌呤、环孢素(环孢素a)、d-青霉胺、金盐、羟氯喹、来氟洛米米诺环素、柳氮磺吡啶、肿瘤坏死因子α(tnfα)阻断剂如依那西普(etanercept)(enbrel)、英夫利昔单抗(infliximab)(remicade)、阿达木单抗(adalimumab)(humira)、培塞利珠单抗(certolizumab pegol)
(cimzia)、戈利木单抗(golimumab)(simponi)、白细胞介素1(il-1)阻断剂如阿那白滞素(anakinra)(kineret)、t细胞共刺激阻断剂如阿巴西普(abatacept)(orencia)、白细胞介素6(il-6)阻断剂如托珠单抗(actemera
®
);白细胞介素13(il-13)阻断剂例如来瑞组单抗(lebrikizumab);干扰素α(ifn)阻断剂例如隆利组单抗(rontalizumab);β7整联蛋白阻断剂例如rhumab β7;ige途径阻断剂,例如抗-m1’;分泌型同三聚体lta3和膜结合异三聚体lta1/β2阻断剂,例如抗淋巴毒素α(lta);放射性同位素(例如,at
211
、i
131
、i
125
、y
90
、re
186
、re
188
、sm
153
、bi
212
、p
32
、pb
212
和lu的放射性同位素);各种研究试剂,例如thioplatin、ps-341、丁酸苯酯、et-18
‑ꢀ
och3或法尼基转移酶抑制剂(l-739749、l-744832);多酚类如槲皮素、白藜芦醇(resveratrol)、白皮杉醇(piceatannol)、没食子酸表没食子儿茶精、茶黄素、黄烷醇、矢车菊苷配基(procyanidins)、白桦酯酸及其衍生物;自噬抑制剂,如氯喹;δ-9-四氢大麻酚(屈大麻酚,marinol
®
);β-拉帕醌(lapachone);拉帕醇;秋水仙碱;白桦酯酸;乙酰基喜树碱(acetylcamptothecin)、东莨菪素(scopolectin)和9-氨基喜树碱);鬼臼毒素;喃氟啶(uftoral
®
);贝沙罗汀(targretin
®
);二膦酸盐,例如氯屈膦酸二钠(例如bonefos
®
或ostac
®
)、依替膦酸钠(didrocal
®
)、ne-58095、唑来膦酸/唑来膦酸盐(zometa
®
)、阿仑膦酸钠(fosamax
®
)、氨羟二磷酸二钠(aredia
®
)、替鲁膦酸钠(skelid
®
)或利塞膦酸钠(actonel
®
);和表皮生长因子受体(egf-r);疫苗,例如theratope
®
疫苗;哌立福辛(perifosine)、cox-2抑制剂(例如塞来昔布或依托考昔(etoricoxib))、蛋白体抑制剂(例如ps341);cci-779;替吡法尼(tipifarnib)(r11577);orafenib、abt510;bcl-2抑制剂,例如奥利默森钠(oblimersen sodium)(genasense
®
);匹克生琼(pixantrone);法尼基转移酶抑制剂,例如洛那法尼(lonafarnib)(sch 6636,sarasar
tm
);和上述任一种的药学上可接受的盐、酸或衍生物;以及上述两种或更多种的组合,例如chop,环磷酰胺、阿霉素、长春新碱和泼尼松龙联合治疗的缩写;和folfox,与5-fu和亚叶酸联合的奥沙利铂(eloxatin
tm
)的治疗方案的缩写。
[0188]
化疗剂还包括具有镇痛、解热和抗炎作用的非类固醇抗炎药。nsaids包括酶环加氧酶的非选择性抑制剂。nsaids的具体实例包括阿司匹林,丙酸衍生物如布洛芬,非诺洛芬钙,酮洛芬,氟比洛芬,奥沙普嗪和萘普生,乙酸衍生物如消炎痛,舒林酸,依托度酸,双氯芬酸钠,烯醇酸(enolic acid)衍生物如吡罗昔康,美洛昔康,替诺昔康,卓喜康,氯诺昔康和伊索昔康,灭酸衍生物,例如甲芬那酸,甲氯芬那酸,氟灭酸,托芬那酸,以及cox-2抑制剂,例如塞来昔布,依托考昔,鲁米考昔(lumiracoxib),帕瑞昔布(parecoxib),洛芬昔布,洛芬昔布和伐地昔布(valdecoxib)。
[0189]
在一些实施方案中,抗-pd-l1抗体(例如阿替利珠单抗)与一种或多种以下化疗剂联合施用:抗-her2抗体(例如,曲妥珠单抗(herceptin
®
,genentech)或帕妥珠单抗(perjeta
®
,genentech))、pd1结合拮抗剂(例如,mdx-1106(纳武单抗)、mk-3475(派姆单抗、兰洛利珠单抗(lambrolizumab))、ct-011(匹地利珠单抗(pidilizumab))或amp-224)和pd-l2结合拮抗剂。
[0190]
在一些实施方案中,抗-pd-l1抗体(例如阿替利珠单抗)与生长抑制剂组合施用。当在本文中使用时,“生长抑制剂”指体外或体内抑制细胞生长的化合物或组合物。示例性生长抑制剂包括,例如,长春花类(vincas)(长春新碱和长春碱)、紫杉烷类(多西他赛(taxotere
®
,rhone-poulenc rorer)和紫杉醇(taxol
®
,bristol-myers squibb))和拓扑
异构酶ii抑制剂,例如阿霉素、表阿霉素、柔红霉素、依托泊苷和博来霉素。那些停滞g1的试剂也溢出到s-期停滞,例如dna烷化剂,例如他莫昔芬、泼尼松、达卡巴嗪、氮芥、顺铂、甲氨蝶呤、5-氟尿嘧啶和ara-c。进一步的信息可以在mendelsohn和israel,编,the molecular basis of cancer, 第1章,murakami等人的题目为“cell cycle regulation, oncogenes, and antineoplastic drugs”(w.b. saunders, philadelphia, 1995),例如,第13页中找到。
[0191]
在一些实施方案中,免疫治疗剂是树突细胞激活剂或树突细胞生长因子。在一些实施方案中,免疫治疗剂是疫苗佐剂。在一些实施方案中,免疫治疗剂是t-细胞刺激物或生长因子。在一些实施方案中,免疫治疗剂是中和或抑制抑制性免疫细胞、细胞因子和/或酶的试剂。
[0192]
在一些实施方案中,方法包括施用选自下述的免疫治疗剂:抗-tigit抗体、tigit拮抗剂、抗-csf-1r抗体、抗-csf-1r拮抗剂、抗-cea抗体、抗-cea拮抗剂、抗-ctla4抗体、ctla4拮抗剂、抗-ox40抗体、ox40激动剂、与一种或多种化疗剂组合的任何抗-pdl1抗体、与一种或多种化疗剂组合的任何抗-pd1抗体和与一种或多种化疗剂组合的阿替利珠单抗。在一些实施方案中,抗-pd1或抗-pdl1抗体与tarceva
®
(厄洛替尼)、zelboraf
®
(威罗菲尼)、gazyva
®
(阿托珠单抗)、avastin
®
(贝伐珠单抗)、cotellic
®
(考比替尼)、zelboraf
®
(威罗菲尼)和cotellic
®
(考比替尼)、alecensa
®
(阿来替尼)、kadcyla
®
(曲妥珠单抗美坦新偶联物)、herceptin
®
(曲妥珠单抗)、perjeta
®
(帕妥珠单抗)、泊洛妥珠单抗、inf-α、抗-cd40剂、抗-ox40抗体(例如,ox40激动剂)、抗-csf-1r抗体、抗-cea抗体、ido抑制剂或抗-tigit抗体中的一种或多种组合。在一些实施方案中,抗pd-l1抗体是阿替利珠单抗,并且阿替利珠单抗与tarceva
®
(厄洛替尼)、zelboraf
®
(威罗菲尼)、gazyva
®
(阿托珠单抗)、avastin
®
(贝伐珠单抗)、cotellic
®
(考比替尼)、zelboraf
®
(威罗菲尼)和cotellic
®
(考比替尼)、alecensa
®
(阿来替尼)、kadcyla
®
(曲妥珠单抗美坦新偶联物)、herceptin
®
(曲妥珠单抗)、perjeta
®
(帕妥珠单抗)、泊洛妥珠单抗、inf-α、抗-cd40剂、抗-ox40抗体(例如,ox40激动剂)、抗-csf-1r抗体、抗-cea抗体、ido抑制剂、抗-ctla4抗体或抗-tigit抗体中的一种或多种组合。在一些实施方案中,免疫治疗剂是细胞因子。在一些实施方案中,细胞因子是il2、人工改造的il2、il15或人工改造的il15。在一些实施方案中,免疫治疗剂是树突细胞调节剂,例如树突细胞激活剂或树突细胞生长因子。
[0193]
在一些实施方案中,细胞治疗是嵌合抗原受体t细胞(car-t)治疗。在一些实施方案中,细胞治疗是人工改造的t-细胞受体t细胞(tcr-t)治疗。在一些实施方案中,细胞治疗是新抗原特异性t细胞治疗。
[0194]
监控患有癌症的主体中的进展的方法本文提供了监控患有癌症的主体中的疾病进展的方法。这种方法包括向主体施用标记的cd8结合剂并在第一时间点和第二时间点检测标记的cd8结合剂与主体肿瘤组织中的cd8
t细胞的结合。在一些实施方案中,方法进一步包括向主体施用治疗有效量的免疫治疗剂(例如,本文别处描述的免疫治疗剂),其中疾病在主体中已进展。在一些实施方案中,方法包括(a)在施用免疫治疗剂之前向主体施用标记的cd8结合剂并检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合,(b)施用免疫治疗剂,(c)在施用免疫治疗剂后的时间点将标记的cd8结合剂施用于主体并检测标记的cd8结合剂与肿瘤组织中的cd8
t 细
胞的结合,和(d)测量施用免疫治疗剂之前和之后肿瘤组织中cd8
t细胞标记中的差异。
[0195]
在一些实施方案中,免疫治疗剂是免疫检查点抑制剂。在一些实施方案中,免疫检查点抑制剂是抗-pd1抗体(例如,但不限于,本文所述的抗-pd1抗体)。在一些实施方案中,免疫检查点抑制剂是抗-pd-l1抗体(例如,但不限于,本文所述的抗-pd-l1抗体)。在一些实施方案中,抗-pd-l1抗体是阿替利珠单抗。在一些实施方案中,将抗-pd-l1抗体(例如阿替利珠单抗)与第二治疗剂(例如,但不限于,本文别处描述的免疫治疗剂和/或化疗剂)组合施用于主体。在一些实施方案中,第二治疗剂是免疫治疗剂。在一些实施方案中,免疫治疗剂是抗-pd-l1抗体或抗-pd1抗体,其进一步与抗-tigit抗体、tigit拮抗剂、抗-csf-1r抗体、抗-csf-1r拮抗剂、抗-cea抗体、抗-cea拮抗剂、抗-ox40抗体、ox40激动剂、抗-ctla4抗体、ctla4拮抗剂、tarceva
®
(厄洛替尼)、zelboraf
®
(威罗菲尼)、gazyva
®
(阿托珠单抗)、avastin
®
(贝伐珠单抗)、cotellic
®
(考比替尼)、zelboraf
®
(威罗菲尼)和cotellic
®
(考比替尼)、alecensa
®
(阿来替尼)、kadcyla
®
(曲妥珠单抗美坦新偶联物)、herceptin
®
(曲妥珠单抗)、perjeta
®
(帕妥珠单抗)、泊洛妥珠单抗、inf-α、抗-cd40剂或ido抑制剂中的一种或多种组合。
[0196]
在一些实施方案中,免疫治疗剂是细胞因子。在一些实施方案中,细胞因子是il2、人工改造的il2、il15或人工改造的il15。
[0197]
在一些实施方案中,免疫治疗剂是树突细胞调节剂。在一些实施方案中,免疫治疗剂是树突细胞激活剂或树突细胞生长因子。
[0198]
在一些实施方案中,免疫治疗剂的效果通过在第二时间点检测肿瘤组织中cd8
t细胞的水平并将其与在第一时间点肿瘤组织中cd8
t细胞的水平进行比较来确定。在一些实施方案中,当在第二时间点肿瘤组织中cd8
t细胞的水平高于在第一时间点肿瘤组织中cd8
t细胞的水平时,检测到疾病进展。在一些实施方案中,在第三个、第四个或第五个后来的时间点检测肿瘤组织中cd8
t细胞的水平。在一些实施方案中,时间点相隔至少1天、3天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月、1.5年、2年、2.5年、3年或不止三年。在一些实施方案中,在向患者施用免疫治疗剂后检测肿瘤组织中cd8
t细胞的水平。
[0199]
在一些实施方案中,免疫治疗剂的一种或多种给药方案对肿瘤组织的效果通过比较在第一时间点和在第二时间点如通过cd8结合剂所测量的患者的肿瘤组织中cd8
t细胞的水平来确定。在一些实施方案中,在向主体施用免疫治疗剂后cd8 t细胞在肿瘤组织中的水平(或定位)通过比较在施用免疫治疗剂前的第一时间点和在施用后的第二时间点通过cd8结合剂测量的肿瘤组织中cd8
t细胞的水平来确定。
[0200]
在一些实施方案中,cd8结合剂用可检测标记(例如,
89
zr、
124
i、
18
f、
68
ga等)标记,并且经由pet或pet/ct检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。在一些实施方案中,cd8结合剂是与
18
f标记缀合的抗-cd8 vhh。在一些实施方案中,cd8结合剂是经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的抗-cd8 vhh。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含seq id no: 3的氨基酸序列。在一些
实施方案中,抗-cd8 vhh包含seq id no: 4的氨基酸序列。
[0201]
在一些实施方案中,不止一次施用cd8结合剂用于重复监控主体中的癌症进展。在一些实施方案中,在延长的时间段内监控主体,例如至少约6个月、1年、2年、3年、4年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0202]
监控患有癌症的主体中的治疗进展的方法本文提供了在患有癌症的主体中监控治疗进展的方法,所述主体以前已经接受或目前正在接受用免疫治疗剂(例如,本文别处描述的免疫治疗剂)的治疗。这种方法包括将标记的cd8结合剂与免疫治疗剂一起施用于主体,并在第一时间点和第二时间点检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。在一些实施方案中,标记的cd8结合剂在免疫治疗剂之前施用,并且第一时间点在标记的cd8结合剂的施用之后并且在免疫治疗剂的施用之前,并且第二时间点在免疫治疗剂的施用之后。在一些实施方案中,与第一时间点相比,在第二时间点肿瘤组织中更低水平的cd8
t细胞表明积极的治疗进展(例如,有益的或期望的临床结果)。在一些实施方案中,与第一时间点相比,在第二时间点肿瘤组织中更高水平的cd8
t细胞表明缺乏治疗进展(例如,缺乏有益或期望的临床结果)。在一些实施方案中,免疫治疗剂在标记的cd8结合剂之前施用,第一时间点在免疫治疗剂的施用之后和标记的cd8结合剂的施用之后,且第二时间点在第一时间点之后。在一些实施方案中,与第一时间点相比,在第二时间点肿瘤组织中更低水平的cd8
t细胞表明积极的治疗进展(例如,有益的或期望的临床结果)。在一些实施方案中,与第一时间点相比,在第二时间点肿瘤组织中更高水平的cd8
t细胞表明缺乏治疗进展(例如,缺乏有益或期望的临床结果)。在一些实施方案中,方法用于解释治疗失败的机制,例如,通过肿瘤cd8
细胞的丧失、通过耗尽和/或通过治疗潜能的丧失。在一些实施方案中,在第三个、第四个或第五个后来的时间点检测肿瘤组织中cd8
t细胞的水平。在一些实施方案中,时间点相隔至少约1天、3天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月、1.5年、2年、2.5年、3年或不止三年。
[0203]
在一些实施方案中,免疫治疗剂是免疫检查点抑制剂。在一些实施方案中,免疫检查点抑制剂是抗-pd-l1抗体(例如,如本文别处所述的)。在一些实施方案中,抗-pd-l1抗体是阿替利珠单抗。在一些实施方案中,将抗-pd-l1抗体(例如阿替利珠单抗)与第二治疗剂(例如,如本文别处所述的)组合施用于主体。
[0204]
在一些实施方案中,cd8结合剂用可检测标记(例如,
89
zr、
124
i、
18
f、
68
ga等)标记,并且经由pet或pet/ct检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。在一些实施方案中,cd8结合剂是与
18
f标记缀合的抗-cd8 vhh。在一些实施方案中,cd8结合剂是经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的抗-cd8 vhh。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含seq id no: 3的氨基酸序列。在一些实施方案中,抗-cd8 vhh包含seq id no: 4的氨基酸序列。
[0205]
在一些实施方案中,不止一次施用cd8结合剂用于重复监控主体中的治疗进展。在一些实施方案中,在延长的时间段内监控主体,例如至少约6个月、1年、2年、3年、4年、5年、
10年或更长时间,包括这些值之间的任何值或范围。
[0206]
预测患有癌症的主体对用癌症疫苗的治疗的反应性的方法和监控已施用了癌症疫苗的患有癌症的主体中的疾病进展的方法本文提供了预测患有癌症的主体对用癌症疫苗的治疗的反应性的方法。在一些实施方案中,癌症疫苗是个性化癌症疫苗(“pcv”)。示例性pcv在例如ott等人,(2017) nature 547, 217-221和sahin等人,(2017) nature 547, 222-226中描述。在一些实施方案中,方法包括施用本文所述的标记的cd8结合剂并检测标记的cd8结合剂与主体中肿瘤组织中的cd8
t细胞的结合,其中所述结合的检测表明主体很可能对癌症疫苗有反应。在一些实施方案中,方法包括施用本文所述的标记的cd8结合剂并检测标记的cd8结合剂与主体中肿瘤组织中的cd8
t细胞的结合,其中所述结合的检测表明主体需要用癌症疫苗进行治疗。在一些实施方案中,癌症疫苗与本文所述的一种或多种免疫治疗剂和/或化疗剂组合施用。
[0207]
本文还提供了监控患有癌症的主体中的疾病进展的方法。这种方法包括向主体施用本文所述的cd8结合剂并在第一时间点和第二时间点检测标记的cd8结合剂与主体中肿瘤组织中cd8
t细胞的结合。在一些实施方案中,方法进一步包括施用治疗有效量的癌症疫苗。在一些实施方案中,癌症疫苗是个性化癌症疫苗(“pcv”)。
[0208]
本文提供了监控以前已接受或目前正在接受用癌症疫苗的治疗的患有癌症的主体中的治疗进展的方法。在一些实施方案中,癌症疫苗是个性化癌症疫苗(“pcv”)。在一些实施方案中,方法包括(a)在施用癌症疫苗(例如,pcv)之前,将标记的cd8结合剂施用给主体并检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合,(b)施用癌症疫苗(例如,pcv),(c)在施用癌症疫苗(例如,pcv)之后的时间点将标记的cd8结合剂施用给主体并检测标记的cd8结合剂与肿瘤组织中的cd8
t 细胞的结合,和(d)测量在施用癌症疫苗(例如,pcv)之前和之后肿瘤组织中cd8
t细胞标记中的差异。在一些实施方案中,方法用于解释治疗失败的机制,例如,通过肿瘤cd8
细胞的丧失、通过耗尽和/或通过治疗潜能的丧失。
[0209]
在一些实施方案中,cd8结合剂用可检测标记(例如,
89
zr、
124
i、
18
f、
68
ga等)标记,并且经由pet或pet/ct检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。在一些实施方案中,cd8结合剂是与
18
f标记缀合的抗-cd8 vhh。在一些实施方案中,cd8结合剂是经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的抗-cd8 vhh。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含seq id no: 3的氨基酸序列。在一些实施方案中,抗-cd8 vhh包含seq id no: 4的氨基酸序列。
[0210]
在一些实施方案中,不止一次施用cd8结合剂用于主体中的重复预测或监控。在一些实施方案中,在延长的时间段内重复所述方法或监控主体,例如至少约6个月、1年、2年、3年、4年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0211]
预测患有癌症的主体对用细胞治疗的治疗的反应性的方法和监控已施用了细胞治疗的患有癌症的主体中的疾病进展的方法本文提供了预测患有癌症的主体对用细胞治疗的治疗的反应性的方法。在一些实施方案中,细胞治疗是car-t或新抗原特异性t细胞治疗。示例性细胞治疗在例如june等人,
suspects; nature reviews thumatology 12:421-428 (2016)。这种方法包括在有或没有介入治疗的情况下向主体施用标记的cd8结合剂,并在第一时间点和第二时间点检测标记的cd8结合剂与组织中的cd8
t细胞的结合。在一些实施方案中,来自第一时间点和第二时间点的cd8
t细胞中的增加是自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病已进展的指示。在一些实施方案中,治疗自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的介入疗法在标记的cd8结合剂之前施用,第一时间点在施用介入疗法以治疗自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病之后,并且在施用标记的cd8结合剂之后,并且第二时间点在第一时间点之后。在一些实施方案中,与第一时间点相比,在第二时间点组织中更低水平的cd8
t细胞表明积极的治疗进展(例如,有益的或期望的临床结果)。在一些实施方案中,与第一时间点相比,在第二时间点患病组织中更高水平的cd8
t细胞表明缺乏治疗进展(例如,缺乏有益或期望的临床结果)。在一些实施方案中,在第三个、第四个或第五个后来的时间点检测组织中cd8
t细胞的水平。在一些实施方案中,与第一时间点相比,在一个或多个后来的时间点组织中更低水平的cd8
t细胞表明缺乏治疗进展(例如,缺乏有益的或期望的临床结果)。在一些实施方案中,与第一时间点相比,在一个或多个后来的时间点患病组织中更高水平的cd8
t细胞表明缺乏治疗进展(例如,缺乏有益或期望的临床结果)。在一些实施方案中,方法用于解释治疗失败的机制。在一些实施方案中,时间点相隔至少约1天、3天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月、1.5年、2年、2.5年、3年或不止三年。
[0218]
本文还提供了预测患有自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的主体对免疫治疗剂(例如,免疫抑制剂)的反应性的方法。在一些实施方案中,方法包括施用本文所述的标记的cd8结合剂并检测标记的cd8结合剂与主体中患病组织中的cd8
t细胞的结合,其中所述结合的检测表明主体很可能对免疫抑制剂有反应。在一些实施方案中,方法包括施用本文所述的标记的cd8结合剂并检测标记的cd8结合剂与主体中患病组织中的cd8
t细胞的结合,其中所述结合的检测表明主体需要用免疫抑制剂进行治疗。在一些实施方案中,方法进一步包括将治疗有效量的免疫治疗剂施用于已检测到结合的主体。
[0219]
进一步提供了监控已经或正在接受免疫治疗剂(例如,免疫抑制剂)的患有自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的主体中的治疗进展的方法。在一些实施方案中,方法包括(a)在施用免疫治疗剂之前,将标记的cd8结合剂施用给主体并检测标记的cd8结合剂与患病组织中的cd8
t细胞的结合,(b)施用免疫治疗剂,(c)在施用免疫治疗剂之后的时间点将标记的cd8结合剂施用给主体并检测标记的cd8结合剂与患病组织中的cd8
t 细胞的结合,和(d)测量在施用免疫治疗剂之前和之后肿瘤组织中cd8
t细胞标记中的差异。在一些实施方案中,与施用免疫治疗剂之前的时间点相比,在施用免疫治疗剂之后的时间点患病组织中更低水平的cd8
t细胞表明积极的治疗进展(例如,有益的或期望的临床结果)。在一些实施方案中,与施用免疫治疗剂之前的时间点相比,在施用免疫治疗剂之后的时间点患病组织中更高水平的cd8
t细胞表明缺乏治疗进展(例如,缺乏有益或期望的临床结果)。在一些实施方案中,在一个、两个、三个、四个或更多个后来的时间点检测组织中cd8
t细胞的水平。在一些实施方案中,方法用于解释治疗失败的机制。在一些实施方案中,时间点相隔至少约1天、3天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月、1.5年、2年、2.5年、3年或不止三年。
[0220]
在一些实施方案中,cd8结合剂用可检测标记(例如,
89
zr、
124
i、
18
f、
68
ga等)标记,并且经由pet或pet/ct检测标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。在一些实施方案中,cd8结合剂是与
18
f标记缀合的抗-cd8 vhh。在一些实施方案中,cd8结合剂是经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的抗-cd8 vhh。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含seq id no: 3的氨基酸序列。在一些实施方案中,抗-cd8 vhh包含seq id no: 4的氨基酸序列。
[0221]
在一些实施方案中,方法用于移植体排斥,例如肾、肝、心或心/肺移植体排斥。在一些实施方案中,方法用于自身免疫性疾病或状况,例如肝炎、狼疮(例如sle)、脉管炎和伴有脱髓鞘的神经炎,包括多发性硬化。
[0222]
在一些实施方案中,免疫治疗剂是免疫抑制剂。合适的免疫抑制剂包括,但不限于,泼尼松,环磷酰胺,环孢素,麦考酚酸吗啉乙酯,依鲁替尼(ibrutinub)、芦可替尼(ruxolitinib)和生物制剂如tnf-α抗体,例如,阿达木单抗、依那西普、戈利木单抗和英夫利昔单抗。
[0223]
在一些实施方案中,不止一次施用cd8结合剂用于主体中的重复预测或监控。在一些实施方案中,在延长的时间段内重复所述方法或监控主体,例如至少约6个月、1年、2年、3年、4年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0224]
在一些实施方案中,cd8结合剂可以使得能够对与癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病有关的淋巴组织和器官进行连续评价。在一些实施方案中,主体中从cd8结合剂检测到的一种或多种水平或一种或多种信号可以与其他成像技术(例如,mri)有关。在一些实施方案中,主体中从cd8结合剂检测到的一种或多种水平或一种或多种信号可以与血液和/或组织生物标志(例如,组织活体解剖生物标志)有关。
[0225]
在一些实施方案中,cd8结合剂使得能够进行多重成像,例如,使用另一成像扫描,例如pet、spect或闪烁照相扫描。
[0226]
在一些实施方案中,使用cd8结合剂获得的成像数据与来自其他放射学方法的数据有关,例如mri、ct、超声或x射线。
[0227]
药物组合物还提供了组合物,包括药物制剂,其包含cd8结合剂例如抗-cd8抗体(例如,抗-cd8 vhh),或包含编码cd8结合剂例如抗-cd8抗体(例如,抗-cd8 vhh)的序列的多核苷酸。在一些实施方案中,组合物包含一种或多种结合cd8的cd8结合剂,或包含编码一种或多种结合cd8的cd8结合剂的序列的一种或多种多核苷酸。这些组合物可进一步包含合适的载体,例如药学上可接受的赋形剂,包括缓冲液,其是本领域众所周知的。
[0228]
在一些实施方案中,提供了药物组合物,其包含本文所述的任何一种cd8结合剂(例如,标记的cd8结合剂)和药学上可接受的载体。在一些实施方案中,提供了药物制剂,其包含本文所述的任何一种标记的cd8结合剂和一种或多种抗氧化剂化合物,例如甲硫氨酸和/或n-乙酰色氨酸。在一些实施方案中,药物制剂包含组氨酸、甲硫氨酸、n-乙酰色氨酸和/或蔗糖。在一些实施方案中,药物制剂包含组氨酸、甲硫氨酸、n-乙酰色氨酸和蔗糖。
[0229]
通过将具有所期望的纯度的这种抗体与一种或多种任选的药学上可接受的载体(remington's pharmaceutical sciences 第16版,osol, a. 编.(1980))混合,以冻干制剂或水溶液的形式,制备如本文所述的cd8结合剂的药物制剂。药学上可接受的载体在所采用的剂量和浓度通常对接受者无毒,且包括,但不限于:缓冲液,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸、n-乙酰色氨酸和甲硫氨酸;防腐剂(例如氯化十八烷基二甲基苄基铵;氯己双胺;苯扎氯铵;氯化苄乙铵;酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白,例如血清清蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,例如edta;糖,例如蔗糖、甘露糖醇、海藻糖或山梨糖醇;形成盐的反荷离子,例如钠;金属复合物(例如zn-蛋白复合物);和/或非离子型表面活性剂,例如聚乙二醇(peg)。本文的示例性药学上可接受的载体进一步包括间质药物分散剂,例如可溶性中性活性透明质酸酶糖蛋白(shasegp),例如人可溶性ph-20透明质酸酶糖蛋白,例如rhuph20(hylenex
®
, baxter international, inc.)。某些示例性shasegps和使用方法,包括rhuph20,描述于美国专利公开nos. 2005/0260186和2006/0104968中。在一方面,shasegp与一种或多种另外的糖胺聚糖酶例如软骨素酶组合。
[0230]
示例性冻干抗体制剂描述于美国专利no. 6,267,958中。水性抗体制剂包括美国专利no. 6,171,586和wo2006/044908中描述的那些,后者的制剂包括组氨酸-乙酸盐缓冲液。
[0231]
本文的制剂还可以根据需要含有不止一种活性成分(例如,免疫治疗剂),用于正在治疗的特定适应症(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病),优选具有不相互产生不利影响的互补活性的那些。例如,可能期望进一步提供抑制素。这种活性成分适当地以对预定目的有效的量组合存在。
[0232]
可以将活性成分包埋在例如通过凝聚技术或通过界面聚合制备的微胶囊中,例如分别在胶体药物递送系统(例如,脂质体、清蛋白小球体、微乳状液、纳米颗粒和纳米胶囊(nanocapsules)))中或在粗乳状液中的羟甲基纤维素或明胶-微胶囊和聚-(甲基丙烯酸甲酯)微胶囊。这种技术公开于remington's pharmaceutical sciences 第16版,osol, a. 编.(1980)中。
[0233]
可以制备持续释放制剂。持续释放制剂的合适实例包括含有抗体的固体疏水聚合物的半透性基质,所述基质呈成形物品的形式,例如膜或微胶囊。
[0234]
用于体内施用的制剂通常是无菌的。无菌可以容易地达到,例如,通过无菌过滤膜过滤。
[0235]
制品和试剂盒在一些实施方案中,提供了包括用于预测患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体对免疫治疗剂的反应性、用于监控患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体中的疾病进展和/或监控患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体中的治疗进展的材料的制品或试剂盒,。
[0236]
在一些实施方案中,制品或试剂盒包括含有本文所述的一种或多种cd8结合剂或组合物的容器。在一些实施方案中,制品或试剂盒包括含有本文所述的编码一种(或多种)cd8结合剂的一种或多种核酸或组合物的容器。在一些实施方案中,试剂盒包括产生如本文所述的cd8结合剂(例如,抗-cd8抗体)的细胞系的细胞。
[0237]
在一些实施方案中,试剂盒或制品包括抗-cd8 vhh。在一些实施方案中,试剂盒或制品包括标记的cd8结合剂,例如,包含可检测标记的免疫缀合物。在一些实施方案中,试剂盒包括抗-cd8抗体(例如,抗-cd8 vhh)和标记的cd8结合剂两者。在一些实施方案中,试剂盒或制品进一步包括用于制备标记的cd8结合剂的试剂,例如式(i)的螯合剂和[
18
f]-氟化铝复合物。
[0238]
在一些实施方案中,标记的cd8结合剂是与
18
f标记缀合的抗-cd8 vhh。在一些实施方案中,cd8结合剂是经由式(i)的化合物与[
18
f]-氟化铝复合物缀合的抗-cd8 vhh。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。在一些实施方案中,抗-cd8 vhh包含seq id no: 3的氨基酸序列。在一些实施方案中,抗-cd8 vhh包含seq id no: 4的氨基酸序列。
[0239]
在一些实施方案中,试剂盒包括一种或多种阳性对照,例如cd8(或其片段)或cd8
细胞。在一些实施方案中,试剂盒包括阴性对照,例如基本上不含cd8的表面或溶液。
[0240]
在一些实施方案中,制品或试剂盒包括容器和在容器上或与容器有关的标签或包装插页。合适的容器包括,例如,瓶、小瓶、注射器、iv溶液袋等。容器可以由多种材料形成,例如玻璃或塑料。容器容纳组合物,所述组合物单独地或与另一种有效治疗、预防和/或诊断癌症的组合物组合,并且可以具有无菌入口(access port)(例如,容器可以是具有可被皮下注射针刺穿的塞子的静脉内溶液袋或小瓶)。组合物中的至少一种试剂是本文所述的cd8结合剂。标签或包装插页表明所述组合物用于预测患有癌症的主体对免疫治疗剂的反应性、用于监控患有癌症的主体中的疾病进展和/或监控患有癌症的主体中的治疗进展。
[0241]
此外,制品或试剂盒可包括(a)其中含有组合物的第一容器,其中所述组合物包含本文所述的cd8结合剂;和(b)其中含有组合物的第二容器,其中所述组合物包含进一步的细胞毒剂或其他方式的治疗剂。在一些实施方案中,治疗剂是如本文所述的免疫治疗剂。
[0242]
本文提供的制品或试剂盒可进一步包括包装插页,所述包装插页表明一种或多种组合物可用于预测患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体对免疫治疗剂的反应性、用于监控患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体中的疾病进展和/或监控患有疾病(例如,癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的主体中的治疗进展。此外,制品可进一步包括第二(或第三)容器,其包括药学上可接受的缓冲液,例如注射用制菌水(bwfi)、磷酸缓冲盐水、林格液和葡萄糖溶液。其可进一步包括从商业和用户立场看期望的其他材料,包括其他缓冲液、稀释剂、过滤器、针和注射器。
[0243]
示例性实施方案本技术提供以下实施方案:1. cd8结合剂,其包含重链抗体的重链的可变结构域(vhh结构域),其中所述cd8
结合剂以约1nm或更小的kd特异性结合人cd8。
[0244]
2. 实施方案1的cd8结合剂,其中所述cd8结合剂以约0.002/s或更小的k
off
结合人cd8。
[0245]
3. 实施方案1或2的cd8结合剂,其中所述kd和/或k
off
通过使用单臂人cd8α/人cd8β-fc融合蛋白(例如,包含人cd8α和人cd8β的单链多肽,其与fc的一条多肽链融合)作为试剂的表面等离振子共振测定。
[0246]
4. 实施方案1-3中任一项的cd8结合剂,其中所述cd8结合剂以约1 nm或更小的kd结合食蟹猴cd8。
[0247]
5. 实施方案1-4中任一项的cd8结合剂,其中所述cd8结合剂以约0.004/s或更小的k
off
结合食蟹猴cd8。
[0248]
6. 实施方案4或5的cd8结合剂,其中所述kd和/或k
off
通过使用单臂食蟹猴cd8α/食蟹猴cd8β-fc融合蛋白(例如,包含食蟹猴cd8α和食蟹猴cd8β的单链多肽,其与fc的一条多肽链融合)作为试剂的表面等离振子共振测定。
[0249]
7. 实施方案1-6中任一项的cd8结合剂,其中所述cd8结合剂不刺激或抑制cd8
t细胞的活化。
[0250]
8. 实施方案1-7中任一项的cd8结合剂,其中所述cd8结合剂不诱导cd8
t细胞增殖。
[0251]
9. 实施方案1-8中任一项的cd8结合剂,其中所述cd8结合剂不结合cd4
t细胞。
[0252]
10. 实施方案1-9中任一项的cd8结合剂,其中所述vhh结构域是家羊驼vhh。
[0253]
11. 实施方案1-10中任一项的cd8结合剂,其中所述vhh是人源化的。
[0254]
12. 实施方案1-11中任一项的cd8结合剂,其中所述vhh结构域特异性结合包含arg25、lys42、gln44、val45、leu46、leu47、ser48、pro50、thr51、ser52、gln75、arg93、leu94、gly95、asp96和thr97的人cd8α表位,其中氨基酸编号根据seq id no: 13。
[0255]
13. 实施方案中12的cd8结合剂,其中所述vhh结构域包含包含seq id no: 6或7的氨基酸序列的互补性决定区(cdr)1;包含seq id no: 8或9的氨基酸序列的cdr2;以及包含seq id no: 10-12中任一项的氨基酸序列的cdr3。
[0256]
14. 实施方案中13的cd8结合剂,其中所述vhh结构域包含:(1)包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 8的氨基酸序列的cdr2和包含seq id no: 10的氨基酸序列的cdr3;(2)包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3;(3)包含seq id no: 7的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 11的氨基酸序列的cdr3;或(4)包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。
[0257]
15. 实施方案中13的cd8结合剂,其中所述vhh结构域包含包含seq id no: 6的氨基酸序列的cdr1、包含seq id no: 9的氨基酸序列的cdr2和包含seq id no: 12的氨基酸序列的cdr3。
[0258]
16. 实施方案1-15中任一项的cd8结合剂,其中所述vhh结构域包含l49a,其中编
号根据kabat编号。
[0259]
17. 实施方案1-16中任一项的cd8结合剂,其中所述vhh结构域包含一个或多个氨基酸修饰,其选自v89t取代、t110q取代、s112q取代和a114添加,其中编号根据kabat编号。
[0260]
18. 实施方案1-17中任一项的cd8结合剂,其中所述vhh结构域包含seq id nos: 1-4中任一项的氨基酸序列。
[0261]
19. 实施方案1-18中任一项的cd8结合剂,其中所述试剂不包含fc区。
[0262]
20. 分离的核酸,其编码实施方案1-19中任一项的cd8结合剂。
[0263]
21. 表达载体,其包含实施方案20的核酸。
[0264]
22. 包含实施方案20的核酸或实施方案21的表达载体的宿主细胞。
[0265]
23. 实施方案22的宿主细胞,其中所述宿主细胞是真核细胞。
[0266]
24. 实施方案23的宿主细胞,其中所述宿主细胞是哺乳动物细胞。
[0267]
25. 实施方案24的宿主细胞,其中所述宿主细胞是expi293细胞。
[0268]
26. 实施方案22的宿主细胞,其中所述宿主细胞是原核细胞。
[0269]
27. 制备cd8结合剂的方法,所述方法包括:a)在其中产生试剂的条件下培养实施方案22-26中任一项的宿主细胞;和b)回收由宿主细胞产生的cd8结合剂。
[0270]
28. 实施方案1-19中任一项的cd8结合剂,其中所述vhh结构域与标记缀合。
[0271]
29. 实施方案28的cd8结合剂,其中所述标记是荧光染料、放射性核素或酶。
[0272]
30. 实施方案29的cd8结合剂,其中所述标记是放射性核素。
[0273]
31. 实施方案30的cd8结合剂,其中所述放射性核素是
18
f、
89
zr、
99m
tc、
67
ga、
68
ga、
64
cu、
52
mn、
111
in或
124
i。
[0274]
32. 实施方案28-31中任一项的cd8结合剂,其中所述vhh结构域通过螯合部分与标记缀合。
[0275]
33. 实施方案32的cd8结合剂,其中所述螯合部分通过赖氨酸残基与vhh结构域共价连接。
[0276]
34. 实施方案32或33的cd8结合剂,其中所述标记与金属形成复合物,其中所述复合物被螯合部分螯合。
[0277]
35. 实施方案34的cd8结合剂,其中所述标记是
18
f并且所述金属是铝。
[0278]
36. 实施方案35的cd8结合剂,其中所述螯合部分是式(i)的化合物:。
[0279]
37. 检测主体中cd8
细胞的方法,所述方法包括:
a)向所述主体施用实施方案28-36中任一项的标记的cd8结合剂;和b)检测所述标记的cd8结合剂与所述主体中的cd8
细胞的结合,其中所述结合的检测表明存在cd8
细胞。
[0280]
38. 实施方案37的方法,其中检测所述标记的cd8结合剂与所述主体中的cd8
细胞的结合包括对所述主体中的cd8
细胞进行成像。
[0281]
39. 实施方案38的方法,其中对所述主体中的cd8
细胞进行成像包括对所述主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像(pet/ct)扫描。
[0282]
40. 实施方案37-39中任一项的方法,其中所述cd8
细胞是cd8
t细胞。
[0283]
41. 实施方案37-40中任一项的方法,其中所述cd8
细胞是cd8
肿瘤细胞。
[0284]
42. 实施方案37-41中任一项的方法,其中所述检测在施用后约1天或更短时间内进行。
[0285]
43. 实施方案37-42中任一项的方法,其中所述方法重复一次或多次。
[0286]
44. 实施方案43的方法,其中所述方法在预先施用cd8结合剂后约1天后重复。
[0287]
45. 实施方案43或44的方法,其中所述方法每年重复1至4次。
[0288]
46. 实施方案43-45中任一项的方法,其中所述方法重复不止1年。
[0289]
47. 实施方案37-46中任一项的方法,其中所述方法具有约1 nm至约30 nm的灵敏度。
[0290]
48. 实施方案37-47中任一项的方法,其中所述主体是人或非人灵长类动物。
[0291]
49. 实施方案48的方法,其中所述非人灵长类动物是食蟹猴或恒河猴。
[0292]
50. 实施方案48的方法,其中所述主体是人。
[0293]
51. 实施方案37-50中任一项的方法,其中所述主体患有癌症。
[0294]
52. 实施方案37-50中任一项的方法,其中所述主体患有自身免疫性疾病、移植体排斥或移植物抗宿主疾病。
[0295]
53. 预测患有癌症的主体对免疫治疗剂、细胞治疗或癌症疫苗的反应性的方法,所述方法包括:a)向所述主体施用实施方案28-36中任一项的标记的cd8结合剂;和b)检测所述标记的cd8结合剂与所述主体中肿瘤组织中的cd8
t细胞的结合,其中所述结合的检测表明所述主体很可能对所述免疫治疗剂、细胞治疗或癌症疫苗有反应。
[0296]
54. 实施方案53的方法,其进一步包括以下步骤:(c)向在其中已检测到结合的主体施用治疗有效量的免疫治疗剂、细胞治疗或癌症疫苗。
[0297]
55. 监控患有癌症的主体的疾病进展的方法,所述方法包括:a)向所述主体施用实施方案28-36中任一项的标记的cd8结合剂,和b)在第一时间点和第二时间点检测所述标记的cd8结合剂与所述主体中肿瘤组织中cd8
t细胞的结合。
[0298]
56. 实施方案55的方法,其进一步包括以下步骤:(c)向所述主体施用治疗有效量的免疫治疗剂、细胞治疗或癌症疫苗,其中在第二时间点肿瘤组织中cd8
t细胞的水平高于在第一时间点肿瘤组织中cd8
t细胞的水平。
[0299]
57. 监控患有癌症的主体中的治疗进展的方法,所述主体已经或正在接受免疫治疗剂、细胞治疗或癌症疫苗,所述方法包括:i)连同所述免疫治疗剂、细胞治疗或癌症疫苗一起向所述主体施用实施方案28-36中任一项的标记的cd8结合剂,和ii)在第一时间点和第二时间点检测所述标记的cd8结合剂与肿瘤组织中的cd8
t细胞的结合。
[0300]
58. 实施方案57的方法,其中所述标记的cd8结合剂在所述免疫治疗剂、细胞治疗或癌症疫苗之前施用,其中所述第一时间点在所述标记的cd8结合剂的施用之后和所述免疫治疗剂、细胞治疗或癌症疫苗的施用之前,并且其中所述第二时间点在所述免疫治疗剂、细胞治疗或癌症疫苗的施用之后。
[0301]
59. 实施方案57的方法,其中在所述标记的cd8结合剂之前施用所述免疫治疗剂、细胞治疗或癌症疫苗,其中所述第一时间点在所述免疫治疗剂、细胞治疗或癌症疫苗的施用之后并且在所述标记的cd8结合剂的施用之后,并且其中所述第二时间点在所述第一时间点之后。
[0302]
60. 实施方案53-54和56-59中任一项的方法,其中将免疫治疗剂施用于所述主体。
[0303]
61. 实施方案60的方法,其中所述免疫治疗剂是抗-pdl1抗体、抗-pd1抗体、抗-tigit抗体、tigit拮抗剂、抗-csf-1r抗体、抗-csf-1r拮抗剂、抗-cea抗体、抗-cea拮抗剂、抗-ctla4抗体、ctla4拮抗剂、抗-ox40抗体或ox40激动剂。
[0304]
62. 实施方案61的方法,其中所述免疫治疗剂是抗-pd-l1抗体。
[0305]
63. 实施方案62的方法,其中所述抗-pd-l1抗体是阿替利珠单抗。
[0306]
64. 实施方案62或63的方法,其中所述抗-pd-l1抗体与一种或多种治疗剂组合施用。
[0307]
65. 实施方案64的方法,其中所述一种或多种治疗剂是tarceva
®
(厄洛替尼)、zelboraf
®
(威罗菲尼)、gazyva
®
(阿托珠单抗)、avastin
®
(贝伐珠单抗)、cotellic
®
(考比替尼)、zelboraf
®
(威罗菲尼)和cotellic
®
(考比替尼)、alecensa
®
(阿来替尼)、kadcyla
®
(曲妥珠单抗美坦新偶联物)、herceptin
®
(曲妥珠单抗)、perjeta
®
(帕妥珠单抗)、泊洛妥珠单抗、inf-α、抗-cd40剂、抗-ox40抗体、ox40激动剂、抗-csf-1r抗体、抗-cea抗体、ido抑制剂或抗-tigit抗体。
[0308]
66. 实施方案60的方法,其中所述免疫治疗剂是细胞因子。
[0309]
67. 实施方案66的方法,其中所述细胞因子是il2、人工改造的il2、il15或人工改造的il15。
[0310]
68. 实施方案60的方法,其中所述免疫治疗剂是特异性结合cd3的双特异性抗原结合分子。
[0311]
69. 实施方案60的方法,其中所述免疫治疗剂是特异性结合cd16的双特异性抗原结合分子。
[0312]
70. 实施方案68或69的方法,其中所述双特异性抗原结合分子是抗体或其抗原结合片段。
[0313]
71. 实施方案69或70的方法,其中所述双特异性抗原结合分子特异性结合cd16a。
[0314]
72. 实施方案60的方法,其中所述免疫治疗剂是树突细胞调节剂。
[0315]
73. 实施方案72的方法,其中所述免疫治疗剂是树突细胞激活剂或树突细胞生长因子。
[0316]
74. 实施方案53-54和56-59中任一项的方法,其中将癌症疫苗施用于所述主体。
[0317]
75. 实施方案74的方法,其中所述癌症疫苗是个性化癌症疫苗(pcv)。
[0318]
76. 实施方案53-54和56-59中任一项的方法,其中将细胞治疗施用于所述主体。
[0319]
77. 实施方案76的方法,其中所述细胞治疗是car-t或新抗原特异性t细胞。
[0320]
78. 预测患有自身免疫性疾病、移植体排斥或移植物抗宿主疾病的主体对免疫治疗剂的反应性的方法,所述方法包括:a)向所述主体施用实施方案28-36中任一项的标记的cd8结合剂;和b)检测所述标记的cd8结合剂与所述主体中患病组织中的cd8
t细胞的结合,其中所述结合的检测表明所述主体很可能对免疫治疗剂有反应。
[0321]
79. 实施方案78的方法,其进一步包括以下步骤:(c)向在其中已检测到结合的主体施用治疗有效量的免疫治疗剂。
[0322]
80. 监控患有自身免疫性疾病、移植体排斥或移植物抗宿主疾病的主体中的疾病进展的方法,所述方法包括:a)向所述主体施用实施方案28-36中任一项的标记的cd8结合剂,和b)在第一时间点和第二时间点检测所述标记的cd8结合剂与所述主体中患病组织中的cd8
t细胞的结合,其中来自所述第一时间点和所述第二时间点的cd8
t细胞中的增加表明所述自身免疫性疾病、移植体排斥或移植物抗宿主疾病已经进展。
[0323]
81. 实施方案80的方法,其进一步包括以下步骤:(c)向所述主体施用治疗有效量的免疫治疗剂,其中在第二时间点患病组织中的cd8
t细胞水平低于在第一时间点患病组织中的cd8
t细胞水平。
[0324]
82. 监控患有自身免疫性疾病、移植体排斥或移植物抗宿主疾病的主体中的治疗进展的方法,所述主体已经或正在接受免疫治疗剂,所述方法包括:i)连同所述免疫治疗剂一起向所述主体施用实施方案28-36中任一项的标记的cd8结合剂,和ii)在第一时间点和第二时间点检测所述标记的cd8结合剂与患病组织中的cd8
t细胞的结合。
[0325]
83. 实施方案82的方法,其中所述标记的cd8结合剂在所述免疫治疗剂之前施用,其中所述第一时间点在所述标记的cd8结合剂的施用之后和所述免疫治疗剂的施用之前,并且其中所述第二时间点在所述免疫治疗剂的施用之后。
[0326]
84. 实施方案82的方法,其中在所述标记的cd8结合剂之前施用所述免疫治疗剂,其中所述第一时间点在所述免疫治疗剂的施用之后并且在所述标记的cd8结合剂的施用之后,并且其中所述第二时间点在所述第一时间点之后。
[0327]
85. 实施方案53-84中任一项的方法,其中检测所述标记的cd8结合剂与所述主体中的cd8
t细胞的结合包括对所述主体中的cd8
t细胞进行成像。
[0328]
86. 实施方案85的方法,其中对所述主体中的cd8
t细胞进行成像包括对所述主体进行正电子发射体层摄影术(pet)扫描或正电子发射体层摄影术/计算机化断层显像
(pet/ct)扫描。
[0329]
87. 实施方案53-86中任一项的方法,其进一步包括在使用所述标记的cd8结合剂成像后约48小时内进行另一次成像扫描(例如,pet、spect或闪烁照相术扫描)。
[0330]
88. 实施方案55-77和80-87中任一项的方法,其中对所述主体监控至少1年。
[0331]
89. 鉴定与对用免疫治疗剂治疗的反应性有关的肠道微生物菌株的方法,包括:a)从患有癌症的主体群体获得肠道微生物组样品,所述群体包括对用免疫治疗剂治疗有反应的主体和对用免疫治疗剂治疗无反应的主体;b)分析对治疗有反应的主体的肠道微生物组样品和对治疗无反应的主体的肠道微生物组样品;和c)鉴定与对治疗有反应的主体有关的肠道微生物菌株;其中反应性通过检测实施方案28-36中任一项的标记的cd8结合剂与所述主体中肿瘤组织中的cd8
t细胞的结合来确定,并且其中所述结合的检测表明所述主体对免疫治疗剂有反应。
[0332]
90. 实施方案89的方法,其进一步包括制备基于微生物组的药物,所述药物包含与对免疫治疗剂的反应性有关的肠道微生物菌株。
[0333]
91. 实施方案89或90的方法,其中所述免疫治疗剂是抗-pd-1抗体。
[0334]
92. 实施方案89或90的方法,其中所述免疫治疗剂是抗-pd-l1抗体。
[0335]
93. 实施方案92的方法,其中所述抗-pd-l1抗体是阿替利珠单抗。
[0336]
94. 试剂盒,其包括实施方案28-36中任一项的标记的cd8结合剂。
[0337]
95. 制备标记的cd8结合剂的方法,包括将螯合部分缀合至实施方案1-19中任一项的cd8结合剂的vhh结构域以提供缀合物,和使所述缀合物与包含
18
f的氟化铝复合物接触以提供标记的cd8结合剂,其中所述螯合部分是式(i)的化合物:。
[0338]
96. 实施方案95的方法,其中所述缀合物与所述氟化铝复合物在有一种或多种抗氧化剂化合物的情况下接触。
[0339]
97. 实施方案96的方法,其中所述一种或多种抗氧化剂化合物包括甲硫氨酸和/或n-乙酰-色氨酸。
[0340]
98. 药物制剂,其包含实施方案1-19和28-36中任一项的cd8结合剂和一种或多种抗氧化剂化合物。
[0341]
99. 实施方案98的药物制剂,其中所述一种或多种抗氧化剂化合物是甲硫氨酸和/或n-乙酰色氨酸。
[0342]
100. 实施方案98或99的药物制剂,其进一步包含组氨酸和蔗糖。
[0343]
实施例实施例1:针对人cd8的vhhs的开发和表征抗-cd8 vhhs的发现和初始筛选家羊驼用两种抗原中的任何一种进行免疫,c-末端hfc-标记的cd8α受体(cd8α-fc)或c-末端组氨酸标签单链蛋白,其中cd8α通过接头融合至cd8β(cd8αβ-his)。如ghahroudi等人febs 1997中所述进行标准免疫规程(也参见美国专利no. 6,015,695)。使用标准rt-pcr方法,扩增vhh重链谱并克隆到噬菌粒载体中以构建免疫噬菌体文库。然后使用具有各不相同的浓度、洗涤时间和洗脱条件的cd8αβ-his或cd8α-fc 进行几轮噬菌体文库的体外选择。三轮和四轮选择后,各个噬菌体克隆通过elisa进行表征并经受桑格测序。
[0344]
此外,通过spr确定选择的vhh抗体对人(hucd8a-fc)和食蟹猴(cynocd8a-fc)cd8 两者的结合亲和力。特别地,2c8.1-h(在本文中也称为“wt2c8”)表现出对hucd8 hpball细胞的可接受的亲和力和结合(图3)。
[0345]
vhh表达和纯化从噬菌体淘选鉴定的独特序列在含有c-末端his标签的哺乳动物表达载体中表达。表达的vhhs经受两步纯化:ni sepharose excel标组氨酸蛋白纯化树脂(ge healthcare),继之以尺寸排阻层析(sec)。无标记的vhhs也在哺乳动物细胞中表达。未标记的vhhs经受离子交换纯化(sp柱)或重组a蛋白树脂(gore),继之以sec。
[0346]
spr表征通过表面等离振子共振(spr)测定每种vhh变体对人(单臂单链hucd8α/hucd8β-fc)和食蟹猴(单臂单链cynocd8α/cynocd8β-fc)两者的结合亲和力。spr实验是在biacore t200(ge healthcare)上于37℃下使用hbs-p (ge healthcare)运行缓冲液进行的。使用抗-huigg1 fc捕获试剂盒(ge healthcare)捕获1.5 μg/ml的cd8αβ-fc,并以100 μl/分钟的流速添加单体vhhs作为溶液中的分析物。使用来自100-0nm 的稀度系列滴定vhh。将传感图(sensorgrams)拟合至1:1 langmuir模型以鉴定动力学参数,包括kd、k
on
和k
off
。
[0347]
cd8
细胞特异性vhh变体的鉴定将与c-末端huigg1 fc融合的重组vhhs表达、纯化并通过facs针对hucd8 hpball细胞,表达cd8的人t-细胞白血病细胞系(dsmz,德国)进行筛选。包括从atcc获得的人胚肾细胞(hek)作为非-cd8表达性对照细胞系。在有补加了10%v/v胎牛血清和1%v/v青霉素-链霉素的100 μl rpmi培养基(thermo fisher scientific)的情况下,将大约300,000个细胞平板接种在圆底96-孔平板中。将与人-igg fc融合的vhh变体在10 μg/ml的浓度与细胞于37℃温育60分钟。接着将未结合的vhh洗掉,并将alexa fluor
® 647山羊抗人igg fc抗体(jackson immuno research, inc.)以7.5 μg/ml的浓度于37℃添加到细胞中达60分钟。然后用补加了0.5%牛血清清蛋白的磷酸缓冲盐水(ph 7.4)洗涤细胞两次,并通过facscalibur流式细胞仪(bd biosciences)进行分析。一式两份分析样品。衍生自结合人cd8a的四链抗体的okt8-fc充当阳性对照。
[0348]
结果示于图3中,其显示2c8 vhh-fc具有与okt8-fc类似的对hpball细胞的亲和力和结合。
[0349]
与全血细胞和pbmcs结合选择2c8 vhh用于对人全血和相应的pbmc样品进行进一步的facs分析。vhh做为标
his的单体表达,并直接用alexa fluor
® 647标记。
[0350]
简而言之,于室温收集来自4名健康供体(健康中心(health center),genentech)的全血样品,并在抽血后小于30分钟进行处理。对于每个供体,保留1ml样品用于直接染色,并在染色前将4ml样品用于外周血单核细胞(pbmcs)分离(菲可帕克分离)。为避免非特异性结合,全血或pbmcs在染色前分别与每1000 μl或107个细胞20 μl fcr封闭人试剂(miltenyi biotech)进行温育。将100 μl全血或5
×
104个pbmcs分配到96深孔平板中用于流式细胞术染色。根据制造商的规程(thermo fisher scientific),通过edc-nhs介导的与alexa fluor
® 647(af647)染料的缀合制备荧光标记的抗体。
[0351]
okt8-af647或vhh-af647变体(20ng/ml)、抗-cd14 vioblue(miltenyi biotech;1/25)、抗-cd16 percp cy5.5(becton-dickinson;1/200)、抗-cd4 viobright-fitc(miltenyi biotech;1/50)、抗-cd3 apc-vio770(miltenyi biotech;1/50)于室温作为预混合的抗体混合物加入达10分钟。然后将样品用2ml红细胞裂解溶液(becton dickinson)重悬浮,充分混合并于室温温育10分钟,然后以1500rpm离心5分钟。去除上清液后,用pbs 1x,bsa 0.5%洗涤沉淀,然后在 macsquant 10分析仪(miltenyi biotech)上采样。
[0352]
除了没有进行红细胞裂解步骤之外,对于pbmc染色采用相同的规程。
[0353]
图4显示了使用全血细胞样品的结果。okt8和2c8 vhh显示出相似的染色模式,包括cd8
t细胞的强染色和cd3-细胞(例如,nk细胞)的低水平染色。利用pbmc样品的实验产生了类似的结果。2c8 vhh仅与全血(其含有多核的和单核的细胞)和pbmc(其仅含有单核的细胞)两者中的cd3
cd8
t细胞群体强烈结合,从而证实了对人cd8的特异性。
[0354]
结构表征为了确定cd8α上2c8的表位,确定了与同二聚体cd8αα结合的2c8的晶体结构(图5)。2c8 结合cd8α的顶尖并接触arg25、lys42、gln44、val45、leu46、leu47、ser48、pro50、thr51、ser52、gln75、arg93、leu94、gly95、asp96和thr97。这些cd8α氨基酸残基在晶体结构中各自在离2c8的一个或多个氨基酸残基的约4.5
ꢀå
以内。所述表位不与和mhci复合的小鼠cd8αβ的结合表位重叠(wang 等人,j immunol 2009)。
[0355]
经由vhh cdrs的nnk步移(walk)的亲和力成熟在没有一些半衰期延长机制如rashidian等人jem 2017所述的聚乙二醇化(pegylation)的情况下,2c8的初始亲和力被认为对于cd8 细胞的灵敏检测是亚最佳的。为了鉴定2c8中改善亲和力的突变,我们对2c8的cdrs进行了nnk步移,如koenig等人,jbc 2015所述的。
[0356]
简而言之,生成了cdr nnk扫描文库,其中每个突变体都含有单个突变,且整个文库包括vhh中每个cdr位置的所有20种氨基酸。将所述文库克隆到噬菌粒载体中,并经受几轮针浓度逐渐降低且洗涤次数逐渐增加的对cd8α-hfc的噬菌体淘选。vhh结构域从初始文库和从第3轮选择的文库扩增,并经受下一代测序(next-generation sequencing)(ngs)。使用 miseq(illumina)仪器对扩增的dna扩增子进行ngs。通过将3轮选择后每种突变的频率除以初始文库中每种突变的频率来确定富集率。
[0357]
在分析ngs结果时,我们观察到a99g和a100fd强烈富集。与亲本克隆相比,产生具有a99g和a100fd突变的2c8将亲和力改进到~10倍。
[0358]
2c8的人源化
我们通过在ighv3-23*04上嫁接cdrs(30-35(h1)、50-65(h2)和 94-102(h3))来使2c8人源化。来自家羊驼的所有vernier位置也被嫁接到其各自的位置。我们在构架中留下了几个家羊驼残基(f37、r45、g47和l49),这是因为这些是维持vhh的结合、稳定性和可溶性表达所需要的。在spr表征之后,我们确定只需要s71和v78 vernier残基来保持高亲和力结合。人源化时,我们注意到与a蛋白树脂的结合非常差,尽管在所有a蛋白接触位点都具有优选的残基(如henry等人,plos one 2016中所述的)。我们检查了直接接触a蛋白的那些残基之外的潜在残基,其可能间接改变对a蛋白结合重要的vhh残基的构象。我们将l49鉴定为一种这种残基。在突变为ala(l49a)时,我们观察到经由a蛋白残基纯化后vhh回收的大的增加(表 3)。
[0359]
表3:a蛋白和sec纯化后纯化的vhh的得率克隆得率(来自30mlexpi293表达的mg)hu2c80.256hu2c8.l49a2.493与预先存在的adas的结合的降低以前关于vhhs的临床数据已显示了患者中预先存在的抗-vhh抗体 [cordy等人,clin exp immunol 2015;holland等人,j clin immunol 2013;papadopoulos等人,cancer chemother pharmacol 2015]。我们评估了vhh变体与预先存在的抗-vhh抗体的结合,引入了四种构架突变(v89t、t110q、s112q和a114添加)以减轻和与这些预先存在的抗体的结合有关的风险。
[0360]
为了进行vhh抗药物抗体测定,将vhh变体以在pbs中2 μg/ml于4℃包被在maxisorp平板上过夜。用pbs 0.5% bsa 0.1%吐温20(pbsbt)洗涤平板并于25℃用2% bsa封闭2小时。来自96名不同健康供体的个别血清样品以1:50稀释,并与vhh-包被的和空的孔于25℃在振荡的情况下温育1-2小时。洗涤后,于25℃在振荡的情况下添加抗人fc-特异性hrp 2
°
抗体(1:10,000)达30分钟。用pbsbt洗涤后,用tmb底物将平板显影10分钟并在650nm处检测。
[0361]
如图6中所示的,构架突变消除了抗-cd8 vhh与从96名健康供体合并的预先存在的抗-vhh抗体的结合。
[0362]
总的说来,我们开发了几个与人和食蟹猴cd8α强烈结合的人源化和最优化的克隆(v130、v142和v144)。图1和表4显示了示例性vhh克隆的氨基酸序列。
[0363]
表4. vhh序列
表5和6分别显示了通过spr测定的2c8v142和2c8v144对αβ的亲和力。2c8v144对人和食蟹猴cd8α具有高亲和力,并且解离速率相对慢。与2c8v144相比,2c8v142克隆在cdr3中含有w98f突变,其使得与2c8v144相比,2c8v142在暴露于高水平辐射时较不易氧化。
[0364]
表5. 2c8v142对人和食蟹猴cd8αβ的亲和力表6.2c8v144对人和食蟹猴cd8αβ的亲和力对t细胞功能的影响为了评价2c8 vhh结合对cd8
t 细胞功能的潜在影响,我们在有2c8.v130的情况下进行了体外t细胞增殖测定。
[0365]
简而言之,将来自三个健康供体的新鲜分离的pbmcs在pbs 1x中洗涤,并且在pbs 1x中以10
×
106个细胞/ml重悬浮沉淀。在于室温温育5分钟之前,添加等体积的新鲜制备的羧基荧光素琥珀酰亚胺酯(cfse)2.5 μm工作溶液(molecular probe)。在以1500rpm离心5分钟之前,通过添加9体积的rpmi,10% fbs停止标记。在细胞计数和分配之前,用rpmi,10% fbs培养基进行了两次额外的洗涤。
[0366]
将100,000个cfse-标记的细胞平板接种在圆底96-孔平板中,用于使用0.2 μg/ml的抗-cd3(becton dickinson;预包被的平板)加新鲜添加的1 μg/ml的抗-cd28或0.4 μg/ml的超抗原葡萄球菌肠毒素b(seb)(truculture管;myriad rbm)进行多克隆刺激。对于抗原特异性刺激,将500,000个cfse-标记的细胞平板接种到圆底96-孔平板中,并将2 μg/ml cef肽库(mabtech)添加到每个孔中。10 ng/ml脂多糖(“lps”,sigma)用作先天细胞激活剂对照,并将单独的培养基(rpmi,10% fbs)用作阴性对照。最后,对于所有条件,一式三份添加pbs 1x,2c8v130 vhh(1 μg/ml和10 μg/ml终浓度)或lys2 vhh(10 μg/ml),对照,达每孔200 μl的最终体积。对照lys2 vhh结合溶菌酶,并在de genst等人,jbc 2005中进行了描
述。
[0367]
此外,为了评价循环人血液分子对vhh结合的效果的潜在影响,在没有刺激或有seb 0.4 μg/ml的情况下,将培养基中的fbs用10%的自体血浆替代。分析前将平板于37℃温育5天。
[0368]
平板离心后,去除上清液并用pbs 1x洗涤沉淀一次。添加100 μl稀释的可固定死活细胞鉴定染料溶液(fixable viability dye solution)(live dead aqua, thermofischer),并将细胞于4℃温育15分钟,然后用pbs,0.5% bsa洗涤。将含有抗-cd4 apc-vio770(miltenyi biotech;1/50)、抗-cd3 pacific blue(becton dickinson;1/100)、抗-cd8α apc(becton dickinson;1/100)的预混合的抗体混合物添加到沉淀。细胞在冰上温育20分钟,然后进行pbs洗涤和使用macsquant 10(miltenyi biotech)的流式细胞术分析。
[0369]
图7a-7e显示了在有高(10 μg/ml)或更低(1 μg/ml)饱和浓度的2c8.v130、高浓度(10 μg/ml)的非cd8-结合性vhh(lys2)或pbs(载体)的情况下使用cfse标记的人pbmcs(n=3)的增殖测定的结果。在没有刺激的情况下(培养基,图7a),2c8.v130和lys2-vhh均未在所测试的三个供体中诱导背景增殖,其表明添加与cd8
细胞结合或不结合的vhh不触发非特异性t细胞活化。在抗-cd3/cd28多克隆刺激时(图7b),对于所有供体都获得了最佳的cd8
t细胞增殖(不止90%的cfse稀释),并且添加2c8.v130或lys2 vhh对t细胞活化没有影响。超抗原seb诱导mhc-ii和tcr之间的交联,但由于高细胞死亡,向样品中添加seb并未提供最佳增殖率(小于15%的cfse低)。尽管如此,但对于单个供体,在不同条件下没有观察到显著差异(图7c)。为了模拟更加生理的mhc-i/tcr/cd8复合物接合,cef肽库用于激活tcr特异性cd8
t 细胞。然而,没有一个被测试的供体具有可检测到的反应性cd8
t细胞,这是因为增殖率类似于培养基条件(图7d),这证实不存在vhh-诱导的背景增殖。以同样的方式,在对单核细胞进行tlr4刺激时(lps条件),当添加vhhs时未观察到间接t细胞增殖(图7e)。
[0370]
图8a-8d比较了以10% fbs或自体供体血浆作为培养基的增殖测定的结果。在pbmc分离之前获得自体供体血浆样品,并用于增殖测定中以模拟生理条件。在没有刺激的情况下,对于所有供体,在使用10% fbs培养基或自体供体血浆的实验之间没有观察到差异(图8a和8b)。因此,在有可溶性人血浆因子的情况下,vhhs也不诱导背景t细胞增殖。
[0371]
实施例2:用于分子成像的2c8v144 vhh的评价2c8 vhhs的标记用于产生resca(受约束螯合剂)-修饰的vhh和
18
f-alf-resca-修饰的vhh(包括
18
f对照vhh和
18
f抗-cd8 vhh)的程序从以前描述的规程(cleeren f.等人,nature protocols 13, 2330-2347(2018))修改得来。示例性resca具有式(i)的化学结构。简而言之,将resca-缀合的vhh添加到在由乙酸钠或乙酸钠与甲硫氨酸和n-乙酰-色氨酸组成的反应介质中的
18
f-氟化物的混合物中。使用用由组氨酸、甲硫氨酸、n-乙酰色氨酸和蔗糖调节的制剂缓冲液平衡的脱盐柱纯化反应混合物,其降低vhh上的氧化率。作为对照,制剂缓冲液用磷酸缓冲盐水调节。仔细控制组氨酸制剂缓冲液的ph和温度以限制
18
f-alf从resca的解离速率。通过se-hplc测定最终产物的蛋白浓度、蛋白纯度和放射化学纯度,以及通过se-hplc和spr测定靶结合(免疫反应性级分,适当时)。
[0372]
使用2c8v145 vhh的
18
f对照vhh和使用2c8v144的
18
f抗-cd8 vhh以40-60%的放射
化学得率(非衰变校正的)获得。最终产物显示出3.0-8.0 ci/μmol的比活范围,超过95%的放射化学纯度,以及对于
18
f抗-cd8 vhh,超过94%的免疫反应性级分。
[0373]
在不受任何理论或假设约束的情况下,抗-cd8 vhh与放射性核素标记的缀合可导致一个或多个vhh残基例如色氨酸的氧化,其导致减小的cd8结合能力。在缀合反应缓冲液、纯化缓冲液和/或制剂缓冲液中使用抗氧化剂化合物,例如甲硫氨酸和/或n-乙酰色氨酸,可以减少vhh残基的氧化,从而改善功能性标记的抗-cd8 vhh的得率。
[0374]
小鼠中嵌合cd8
肿瘤异种移植的pet成像通过在小鼠中进行嵌合cd8 肿瘤异种移植的pet成像来评估
18
f-抗-cd8 vhh的灵敏度和动态范围。
[0375]
简而言之,将hpball,表达cd8的人t-细胞白血病细胞系(dsmz,德国),与daudi,没有cd8的人淋巴瘤细胞系(dsmz,德国)以不同的比例混合,以产生不同cd8浓度的嵌合肿瘤,用于使用
18
f-抗-cd8 vhh的pet成像。简而言之,雌性cb17.scid.bg小鼠用皮下接种到背胸部(dorsal thoracic region)的各自在hbss:基质胶(matrigel)的50:50混合物中的1000万个细胞接种。一旦肿瘤达到约400mm3大小,就经由尾静脉向动物注射
18
f-抗-cd8 vhh,并在inveon pet/计算机化断层显像(ct)扫描仪(siemens preclinical solutions, inc.)上经受动态60分钟pet扫描。
[0376]
为了评价完成pet成像后的cd8表达,将嵌合肿瘤从小鼠中切除,并根据制造商的规程使用gentlemacs octo离解器(dissociator)(miltenyi biotec)离解。然后将所得到的细胞悬浮液通过70 μm细胞滤过器(corning)以去除聚集体。然后对肿瘤细胞进行计数,且在有100μl rpmi培养基的情况下将300,000个细胞平板接种在圆底96-孔平板中。用20nm的alexa fluor
® 647-标记的okt8抗-cd8抗体(60分钟,4℃)以及sytox橙色死细胞染色剂(15分钟,4℃)(thermo fisher scientific)对细胞进行染色。洗涤细胞,且然后通过facs calibur流式细胞仪进行分析以确定肿瘤中cd8
细胞的百分比。
[0377]
如图9中所示的,
18
f-抗-cd8 vhh允许在低至10%cd8
hpball细胞的情况下通过pet成像清楚地显示cd8
肿瘤细胞。结果还显示了pet摄取(%id/g)和cd8
hpball细胞浓度之间明显的相关性。基于以前的facs数据,估计每个hpball细胞具有大约55,000-85,000个拷贝的cd8分子,而每个幼稚cd8
t细胞具有200,000-300,000个拷贝的cd8分子。
18
f-抗-cd8 vhh是可以检测肿瘤细胞上cd8表达的低水平(约 1-30nm灵敏度)的灵敏的显像剂。
[0378]
小鼠中tall1肿瘤异种移植的pet成像
18
f-抗-cd8 vhh和
89
zr-单臂(“oa”)-抗-cd8抗体(参见,国际专利申请公开no. wo2019/033043a2)用于对小鼠中的tall1肿瘤异种移植进行成像。tall1是低cd8表达性白血病细胞系。基于以前的facs数据,估计每个tall1细胞具有约12,000-15,000个拷贝的cd8分子。
[0379]
简而言之,雌性cb17.scid.bg小鼠用在hbss:基质胶的50:50混合物中的1000万个tall1细胞皮下接种到右胁腹。一旦肿瘤达到约400m3大小,动物就被分出用于pet成像。对于用
89
zr-oa-抗-cd8抗体的成像,将动物经由尾静脉注射,并经受在第0、1、2和5天的静态pet扫描。对于用18f-抗-cd8 vhh的成像,将动物经由尾静脉注射,并像以前一样经受动态60分钟pet扫描。
[0380]
使用irw软件(siemens preclinical solutions, inc.)对组织的多个轴切片进
行感兴趣区域(roi)测量。假定1克软组织中的1cc当量,将器官的衰变校正的信号强度测量为每克注射剂量的百分比(%id/g)。
[0381]
18
f-抗-cd8 vhh允许在1小时内快速显示低cd8表达性tall1异种移植肿瘤。如图10中所示的,在注射后90分钟后可以清楚地显示表达cd8的tall1异种移植肿瘤,并且实现了14的高肿瘤与血液比。使用
18
f-抗-cd8 vhh成像可在0.5
ꢀ‑ꢀ
4小时内完成。相比之下,
89
zr-oa-抗-cd8抗体适合在更长时间点的有意义的成像,即,注射后1至5天。由于其小的尺寸,
18
f-抗-cd8 vhh非常快速地穿透组织并表现出快速的肾清除,从而便于在同一天较后对同一患者进行额外的pet扫描(例如fdg pet),或在如次日一样早地进行重复pet扫描。与
18
f标记(或其他标记,如
68
ga)的相容性提供了导致对患者相对低的辐射负荷的用抗-cd8 vhh的成像程序,因此可以在人患者的通用剂量确定法指南内的整个治疗过程中进行额外的扫描。例如,使用
18
f-抗-cd8 vhh,可能在典型的数月或数年长的治疗和随访过程中对同一患者重新成像(re-image)最多到约5次。
[0382]
恒河猴中的pet成像研究在恒河猴中用
18
f-抗-cd8 vhh进行成像实验以确定是否可以在通常富含cd8的组织中检测到摄取。将恒河猴(2.5kg)注射含有1.2 mci辐射剂量的64微克
18
f-抗-cd8 vhh。富含cd8的组织,如淋巴结、胸腺和脾,可在注射后1小时内清楚地成像。例如,图11的顶部图显示了注射后一小时的pet mip图像。对比起来,在注射
18
f-对照vhh后一小时,在pet mip图像中看不到富含cd8的组织(图11底部)。仅仅到肾的清除是显著的。
[0383]
实施例3:使用cd8成像用于确定免疫治疗对癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的功效的方法本文所述的cd8结合剂,例如
18
f-抗-cd8 vhh,用于评估cd8
细胞对肿瘤和淋巴结的浸润。这种成像用于鉴定可预测患者预后和/或对免疫治疗的反应的免疫表型。例如,这种成像用于确定患病组织(例如,肿瘤)和其他淋巴结中cd8
t-细胞的普遍程度。这种成像用于为患有癌症、自身免疫性疾病或状况(例如关节炎、结肠炎或腹部疾病)、移植体排斥或移植物抗宿主疾病的患者选择免疫治疗剂或包括一种或多种免疫治疗剂的联合治疗剂。
[0384]
在本文公开的所有实施方案中,对于癌症患者的免疫治疗是例如本文公开的任何抗-pd1剂或抗-pdl1剂,例如治疗癌症的单克隆抗体,结合t细胞和肿瘤相关蛋白的双特异性抗体,结合nk细胞和肿瘤相关蛋白的双特异性抗体,细胞因子,car-t细胞治疗,非特异性癌症免疫治疗和佐剂以及免疫检查点抑制剂。结合t细胞和肿瘤相关蛋白的双特异性抗体包括,例如抗-cd3双特异性抗体。结合nk细胞和肿瘤相关蛋白的双特异性抗体包括,例如,抗-cd16(fcγriii)双特异性抗体、抗-cd16a双特异性抗体、抗-cd56双特异性抗体、抗-nkp46双特异性抗体和任何其他nk-细胞结合性双特异性抗体。
[0385]
在一些实施方案中,cd8结合剂(例如,
18
f-抗-cd8 vhh)可用于如本文所述的疾病例如癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病的治疗、诊断、预后、伴随诊断(companion diagnostic)和监控进展/缓和。
[0386]
在一些实施方案中,cd8结合剂(例如,
18
f-抗-cd8 vhh)可用于对已经历用免疫治疗剂对疾病(例如癌症、自身免疫性疾病或状况、移植体排斥或移植物抗宿主疾病)的治疗失败的主体进行成像,其中成像结果解释了治疗失败的一种或多种机制。例如,主体可能接受阿替利珠单抗组合,但对治疗没有反应。成像结果可能揭示主体已经丧失了cd8 肿瘤细
胞,或仍有cd8 肿瘤细胞,但治疗剂已耗尽或不再针对cd8 肿瘤细胞有效。
[0387]
实施例4:使用cd8成像用于微生物组研究和免疫表型鉴定的方法本文所述的cd8结合剂,例如
18
f-抗-cd8 vhh,可用于评估cd8
细胞对肿瘤和淋巴结的浸润。这种成像用于鉴定作为预测患者预后和/或对癌症免疫治疗的反应的微生物组特征基础的免疫表型。
[0388]
此外,本文所述的cd8结合剂,例如
18
f-抗-cd8 vhh,可用于鉴定与cd8
t-细胞生物分布中的特定全身模式有关的微生物组特征。例如,这种成像用于确定肿瘤和其他淋巴结中cd8
t-细胞的普遍程度。这种成像用于选择最稳健的微生物组生物标志,即使当与结果的直接关联是有干扰的或弱的时候。
[0389]
定居肠道细菌可能影响患者对癌症免疫治疗的反应。参见,例如,gopalakrishnan等人,(2018) science. 359(6371): 97-103。因此,鉴定与患者对癌症免疫治疗的反应性有关的关键微生物菌株可能对于鉴定癌症患者的适当治疗方案是有用的。本文所述的cd8结合剂,例如
18
f-抗-cd8 vhh,可用于鉴定与患者对免疫治疗(例如,本文讨论的免疫治疗)的反应性有关的一种或多种微生物组概况(例如,一种或多种肠道区系组成)。
[0390]
简而言之,从要经受免疫治疗(例如,本文其他地方描述的免疫治疗)的癌症患者获得肠道微生物组样品(例如,粪便样品)。在每位患者经受癌症免疫治疗之前,将本文所述的cd8结合剂,例如
18
f-抗-cd8 vhh,施用于他们,并在每位患者中评估cd8
细胞对肿瘤和淋巴结的浸润。紧接着,患者各自接受癌症免疫治疗(例如,本文所述的免疫治疗)。本文所述的cd8结合剂,例如
18
f-抗-cd8 vhh,在癌症免疫治疗后再次施用于患者,并且在每位患者中第二次评估cd8
细胞对肿瘤和淋巴结的浸润。评估免疫治疗后患者的一种或多种肿瘤和淋巴结中cd8浸润的水平,并确定每个患者的微生物组概况(例如,肠道微生物组样品中存在的微生物的类型,以及每种类型的微生物的丰度)。鉴定了显示出cd8
t细胞到一种或多种肿瘤和淋巴结的浸润的患者的肠道微生物组样品中存在的关键微生物菌株。
[0391]
在有cd8
t细胞浸润到淋巴结和/或肿瘤的患者中鉴定关键微生物菌株后,从由这些患者获得的供体粪便制备包含关键微生物菌株的微生物组药物。将微生物组药物施用于没有显示出cd8
t细胞到淋巴结或肿瘤中的浸润的患者。另一方面,使用从显示出cd8
t细胞到淋巴结和/或肿瘤的浸润的患者收集的供体粪便,对未显示出cd8
t细胞到淋巴结和/或肿瘤中的浸润的患者进行fmt(粪菌移植(fecal microbiota transplant))程序。在一些实施方案中,fmt或微生物组药物将癌症免疫治疗后未表现出cd8
到淋巴结和/或肿瘤中的浸润的患者转化为对癌症免疫治疗有反应的患者。
[0392]
在一些实施方案中,对在fmt以前或在施用微生物组药物以前没有表现出cd8
到淋巴结和/或肿瘤中的浸润的患者进行cd8成像。在fmt或微生物组药物施用后,患者接受免疫治疗。免疫治疗后,对患者进行成像以确定fmt或微生物组药物是否导致增加的cd8
到淋巴结和/或肿瘤中的浸润。在一些实施方案中,如果在fmt或其他微生物组药物之后观察到响应于癌症免疫治疗治疗的增加的cd8
浸润,则认为 fmt或其他微生物组药物已是成功的。
[0393]
与微生物组研究和发现一起使用的cd8显像剂可以是本文所述的任何cd8结合剂,例如
18
f-抗-cd8 vhh,使用wt2c8 vhh、2c8v130 vhh、2c8v142 vhh或2c8v144 vhh。
[0394]
在一些实施方案中,癌症免疫治疗是检查点抑制剂。在一些实施方案中,癌症免疫
治疗是t-细胞靶向疗法。在一些实施方案中,t-细胞靶向疗法是t-细胞双特异性、三特异性或多特异性抗体或其抗原结合片段。在一些实施方案中,癌症免疫治疗是nk细胞靶向疗法。在一些实施方案中,nk细胞靶向疗法是双特异性、三特异性或多特异性抗体或其抗原结合片段。
[0395]
在一些实施方案中,使用本文所述的cd8结合剂(例如
18
f-抗-cd8 vhh)的cd8成像可用于评估在施用检查点抑制剂或免疫调谐分子例如cd16或cd3靶向部分之前、期间和之后的肿瘤和淋巴结cd8
浸润。这种成像用于确定与检查点抑制剂或免疫调谐分子例如cd16或cd3靶向部分的功效有关的微生物组生物标志。
[0396]
所述实施例中使用的检查点抑制剂可以是任何检查点抑制剂。在一些实施方案中,检查点抑制剂是抗-pd1或抗-pdl1抗体。在一些实施方案中,检查点抑制剂是阿替利珠单抗(tecentriq
®
)。
[0397]
免疫调谐分子可以是影响cd8细胞增殖和浸润的任何分子。例子包括t-细胞双特异性分子,例如结合cd3和肿瘤相关抗原的抗体和结合cd16和肿瘤相关抗原的分子。
[0398]
示例性实施方案和实施例是仅仅为了举例说明起见而提供的,且不意图以任何方式限制本技术的范围。实际上,除了本文所示和描述的那些之外的各种修改根据前面的描述对于本领域技术人员而言将变得显而易见并且落入所附权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。