一种从废旧三元电池粉中回收镍钴锰的方法与流程
- 国知局
- 2024-06-20 14:29:27
本发明属于废弃物回收再生,具体涉及一种从废旧三元电池粉中回收镍钴锰的方法。
背景技术:
1、随着新能源汽车行业的飞速发展,三元锂电池的产量呈现快速增加趋势,废旧锂电池再资源化成为了研究热点,其中已有大量ncm三元锂电池进入失效、回收阶段,废旧ncm三元电池粉主要含有有价金属镍、钴、锰、锂,其中镍钴锰均为高化合价态,且含量较高,因此具有较高的经济价值。近年来,众多科研工作者对退役三元锂电材料回收镍钴锰做了大量的工作,其中最主要的回收镍钴锰方法有以湿法直接将电池粉中的锂、镍、钴、锰等有价元素全部浸出,浸出时需加入还原剂,浸出液再依次分离杂质,最终制备镍钴锰盐溶液,该传统的湿法工艺存在净化分离工序复杂、锂的回收困难且回收率低的问题。也可采用火法与湿法联合的方式回收镍钴锰,其中研究较多的为:先将电池粉焙烧或还原焙烧,再以湿法提取镍钴锰,当采用还原焙烧法时,通常是将电池粉与还原剂混合,电池粉中的高化合价态的镍钴锰被还原为低价态的金属单质混合物以及低价氧化物混合物,再通过湿法浸出回收其中的镍钴锰。
2、公开号为cn112374511b的中国发明专利,公开了《一种废旧三元锂电池回收制备碳酸锂和三元前驱体的方法》,采用废旧三元电池预处理后得到的黑粉中自带的石墨、粘结剂作为还原剂,通过自还原相转化破坏三元材料的结构;采用碳酸化水浸的方法,将碳酸锂转化为易于水浸的碳酸氢锂,实现锂的优先浸出;提锂后的材料无需加入还原剂,直接进行硫酸浸出得到镍钴锰溶液,镍钴锰溶液再通过沉淀除杂、萃取得到镍钴锰的硫酸盐溶液,经调整金属配比后可制备高质量的三元正极材料前驱体。采用还原焙烧后,镍、钴、锰转变为金属或低价氧化物形态,酸浸难度降低,在无需使用还原剂且浸出条件更为温和的条件下即可实现镍、钴、锰浸出率大于98%。经过还原焙烧,可将电池粉中的部分有机物分解或挥发,以免其在酸溶浸出时产生大量泡沫冒槽,进而影响生产效率,然而经发明人大量实验与实践证明,通过对电池粉的还原焙烧优先提锂的方式,虽然可基本消除电池粉中有机物在后续酸溶过程中引起的酸溶困难问题,但并不能消除因镍钴单质与硫酸反应生成大量气泡导致的酸溶不畅问题,也正是由于其中的镍钴在还原焙烧过程中转化为金属单质,因此酸溶浸出槽上部会产生厚厚一层浓稠的泡沫,不断冒槽,这是因为直接加硫酸对其酸溶浸出时,镍钴单质与硫酸反应生成大量二氧化硫与氢气气体难以消散,进而阻碍酸溶及反应正常进行,酸溶浸出时硫酸添加速度难以控制,工艺稳定性变差,生产效率低。
3、公开号为cn106129511b的的中国发明专利,公开了《一种从废旧锂离子电池材料中综合回收有价金属的方法》将废旧锂离子电池正极材料与还原剂混合还原焙烧处理,通过水浸通入co2提锂,水浸渣采用氧化酸浸或氧化氨浸浸出其中的钴、镍、锰等有价元素,经萃取、净化后制取相应的化合物产品。虽然采用了还原法焙烧,但酸浸过程仍然需要单独使用氧化剂或含氨试剂,氧化酸浸的浸出剂可选h2so4、hcl、hno3,氧化剂可选空气、氧气、过氧化氢,然而也未提出如何解决酸溶浸出过程加酸困难的问题的方案。
4、因此,研究开发一种能够解决从废旧三元电池粉中回收镍钴锰时,还原焙烧提锂后额外单独添加氧化剂和镍钴锰酸溶过程加酸出泡的问题非常有必要。
技术实现思路
1、本发明旨在解决上述技术问题,提供一种从废旧三元电池粉中回收镍钴锰的方法,该方法能够从废旧三元电池粉中回收得到镍钴锰,还原焙烧提锂后不需要额外单独添加氧化剂,在酸浸过程中也不会产生气泡和污染性气体。
2、本发明的技术方案为:
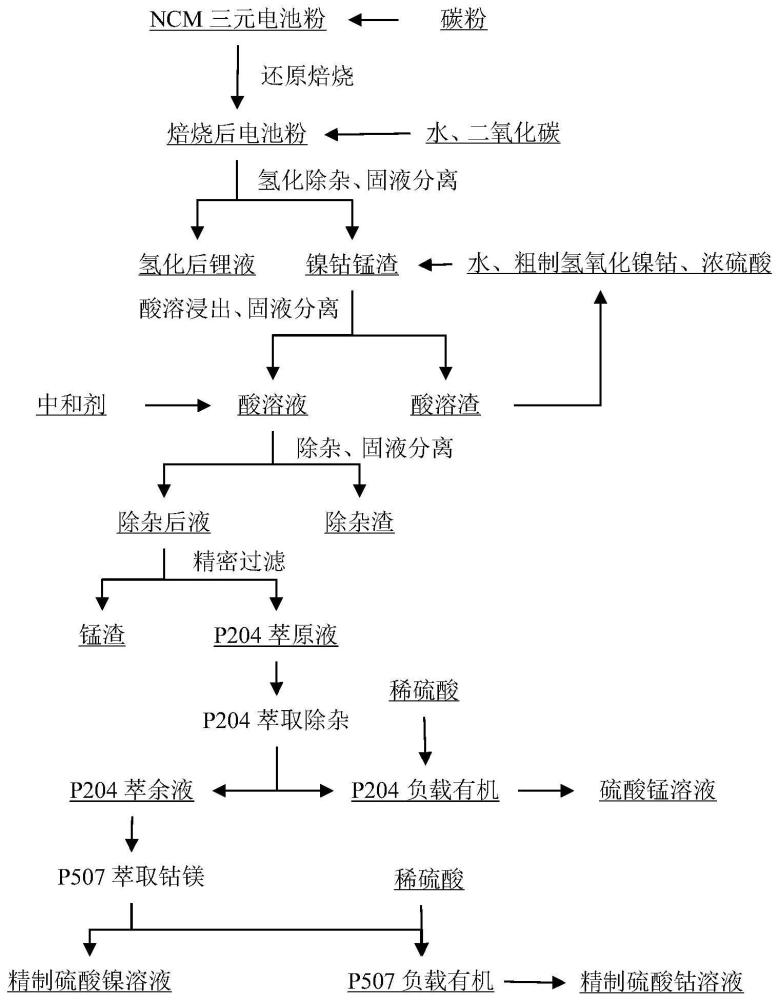
3、一种从废旧三元电池粉中回收镍钴锰的方法,包括以下步骤:
4、(1)预先提锂:将废旧三元电池粉在隔绝氧气的条件下,进行还原焙烧,得到焙烧后电池粉,向焙烧后电池粉中加水制浆,进行氢化除杂,固液分离,得到氢化后锂液和镍钴锰渣,将氢化后锂液热分解,回收得到碳酸锂;
5、(2)镍钴锰的回收:
6、s1、浸出:向步骤(1)中得到的镍钴锰渣中混入粗制氢氧化镍钴,按照液固质量比3.0-6.5:1加水制浆,加入浓硫酸,酸溶浸出,固液分离,得到酸溶液与酸溶渣,酸溶渣返回步骤s1中使用;
7、s2、除杂:向酸溶液中加入中和剂,固液分离,得到除杂渣和除杂后液;
8、s3、萃取:将除杂后液过滤后加入p204,萃取杂质、分相,得到p204萃余液和负载有机相ⅰ;向p204萃余液中加入p507,萃取钴镁、分相,得到精制硫酸镍溶液和负载有机相ⅳ;
9、s4、回收锰钴:对负载有机相ⅰ加稀硫酸,反萃、分相,得到硫酸锰溶液,将负载有机相ⅳ加稀硫酸,反萃、分相,得到精制硫酸钴溶液。
10、本发明s1中,对于浓硫酸浓度无严格要求,质量浓度在50-98%均可。
11、本发明的废旧ncm三元电池粉中主要有价金属元素为镍、钴、锰、锂,在电池拆解过程中,由于存在含氟有机物、正负极,因此最终电池粉中往往同时含有少量铜、铝、氟等杂质,其中铜、铝主要以单质形式存在,还原焙烧时,铜、铝、碳粉作为还原剂参与氧化还原反应,还原焙烧时主要反应如下:
12、2licoo2+2a1=a12o3+2co+li2o (1)
13、2licoo2+3cu=3cuo+2co+li2o (2)
14、2linio2+2a1=a12o3+2ni+li2o (3)
15、2linio2+3cu=3cuo+2ni+li2o (4)
16、2limn2o4+2a1=a12o3+4mno+li2o (5)
17、2limn2o4+3cu=3cuo+4mno+li2o (6)
18、4linio2+3c=2li2co3+4ni+co2 (7)
19、4licoo2+3c=2li2co3+4co+co2 (8)
20、4limn2o4+7c=2li2co3+8mn+5co2 (9)
21、还原剂用量不宜过多或过少,过少将导致还原不彻底,进一步导致锂浸出率降低,还原剂过多时,还原剂利用率低,过量的还原剂会留在焙烧后电池粉中,不利于后续镍钴锰的提取,因此,本发明优选加入废旧三元电池粉重量5-20%的碳粉进行还原焙烧。
22、优选地,本发明还原焙烧条件:温度为700-1200℃、时间为1-3h。还原焙烧过程中,还原焙烧温度低于700℃时,还原不彻底,进一步导致锂浸出率降低,镍钴锰仍以高价态氧化物形式存在,同时锂未完全转化为氧化锂或碳酸锂,不利于提高镍钴锰锂的回收率。还原温度过高时,能耗过高,不利于节约成本。还原焙烧时间过短时,还原不彻底,不利于提高后续镍钴锰锂的回收率,还原时间过长,不利于节约能耗,在其他条件相同时,1-3h的还原效果相近,为节约能耗及综合考虑还原效果,还原焙烧时间宜控制在1-3h。
23、还原焙烧后电池粉中除生成碳酸锂与氧化锂之外,镍钴锰分别被还原为镍、钴、锰的单质,以及部分氧化锰,同时电池粉中参与氧化还原反应的铜、铝分别转化为其对应的氧化物。还原焙烧过程中由于电池粉本身具有还原性物质,故补加还原剂碳粉,经焙烧之后存在还原剂过量的情况,焙烧后电池粉中还有少量未参与反应的碳粉。为提高还原效率,应控制焙烧时隔绝氧气,如采用真空或二氧化碳或氮气气氛保护的方式,通过还原焙烧在提高电池粉中镍钴锰还原率的同时,可将其中的锂转化为碳酸锂和氧化锂,更有利于下一步镍钴锰锂的提取。
24、氢化除杂时中制浆液固比过低,将导致锂过饱和,碳酸锂溶解不完全,降低后续锂的回收率;液固比过高,将导致氢化后锂液中锂浓度过低,增加热分解时的水蒸发量,不利于降低能耗和提高生产效率,因此,优选地,本发明步骤(1)中,氢化除杂时按照锂浓度为5-10g/l加水制浆。氢化时间可根据氢化过程ph确定,还未开始通入二氧化碳时,浆体呈碱性,ph在11-13,通入二氧化碳后,氢化反应开始,浆体碱度降低,直到ph不再变化时,氢化反应结束,一般1h以上即可完成氢化过程,为提高生产效率,氢化时间宜控制在3h以内。氢化时通入的二氧化碳量过少会导致氢化不完全,过多造成试剂的浪费,优选二氧化碳过量系数为1.5-3.0。
25、氢化除杂时,碳酸锂、氧化锂溶于水或与水发生化学反应,其他氧化物、金属单质不溶于水,从而可实现锂与其他杂质的初步分离,氧化锂与水反应生成氢氧化锂,通入的二氧化碳将碳酸锂、氢氧化锂(后者先转化为碳酸锂,再在过量二氧化碳的作用下转化为碳酸氢锂)转化为溶解度较大的碳酸氢锂,氢化后锂液中锂的存在形态为碳酸氢锂:
26、li2o+h2o=2lioh (10)
27、2lioh+co2=li2co3+h2o (11)
28、li2co3+h2o+co2=2lihco3 (12)
29、由于氢化过程为中性偏碱环境,ph为7-9,因此,即便电池粉中含有少量的硅、铝、铜、镍、钴、锰、锌等杂质,也会在氢化过程中水解沉淀,固液分离后得到的氢化后锂液中不含上述杂质,热分解时为碳酸氢锂分解为碳酸锂,固液分离时得到的母液主要成分为碳酸氢锂,热分解条件:温度为85-95℃、时间为1-3h,热分解时发生如下反应:
30、2lihco3=li2co3+h2o+co2↑ (13)
31、由于还原焙烧后电池粉中含有镍、钴、锰的单质,以及还可能含有未反应完全的碳粉,经氢化除杂后得到镍钴锰渣,该过程除将锂溶出之外,并未引起其中镍钴锰的化学性质发生变化,因此,直接向镍钴锰渣中只加无机酸,如浓硫酸,不加其他任何试剂时,主要发生如下反应:
32、m+2h2so4(浓)=mso4+so2↑+2h2o(14)
33、m+h2so4(稀)=mso4+h2↑ (15)
34、(m=ni、co、mn)
35、c+h2so4(浓)=co2↑+so2↑+2h2o(16)
36、mno+h2so4=mnso4+h2o(17)
37、a12o3+3h2so4=a12(so4)3+3h2o(18)
38、cuo+h2so4=cuso4+h2o (19)
39、即:镍钴锰渣中只加硫酸时,虽然能将其中的镍钴锰金属和氧化物转化为离子形式进入酸溶液,但是由于在浓硫酸作用下,镍钴锰渣中含有大量的镍钴锰单质,因此会发生单质与浓硫酸反应生成大量二氧化硫、单质与稀硫酸反应生成大量氢气的反应,同时当电池粉中还存在未参与反应的碳粉时,碳粉也可与浓硫酸发生氧化还原反应,生成二氧化碳、二氧化硫气体,因此在实际生产实践中,若对镍钴锰渣单独加无机酸溶解时,常常会在酸溶过程中产生大量气泡,阻止反应正常进行,由于容易发生冒槽现象,且产生的大量气泡难以消除,因此将会导致加酸时间大大延长,工艺过程不稳定。本发明为解决上述问题,采用粗制氢氧化镍钴与镍钴锰渣联合浸出的方式,优选地,所述步骤s1中,粗制氢氧化镍钴加入量为镍钴锰渣重量的15-50倍,粗制氢氧化镍钴的比例过低时,由于其中的二氧化锰含量较少,会导致其在参与氧化还原反应时对镍钴单质与硫酸反应生成大量气体的置换反应的抑制作用减弱,酸溶浸出时冒槽现象得不到有效改善。当粗制氢氧化镍钴比例过高时,一方面,由于二氧化锰的过量,导致其在酸溶浸出完成之后仍有大量二氧化锰渣残留,锰的整体浸出率降低,另一方面,粗制氢氧化镍钴占比过多,最终的酸溶渣主要成分为二氧化锰,二氧化锰占比越大,酸溶浆体的过滤性能越差,为兼顾锰的浸出率、解决酸溶过程困难、以及确保酸溶浆体的过滤性能良好,粗制氢氧化镍钴加入量为镍钴锰渣重量的15-50倍。
40、优选地,本发明所述粗制氢氧化镍钴中含2-10wt.%锰,二氧化锰含量过低,粗制氢氧化镍钴用量过大,起不到氧化和抑制氢气与二氧化硫气体产生的作用,常见的粗制氢氧化镍钴中锰含量为2-10%,其中+4价态的锰主要以二氧化锰形式存在,其在只加硫酸,不加其他任何浸出剂时,不随酸溶过程浸出,而是以二氧化锰渣的形式存在,锰含量为2-10%的粗制氢氧化镍钴中+4价锰的占比一般在50-80%,都可用于本发明中与镍钴锰渣联合酸溶浸出,达到抑制酸溶浸出过程冒槽的效果。
41、本发明利用粗制氢氧化镍钴中的二氧化锰的强氧化特性,抑制上述产生大量气体的反应,可同时实现粗制氢氧化镍钴与镍钴锰渣中有价金属的回收,粗制氢氧化镍钴与镍钴锰钴渣中均含有有价金属镍钴锰,因此两者一起回收有价金属并不相冲突,也不增加生产流程,粗制氢氧化镍钴在硫酸的作用下,其中的镍钴锰氢氧化物与硫酸发生中和反应,而其中含有的高化合价态的锰以二氧化锰形式存在,在不添加还原剂的条件下,二氧化锰不会随氢氧化物一起溶出转化为mn2+,经实验与生产实践证明,二氧化锰具有强氧化性,其可优先与镍钴锰渣中的金属单质在酸性条件下发生氧化还原反应,从而抑制镍钴单质与硫酸反应生成大量气体的反应,酸溶浸出体系中的反应转化为镍钴单质与二氧化锰、硫酸的反应,而镍钴单质直接与浓硫酸、稀硫酸反应生成大量气体的反应减弱,浸出体系以下列反应为主:
42、m(oh)2+2h2so4=mso4+2h2o (20)
43、n+2h2so4+mno2=nso4+mnso4+2h2o (21)
44、(m=ni、co、mn,n=ni、co)
45、同时发生的其他反应如下:
46、c+h2so4(浓)=co2↑+so2↑+2h2o(22)
47、mno+h2so4=mnso4+h2o (23)
48、a12o3+3h2so4=a12(so4)3+3h2o(24)
49、cuo+h2so4=cuso4+h2o (25)
50、因此,通过粗制氢氧化镍钴与镍钴锰渣的混合,再联合硫酸酸溶,酸溶过程不再产生大量气泡,产生气泡的唯一途径为少量过剩的碳粉与浓硫酸反应生成的二氧化硫与二氧化碳,由此,可基本消除或减少镍钴锰渣在酸溶过程中的冒槽现象,酸溶浸出过程更稳定、易操作、作业环境得以改善。优选地,本发明酸溶浸出终点ph为1.0-2.5,酸溶浸出时ph过低将导致后续除杂消耗大量的中和剂,进而产生大量除杂渣,ph过高则导致有价金属镍钴锰溶出不完全,进而降低镍钴锰的回收率,在ph=1.0-2.5的条件下,不但可将镍钴锰浸出完全,还有利于二氧化锰充分发挥其氧化作用,进而抑制氢气和二氧化硫的产生。
51、本发明步骤s1中酸溶渣的主要成分为剩余的二氧化锰,其可作为氧化剂代替粗制氢氧化镍钴,与镍钴锰渣一并酸溶,也可抑制氢气、二氧化硫的产生,以消除或减少镍钴锰渣在酸溶过程中的冒槽现象。
52、本发明步骤s2中,中和剂可将酸溶液中的主要杂质铁、铝、硅、铜、铬、硅等水解沉淀,通过固液分离去除,水解过程中主要发生的反应如下:
53、fe3++3h2o=fe(oh)3(s)+3h+ (26)
54、fe2++2h2o=fe(oh)2(s)+2h+ (27)
55、4fe(oh)2+o2+2h2o=4fe(oh)3 (28)
56、al3++3h2o-=al(oh)3(s)+3h+ (29)
57、cu2++2h2o=cu(oh)2(s)+2h+ (30)
58、cr3++3h2o=cr(oh)3(s)+3h+ (31)
59、sio32-+h2o=h2sio3(s)+3h+ (32)
60、在中和剂的作用下,酸溶液中的硫酸被中和,体系ph升高,溶液中的杂质离子先后水解生成氢氧化物胶体或沉淀,生成沉淀或胶体的同时也生成了氢离子,然而随着中和剂的加入,中和剂还可消耗水解产生的氢离子,从而促进水解反应正向进行,因此通过固液分离可去除上述杂质,生成的氢氧化铁胶体具有吸附作用,也可以吸附去除溶液中的硅。本发明中和剂优选为石灰石或氢氧化锆,其中当以石灰石为中和剂时,在杂质离子发生水解的同时,碳酸钙中的钙与酸溶液中的硫酸根离子发生复分解反应,部分转化为硫酸钙沉淀,ph过低将导致杂质离子水解不彻底,增加后续萃取负担,萃取时容易产生乳化、降低萃取效果与增加分相难度,ph过高时,酸溶液中的镍钴锰也将部分水解生成氢氧化物沉淀,且中和剂用量剧增,为兼顾除杂效果、减少中和剂用量与提高镍钴锰的回收率,除杂ph应当控制在5.0-6.0。当以氢氧化锆为中和剂时,同样的,ph过低,铝、铬、硅的去除不彻底,当ph高于6.0时,氢氧化锆用量较大,且除杂效果无明显提高,同时由于过量氢氧化锆的引入,有价金属离子将部分水解沉淀进入除杂渣中,不利于提高镍钴锰的回收率,ph=5.0-6.0时,除杂效果相近,都可达到深度除杂的效果,因此除杂终点ph应当控制在5.0-6.0。对除杂温度无严格要求,常温或加温均可达到相近的除杂效果,其中在温度为20-95℃范围内,其他条件相同时,除杂效果相近,除杂时间在2h以上即可,为提高除杂效率,除杂时间宜控制在4h以内。
61、由于二氧化锰为极细微粒,若二氧化锰未反应完全,则在固液分离步骤时容易穿过滤布,因此需对除杂后液进行精密过滤,以防止萃取除杂过程中悬浮物和乳化物的产生,精密过滤得到的锰渣可代替一部分粗制氢氧化镍钴使用,锰渣与镍钴锰渣一并酸溶,也可抑制氢气、二氧化硫的产生,以消除或减少镍钴锰渣在酸溶过程中的冒槽现象。
62、经过除杂之后,已经去除了大部分杂质,但还有少量的钙、锌等杂质留在除杂后液中,通过步骤s3的p204萃取除杂可将钙、锌萃取进入p204有机相中,从而实现钙、锌与镍钴的分离,p204在萃取钙锌的同时,溶液中的锰也一并被萃取,因此,若想回收其中的锰,还需对p204负载有机进行反萃,得到硫酸锰溶液,再进一步回收锰。经过p204萃取之后的p204萃余液,主要成分为硫酸镍钴溶液,同时还含有少量的镁杂质,为将镁去除,可以p507对p204萃余液进行萃取,然而在萃取镁的同时溶液中的钴也一并被萃取,为此,若想回收其中的钴,需对p507负载有机进行反萃,得到精制硫酸钴溶液,再进一步回收钴,p507萃余液为精制硫酸镍溶液。精制硫酸镍、硫酸钴溶液可用于生产电池级硫酸镍、硫酸钴结晶,硫酸锰溶液中主要杂质为钙、少量锌,经除杂后可用于生产电池级硫酸锰结晶。
63、本发明步骤s3中对萃取剂的体积浓度无严格要求,当萃取剂浓度过高时,黏度较大,不利于萃取后的分相,浓度过低时,不利于提高萃取效率,p204体积浓度控制在20-25%,p507的体积浓度控制在10-15%为宜,单级萃取时间在10min以上可达到萃取相应杂质的效果,为提高工作效率,萃取时间控制在10-20min,对萃取温度无严格要求,温度过低时萃取后分相较慢,为节约能耗和快速分相,萃取温度控制在20-50℃为宜。
64、为了回收有价金属锰、钴,以及对负载杂质的p204、p507萃取剂再次使用,须将其负载的杂质离子反萃,以达到萃取剂再生、循环使用的目的。p204有机相的主要杂质为锰、锌、钙,可通过稀硫酸将其反萃,为提高镍的回收率,在反萃取除杂质之前,可先以纯水对负载有机相进行洗涤,洗涤去除负载有机相夹带的镍,得到的洗镍液可返回作为p204萃原液使用,再对其加入稀硫酸反萃负载的杂质,具体为:
65、(1)将负载有机相ⅰ先以纯水洗镍,以1.5-2.5n的稀硫酸反萃锰,控制水相ph为2.0-2.5,得到硫酸锰溶液和负载有机相ⅱ,继续向负载有机相ⅱ加入1.5-2.5n的稀硫酸反萃锌,控制水相ph为1.0-1.8,得到硫酸锌溶液和负载有机相ⅲ,负载有机相ⅲ即为再生p204,可返回萃取除杂使用。在上述反萃过程中,一段反萃ph若高于2.5,将导致锰反萃不彻底,从而使得负载有机相ⅱ中剩余的锰进入含硫酸锌溶液中,锰与锌分离不彻底,若一段反萃ph低于2.0,则过量的酸度将使得锌先被部分反萃,导致大量锌进入含硫酸锰溶液中,同样锰与锌分离不彻底;反萃锌时,ph若高于1.8,锌反萃不彻底,降低萃取剂再次使用时的萃取效果,ph若低于1.0,得到的硫酸锌溶液中余酸较高,不利于处理硫酸锌溶液时节约成本。对上述反萃过程所使用的稀硫酸浓度无严格要求,只要有利于操作(反萃时方便控制各段的ph)即可。
66、(2)将负载有机相ⅳ先以纯水洗镍,以0.5-1.5n的稀硫酸反萃镁,控制水相ph为4.0-4.5,得到硫酸镁溶液和负载有机相ⅴ,继续向负载有机相ⅴ中加入1.5-2.5n的稀硫酸进行一次反萃钴,控制水相ph为2.5-3.5,得到精制硫酸钴溶液和负载有机相ⅵ,向负载有机相ⅵ中继续加入1.5-2.5n的稀硫酸进行二次反萃钴,控制水相ph为1.0-1.5,得到二次钴反萃后液和有机相vii,有机相vii即为再生p507,可返回萃取钴镁使用。在上述反萃过程中,反萃镁过程中ph若高于4.5,则镁反萃不彻底,从而使得负载有机相ⅴ中剩余的镁大量进入精制硫酸钴溶液中,镁与钴分离不彻底,若是反萃镁过程中ph低于4.0,则过量的酸度将使得少量钴先被反萃下来,大量钴进入含硫酸镁溶液中,镁与钴同样分离不彻底。对反萃钴用的稀硫酸浓度无严格要求,只要有利于操作(反萃时方便控制各段的ph)即可。其中一次反萃钴过程中ph若高于3.5,将导致钴反萃率较低,ph若低于2.5,含精制硫酸钴溶液中余酸较高,不利于精制硫酸钴溶液的后续处理。二次反萃钴时,ph若高于1.5,有机中负载的钴及其他杂质反萃不彻底,降低萃取剂再次使用时的萃取效果,ph若低于1.0,二次钴反萃后液中余酸较高,增加后续处理二次钴反萃液成本。
67、由于采用上述技术方案,本发明的有益效果为:
68、1、本发明方法能够从废旧三元电池粉中回收分别得到硫酸镍、硫酸钴、硫酸锰溶液,且在回收过程中,没有气泡和污染气体产生,还原焙烧时,也不需要单独添加氧化剂。
69、2、本发明方法中通过提取锂之后的镍钴锰渣与粗制氢氧化镍钴联合酸溶浸出的方法,利用粗制氢氧化镍钴原料中的二氧化锰,抑制镍钴锰渣中镍钴单质与浓硫酸、稀硫酸反应生成大量二氧化硫与氢气的反应,从而达到镍钴锰渣酸溶不冒槽的效果,两者联合浸出时基本无气泡产生,由于基本消除了大量气体的产生,因此作业环境得到极大改善,硫酸添加速度易控,生产效率提高。
70、3、本发明方法中萃取剂p204和p507能回收反复使用,降低萃取成本,进一步达到节能环保的效果。
本文地址:https://www.jishuxx.com/zhuanli/20240619/10397.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表