一种双位点定点抗体功能分子偶联物,其制备方法及用途
- 国知局
- 2024-09-14 14:55:09
本发明涉及药物化学、生物技术药物领域,具体涉及一类双位点定点抗体-功能分子偶联物、其制备方法和用途。
背景技术:
1、抗体药物偶联物(antibody-drug conjugates,adcs)由抗体、细胞毒素和连接子三部分组成,通过抗体将细胞毒素输送到肿瘤组织,实现毒素的靶向输送,从而发挥抗肿瘤活性。大量的数据显示定点抗体药物偶联物相比随机偶联adcs化合物具有更好的治疗指数。药物抗体比(drug-to-antibody ratio,dar)代表抗体偶联毒素的平均数量,dar值大小对adcs化合物的疗效发挥至关重要,低dar值可能会影响adcs化合物的治疗效果,高dar值则会增加adcs化合物的疏水性,影响体内药代动力学行为。因此,在adcs化合物的结构设计中,应综合考虑抗体、毒素、连接子、偶联位点,并确定合适的dar值。如对一些毒性较弱的细胞毒素,可以通过在药物-连接子中引入亲水片段,制备高dar值adcs化合物,从而发挥更好的杀伤作用。
2、此外,近年来双药adcs的概念也崭露头角,以期发挥1+1>2的功效。然而,不论是特定dar值adc化合物还是双药adcs,均需要特定的手段制备。stephen caddick等报导利用半胱氨酸桥联技术在抗体中引入线性炔和环张力炔结构,进一步利用生物正交反应引入两种不同的毒素分子,从而制备双药adcs化合物。christoph rader等组合thiomab技术和selenomab技术制备双药adcs化合物。matthew r.levengood等则在抗体中引入两个含不同保护基的巯基,分别脱保护偶联不同的毒素分子,制备得到的双药adcs化合物具有较好的抗肿瘤活性。nazzareno dimasi等则合成三功能连接子结构,结构中含有马来酰亚胺结构、炔基和酮糖基,最终制备双药adcs化合物。
3、上述工作对高dar值adcs和双药adcs的制备提供了多种策略,这些策略通常需要设计多分支结构,或者需要利用不同的基因工程技术手段,或复杂的酶组合,或进行蛋白蛋白偶联。大部分策略可能引入多种疏水性结构或者导致低的偶联效率。这一方面导致双药抗体-功能分子偶联物的制备方法复杂,不易于工业化,另一方面导致所制备的药物局部疏水性高,稳定性差。
4、因此,仍然需要提供具有新的结构的双位点定点抗体-功能分子偶联物,以及关于其的简单、高效的制备方法。
技术实现思路
1、因此,本公开的发明人发明了一类双位点抗体-功能分子偶联物,通过组合糖链定点技术和导向肽介导的定点修饰技术,实现抗体糖基化位点和246或248位赖氨酸位点功能分子的定点定量引入,从而制备得到特定dar值的抗体-功能分子偶联物。本公开提供的双位点定点adcs化合物制备方法简单、高效,制备获得的adcs分子结构新颖,具有较好的体内外稳定性和活性。
2、本发明的一个目的是提供一种双位点定点抗体-功能分子偶联物。
3、本发明的另一个目的提供所述双位点定点抗体-功能分子偶联物的制备方法。
4、本发明的另一个目的是提供所述双位点定点抗体-功能分子偶联物在抗肿瘤等中的应用。
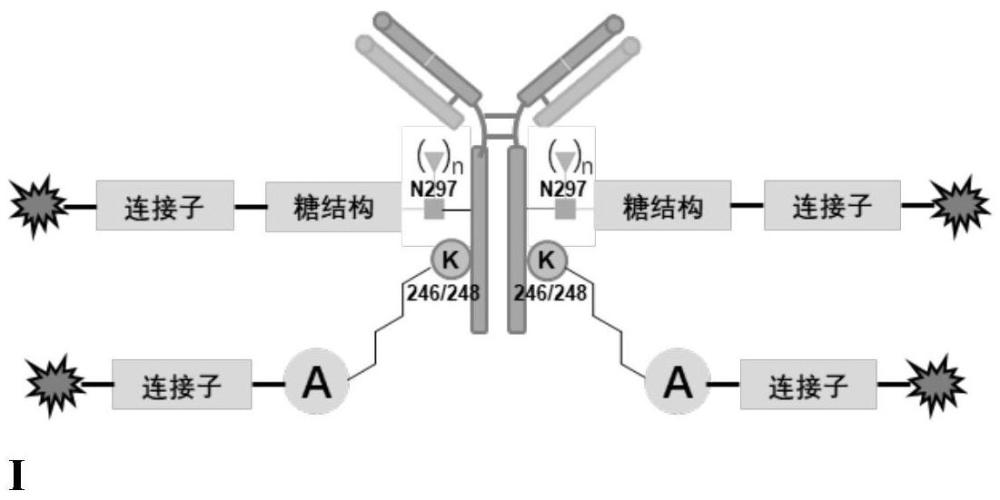
5、根据本发明的一个实施方式,其提供了一种双位点定点抗体-功能分子偶联物,其包括抗体,连接片段1和2,功能分子;其中,所述功能分子通过连接片段1偶联至抗体fc区域保守糖基化位点,以及通过连接片段2偶联至抗体246或248位赖氨酸位点。
6、根据本发明的一个实施方式,其中,
7、其中,所述功能分子通过连接片段1偶联至抗体fc区域保守糖基化位点,以及通过连接片段2偶联至抗体248位赖氨酸位点。
8、根据本发明的一个实施方式,其中,
9、所述抗体选自任何包括fc区域的人源化抗体或包括fc区域的其他动物源抗体;
10、所述功能分子彼此相同或不同,独立地选自反应性官能团、荧光基团、药物、毒素、放射性结构、溶酶体导向肽;
11、所述连接片段1包括连接子和糖结构,其中糖结构与抗体fc区域保守糖基化位点连接,连接子与功能分子连接;
12、所述连接片段2包括连接子和片段a,其中片段a与抗体246或248位赖氨酸位点连接,连接子与功能分子连接;
13、其中,所述糖结构代表单糖、二糖、寡糖或分支糖结构;所述片段a代表酰胺结构、三氮唑结构;在抗体fc结构域糖基化位点上,连接子代表任何可以连接糖结构和功能分子之间的结构;在抗体246或248位赖氨酸位点上,连接子代表任何可以连接片段a和功能分子之间的结构。
14、在本发明中,更具体而言:
15、所述抗体选自不同igg亚型抗体、单克隆抗体、双功能或多功能抗体、多克隆抗体、不同种属来源的功能性抗体;例如曲妥珠单抗(赫赛汀)、美罗华、帕妥珠单抗、帕尼单抗、特瑞普利单抗、纳武单抗、鼠源抗体、兔源抗体、羊源抗体;
16、在所述功能分子中,所述反应性官能团选自叠氮基团、四嗪基团、tco基团、炔基结构、醛基结构、羰基结构、羟胺结构、异硫氰酸酯、氨基、羧基、巯基、烯基、马来酰亚胺、酰腙结构等;
17、所述荧光基团选自生物素、fitc、罗丹明、cy3、cy5等;
18、所述药物或毒素选自mmae、mmaf、dxd、dx8951、sn38、dm1、dm4、pbd、pbd二聚体、艾瑞布林、多卡霉素及这些药物的衍生物等;
19、所述放射性结构选自68ga、18f、89zr等;
20、所述溶酶体导向肽为signaltac。
21、根据本发明的一个实施方式,所述双位点定点抗体-功能分子偶联物由以下式i表示:
22、
23、在式i中,中心的“y”形结构是抗体;代表核心岩藻糖结构;n为0或1;连接子代表peg链、碳链、可裂解连接子等;糖结构代表单糖、二糖、寡糖或分支糖结构;片段a代表酰胺结构、三氮唑结构;代表功能分子,糖基化位点和赖氨酸位点的功能分子可以相同或者不同,且可以偶联一个或者多个功能分子。
24、根据本发明的一方面,所述式i的双位点定点抗体-功能分子偶联物由以下式ii表示:
25、
26、在式ii中,各部分的定义与上文相同。
27、根据本发明的一方面,所述式ii的双位点定点抗体-功能分子偶联物选自以下具体化合物:
28、
29、
30、
31、
32、其中,mmae结构为mmaf结构为dx8951结构为eribulin(即艾瑞布林)结构为signaltac结构为
33、根据本发明的一个实施方式,其提供了一种制备上述双位点抗体-功能分子偶联物的制备方法,该方法选自以下方法一至方法三,如以下反应式所示:
34、
35、其中,在以上反应式中,各部分的定义分别如上文所定义:
36、方法一:野生型抗体或去岩藻糖抗体经过糖基转移酶或糖苷内切酶介导的糖链定点技术,获得抗体糖基化位点修饰功能分子的糖链定点抗体-功能分子偶联物,随后通过导向肽或导向蛋白介导的k246或k248定点技术在抗体246或248位赖氨酸位点偶联功能分子-连接子,最终得到双位点修饰的抗体-功能分子偶联物;或者
37、方法二:野生型抗体或去岩藻糖抗体在加入糖链定点技术所需要的酶和底物的同时,加入导向肽/蛋白介导的赖氨酸定点技术所需的底物,孵育后得到双位点修饰的抗体-功能分子偶联物;或者
38、方法三:野生型抗体或去岩藻糖抗体首先经过导向肽或导向蛋白介导的k246或k248定点技术在抗体246或248位赖氨酸位点偶联功能分子-连接子,随后利用糖基转移酶或糖苷内切酶介导的糖链定点技术在抗体糖基化位点偶联功能分子,最终得到双位点修饰的抗体-功能分子偶联物;
39、其中,所述糖基转移酶包括但不局限于岩藻糖转移酶、半乳糖转移酶、唾液酸转移酶等,所述糖苷内切酶包括但不局限于endo-s、endo-s2、endo-f3、endo-m以及这些酶的突变体,并包含融合这些不同糖苷内切酶功能区形成的融合蛋白。
40、根据本发明的一个实施方式,所述方法一包括:
41、步骤a1:将抗体置于缓冲液(例如,ph 5.5-8.0)中,加入糖结构-功能分子复合物及糖基转移酶或糖苷内切酶,在15℃-37℃温度下反应30分钟至过夜(如20小时),获得抗体糖基化位点修饰功能分子的糖链定点抗体-功能分子偶联物,
42、步骤a2:随后将步骤a1中得到的产物置于缓冲液(例如,ph 5.5-8.0)中,加入导向肽-功能分子复合物,在0℃-40℃温度下反应30分钟至过夜(如20小时),以在抗体246或248位赖氨酸位点偶联功能分子-连接子,最终得到双位点修饰的抗体-功能分子偶联物。
43、根据本发明的一个实施方式,所述方法二包括:
44、将抗体置于缓冲液(ph 5.5-8.0)中,加入糖基转移酶或糖苷内切酶及糖结构-功能分子复合物,并同时加入导向肽-功能分子复合物,在15℃-37℃温度下反应30分钟至过夜(如20小时),孵育后得到双位点修饰的抗体-功能分子偶联物。
45、根据本发明的一个实施方式,所述方法三包括:
46、步骤c1:将抗体置于缓冲液(ph 5.5-8.0)中,加入导向肽-功能分子复合物,在0℃-40℃温度下反应30分钟至过夜(如20小时),从而在抗体246或248位赖氨酸位点偶联功能分子-连接子,
47、步骤c2:随后将步骤c1中得到的产物置于缓冲液(ph 5.5-8.0)中,加入糖基转移酶或糖苷内切酶及糖结构-功能分子复合物,在15℃-37℃温度下反应30分钟至过夜(如20小时)最终得到双位点修饰的抗体-功能分子偶联物。
48、上述方法一、二、三中所述糖基转移酶包括但不局限于岩藻糖转移酶、半乳糖转移酶、唾液酸转移酶等,所述糖苷内切酶包括但不局限于endo-s、endo-s2、endo-f3、endo-m以及这些酶的突变体,并包含融合这些不同糖苷内切酶功能区形成的融合蛋白。
49、根据本发明的一个实施方式,其中,方法一的步骤a1所得中间体糖链定点抗体-功能分子偶联物无需纯化直接进行下一步赖氨酸定点修饰或经过纯化后进行下一步操作,和/或
50、方法三的步骤c1所得中间体k246或k248定点抗体-功能分子偶联物无需纯化直接进行下一步糖基化位点定点修饰或经过纯化后进行下一步操作。
51、根据本发明的一个实施方式,其中,所述双位点抗体功能分子偶联物通过方法一或方法三制备,其中,方法一的步骤a1和方法三的步骤c2中,使用了糖苷内切酶介导的糖链定点技术;方法一的步骤a2和方法三的步骤c1中,使用了fc结合肽作为抗体fc结构域导向片段,硫酯结构为酰基转移片段,具体而言:
52、方法一:野生型抗体或去岩藻糖抗体经过糖苷内切酶介导的糖链定点技术,获得抗体糖基化位点修饰功能分子的糖链定点抗体-功能分子偶联物,随后通过导向肽介导的k246或k248定点技术在抗体246或248位赖氨酸位点偶联功能分子-连接子,最终得到双位点修饰的抗体-功能分子偶联物。其中,中间体糖链定点抗体-功能分子偶联物可以经过纯化或直接反应体系进行下一步赖氨酸定点修饰。
53、方法三:野生型抗体或去岩藻糖抗体首先经过导向肽介导的k246或k248定点技术在抗体246或248位赖氨酸位点偶联功能分子-连接子,随后利用糖苷内切酶介导的糖链定点技术在抗体糖基化位点偶联功能分子,最终得到双位点修饰的抗体-功能分子偶联物。其中,中间体k246或k248定点抗体-功能分子偶联物可以经过纯化或直接反应体系进行下一步糖基化位点定点修饰。
54、根据本发明的一个实施方式,其提供了一种制备双位点抗体-功能分子偶联物的制备方法,,该方法选自方法四和方法五,如以下反应式所示:
55、方法四:
56、
57、其中,在以上反应式中,各部分的定义与权利要求5中的定义相同,表示反应性官能团:
58、方法四:野生型抗体或去岩藻糖抗体经过糖基转移酶或糖苷内切酶介导的糖链定点技术,获得抗体糖基化位点修饰功能分子的糖链定点抗体-反应性官能团偶联物,随后通过导向肽或导向蛋白介导的k246或k248定点技术在抗体246或248位赖氨酸位点偶联反应性官能团-连接子,得到双位点修饰的双功能化抗体,之后再经过生物正交反应在糖基化位点和k246或k248位点分别引入功能分子(如毒素),最终得到双位点修饰的抗体-功能分子偶联物;或者
59、方法五:野生型抗体或去岩藻糖抗体首先经过导向肽或导向蛋白介导的k246或k248定点技术在抗体246或248位赖氨酸位点偶联反应性官能团-连接子,随后利用糖基转移酶或糖苷内切酶介导的糖链定点技术在抗体糖基化位点偶联反应性官能团,得到双位点修饰的双功能化抗体,之后再经过生物正交反应在糖基化位点和k246或k248位点分别引入功能分子(如毒素),最终得到双位点修饰的抗体-功能分子偶联物。
60、其中,所述糖基转移酶选自岩藻糖转移酶、半乳糖转移酶、唾液酸转移酶,所述糖苷内切酶选自endo-s、endo-s2、endo-f3、endo-m以及这些酶的突变体,并包含融合这些不同糖苷内切酶功能区形成的融合蛋白;所述反应性官能团定义如上文所述。
61、根据本发明的一个实施方式,其中,
62、所述方法四包括:
63、步骤b1:将抗体置于缓冲液中,加入糖结构-反应性官能团复合物及糖基转移酶或糖苷内切酶,在15℃-37℃温度下反应30分钟至20小时,获得抗体糖基化位点修饰反应性官能团的糖链定点抗体-反应性官能团偶联物;随后往上述体系中加入导向肽-反应性官能团复合物,在0℃-40℃温度下反应30分钟至20小时,以在抗体246或248位赖氨酸位点偶联反应性官能团-连接子,获得双位点修饰的双功能化抗体,
64、步骤b2:随后往步骤b1的缓冲体系中加入两种功能分子-连接子,在0℃-40℃温度下反应30分钟至20小时,以在抗体糖基化位点和246或248赖氨酸位点引入不同或相同的功能分子,最终得到双位点修饰的抗体-功能分子偶联物;或者
65、所述方法五包括:
66、步骤d1:将抗体置于缓冲液中,加入导向肽-反应性官能团复合物,在0℃-40℃温度下反应30分钟至20小时,获得抗体246或248赖氨酸位点修饰反应性官能团的赖氨酸定点抗体-反应性官能团偶联物;随后往上述体系中加入糖结构-反应性官能团复合物及糖基转移酶或糖苷内切酶,在15℃-37℃温度下反应30分钟至20小时,以在抗体糖基化位点偶联反应性官能团-连接子,获得双位点修饰的双功能化抗体,步骤d2:随后往步骤d1的缓冲体系中加入两种功能分子-连接子,在0℃-40℃温度下反应30分钟至20小时,以在抗体糖基化位点和246或248赖氨酸位点引入不同或相同的功能分子,最终得到双位点修饰的抗体-功能分子偶联物。
67、根据本发明的一个实施方式,其中
68、方法四的步骤b1所得中间体糖链定点抗体-反应性官能团偶联物以及双位点修饰的双功能化抗体可无需纯化或经过超滤纯化直接进行下一步操作,和/或
69、方法五的步骤d1所得中间体k246或k248定点-反应性官能团偶联物以及双位点修饰的双功能抗体可无需纯化或经过超滤纯化直接进行下一步操作。
70、根据本发明的一个实施方式,该方法通过以下方法六进行
71、方法六:
72、
73、其中,在以上反应式中,各部分的定义与前文中的定义相同,
74、方法六:野生型抗体或去岩藻糖抗体经过糖苷内切酶众导的糖链定点技术,获得抗体糖基化位点修饰酰腙结构的糖链定点抗体-反应性官能团偶联物,随后通过导向肽或导向蛋白介导的k246或k248定点技术在抗体246或248位赖氨酸位点偶联叠氮官能团,得到双位点修饰酰腙和叠氮的双功能化抗体;之后再经过酰腙-肟交换化学和点击化学反应在糖基化位点和k246或k248位点分别引入功能分子,最终得到双位点修饰的抗体-功能分子偶联物。
75、根据本发明的一个实施方式,其中,所述方法六包括:
76、步骤e1:将抗体置于ph 6.0-8.0缓冲液中,加入糖结构-反应性官能团复合物及糖基转移酶或糖苷内切酶,在15℃-37℃温度下反应30分钟至20小时,获得抗体糖基化位点修饰功能分子的糖链定点抗体-反应性官能团偶联物;随后往上述体系中加入导向肽-反应性官能团复合物,并使用不同浓度的有机溶剂助溶,在0℃-40℃温度下反应30分钟至20小时,以在抗体246或248位赖氨酸位点偶联反应性官能团-连接子,获得双位点修饰的双功能化抗体,
77、步骤e2:随后往步骤e1的缓冲体系中加入两种功能分子-连接子和催化酰腙-肟交换化学的催化剂,在0℃-40℃温度下反应30分钟至20小时,以在抗体糖基化位点和246或248赖氨酸位点引入不同或相同的功能分子,最终得到双位点修饰的抗体-功能分子偶联物。
78、上述方法中所述糖苷内切酶包括但不局限于endo-s、endo-s2、endo-f3、endo-m以及这些酶的突变体,并包含融合这些不同糖苷内切酶功能区形成的融合蛋白。
79、再一方面,本发明提供上述双位点抗体-功能分子偶联物在制备药物、诊断治疗试剂、试剂盒等中的用途,其中,所述药物、诊断治疗试剂、试剂盒用于治疗肿瘤、炎症引起的疾病、病毒感染引起的疾病、免疫疾病。
80、在本发明的一个实施方式中,所述肿瘤选自卵巢癌、乳腺癌、输卵管癌、子宫内膜癌、腹膜癌、胃癌、结肠癌、膀胱癌、胰腺癌、胆道癌、骨肉瘤、宫颈癌、头颈肿瘤、生殖细胞和胚胎癌、食道癌、恶性胶质瘤、尤文肉瘤、胰腺癌、黑色素瘤、胆管癌、前列腺癌、小细胞肺癌、非小细胞肺癌、淋巴癌和血液癌中的任一种;
81、所述炎症引起的疾病选自结膜炎、支气管炎、鼻窦炎、克罗恩氏病等;
82、所述病毒感染引起的疾病选自流感、带状疱疹、人乳头瘤病毒感染、艾滋病、甲肝、乙肝、水痘等;
83、所述免疫疾病选自类风湿性关节炎、系统性红斑狼疮、重症肌无力、骨髓瘤、皮肌炎、银屑病等。
84、有益效果
85、本发明组合糖链定点技术和导向肽/蛋白介导的k246或k248位定点技术,实现了抗体糖基化位点和246或248位赖氨酸位点双位点的功能分子引入,可用于制备抗体-功能分子偶联物、荧光诊断试剂等,其制备的双位点抗体-功能分子偶联物具有很好的稳定性、细胞毒性和体内活性,具备较好的成药性等。
86、本发明选择的特定双位点为糖基化位点和k246或k248位点,制备该双位点使用的定点技术与其它的双位点定点抗体-功能分子偶联物使用的技术对比,无需对抗体进行体内工程化改造,适用于多种类型抗体,且具有操作简单、纯化步骤少等优势,具有较好的成药性,易于工业化;与其它的单一位点偶联高dar值或双药抗体-功能分子偶联物对比,双位点可分散抗体-功能分子偶联物的局部疏水性,且避免局部空间过于拥挤,从而增加稳定性。
本文地址:https://www.jishuxx.com/zhuanli/20240914/296367.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表