EPHRINA型受体10特异性抗体、表现其之嵌合抗原受体T细胞及其应用的制作方法
- 国知局
- 2024-09-14 15:16:39
本发明关于对ephrin a型受体10(epha10)具有特异性之抗体或其抗原结合片段、表现其之嵌合抗原受体t细胞及其应用。
背景技术:
1、利用治疗性单株抗体治疗包括实体及血液系统恶性疾病在内之人类疾病是得到充分验证及确定的。嵌合或人类化单株抗体因其较低之免疫副作用而特别适用于治疗应用。在开发用于癌症治疗之各种免疫疗法中,嵌合抗原受体(car)t细胞疗法被视为一种强大的策略。一般而言,car t细胞疗法藉由以下方式执行:对患者之t细胞进行基因修饰以使其表现肿瘤特异性car,离体细胞扩增并将其再回输至患者体内。尽管在急性淋巴球性白血病之临床试验中实现高达92%的完全恢复率,但car t细胞疗法之临床经验仍受到若干挑战限制,例如car-t细胞之扩增及肿瘤特异性抗原之选择。
2、因此,需要开发一种治疗癌症的新颖方法。
技术实现思路
1、本揭示提供一种新颖癌症抗原受体及其应用。
2、因此,本揭示提供一种对epha10之抗原决定基具有特异性的抗体或其抗原结合片段。因此,根据本揭示之抗体可用于治疗及/或预防由epha10活性及/或信号传导引起或与epha10活性及/或信号传导相关之疾病及/或病症。本揭示之抗体亦可用于侦测epha10。
3、在一些实施例中,本揭示提供一种对epha10中之抗原决定基具有特异性的抗体或其抗原结合片段;其中该抗体或其抗原结合片段包含重链可变区之互补决定区(cdr)及轻链可变区之互补决定区,其中该重链可变区之该等互补决定区包含cdrh1区、cdrh2区及cdrh3区,且该轻链可变区之该等互补决定区包含cdrl1区、cdrl2区及cdrl3区,且其中:
4、该cdrh1区包含seq id no:1之氨基酸序列或其实质上类似之序列;该cdrh2区包含seq id no:2之氨基酸序列或其实质上类似之序列;该cdrh3区包含seq id no:3之氨基酸序列或其实质上类似之序列;且
5、该cdrl1区包含seq id no:4之氨基酸序列或其实质上类似之序列;该cdrl2区包含seq id no:5之氨基酸序列或其实质上类似之序列;该cdrl3区包含seq id no:6之氨基酸序列或其实质上类似之序列。
6、在一些实施例中,该抗体或其抗原结合片段包括含seq id no:7之氨基酸序列或其实质上类似之序列的重链可变区;及包括含seq id no:8之氨基酸序列或其实质上类似之序列的轻链可变区。
7、在一些实施例中,该抗体是单株抗体、嵌合抗体、人类化抗体、人类抗体或奈米抗体。
8、在一些实施例中,本揭示提供一种多特异性抗体或其抗原结合片段,其包含:
9、第一抗原结合部分,其包含如本文所揭示之抗epha10抗体或其抗原结合片段;及
10、至少一个第二抗原结合部分。
11、在一些实施例中,该第二抗原结合部分包含对cd3中之抗原决定基具有特异性之抗体或其抗原结合片段的抗cd3部分或包含对cd16中之抗原决定基具有特异性之抗体或其抗原结合片段的抗cd16部分。
12、在一些实施例中,该多特异性抗体或其抗原结合片段包含
13、该第一抗原结合部分及该抗cd3部分;
14、该第一抗原结合部分及该抗cd16部分;或
15、该第一抗原结合部分、该抗cd3部分及该抗cd16部分。
16、在一些实施例中,该多特异性抗体或其抗原结合片段自n末端至c末端呈以下布置:[该第一抗原结合部分]-[该抗cd3部分]、[该抗cd3部分]-[该第一抗原结合部分]、[该第一抗原结合部分]-[该抗cd16部分]、[该抗cd16部分]-[该第一抗原结合部分]、[该第一抗原结合部分]-[该抗cd3部分]-[该抗cd16部分]、[该第一抗原结合部分]-[该抗cd16部分]-[该抗cd3部分]、[该抗cd3部分]-[该第一抗原结合部分]-[该抗cd16部分]、[该抗cd3部分]-[该抗cd16部分]-[该第一抗原结合部分]、[该抗cd16部分]-[该抗cd3部分]-[该第一抗原结合部分]或[该抗cd16部分]-[该第一抗原结合部分]-[该抗cd3部分]。
17、在一些实施例中,该多特异性抗体或其抗原结合片段进一步包含位于该第一抗原结合部分与该第二抗原结合部分中之任何两个之间的连接符。
18、在本揭示之一些实施例中,该多特异性抗体或其抗原结合片段进一步包含分泌信号肽。
19、在本揭示之一些实施例中,该多特异性抗体或其抗原结合片段进一步包含蛋白质纯化标签。
20、在本揭示之一些实施例中,该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段是与治疗剂结合。治疗剂之实例包括但不限于抗代谢物、烷化剂、类烷化剂、dna小沟(minor groove)烷化剂、蒽环霉素(anthracyclines)、抗生素、卡奇霉素(calicheamicin)、抗有丝分裂剂、拓朴异构酶抑制剂、hdac抑制剂、蛋白酶体抑制剂及放射性同位素。
21、在本揭示之一些实施例中,该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段是在细胞之表面上表现。该细胞可为免疫细胞或干细胞。在本揭示之一个实施例中,该免疫细胞是t细胞。在另一态样中,干细胞可为诱导性富潜能干细胞。
22、本揭示亦提供一种载体,其编码该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段。
23、在另一态样中,本揭示提供一种经基因工程改造之细胞,其表现该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段,或含有该载体。该经基因工程改造之细胞可为免疫细胞或干细胞。此外,本揭示提供一种免疫细胞,其由经基因工程改造之细胞分化得到。
24、本揭示提供一种医药组合物,其包含有效量的该抗体或其抗原结合片段、该多特异性抗体或其抗原结合片段、该经基因工程改造之细胞或该免疫细胞。
25、本揭示提供一种用于抑制有需要之个体中epha10介导之信号传导的方法,其包含向该个体投与该医药组合物。或者,本揭示提供一种用于抑制有需要之个体中epha10介导之信号传导的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段、该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
26、本揭示亦提供一种用于在罹患由epha10活性及/或信号传导引起或与epha10活性及/或信号传导相关之疾病及/或病症的个体中治疗、预防性治疗及/或预防该等疾病及/或病症的方法,其包含向该个体投与该医药组合物。或者,本揭示提供一种用于在罹患由epha10活性及/或信号传导引起或与epha10活性及/或信号传导相关之疾病及/或病症的个体中治疗、预防性治疗及/或预防该等疾病及/或病症的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段、该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
27、本揭示亦提供一种用于在罹患肿瘤之个体中治疗、预防性治疗及/或预防该肿瘤的方法,其包含向该个体投与该医药组合物。在本揭示之一些实施例中,肿瘤是实体肿瘤。肿瘤之实例包括但不限于肾细胞癌、胰脏癌、乳癌、头颈癌、前列腺癌、恶性神经胶质瘤、骨肉瘤、大肠直肠癌、胃癌、恶性间皮瘤、多发性骨髓瘤、卵巢癌、小细胞肺癌、非小细胞肺癌、滑膜肉瘤、甲状腺癌或黑色素瘤。或者,本揭示提供一种用于在罹患肿瘤之个体中治疗、预防性治疗及/或预防该肿瘤的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段、该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
28、本揭示提供一种用于侦测样本中之epha10的方法,其包含使该样本与该抗体或其抗原结合片段接触。
29、本揭示提供一种用于中和有需要之个体中之epha10的方法,其包含向该个体投与该抗体或其抗原结合片段。或者,本揭示提供一种用于中和有需要之个体中之epha10的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段、该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
30、本揭示提供一种用于侦测样本中之epha10的套组,其中该套组包含该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段。
31、以下部分中详细描述本揭示。本揭示之其他特征、目的及优点可见于实施方式及权利要求中。
32、图式简单说明
33、图1显示针对抗epha10抗体cmu#5之结合特异性分析的结果。
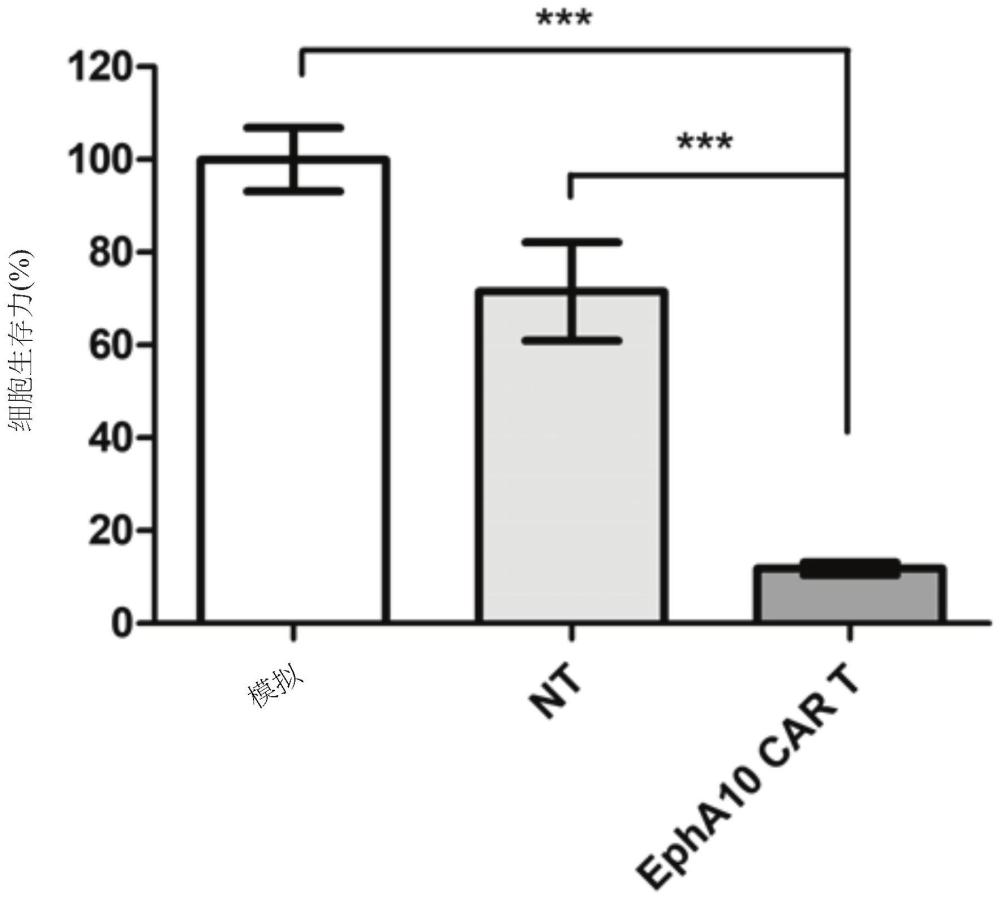
34、图2显示抗epha10抗体cmu#5之结合亲和力分析的结果。
35、图3显示epha10 trinte对乳癌细胞之细胞毒性作用。
36、图4显示epha10 bite对乳癌细胞之细胞毒性作用。
37、图5显示epha10 bike对乳癌细胞之细胞毒性作用。
38、图6显示epha10 trinte对t细胞或nk细胞活化之作用。
39、图7显示epha10 trinte在动物模型中对癌症抑制之作用。
40、图8显示共培养t细胞、nk细胞、bt-549细胞及epha10 trinte之免疫染色结果。
41、图9显示,藉由将抗epha10 car t细胞与乳癌细胞共培养来验证抗epha10car-t细胞的增加之细胞毒性作用。
42、实施方式
43、应了解,本揭示不限于本文所描述之特定材料及方法。亦应了解,本文所使用之术语系出于描述特定实施例之目的且不意欲限制本揭示之范围,本揭示之范围将仅由所附权利要求限制。
44、必须注意的是,除非上下文另外明确指示,否则如本说明书及所附权利要求中所使用,单数形式“一个(种)(a/an)”及“该(the)”包括多数个(种)指示物。
45、如本文所使用,术语“抗体”意谓与特定抗原(epha10)特异性结合或相互作用的包含至少一个互补决定区(cdr)之任何抗原结合分子或分子复合物。术语“抗体”包括免疫球蛋白分子以及其多聚体(例如igm),该等免疫球蛋白分子包含四条多肽链,即藉由二硫键互连的两条重(h)链及两条轻(l)链。各重链包含重链可变区(本文中缩写为hcvr或vh)及重链恒定区。重链恒定区包含三个域,即ch1、ch2及ch3。各轻链包含轻链可变区(本文中缩写为lcvr或vl)及轻链恒定区。轻链恒定区包含一个域(cl1)。vh区及vl区可进一步再分成高变区,称为互补决定区(cdr),间杂有称为构架区(fr)的更为保守之区域。各vh及vl由三个cdr及四个fr构成,自氨基末端至羧基末端按以下次序布置:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在本揭示之不同实施例中,抗epha10抗体(或其抗原结合部分)之fr可与人类生殖系序列一致,或可经天然或人工修饰。氨基酸共同序列可以基于两个或更多个cdr之并列分析来界定。
46、如本文所使用,术语“对……具有特异性”意谓抗体不与其他抗原决定基发生显著程度的交叉反应。
47、如本文所使用,术语“抗原决定基”指抗原上抗体所结合之位点。
48、如本文所使用,术语“互补决定区”(cdr)指在重链及轻链多肽之可变区内发现的不连续抗原组合位点。cdr描述于kabat等人,j.biol.chem.252:6609-6616(1977);kabat等人,u.s.dept.of health and human services,“sequences of proteins ofimmunological interest”(1991);chothia等人,j.mol.biol.196:901-917(1987);及maccallum等人,j.mol.biol.262:732-745(1996),其中定义包括相互比较时氨基酸残基的重迭或子集。
49、当应用于多肽时,术语“相当大的相似性”或“实质上类似”意谓两个肽序列在诸如藉由程序gap或bestfit,使用预设空位权重最优选地比对时,共有至少95%序列一致性,甚至更优选地至少98%或99%序列一致性。不一致之残基位置优选因保守性氨基酸取代而不同。“保守性氨基酸取代”是这样一种氨基酸取代,其中氨基酸残基经侧链(r基团)具有类似化学特性(例如电荷或疏水性)之另一氨基酸残基取代。一般而言,保守性氨基酸取代实质上不会改变蛋白质之功能特性。在两个或更多个氨基酸序列因保守取代而彼此不同的情况下,可上调序列一致性或相似度百分比以根据取代之保守性质加以校正。进行此调节之方式是熟习此项技术者熟知的。侧链具有类似化学特性之氨基酸组的实例包括(1)脂族侧链:甘氨酸、丙氨酸、缬氨酸、白氨酸及异白氨酸;(2)脂族羟基侧链:丝氨酸及苏氨酸;(3)含有酰氨之侧链:天冬酰氨及麸酰氨酸;(4)芳族侧链:苯丙氨酸、酪氨酸及色氨酸;(5)碱性侧链:离氨酸、精氨酸及组氨酸;(6)酸性侧链:天冬氨酸及麸氨酸;及(7)含硫侧链系半胱氨酸及甲硫氨酸。优选的保守性氨氨基酸取代组为:缬氨酸-白氨酸-异白氨酸、苯丙氨酸-酪氨酸、离氨酸-精氨酸、丙氨酸-缬氨酸、麸氨酸-天冬氨酸及天冬酰氨-麸酰氨酸。或者,保守性置换是在以引用的方式并入本文中之gonnet等人(1992)science 256:1443-1445中所揭示的pam250对数概似矩阵中具有正值的任何变化。“中等保守性”置换是在pam250对数概似矩阵中具有非负值的任何变化。
50、如本文所使用,术语“单株抗体”不限于经由融合瘤技术产生之抗体。单株抗体是藉由此项技术中可用或已知的任何手段,自单一殖株得到,该殖株包括任何真核、原核或噬菌体殖株。
51、如本文所使用,术语“嵌合”抗体指具有来源于非人类免疫球蛋白之可变序列及通常选自人类免疫球蛋白模板之人类免疫球蛋白恒定区的抗体。
52、非人类抗体之“人类化”形式含有来源于非人类免疫球蛋白之最小序列的嵌合免疫球蛋白。一般而言,人类化抗体将包含至少一个且通常两个可变域之实质上全部,其中全部或实质上全部的cdr区对应于非人类免疫球蛋白之cdr区且全部或实质上全部的fr区系人类免疫球蛋白序列之fr区。
53、如本文所使用,术语“奈米抗体”指包含小型单一可变域(自骆驼及单峰驼获得的抗体之vhh)的抗体。自骆驼及单峰驼(双峰骆驼(camelus baclrianus)及单峰骆驼(calelus dromaderius))家族成员(包括新世界成员,诸如骆马物种(羊驼(lama pacos)、大羊驼(lama glama)及瘦驼(lama vicugna)))获得的抗体蛋白已在大小、结构复杂性及对人类个体之抗原性方面进行表征。来自在自然界中所发现之此哺乳动物家族的某些igg抗体缺少轻链,且因此在结构上不同于来自其他动物之抗体的具有两条重链及两条轻链之典型四链四级结构。
54、如本文所使用,术语抗体之“抗原结合部分”、抗体之“抗原结合片段”及类似术语包括特异性结合抗原以形成复合物的任何天然存在、可以酶方式获得、合成或经基因工程改造之多肽或醣蛋白。
55、如本文所使用,“连接符”或“间隔子”肽指接合两个多肽序列之短氨基酸序列(或编码此类氨基酸序列之核酸)。“肽连接符”指接合两个多肽序列之短氨基酸序列。示例性多肽连接符是将肽转导域接合至抗体的连接符或在诸如scfv片段之类合成抗体片段中接合两条抗体链之连接符。连接符是熟知的且任何已知连接符均可用于所提供之方法中。示例性多肽连接符为(gly-ser)n氨基酸序列,其中一些glu或lys残基分散在各处以增加溶解性。其他示例性连接符描述于本文中;此等及其他已知连接符中之任一者均可用于所提供之组合物及方法。
56、如本揭示中所使用,术语“治疗剂”意谓适合投与哺乳动物,例如人类的具有治疗或药理学作用之任何化合物、物质、药物、药物或活性成分。如本文所使用,术语“免疫细胞”指在免疫反应中起作用之细胞。免疫细胞为造血来源的,且包括淋巴球,诸如b细胞及t细胞;自然杀手细胞;骨髓细胞,诸如单核球、巨噬细胞、嗜伊红血球、肥大细胞、嗜碱性球及颗粒球。
57、如本文所使用,术语“t细胞”包括cd4+t细胞及cd8+t细胞。术语t细胞亦包括t辅助1型t细胞、t辅助2型t细胞、t辅助17型t细胞及抑制性t细胞。
58、如本文所使用,术语“干细胞”指呈未分化或部分地分化状态之细胞,其具有自我更新特性且具有自然分化为更易分化之细胞类型的发育潜能,关于发育潜能无特定隐含含义(亦即,分化全能、富潜能、多潜能等)。自我更新意谓干细胞能够增殖且产生更多此类干细胞,同时维持其发育潜能。因此,术语“干细胞”指在特定情况下具有分化为更特定或分化表型之发育潜能,且在某些情况下保持增殖而不实质上分化之能力的任何细胞亚群。
59、当用于“富潜能细胞”时,术语“富潜能”指具有在不同条件下分化成全部三种生殖细胞层(内胚层、中胚层及外胚层)特有之细胞类型之能力的细胞。富潜能细胞主要系藉由使用例如裸小鼠畸胎瘤形成分析测定的其分化成全部三种胚层之能力来表征。富潜能性亦藉由表现胚胎干(es)细胞标志物证实,但针对富潜能性之优选测试展示分化成该三种胚层中之各者之细胞的能力。
60、如本文所使用,术语“ips细胞”与“诱导性富潜能干细胞”可互换使用且指自分化细胞(例如非富潜能细胞),通常为成体分化细胞,例如藉由使该细胞与任何化合物中之至少一种化合物接触,而在技术上得到(例如藉由完全或部分反向诱导)的富潜能细胞,该等化合物选自黄嘌呤、黄苷、次黄嘌呤或其类似物,例如具有黄嘌呤核之化合物。
61、如本文所使用,术语“载体”意指能够转运所连接之另一种核酸的核酸分子。载体之一种类型为“质体”,其指环状双股dna环,其中可连接额外dna区段。载体之另一类型为病毒载体,其中额外dna区段可连接至病毒基因体中。某些载体能够在引入其之宿主细胞中自主复制(例如具有细菌复制起点之细菌载体及游离型哺乳动物载体)。其他载体(例如非游离型哺乳动物载体)在引入至宿主细胞中时可整合至宿主细胞之基因体中,且藉此与宿主基因体一起复制。此外,某些载体能够引导其操作性连接之基因的表现。此类载体在本文中被称作“重组表现载体”(或简称为“表现载体”)。一般而言,用于重组dna技术中之表现载体常常呈质体形式。由于质体为载体之最常用形式,故在本说明书中,“质体”与“载体”可互换使用。然而,本揭示意欲包括发挥等效功能的此类其他形式之表现载体,诸如病毒载体(例如复制缺陷型反转录病毒、腺病毒以及腺相关病毒)。
62、术语细胞之“经基因工程改造(genetically engineered)”或“基因工程改造(genetic engineering)”意指使用遗传物质操纵基因以改变细胞中之基因拷贝及/或基因表现量。遗传物质可呈dna或rna形式。遗传物质可藉由包括病毒转导及非病毒转染在内之各种方式转移至细胞中。在经基因工程改造之后,细胞中某些基因之表现量可永久或暂时改变。
63、在细胞个体发生之情形中,形容词“分化(differentiated)”或“分化(differentiating)”为相对术语。“分化细胞”为相对于供比较之细胞,在发育途径中进一步向下发展的细胞。因此,干细胞可分化为谱系限制性前驱细胞,该等细胞又可进一步沿路径向下分化为其他类型之前驱细胞,且接着分化为末期分化细胞,该末期分化细胞在某一组织类型中起特有的作用,且可保持或可不保持进一步增殖之能力。
64、如本揭示中所使用,术语“医药组合物”意谓含有向哺乳动物,例如人类投与以预防、治疗或消除哺乳动物所患之特定疾病或病理病况之治疗剂的混合物。
65、如本文所使用,术语“治疗有效量”或“有效量”指当投与哺乳动物或其他个体用于治疗疾病时,足以实现对该疾病之该治疗的抗体之量。
66、如本文所使用,术语“治疗(treatment)”、“治疗(treating)”及类似术语涵盖哺乳动物,特别是人类之疾病的任何治疗,且包括:(a)预防可能易患疾病但尚未诊断出患有该疾病的个体发生该疾病;(b)抑制疾病,亦即,遏制其发展;及(c)缓解疾病,亦即,使疾病消退。
67、术语“预防(preventing)”或“预防(prevention)”在此项技术中为公认的,且当与病况结合使用时,其包括在病况发作之前投与药剂以相对于未接受该药剂之个体,降低个体之医学病况之症状的发生频率或严重程度,或延迟其发作。
68、如本文可互换地使用的,术语“个人(individual)”、“个体(subject)”、“宿主”及“患者”指哺乳动物,包括但不限于鼠类(大鼠、小鼠)、非人类灵长类动物、人类、犬科动物、猫科动物、有蹄动物(例如马科动物、牛科动物、绵羊科动物、猪科动物、山羊科动物)等。
69、如本文所使用,术语“需要治疗”指由照护者(例如在人类之情况下为医师、护士、护理从业者或个人;在包括非人类之哺乳动物在内之动物的情况下为兽医)作出的个体需要治疗或将受益于治疗之判断。此判断是基于多种因素作出,该等因素系在照护者之专业知识领域内,且包括个体由于可用本揭示之化合物治疗之病况而患病或将患病的知识。
70、“癌症”、“肿瘤”及类似术语包括癌变前细胞、赘生性细胞、转型细胞及癌细胞,且可指实体肿瘤或非实体癌症(参见例如edge等人,ajcc cancer staging manual(第7版,2009);cibas及ducatman cytology:diagnostic principles and clinical correlates(第3版,2009))。癌症包括良性赘瘤及恶性赘瘤(异常生长)两者。“转型”指自发性或诱导性表型变化,例如细胞不朽化、形态变化、异常细胞生长、减少之接触抑制及固着及/或恶性疾病(参见freshney,culture of animal cells a manual of basic technique(第3版,1994))。尽管转型可由用转型病毒感染及并入新基因体dna或摄入外源dna引起,其亦可自发产生或在暴露于致癌物之后产生。
71、如本文所使用,术语“样本”涵盖获自个人、个体或患者之多种样本类型,且可用于诊断性或监测分析中。该定义涵盖血液及生物来源之其他液体样本;固体组织样本,诸如活组织检查试样或组织培养物或源自其之细胞及其后代。
72、本揭示产生对ephrin a型受体10中之抗原决定基具有特异性的抗体或其抗原结合片段。
73、epha10系ephrin受体,即受体酪胺酸激酶(rtk)最大亚家族之成员,且在发育、血管生成及细胞分化中具有重要功能。先前的研究指示开发靶向epha10之单株抗体用于癌症免疫疗法的治疗应用。已发现,(1)epha10水平在除睪丸外之正常组织中极低;(2)相较于正常组织,epha10水平在各种类型之癌症中较高;(3)epha10缺失藉由增强ctl介导之抗肿瘤免疫而诱导肿瘤消退。
74、具体言之,抗体或其抗原结合片段包含重链可变区之互补决定区(cdr)及轻链可变区之互补决定区,其中该重链可变区之该等互补决定区包含cdrh1区、cdrh2区及cdrh3区,且该轻链可变区之该等互补决定区包含cdrl1区、cdrl2区及cdrl3区,且其中:
75、该cdrh1区包含seq id no:1之氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列一致性之实质上类似之序列;该cdrh2区包含seq id no:2之氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列一致性之实质上类似之序列;该cdrh3区包含seq id no:3之氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列一致性之实质上类似之序列;且
76、该cdrl1区包含seq id no:4之氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列一致性之实质上类似之序列;该cdrl2区包含seq id no:5之氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列一致性之实质上类似之序列;该cdrl3区包含seq id no:6之氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列一致性之实质上类似之序列。
77、序列表示于表1中。
78、表1:
79、
80、
81、在一些实施例中,该抗体或其抗原结合片段包括含seq id no:7之氨基酸序列或其实质上类似之序列的重链可变区;及包括含seq id no:8之氨基酸序列或其实质上类似之序列的轻链可变区。在一些其他实施例中,该抗体或其抗原结合片段包括含seq id no:7之氨基酸序列或其具有至少90%、至少95%、至少98%或至少99%序列一致性的实质上类似之序列的重链可变区。在一些其他实施例中,该抗体或其抗原结合片段包括含seq idno:8之氨基酸序列或其具有至少90%、至少95%、至少98%或至少99%序列一致性的实质上类似之序列的轻链可变区。
82、根据本揭示之抗体可为全长的(例如igg1或igg4抗体)或可仅包含抗原结合部分(例如fab、f(ab')2或scfv片段),且可视需要经修饰以影响功能性。
83、一般熟习此项技术者已知之各种技术均可用于确定抗体是否“对多肽或蛋白质内之一或多个氨基酸具有特异性”。例示性技术包括例如常规交叉阻断分析,诸如antibodies,harlow及lane(cold spring harbor press,cold spring harb.,ny)所描述之分析;丙胺酸扫描突变分析;肽墨点分析(reineke,2004,methods mol biol 248:443-463);及肽裂解分析。另外,可采用诸如抗原决定基切除、抗原决定基提取及抗原化学修饰之类方法(tomer,2000,protein science 9:487-496)。可用于鉴别与抗体特异性结合之多肽内之氨基酸的另一方法为藉由质谱法侦测之氢/氘交换。一般而言,氢/氘交换方法涉及氘标记感兴趣蛋白质,随后使抗体与该氘标记之蛋白质结合。接下来,将蛋白质/抗体复合物转移至水中以允许氢-氘交换在除了受抗体保护之残基(其保持氘标记)以外的所有残基处发生。在抗体解离之后,对目标蛋白进行蛋白酶裂解及质谱分析,由此揭露对应于与抗体相互作用之特定氨基酸的氘标记之残基。参见例如ehring(1999)analyticalbiochemistry 267(2):252-259;engen及smith(2001)anal.chem.73:256a-265a。
84、藉由使用此项技术中已知之常规方法,可以容易地确定抗体是否对与参考抗epha10抗体相同之抗原决定基具有特异性或与参考抗epha10抗体竞争结合。举例而言,为了确定测试抗体是否与本揭示之参考抗epha10抗体结合至相同之抗原决定基,使参考抗体结合至epha10蛋白。接下来,评估测试抗体与epha10分子结合之能力。若在epha10与参考抗epha10抗体饱和结合之后,测试抗体仍能够结合至epha10,则可推断测试抗体与参考抗epha10抗体结合至不同的抗原决定基。另一方面,若在epha10与参考抗epha10抗体饱和结合之后,测试抗体不能够结合至epha10分子,则测试抗体可结合至与本揭示之参考抗epha10抗体所结合之抗原决定基相同的抗原决定基。接着,可进行其他常规实验(例如肽突变及结合分析),以确认所观察到的测试抗体结合之缺乏实际上系由于与参考抗体结合至同一抗原决定基,还是空间阻断(或另一现象)造成所观察到的结合之缺乏。此类实验可使用elisa、ria、biacore、流式细胞分析技术或此项技术中可用之任何其他定量或定性抗体结合分析来进行。根据本揭示之某些实施例,当在竞争性结合分析中量测时,若例如1倍、5倍、10倍、20倍或100倍过量之一种抗体将另一种抗体之结合抑制至少50%但优选地75%、90%或甚至99%,则两种抗体结合至相同(或重迭)的抗原决定基。或者,若抗原中降低或消除一种抗体之结合的基本上所有氨基酸突变皆降低或消除另一种抗体之结合,则将两种抗体视为结合至相同抗原决定基。若仅一小组减少或消除一种抗体之结合的氨基酸突变减少或消除另一种抗体之结合,则认为两种抗体具有“重迭的抗原决定基”。
85、抗体亦包括完整抗体分子之抗原结合片段。抗体之抗原结合片段可使用任何适合之标准技术,诸如蛋白水解消化或涉及编码抗体可变域及视情况存在之恒定域之dna之操纵及表现的重组基因工程改造技术,例如自完整抗体分子得到。此类dna是已知的及/或可自例如商业来源、dna库(包括例如噬菌体-抗体库)容易地获得,或可以合成。可以对dna定序,并以化学方式或藉由使用分子生物学技术定序及操纵,例如将一或多个可变域及/或恒定域布置成适合组态,或引入密码子,产生半胱胺酸残基,修饰、添加或缺失氨基酸等。
86、抗原结合片段之非限制性实例包括:(i)fab片段;(ii)f(ab')2片段;(iii)fd片段;(iv)fv片段;(v)单链fv(scfv)分子;(vi)dab片段;以及(vii)由模拟抗体高变区之氨基酸残基组成的最小识别单元(例如经分离之互补决定区(cdr),诸如cdr3肽),或受限制之fr3-cdr3-fr4肽。其他经工程改造之分子,诸如域特异性抗体、单域抗体、域缺失抗体、嵌合抗体、cdr移植抗体、双功能抗体、三功能抗体、四功能抗体、微型抗体、奈米抗体(例如单价奈米抗体、二价奈米抗体等)、小模块免疫药物(smip)及鲨鱼可变ignar域亦涵盖在如本文所使用之表述“抗原结合片段”内。
87、抗体之抗原结合片段通常包含至少一个可变域。可变域可为任何大小或氨基酸组成且一般将包含与一或多个构架序列相邻或同框之至少一个cdr。在具有与vl域相关联之vh域的抗原结合片段中,vh及vl域可相对于彼此以任何适合的布置定位。举例而言,可变区可为二聚体且含有vh-vh、vh-vl或vl-vl二聚体。或者,抗体之抗原结合片段可以含有单体vh或vl域。
88、在某些实施例中,抗体之抗原结合片段可含有与至少一个恒定域共价连接之至少一个可变域。可见于本揭示之抗体之抗原结合片段内的可变域及恒定域之非限制性例示性组态包括:(i)vh-ch1;(ii)vh-ch2;(iii)vh-ch3;(iv)vh-ch1-ch2;(v)vh-ch1-ch2-ch3;(vi)vh-ch2-ch3;(vii)vh-cl;(viii)vl-ch1;(ix)vl-ch2;(x)vl-ch3;(xi)vl-ch1-ch2;(xii)vl-ch1-ch2-ch3;(xiii)vl-ch2-ch3;及(xiv)vl-cl。在可变域及恒定域之任何组态,包括上文所列之例示性组态中的任一者中,可变域及恒定域可彼此直接连接或可以藉由完全或部分铰链区或连接符区连接。铰链区可由至少2个(例如5个、10个、15个、20个、40个、60个或更多个)氨基酸组成,该等氨基酸在单个多肽分子中之相邻可变域及/或恒定域之间产生可挠性或半可挠性键联。此外,本揭示抗体之抗原结合片段可包含上文列出的任何可变域及恒定域组态彼此非共价缔合及/或与一或多个单体vh或vl域(例如藉由二硫键)非共价缔合之均二聚体或杂二聚体(或其他多聚体)。
89、相较于得到抗体之相应生殖系序列,本文所揭示之抗epha10抗体可在重链及轻链可变域之构架区及/或cdr区中包含一或多个氨基酸取代、插入及/或缺失。此类突变可容易地藉由比较本文所揭示之氨基酸序列与可得自例如公共抗体序列数据库之生殖系序列来确定。本揭示包括一种抗体及其抗原结合片段,其来源于本文所揭示之氨基酸序列中之任一者,其中在一或多个构架区及/或cdr区内之一或多个氨基酸突变为得到该抗体之生殖系序列的相应残基,或另一哺乳动物生殖系序列之相应残基,或相应生殖系残基之保守性氨基酸取代(此类序列变化在本文中统称为“生殖系突变”)。以本文所揭示之重链及轻链可变区序列为起始物质,熟习此项技术者可以容易地产生许多包含一或多个个别生殖系突变或其组合的抗体及抗原结合片段。在某些实施例中,vh及/或vl域内之所有构架及/或cdr残基全部回复突变为在得到该抗体之初始生殖系序列中发现的残基。在其他实施例中,仅某些残基回复突变为原始生殖系序列,例如仅fr1之前8个氨基酸内或fr4之最后8个氨基酸内发现之突变残基,或仅cdr1、cdr2或cdr3内发现之突变残基。在其他实施例中,构架及/或cdr残基中之一或多者突变成不同生殖系序列(亦即,不同于最初得到该抗体之生殖系序列的生殖系序列)之相应残基。此外,本揭示之抗体可含有构架区及/或cdr区内两个或更多个生殖系突变之任何组合,例如其中某些个别残基突变为特定生殖系序列之相应残基,而与原始生殖系序列不同之某些其他残基维持不变或突变为不同生殖系序列之相应残基。一旦获得,即可容易地测试含有一或多个生殖系突变之抗体及抗原结合片段的一或多种所需特性,该等特性为诸如改善之结合特异性、增加之结合亲和力、改善或增强之拮抗或促效生物特性(视具体情况而定)、降低之免疫原性等。本揭示内涵盖以此一般方式获得的抗体及抗原结合片段。
90、本揭示亦包括这样一种抗epha10抗体,其包含具有一或多个保守性取代的本文所揭示之vh、vl及/或cdr氨基酸序列中之任一者的变异体。举例而言,本揭示包括这样一种抗epha10抗体,该抗体具有相对于本文所揭示之vh、vl及/或cdr氨基酸序列中之任一者含例如10个或更少、8个或更少、6个或更少、4个或更少等保守性氨基酸取代的vh、vl及/或cdr氨基酸序列。
91、在本揭示之一些实施例中,根据本揭示之抗体系人类化抗体。为了改善根据本揭示之人类化抗体之结合亲和力,人类构架区中之一些氨基酸残基经cdr之物种(例如啮齿动物)中的相应氨基酸残基置换。
92、本揭示之抗体可为单特异性、双特异性或多特异性的。多特异性抗体可对一种目标多肽之不同抗原决定基具有特异性或可含有对多于一种目标多肽具有特异性之抗原结合域。本揭示之抗epha10抗体可连接至另一官能性分子(例如另一种肽或蛋白质),或与另一官能性分子共表现。举例而言,抗体或其片段可与一或多个其他分子实体,诸如另一抗体或抗体片段功能性连接(例如藉由化学偶合、基因融合、非共价缔合或其他方式),以产生具有第二结合特异性之双特异性或多特异性抗体。举例而言,本揭示包括双特异性抗体,其中免疫球蛋白之一个臂对epha10或其片段具有特异性,且免疫球蛋白之另一个臂对第二治疗目标具有特异性或与治疗部分结合。
93、在一些实施例中,本揭示提供一种多特异性抗体或其抗原结合片段,其包含:
94、第一抗原结合部分,其包含如本文所揭示之抗epha10抗体或其抗原结合片段;及
95、至少一个第二抗原结合部分。
96、在一些实施例中,该第二抗原结合部分系包含对cd3中之抗原决定基具有特异性之抗体或其抗原结合片段的抗cd3部分或包含对cd16中之抗原决定基具有特异性之抗体或其抗原结合片段的抗cd16部分。
97、如本文所使用,术语“分化簇3”或“cd3”系指来自包括哺乳动物诸如灵长类动物(例如人类)及啮齿动物(例如小鼠及大鼠)在内之任何脊椎动物来源的任何原生cd3,除非另外指示,否则其包括例如cd3ε、cd3γ、cd3α及cd3β链,且涵盖全长、“未加工”之cd3(例如未加工或未修饰之cd3ε或cd3γ),以及在细胞中加工产生的任何形式之cd3,诸如“经加工”之cd3ε多肽,不含其信号肽之全部或一部分。cd3系一种多聚体蛋白复合物,历史上称为t3复合物,且由四条不同多肽链构成:ε、γ、δ及ζ,该等多肽链组装成三对二聚体(εγ、εδ、ζζ)并发挥作用。cd3复合物用作t细胞辅助受体,其与t细胞受体非共价缔合。
98、在本揭示之一个实施例中,抗cd3部分具有seq id no:11之序列的scfv。
99、cd16(又称为fcγriii)是已知涉及抗体依赖性细胞毒性(adcc)之一些igg之fc部分的低亲和力受体,并为负责藉由nk细胞触发目标细胞溶解的得到最佳表征之膜受体(mandelboim等人,1999,pnas 96:5640-5644)。大多数(约90%)的人类nk细胞以低密度表现cd56(cd56dim)且高水平表现fcγriii(cd16)(cooper等人,2001,trends immunol.22:633-640)。人类fcγriii系以两种同功异型物,即fcγriiia及fcγriiib存在,该两种同功异型物在其细胞外免疫球蛋白结合区中共有96%序列一致性(van de winkel及capel,1993,immunol.today 14(5):215-221)。
100、在本揭示之一些实施例中,抗cd16部分具有seq id no:12之序列的scfv。
101、在一些实施例中,该多特异性抗体或其抗原结合片段包含
102、该第一抗原结合部分及该抗cd3部分;
103、该第一抗原结合部分及该抗cd16部分;或
104、该第一抗原结合部分、该抗cd3部分及该抗cd16部分。
105、在一些实施例中,该多特异性抗体或其抗原结合片段自n末端至c末端呈以下布置:[该第一抗原结合部分]-[该抗cd3部分]、[该抗cd3部分]-[该第一抗原结合部分]、[该第一抗原结合部分]-[该抗cd16部分]、[该抗cd16部分]-[该第一抗原结合部分]、[该第一抗原结合部分]-[该抗cd3部分]-[该抗cd16部分]、[该第一抗原结合部分]-[该抗cd16部分]-[该抗cd3部分]、[该抗cd3部分]-[该第一抗原结合部分]-[该抗cd16部分]、[该抗cd3部分]-[该抗cd16部分]-[该第一抗原结合部分]、[该抗cd16部分]-[该抗cd3部分]-[该第一抗原结合部分]或[该抗cd16部分]-[该第一抗原结合部分]-[该抗cd3部分]。
106、在一些实施例中,该多特异性抗体或其抗原结合片段进一步包含位于该第一抗原结合部分与该第二抗原结合部分中之任何两个之间的连接符。
107、在本揭示之一些实施例中,该多特异性抗体或其抗原结合片段进一步包含分泌信号肽。如本文所使用,信号肽(有时称为信号序列、靶向信号、定位信号、定位序列、转运肽、前导序列或前导肽)系指位于预定朝向分泌路径之蛋白质之n末端的短肽。
108、在本揭示之一些实施例中,该多特异性抗体或其抗原结合片段进一步包含蛋白质纯化标签,诸如6×his纯化标签(hhhhhh)、myc侦测标签(eqkliseedl)及strepii亲和纯化标签(wshpqfek)。若采用ni-nta亲和树脂(对于6×his标签)或链霉亲和素(streptactin)亲和树脂(对于strep ii标签)分离未结合之受质与经结合产物,则此允许选择经结合产物。
109、根据本揭示之融合蛋白识别肿瘤细胞上之epha10、t细胞上之cd3及/或nk细胞上之cd16(trinte、bite及bike)。在本揭示之一些实施例中,融合蛋白是t细胞接合三特异性构筑体,其以经短连接符连接的三个单链可变片段(scfv)形式存在。一个scfv经由cd3受体结合t细胞;一个scfv经由肿瘤相关抗原结合肿瘤细胞及/或另一个结合至nk细胞cd16受体。
110、尽管不希望受理论限制,咸信根据本揭示之融合蛋白将t细胞及/或nk细胞引至癌细胞周围。其达成之作用优于单独t细胞或nk细胞。在本揭示之一些实施例中,在人类t细胞存在下,trinte、bite及bike引起人类癌症细胞之特异性杀灭。
111、在本揭示之一个优选实施例中,抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段与治疗剂结合。
112、在本揭示之一些实施例中,治疗剂表示细胞生长抑制剂或细胞毒性剂或具有相应放射性同位素之同位素螯合剂。细胞生长抑制或细胞毒性剂之实例包括但不限于抗代谢物(例如氟尿嘧啶(5-fu)、氟尿苷(5-fudr)、甲胺喋呤(methotrexate)、甲酰四氢叶酸(leucovorin)、羟基脲、硫鸟嘌呤(6-tg)、巯基嘌呤(6-mp)、阿糖胞苷(cytarabine)、喷司他丁(pentostatin)、磷酸氟达拉滨(fludarabine phosphate)、克拉屈滨(cladribine)(2-cda)、天冬酰胺酶(asparaginase)、吉西他滨(gemcitabine)、卡培他滨(capecitibine)、硫唑嘌呤(azathioprine)、胞嘧啶甲胺喋呤、甲氧苄啶(trimethoprim)、乙胺嘧啶(pyrimethamine)或培美曲塞(pemetrexed));烷化剂(例如美法仑(cmelphalan)、苯丁酸氮芥(chlorambucil)、白消安(busulfan)、噻替派(thiotepa)、异环磷酰胺(ifosfamide)、卡莫司汀(carmustine)、洛莫司汀(lomustine)、司莫司汀(semustine)、链脲菌素(streptozocin)、达喀尔巴嗪(dacarbazine)、丝裂霉素c(mitomycin c)、环磷酰胺(cyclophosphamide)、甲氮芥(mechlorethamine)、乌拉莫司汀(uramustine)、二溴甘露醇(dibromomannitol)、四硝酸酯(tetranitrate)、丙卡巴肼(procarbazine)、六甲蜜胺(altretamine)、米托唑胺(mitozolomide)或替莫唑胺(temozolomide));类烷化剂(例如顺铂(cisplatin)、卡铂(carboplatin)、奈达铂(nedaplatin)、奥沙利铂(oxaliplatin)、赛特铂(satraplatin)或特瑞铂(triplatin));dna小沟烷化剂(例如倍癌霉素(duocarmycins),诸如cc-1065及任何类似物或其衍生物;吡咯并苯并二氮呯或其任何类似物或衍生物);蒽环霉素(例如道诺霉素(daunorubicin)、小红莓(doxorubicin)、表柔比星(epirubicin)、埃达霉素(idarubicin)或伐柔比星(valrubicin);抗生素(例如放线菌素d(dactinomycin)、博莱霉素(bleomycin)、光神霉素(mithramycin)、安曲霉素(anthramycin)、链佐霉素(streptozotocin)、短杆菌素d(gramicidin d)、丝裂霉素(例如丝裂霉素c);卡奇霉素;抗有丝分裂剂(包括例如类美登素(maytansinoids)(诸如dm1、dm3及dm4)、奥瑞他汀(auristatins)(包括例如单甲基奥瑞他汀e(mmae)及单甲基奥瑞他汀f(mmaf))、海兔毒素(dolastatins)、念珠藻素(cryptophycins)、长春花生物碱(vinca alkaloids)(例如长春新碱(vincristine)、长春花碱(vinblastine)、长春地辛(vindesine)、长春瑞滨(vinorelbine))、紫杉烷(taxanes)(例如太平洋紫杉醇(paclitaxel)、多西他赛(docetaxel)或新颖紫杉烷)、妥布赖森(tubulysins)及秋水仙碱(colchicines));拓朴异构酶抑制剂(例如伊立替康(irinotecan)、拓朴替康(topotecan)、喜树碱(camptothecin)、依托泊苷(etoposide)、替尼泊苷(teniposide)、安吖啶(amsacrine)或米托蒽醌(mitoxantrone));hdac抑制剂(例如伏立诺他(vorinostat)、罗米地辛(romidepsin)、西达本胺(chidamide)、帕比司他(panobinostat)或贝林司他(belinostat));蛋白酶体抑制剂(例如肽基亚硼酸);以及放射性同位素,诸如at211、i131、i125、y90、re186、re188、sm153、bi212或bi213、p32及lu之放射性同位素,包括lu177。同位素螯合剂之实例包括但不限于乙二胺四乙酸(edta)、二伸乙基三胺-n,n,n',n",n"-五乙酸盐(dtpa)、1,4,7,10-四氮杂环十二烷-n,n',n",n"'-四乙酸盐(dota)、1,4,7,10-肆(2-羟丙基)-1,4,7,10-四氮杂环十二烷(thp)、三伸乙基四胺-n,n,n',n",n"',n"'-六乙酸盐(ttha)、1,4,7,10-四氮杂环十二烷-n,n',n",n"'-肆(亚甲基膦酸盐)(dotp)及巯基乙酰基三甘胺酸(mag3)。
113、在本揭示之一个实施例中,该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段是在细胞表面上表现。特定言之,细胞是t细胞或干细胞,诸如ipsc。诱导性富潜能干细胞可藉由将山中因子(yamanaka factor)诱导至体细胞中来再程序化。与胚胎干细胞相同,ipsc能够分化成三种胚层之细胞,而无需关注伦理问题。利用此特性,ipsc展现出有前景的临床用途应用。
114、在本揭示之一些实施例中,该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段呈嵌合抗原受体之形式。
115、术语“嵌合抗原受体”或者“car”指包含至少细胞外抗原结合域、跨膜域及胞质信号传导域(在本文中亦称为“胞内信号传导域”)的重组多肽构筑体,该胞质信号传导域包含来源于如下所定义之刺激分子的功能性信号传导域。在一些实施例中,car多肽构筑体中之各域是在同一多肽链中,例如构成嵌合融合蛋白。在一些实施例中,car多肽构筑体中各域彼此不相邻,例如在不同多肽链中。car之产生及构筑由以下概括:jayarama等人,ebiomedicine 58(2020)102931;zhang等人,biomarker research(2017)5:22;feins等人,am j hematol.(2019)94:s3-s9;及roselli等人,j clin invest.2021;131(2):e142030。
116、该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段可在编码该抗体或其抗原结合片段之载体中编码。例示性载体为慢病毒载体。“慢病毒”指能够感染分裂细胞及非分裂细胞之反转录病毒属。慢病毒之若干实例包括hiv(人类免疫缺乏病毒:包括第1型hiv及第2型hiv);马感染性贫血病毒;猫免疫缺乏病毒(fiv);牛免疫缺乏病毒(biv);及猿猴免疫缺乏病毒(siv)。
117、在另一态样中,本揭示提供一种经基因工程改造之细胞,其表现该抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段,或含有该载体。该经基因工程改造之细胞可为免疫细胞或干细胞。此外,本揭示提供一种免疫细胞,其是由经基因工程改造之细胞分化得到。
118、在本揭示之一个实施例中,产生具有携带epha10基因之慢病毒的抗epha10ipsc及t细胞。另外,ipsc将此等分化成car-免疫细胞。观察到此等car-免疫细胞对癌细胞之细胞毒性作用。本揭示提供一种克服肿瘤抗原之特异性并产生用于临床癌症治疗应用之无限制性car-免疫细胞的方法。
119、本揭示提供医药组合物,其包含本揭示之抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段、基因工程改造之细胞或免疫细胞。本揭示之医药组合物是用适合稀释剂、载剂、赋形剂及提供改良之转移、递送、耐受性及类似特性之其他试剂调配。该等组合物可以调配用于特定应用,诸如用于兽医学应用或人类医药应用。所用组合物及赋形剂、稀释剂及/或载剂之形式将取决于抗体之预期应用及用于治疗应用之投与模式。众多适当调配物可于所有医药化学家已知之处方集:remington's pharmaceutical sciences,mackpublishing company,easton,pa。此等调配物包括例如粉剂、糊剂、软膏、凝胶剂、蜡、油、脂质、含有脂质(阳离子型或阴离子型)之囊泡(诸如lipofectin.tm.,life technologies,carlsbad,calif.)、dna结合物、无水吸收糊剂、水包油及油包水乳液、乳液卡波蜡(carbowax)(各种分子量之聚乙二醇)、半固体凝胶剂及含有卡波蜡之半固体混合物。亦参见powell等人,“compendium of excipients for parenteral formulations”pda(1998)jpharm sci technol 52:238-311。
120、向患者投与之抗体的剂量可取决于患者之年龄及体型、目标疾病、病况、投与途径及类似因素而变化。优选剂量通常根据体重或体表面积计算。当使用本揭示之抗体治疗成年患者的与epha10相关之病况或疾病时,静脉内投与本揭示之抗体可为有利的。取决于病况之严重程度,可调整治疗之频率及持续时间。投与抗体之有效剂量及时程可凭经验确定;例如,可藉由定期评估来监测患者进展,且相应地调整剂量。此外,可使用此项技术中熟知之方法(例如mordenti等人,1991,pharmaceut.res.8:1351)执行剂量之种间缩放。
121、各种递送系统为吾人所知且可用于投与本揭示之医药组合物,例如囊封于脂质体中、微粒、微胶囊、能够表现突变病毒之重组细胞、受体介导之内吞作用(参见例如wu等人,1987,j.biol.chem.262:4429-4432)。引入方法包括但不限于皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外及经口途径。该组合物可以藉由任何适宜途径投与,例如藉由输注或弹丸注射、藉由经上皮或黏膜皮肤内层(例如口腔黏膜、直肠黏膜和肠黏膜等)吸收投与并且可以与其他生物活性剂一起投与。投药可为全身性或局部的。
122、可使用标准针及注射器皮下或静脉内递送本揭示之医药组合物。此外,关于皮下递送,笔式递送装置易于在递送本揭示之医药组合物时应用。此类笔式递送装置可为可再用的或抛弃式的。可再用的笔式递送装置一般利用含有医药组合物之可替换套筒。在投与了套筒内之所有医药组合物且套筒变空后,可容易地丢弃空套筒且用含有医药组合物之新套筒替换。接着,可再使用笔式递送装置。在抛弃式笔式递送装置中,不存在可替换套筒。实际上,抛弃式笔式递送装置用保持在该装置内之储集器中的医药组合物预填充。一旦清空储集器之医药组合物,即弃去整个装置。
123、在某些情况中,该医药组合物可在控制释放系统中递送。在一个实施例中,可以使用泵(参见langer,同上文;sefton,1987,crc crit.ref.biomed.eng.14:201)。在另一实施例中,可使用聚合材料;参见medical applications of controlled release,langer andwise(编辑),1974,crc pres.,boca raton,fla。在另一实施例中,控制释放系统可置放在该组合物之目标附近,因此仅需要全身性剂量之一部分(参见例如goodson,1984,medicalapplications of controlled release,同上文,第2卷,第115-138页)。其他受控释放系统论述于langer,1990,science 249:1527-1533之综述中。
124、可注射制剂可包括用于静脉内、皮下、皮内及肌肉内注射、点滴等之剂型。此等可注射制剂可藉由公开已知之方法制备。举例而言,可注射制剂可例如藉由在习知用于注射之无菌水性介质或油性介质中溶解、悬浮或乳化上文所描述之抗体或其盐来制备。作为注射用水性介质,存在例如生理盐水、含有葡萄糖及其他助剂之等张溶液等,其可与适当增溶剂,诸如醇(例如乙醇)、多元醇(例如丙二醇、聚乙二醇)、非离子型界面活性剂[例如聚山梨醇酯80、hco-50(氢化蓖麻油之聚氧乙烯(50mol)加合物)]等组合使用。采用例如芝麻油、大豆油等作为油性介质,其可与增溶剂,诸如苯甲酸苯甲酯、苯甲醇等组合使用。优选将由此制备之注射液填充于适当安瓿中。
125、上文所描述的供经口或非经肠使用之医药组合物宜制备成呈适于符合活性成分之剂量之单位剂量的剂型。此类呈单位剂量之剂型包括例如锭剂、丸剂、胶囊、注射剂(安瓿)、栓剂等。
126、本揭示提供一种用于抑制有需要之个体中epha10介导之信号传导的方法,其包含向该个体投与该医药组合物。或者,本揭示提供一种用于抑制有需要之个体中epha10介导之信号传导的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
127、本揭示亦提供一种用于在罹患由epha10活性及/或信号传导引起或与epha10活性及/或信号传导相关之疾病及/或病症的个体中治疗、预防性治疗及/或预防该等疾病及/或病症的方法,其包含向该个体投与该医药组合物。或者,本揭示提供一种用于在罹患由epha10活性及/或信号传导引起或与epha10活性及/或信号传导相关之疾病及/或病症的个体中治疗、预防性治疗及/或预防该等疾病及/或病症的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
128、本揭示亦提供一种用于在罹患肿瘤之个体中治疗、预防性治疗及/或预防该肿瘤的方法,其包含向该个体投与该医药组合物。在本揭示之一些实施例中,肿瘤是实体肿瘤。肿瘤之实例包括但不限于肾细胞癌、胰脏癌、乳癌、头颈癌、前列腺癌、恶性神经胶质瘤、骨肉瘤、大肠直肠癌、胃癌、恶性间皮瘤、多发性骨髓瘤、卵巢癌、小细胞肺癌、非小细胞肺癌、滑膜肉瘤、甲状腺癌或黑色素瘤。或者,本揭示提供一种用于在罹患肿瘤之个体中治疗、预防性治疗及/或预防该肿瘤的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
129、本揭示提供一种用于侦测样本中之epha10的方法,其包含使该样本与该抗体或其抗原结合片段接触。
130、本揭示提供一种用于中和有需要之个体中之epha10的方法,其包含向该个体投与该抗体或其抗原结合片段。或者,本揭示提供一种用于中和有需要之个体中之epha10的医药组合物,其包含有效量的如本文所揭示之抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段、经基因工程改造之细胞或免疫细胞。
131、本揭示提供一种用于侦测样本中之epha10的套组,其中该套组包含抗体或其抗原结合片段或该多特异性抗体或其抗原结合片段。
132、本揭示之抗epha10抗体亦可用于侦测及/或量测样本中之epha10或epha10表现细胞,例如用于诊断目的。举例而言,抗epha10抗体或其片段可用于诊断以epha10异常表现(例如过度表现、表现不足、缺乏表现等)为特征病况或疾病。用于epha10之例示性诊断分析可包含例如使获自患者之样本与本揭示之抗epha10抗体接触,其中该抗epha10抗体系用可侦测标记或报导体分子标记。或者,未标记之抗epha10抗体可与自身经可侦测标记之二次抗体组合用于诊断应用中。可侦测标记或报导体分子可为放射性同位素,诸如3h、14c、32p、35s或125i;荧光或化学发光部分,诸如异硫氰酸荧光素或若丹明(rhodamine);或酶,诸如碱性磷酸酶、β-半乳糖苷酶、辣根过氧化酶或荧光素酶。可用于侦测或量测样本中之epha10的特定例示性分析包括酶联免疫吸附分析(elisa)、放射免疫分析(ria)及荧光活化细胞分选(facs)。
133、提供以下实例以帮助熟习此项技术者实施本揭示。
134、实例
135、噬菌体呈现库筛选
136、使用人类b细胞来源之scfv噬菌体呈现库(creative biolabs,usa)淘选在c末端与ddk/his标签融合之重组人类epha10细胞外域蛋白质(glu34-ala565),转录物变异体3(creative biomart,usa,目录号epha10-369h)。使用elisa筛选阳性殖株。藉由dna定序鉴别独特的cmu#13。藉由facs,使用表现全长人类epha10之nih 3t3细胞证实该等独特殖株之结合特异性。
137、epha10-scfv-cd3z-scfv-cd16-scfv、epha10-scfv-cd3z-scfv及epha10-scfv-cd16-scfv质体之构筑
138、设计并构筑三种质体以产生trinte(epha10(cmu#5)-scfv(seq id no:9)-cd3z-scfv(seq id no:11)-cd16-scfv(seq id no:12))、bite(epha10(cmu#5)-scfv(seq idno:9)-cd3z-scfv(seq id no:11))及bike(epha10(cmu#5)-scfv(seq id no:9)-cd3z-scfv(seq id no:12))。在组装各抗体之氨基酸序列之后,合成scfv序列并将其选殖至真核表现载体中。
139、抗epha10/抗cd3/抗cd16 trinte抗体产生
140、藉由使用expifectamine 293转染套组(thermo fisher scientific)将表现质体短暂转染至hek293细胞中,产生trinte、bite及bike。简言之,将质体稀释于opti-mem中,在室温下与预先稀释之expifectamine混合20–30分钟,并添加至hek293细胞中。使转染效率优化以测定产生具有良好产率及纯度之trinte、bite及bike的最佳质体比率。在转染后4–5天,收集来自经转染细胞之上清液并经由0.45μm过滤器单元(nalgene)过滤。使用抗his珠粒纯化出上清液中之trinte、bite及bike。接着,将纯化之trinte、bite及bike等分并在-80℃储存。
141、酶联免疫吸附分析(elisa)
142、将scfv序列与小鼠igg2a序列融合并次选殖至pcdna3.1质体中。将三种scfv-小鼠igg2a质体转染至hek293细胞中。藉由蛋白质a树脂纯化三种scfv-小鼠igg2a抗体。利用间接elisa针对经涂覆之9种epha抗原(epha1-8及10,r&d系统)测试三种抗体。
143、结果显示于图1及表2中。cmu#5被证明只与epha10结合而不与其他epha结合,通过elisa测定的对epha 10的ec50为0.117nm。
144、表2
145、
146、细胞毒性分析
147、将人类乳癌细胞(bt-549)用cfse标记并在trinte、bite、bite或pbs存在下,与纯化之人类t细胞及nk细胞以指定的e:t比一起培育4小时。为了监测自发死亡,将单独经cfse标记之目标细胞在相同条件下培养。4小时之后,收集细胞并在分析之前添加7-氨基放线菌素d(7aad)。将样本充分混合并藉由流式细胞分析技术分析。
148、epha10 trinte之结果显示于图3中。在超过3.125μg/ml时,细胞毒性作用明显高于对照组之作用。在超过50μg/ml时,细胞毒性百分比为约80%。由此得出结论,epha10trinte提供有效的抗肿瘤活性。
149、epha10 bite之结果显示于图4中。在超过50μg/ml时,细胞毒性百分比为约80%。由此得出结论,epha10 bite提供有效的抗肿瘤活性。
150、epha10 bike之结果显示于图4中。在超过50μg/ml时,细胞毒性百分比为约80%。由此得出结论,epha10 bike提供有效的抗肿瘤活性。
151、nk细胞及t细胞之分离及纯化
152、利用流式细胞分析技术,使用人类pbmc或经分离之t细胞及nk细胞作为效应细胞且使用各种epha10阳性人类乳癌细胞株检查复位向细胞之细胞毒性。使用标准程序,利用ficoll密度梯度离心自健康供体分离pbmc。简言之,在离心后,在室温下将细胞于10ml红血球溶解缓冲液(sigma–aldrich)中培育10分钟,用pbs洗涤,使其以6×106个细胞/毫升之浓度再悬浮于rpmi-1640培养基中。或者,使用pan t细胞分离套组ii(miltenyi biotec)自pbmc中分离出t细胞。对于t细胞活化,将2×106个t细胞在涂有1μg抗cd3抗体及1μg抗cd28抗体(ebioscience)之24孔盘中培养。将细胞在5% co2含湿气培育箱中在37℃下培育3天。使用nk细胞分离套组(miltenyi biotec)自pbmc分离出nk细胞。将细胞在facs缓冲液(pbs,2% fbs及0.02%nan3)中洗涤一次并在4℃于200μl中培育30分钟。添加碘化丙锭(pi)达到1μg/ml最终浓度,并藉由流式细胞分析技术(bd biosciences)分析样本。目标细胞溶解是以经pi染色之细胞的百分比测定。所有实验均一式两份进行。
153、t细胞活化之表征
154、藉由流式细胞技术分析,根据cd25表现测定t细胞活化。将淋巴球在存在或不存在自体目标mdm(e:t比率为4:1及8:1)之96孔盘中培育,且用trinte、bite及bike处理。在50%腹水液中进行实验。共培养4天之后,收集淋巴球并用抗cd4、抗cd8、抗cd25、抗cd69、抗cd107a及抗hla-dr抗体染色。
155、nk细胞活化之表征
156、使用流式细胞分析技术,根据cd107a介导之脱粒及ifn-γ制造量测在处理存在或不存在下针对肿瘤目标之nk细胞活化作用。将淋巴球在存在或不存在自体目标mdm(e:t比率为4:1及8:1)之96孔盘中培育,且用trinte、bite及bike处理。在50%腹水液中进行实验。在共培养4天之后,收集淋巴球并用抗cd69、抗cd107a、抗trial、抗ifn-γ及抗tnf-α抗体染色。
157、k细胞及nk细胞活化之结果显示于图5中。当共培养乳癌细胞及t细胞或nk细胞时,epha10 trinte处理组使细胞介素之释放量增加约三倍。实际上,epha10 trinte增加t细胞或nk细胞之活化并增加细胞介素之释放。
158、活体内植入乳癌细胞
159、在接受皮下植入之1×106个mda-mb-231细胞及1×106个未刺激pbmc的nsg小鼠中评价epha10 trinte之活体内功效。将每组六只动物用1μg或10μg trinte静脉内治疗,并在研究第0天、第1天、第2天及第3天,投与对照盐水。在指定日,用测径规量测在两个垂直方向上之肿瘤生长,并使用下式计算肿瘤体积(mm3):v=(宽度2×长度)/2(taki等人,2015)。亦使用ivis量测nsg小鼠体内之肿瘤生长。
160、结果显示于图7中。epha10 trinte治疗组显示对肿瘤生长之显著抑制作用。因此,epha10 trinte显示针对epha10阳性乳癌肿瘤之活体内效用。
161、免疫染色
162、将t细胞、nk细胞及bt-549细胞与epha10 trinte一起培养。将细胞用4%pfa/pbs固定10分钟并在4℃下与单株抗体一起培育隔夜。次日,将群落用dapi染色,用抗cd3(fitc)抗体及用抗cd16(txrd)抗体监测bt-549。
163、结果显示于图8中。epha10 trinte同时结合至t细胞、nk细胞及bt-549细胞。
164、epha10-car-t慢病毒载体之构筑
165、将cmu#5scfv(seq id no:9)选殖并插入含有cd8铰链、cd28 tm及ic、41-bb及cd3ζ之第三代car-t慢病毒载体中。合成cmu#5scfv序列并将其次选殖至第三代car-t慢病毒载体(pcdh-ef1a-mcs)(creative biolabs,usa)中。为了产生epha10 car慢病毒,将第三代car-t慢病毒载体及包装载体(lentiarttm病毒包装套组,creative biolabs,usa,目录号cart-027cl)共转染至hek293细胞中。epha10-car t(epha10-car t)之产生
166、使用人类cd8+t细胞产生epha10-car t。简言之,用编码cmu#5 scfv(seq id no:9)之car慢病毒稳定转导cd8+t细胞。所有epha10-car t细胞株皆维持在kbm502培养基(kohjin bio,japan)中。每2个月测试epha10-car t细胞株之霉浆菌污染情况。
167、细胞毒性分析
168、在非放射性细胞毒性分析中评价epha10-car-t细胞的细胞毒性潜力。将epha10-car-t细胞与epha10阳性mda-mb-231细胞以10之效应物比目标比率(e/t比率=10;效应细胞:epha10-car-t细胞;目标细胞:mda-mb-231细胞)共培养24小时。利用mtt分析来分析mda-mb-231之细胞生存力。
169、结果显示于图9中。epha10-car-t细胞处理明显降低mda-mb-231之生存力。
170、尽管已结合上述特定实施例描述本揭示,但其许多替代方案以及其修改及变化对于一般熟习此项技术者而言将为显而易见的。所有此类替代方案、修改及变化被视为属于本揭示之范围内。
本文地址:https://www.jishuxx.com/zhuanli/20240914/297623.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表