包括人透明质酸酶PH20和药物的药物组合物的制作方法
- 国知局
- 2024-10-09 16:10:52
本发明涉及包含透明质酸酶ph20或其变体和至少一种药物的药物组合物,以及使用该药物组合物治疗疾病的方法,其中该组合物包含基于泊洛沙姆的表面活性剂。根据本发明的药物组合物可以用于治疗各种疾病,优选用于皮下注射。
背景技术:
1、应当以高剂量或高量给药的药物,尤其是抗体药物,通常通过静脉内注射给药,这需要大约90分钟或更长时间,并且涉及额外的准备工作,因此不利的是,会给患者和医务人员带来不便,而且必然导致额外的费用。另一方面,皮下注射有利于立即给药,但是当注射量为3~5ml或更多时,由于与静脉注射相比吸收速率和速度较慢,可能导致注射部位的肿胀和疼痛。由于这个原因,已经将蛋白质治疗剂的皮下注射限制性地以2ml的少量溶液的注射来应用。然而,当将透明质酸酶联合治疗性药物皮下给药或注射时,透明质酸酶水解分散在细胞外基质中的透明质酸,从而降低皮下层的粘度,增加材料渗透性,并容易将高剂量和大量的药物递送到体内。
2、在人类中有六种类型的透明质酸酶基因,即,hyal1、hyal2、hyal3、hyal4、hyalps1和ph20/spam1。hyal1和hyal2在大多数组织中表达,而ph20/spam1(以下称为“ph20”)在精子的细胞膜和顶体膜中表达。hyalps1作为假基因不表达。ph20是一种切割n-乙酰葡糖胺和葡萄糖醛酸(透明质酸的构成糖)之间的β-1,4键的酶(ec 3.2.1.35)。人透明质酸酶ph20的最适ph为5.5,但即使在ph为7至8时也表现出轻微的活性,而其他的人透明质酸酶,包括hyal1,最适ph为3至4,在ph为7至8时活性较低。由于人体皮下部位的中性ph值约为7.4,因此在几种类型的透明质酸酶中,ph20被广泛用于临床实践。例如,ph20在临床上用于皮下注射抗体治疗剂、眼部松弛剂和用于眼科手术的麻醉注射添加剂,水解肿瘤细胞的细胞外基质中的透明质酸以增加抗癌药物的肿瘤细胞可及性,以及促进组织中过量体液和血液的重吸收。
3、同时,目前商业使用的ph20是从牛或羊的睾丸中提取的。这种ph20的实例包括(牛透明质酸酶)、(羊透明质酸酶)等。
4、据报道,人ph20的重组蛋白在酵母(巴斯德毕赤酵母(p.pastoris))、ds-2昆虫细胞和动物细胞中表达(chen et al.,2016,hofinger et al.,2007)。在蛋白质翻译后修饰期间,在n-糖基化模式方面,昆虫细胞和酵母中产生的重组ph20蛋白质不同于人ph20。
5、尽管为了使用人ph20开发皮下注射制剂形式的各种治疗药物而进行了研究,但人ph20本身稳定性低的问题仍未解决。
6、在该技术背景下,本发明人发现包括在野生型透明质酸酶ph20的氨基酸序列中的α螺旋8区(s347至c381),以及α螺旋7和α螺旋8之间的接头(a333至r346)中的至少一个氨基酸置换并且其中位于ph20的n-末端和/或c-末端处的一些氨基酸被截短的人ph20变体具有优异的酶活性和热稳定性,并基于此提交了专利申请(pct/kr2019/009215)。
7、此外,本申请的发明人发现,ph20或其变体可以应用于药物,优选抗体药物,特别是包含高剂量的抗her2抗体或免疫检查点抗体的药物组合物或制剂,并且特别地,当组合物或制剂包含基于泊洛沙姆的表面活性剂时,药物诸如抗体药物和ph20或其变体的活性非常稳定并且可以长时间地保持。基于此,完成了本发明。
技术实现思路
1、本发明的一个目的是提供一种新型药物组合物,其包含ph20或其变体和基于泊洛沙姆的表面活性剂以及药物,其中药物和ph20或其变体的热稳定性和活性可以长时间地保持,特别是一种适用于皮下给药的药物组合物。
2、本发明的另一目的是提供一种治疗疾病的方法,包括向需要治疗的受试者给药根据本发明的药物组合物。
3、根据本发明的一个方面,上述和其他目的可以通过提供包含(a)药物,(b)透明质酸酶和(c)基于泊洛沙姆的表面活性剂的药物组合物来实现,其中透明质酸酶是具有seqid no:1的序列的野生型ph20或其变体。
4、在本发明中,透明质酸酶优选地是透明质酸酶ph20,特别是人ph20或其变体,但不限于此,并且ph20变体包括选自由t341s、l342w、s343e、i344n、m345t、s347t、m348k、k349e、l352q、l353a、l354i、d355k、n356e、e359d、i361t和n363g组成的组的一个或多个氨基酸残基的置换,并且还包括在选自α螺旋8序列(s347至c381)和/或α螺旋7和α螺旋8之间的接头(a333至r346)的一个或多个位点处的氨基酸置换,其中ph20或其变体的特征在于位于n-末端和/或c-末端处的一部分氨基酸残基被选择性地截短。
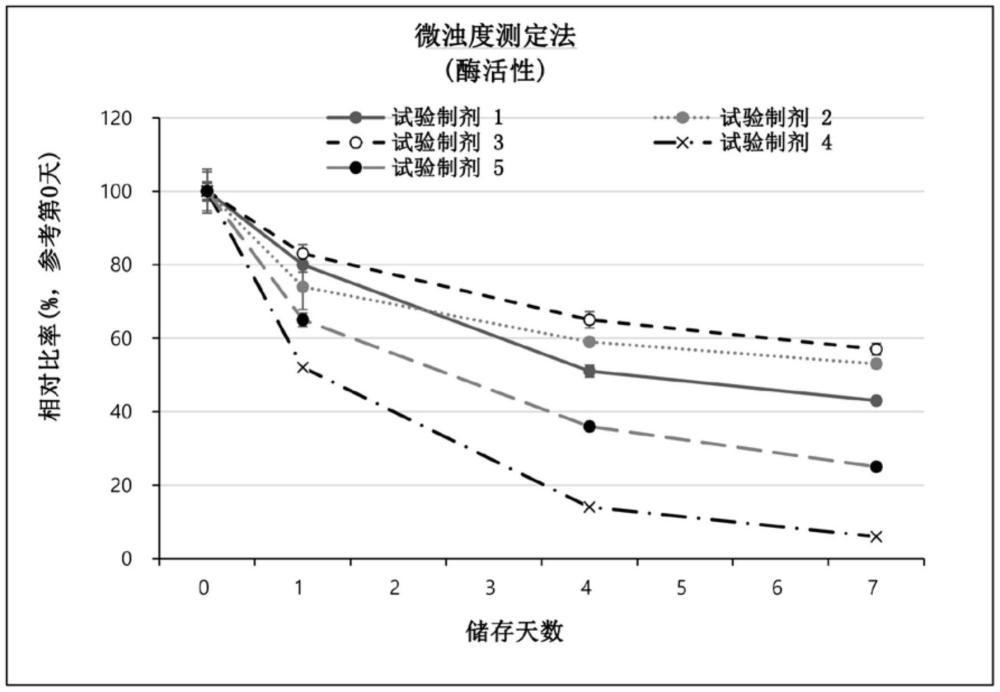
5、在本发明中,药物组合物中所包含的透明质酸酶即使在苛刻的条件下也能长时间地保持活性,特别是在40±2℃下甚至在7天后仍具有20%的残留酶活性。
6、根据本发明的药物组合物还可以包含选自由药学上可接受的添加剂(特别是缓冲剂和稳定剂)组成的组的至少一种。
7、根据本发明的药物组合物可以以用于皮下给药的可注射制剂形式来使用。
技术特征:1.一种药物组合物,包括:
2.根据权利要求1所述的药物组合物,其中,所述ph20变体包括选自由l354i和n356e组成的组的一个或多个氨基酸残基的置换。
3.根据权利要求1所述的药物组合物,其中,所述ph20变体包括在选自由具有seq idno:1所示序列的ph20变体的α螺旋及其接头组成的组的一个或多个位置处的一个或多个氨基酸残基的置换。
4.根据权利要求3所述的药物组合物,其中,seq id no:1的所述野生型ph20变体的所述α螺旋是α螺旋8(s347至c381),以及所述接头是α螺旋7和α螺旋8之间的接头(a333至r346)。
5.根据权利要求4所述的药物组合物,其中,seq id no:1的所述野生型ph20变体的所述α螺旋和所述接头的相应区域为t341至n363、t341至i361、l342至i361、s343至i361、i344至i361、m345至i361或m345至n363。
6.根据权利要求4所述的药物组合物,其中,seq id no:1的所述野生型ph20变体的所述α螺旋8(s347至c381)和α螺旋7与α螺旋8之间的所述接头(a333至r346)的至少一个区域被在hyal1的相应区域的氨基酸序列中的一个或多个氨基酸残基置换。
7.根据权利要求1所述的药物组合物,其中,所述ph20变体包括l354i和/或n356e的置换,并且
8.根据权利要求7所述的药物组合物,其中,所述ph20变体包括l354i和/或n356e的置换,并且
9.根据权利要求7所述的药物组合物,其中,所述ph20变体包括m345t、s347t、m348k、k349e、l352q、l353a、l354i、d355k、n356e、e359d和i361t的置换。
10.根据权利要求9所述的药物组合物,其中,所述ph20变体还包括t341s、l342w、s343e、i344n和n363g中的一个或多个氨基酸残基的置换。
11.根据权利要求10所述的药物组合物,其中,所述ph20变体包括选自由以下组成的组中的任何一种氨基酸置换组:
12.根据权利要求1至11中任一项所述的药物组合物,其中,所述野生型ph20或ph20变体还包括c-末端和n-末端的一个或多个氨基酸残基的缺失。
13.根据权利要求12所述的药物组合物,其中,所述野生型ph20或ph20变体还包括选自由在n-末端处的m1至p42组成的组的氨基酸残基之前的截短以缺失一个或多个氨基酸残基。
14.根据权利要求13所述的药物组合物,其中,所述野生型ph20或ph20变体还包括在n-末端处的l36、n37、f38、r39、a40、p41或p42的氨基酸残基之前的截短以缺失一个或多个氨基酸残基。
15.根据权利要求12所述的药物组合物,其中,所述野生型ph20或ph20变体还包括选自由在c-末端处的v455至l509组成的组的氨基酸残基之后的截短以缺失一个或多个氨基酸残基。
16.根据权利要求15所述的药物组合物,其中,所述野生型ph20或ph20变体还包括选自由在c-末端处的v455至s490组成的组的氨基酸残基之后的截短以缺失一个或多个氨基酸残基。
17.根据权利要求16所述的药物组合物,其中,所述野生型ph20或ph20变体还包括在n-末端处的v455、c458、d461、c464、i465、d466、a467、f468、k470、p471、p472、m473、e474、t475、e476、p478、i480、y482、a484、p486、t488或s490的氨基酸残基之前的截短以缺失一个或多个氨基酸残基。
18.根据权利要求1至17中任一项所述的药物组合物,其中,所述野生型ph20或ph20变体还包括在n-末端处的源自人透明质酸酶-1(hyal1)、人生长激素或人血清白蛋白的信号肽。
19.根据权利要求1至17中任一项所述的药物组合物,其中,所述ph20变体还选自由seqid no:5至seq id no:50的氨基酸序列组成的组。
20.根据权利要求19所述的药物组合物,其中,所述ph20变体具有由seqid no:44表示的序列。
21.根据权利要求1所述的药物组合物,其中,所述药物是蛋白质药物、抗体、小分子、适体、rnai、反义基因或细胞治疗剂。
22.根据权利要求21所述的药物组合物,其中,所述药物是抗体、可溶性受体或可溶性受体与fc的融合蛋白。
23.根据权利要求22所述的药物组合物,其中,所述抗体结合选自由以下组成的组的至少一种抗原:4-1bb、5t4、整联蛋白、激活素、β淀粉样蛋白、血管生成素1或2、血管生成素类似物3、b细胞成熟抗原(bcma)、b细胞激活因子(baff)、b7-h3、补体5、ccr4、ccr5、ccl11、cd2、cd3、cd4、cd6、cd11a、cd16a、cd19、cd20、cd22、cd25、cd27、cd28、cd30、cd32b、cd33、cd38、cd40、cd45、cd46、cd47、cd52、cd56、cd62、cd70、cd73、cd74、cd79b、cd80、cd105、cd123、cd154、cd166、cd262、cd278、cd319、cd326、癌胚抗原(cea)、cgrp、紧密连接蛋白-18、c-met、csf-1、csf-1受体、ctla4、dll3、egf受体、血友病因子、fc受体、fgf23、叶酸受体、gd2、糖皮质激素诱导的tnf受体(gitr)、磷脂酰肌醇蛋白聚糖3、gm-csf、her2、her3、肝细胞生长因子(hgf)、干扰素受体、干扰素γ、ige、igf-1受体、白细胞介素1、白细胞介素2受体、白细胞介素4、白细胞介素4受体、白细胞介素5、白细胞介素5受体、白细胞介素6、白细胞介素6受体、白细胞介素8、白细胞介素12/23、白细胞介素13、白细胞介素17a、白细胞介素17受体a、白细胞介素23、白细胞介素31受体、白细胞介素36受体、淋巴细胞激活基因3(lag3)、赖氨酰氧化酶同系物2(loxl2)、间皮素、粘蛋白-1、粘蛋白-16、纤连蛋白4、神经生长因子(ngf)、ox40、前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(pcsk9)、pd-1、pd-l1、磷脂酶c、rankl(核因子κb受体激活因子配体)、酪氨酸-蛋白激酶跨膜受体(ror1)、唾液酸结合ig样凝集素15(siglec-15)、转化生长因子β(tgfβ)、tigit(具有免疫球蛋白和itim结构域的t细胞免疫受体)、t细胞免疫球蛋白域和黏蛋白域蛋白-3(tim-3)、组织因子、组织因子途径抑制剂(tfpi)、torp-2、肿瘤坏死因子(tnf)、胸腺基质淋巴细胞生成素(tslb)、大集落刺激因子1受体(csf1r)、血管内皮生长因子(vegf)、vegf受体和血管性血友病因子(vwf)。
24.根据权利要求22所述的药物组合物,其中,所述抗体包括选自由以下组成的组的至少一种:adg 106、eu101、lvgn6051、乌瑞芦单抗、乌托鲁单抗、贝特洛韦单抗、阿杜那单抗、巴皮内珠单抗、克瑞组单抗、多奈单抗、更汀芦单抗、仑卡奈单抗、苏兰组单抗、奈司库人单抗、依维苏单抗、依诺妥珠单抗、奥博妥单抗、贝利木单抗、伊利尤单抗、他贝芦单抗、柏替木单抗、莫格利珠单抗、乐利单抗、西利珠单抗、福雷芦单抗、莫罗单抗-cd3、奥昔组单抗、替利组单抗、伊巴组单抗、曲利组单抗、扎木单抗、艾托利珠单抗、依法利珠单抗、伊奈利珠单抗、他法西他单抗、托西莫单抗、奥瑞珠单抗、奥法妥木单抗、利妥昔单抗、乌妥昔单抗、维妥组单抗、依帕珠单抗、巴利昔单抗、达克珠单抗、伐立鲁单抗、培戈-鲁利珠单抗、伊妥木单抗、bi-1206、林妥珠单抗、达雷木单抗、菲泽妥单抗、gen3014、艾沙妥昔单抗、迈泽妥单抗、cdx-1140、布来芦人单抗、达西组单抗、伊卡利单抗、卢卡木单抗、米佐利单抗、sea-cd40、索替利单抗、sar441344、tegoprubart、培戈-达匹利珠单抗、i-131-艾妥单抗、ao-176、莱法利单抗、莫洛利单抗、阿伦珠单抗、立赞利珠单抗、英拉库人单抗、古妥珠单抗、奥来鲁单抗、米拉组单抗、加利昔单抗、卡罗妥昔单抗、阿德木单抗、艾普奈珠单抗、依瑞奈尤单抗、瑞玛奈珠单抗、加卡奈珠单抗、tst001、zl-1211、佐妥昔单抗、奥那妥组单抗、托西珠单抗、帕泽利单抗、雷夫利珠单抗、拉妥珠单抗、pd-0360324、amb-051、艾克利单抗、卡比利珠单抗、依米妥珠单抗、ba3071、伊匹木单抗、齐沃利单抗、曲美木单抗、泽弗利单抗、西妥昔单抗、迪妥昔珠单抗、伏妥昔单抗、伊马曲单抗、马妥珠单抗、扎妥昔单抗、耐昔妥珠单抗、尼妥珠单抗、帕尼单抗、托木妥昔单抗、扎芦木单抗、mk-2060、巴托利单抗、尼卡利单抗、洛利昔珠单抗、布洛舒单抗、法妥组单抗、地努妥昔单抗、达妥昔单抗β、那昔妥单抗、bms-986156、拉格芙利单抗、瑾司鲁单抗、仑兹鲁单抗、玛弗利木单抗、那美芦单抗、奥替利单抗、普那利单抗、考曲妥珠单抗、马吉妥昔单抗、帕妥珠单抗、曲妥珠单抗、hmbd-001、帕曲妥单抗、瑟瑞妥单抗、度戈妥珠单抗、非拉妥组单抗、利妥木单抗、艾洛利单抗、阿尼鲁单抗、依玛鲁单抗、fb825、利格利珠单抗、奥马珠单抗、西妥木单抗、达罗托组单抗、芬妥木单抗、加尼妥单抗、替妥木单抗、贝迈奇单抗、卡那单抗、吉伏组单抗、布雷奴单抗、乌司奴单抗、安芦组单抗、申达奇单抗、来瑞组单抗、曲罗芦单抗、布罗达单抗、比美吉珠单抗、依奇珠单抗、司库奇尤单抗、布雷库单抗、古塞奇尤单抗、米吉珠单抗、利生奇珠单抗、替曲吉珠单抗、奈莫利珠单抗、艾米司利单抗、司柏索利单抗、帕考珠单抗、cbp201、度匹鲁单抗、德莫奇单抗、美泊利单抗、瑞利珠单抗、贝那利珠单抗、克拉扎珠单抗、奥洛组单抗、塞妥昔单抗、西鲁库单抗、泽韦奇单抗、乐维利单抗、萨瑞鲁单抗、萨特利珠单抗、托珠单抗、humax-il8、阿比妥珠单抗、玛维泽利单抗、弗安利单抗、gsk2831781、埃拉利单抗、incagn02385、瑞拉利单抗、辛妥珠单抗、阿巴伏单抗、奥戈伏单抗、他尼组单抗、bms-986178、gsk3174998、incagn01949、艾沃利单抗、诺卡替利单抗、他利昔珠单抗、特拉佐利单抗、珀伽利珠单抗、阿利苏单抗、伯考赛珠单抗、伊努西单抗、依沃苏单抗、弗洛西单抗、昂戈瑞西单抗、托莱西单抗、多塔利单抗、巴替利单抗、坎利珠单抗、西米普利单抗、杰洛利单抗、medi0680、纳武利尤单抗、帕博利珠单抗、派安普利单抗、匹地利珠单抗、帕洛利单抗、瑞弗利单抗、萨善利单抗、斯鲁利单抗、信迪利单抗、斯巴达珠单抗、替雷利珠单抗、特瑞普利单抗、埃本利单抗、赛帕利单抗、阿特珠单抗、阿维鲁单抗、柯希利单抗、舒格利单抗、度伐鲁单抗、imc-001、恩弗利单抗、舒瓦度尤单抗、迪诺苏单抗、泽罗妥单抗、nc318、依妥组单抗、nis793、bms-986207、度纳利单抗、eos-448、艾替利单抗、欧司珀利单抗、替瑞利尤单抗、维博利单抗、舒泽利单抗、考伯利单抗、萨巴托利单抗、tqb2618、康赛珠单抗、马塔西单抗、阿达木单抗、戈利木单抗、英利昔单抗、培戈-赛妥珠单抗、可那木单抗、替加组单抗、特泽芦人单抗、伽妥珠单抗、卡比利珠单抗、贝伐珠单抗、布洛赛珠单抗、雷尼株单抗、奥伐西单抗、艾芦库单抗、雷莫芦单抗、卡拉西组单抗、阿贝人单抗、依曲利组单抗、维多珠单抗、英妥木单抗、那他珠单抗、dsp107、ro7122290、希比芙普α、gen1042、洛比芙普α、gen1044、奥瑞达妥单抗、gen1047、埃纳妥单抗、利伏赛坦单抗、特立妥单抗、艾可瑞妥单抗、格菲妥单抗、莫妥珠单抗、奥尼妥单抗、伏妥珠单抗、维克妥单抗、卡妥索单抗、赛必妥单抗、tak-186、塔奎妥单抗、乌巴妥单抗、nvg-111、恩菲妥单抗、hpn536、afm13、兰妥莫单抗、isb1442、cpo107、afm24、埃万妥单抗、mcla-129、si-b001、依米赛珠单抗、mim8、泽妥珠单抗、泽尼达妥单抗、替布利珠单抗、gi-101、沃巴利珠单抗、regn5668、hx009、卡度尼利单抗、沃达利单抗、emb-02、ro7247669、特泊利单抗、ibi318、azd2936、azd7789、ro7121661、依沃西单抗、ibi322、es101、gen1046、prs-344、依瑞利单抗、fs118、必特芙普α、hb0036、hlx301、nm21-1480、奥佐拉珠单抗、bi836880、法瑞西单抗、伐努赛珠单抗、那赛昔珠单抗、ibi302、埃托-那普妥莫单抗、贝兰他单抗莫福汀、ds-7300、mgc018、苏奈匹维奇单抗、雷普罗妥单抗、雷考
25.根据权利要求22所述的药物组合物,其中,所述可溶性受体或所述可溶性受体和fc的所述融合蛋白中所包含的所述可溶性受体选自由tnf-α可溶性受体、vegf可溶性受体、ctla-4、白细胞介素1可溶性受体和lfa3可溶性受体组成的组。
26.根据权利要求25所述的药物组合物,其中,所述可溶性受体和fc的所述融合蛋白选自依那西普、阿柏西普、康伯西普、opt-302、阿巴西普、贝拉西普、利纳西普、因奇西普、阿来西普、艾沃帕西普、昂托瑞泊西普、tti-622、索特西普、达兰西普、艾卡泽西普和达佐利贝普。
27.一种药物组合物,包括:
28.根据权利要求1或27所述的药物组合物,其中,所述基于泊洛沙姆的表面活性剂是泊洛沙姆188。
29.根据权利要求1或27所述的药物组合物,其中,所述基于泊洛沙姆的表面活性剂以0.001%至1.5%(w/v)的量存在。
30.根据权利要求1或27所述的药物组合物,还包括选自由缓冲剂和稳定剂组成的组的至少一种。
31.根据权利要求30所述的药物组合物,其中,所述缓冲剂包括选自以下组成的组的至少一种:苹果酸盐、甲酸盐、柠檬酸盐、乙酸盐、丙酸盐、吡啶、哌嗪、卡可酸盐、琥珀酸盐、2-(n-吗啉代)乙磺酸(mes)、组氨酸、tris、bis-tris、磷酸盐、乙醇胺、碳酸盐、哌嗪-n,n'-双(2-乙磺酸)、(pipes)、咪唑、双-三丙烷、bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)、mops(3-(n-吗啉代)丙磺酸)、hepes(羟乙基哌嗪乙磺酸)、焦磷酸盐和三乙醇胺,并且
32.根据权利要求31所述的药物组合物,其中,所述碳水化合物、糖或糖醇包括选自由以下组成的组的至少一种:海藻糖或其水合物、蔗糖、糖精、甘油、赤藓糖醇、苏糖醇、木糖醇、阿拉伯糖醇、核糖醇、甘露醇、山梨醇、半乳糖醇、岩藻糖醇、艾杜糖醇、肌醇、庚七醇、异麦芽酮糖醇、麦芽糖醇、聚乙二醇、环糊精、羟丙基β-环糊精和葡萄糖,并且
33.根据权利要求30所述的药物组合物,包括50至350mg/ml的抗体,所述抗体包括抗her2抗体或免疫检查点抗体,100至20,000单位/ml的ph20变体,0.001%至1.5%(w/v)的基于泊洛沙姆的表面活性剂,用于提供5.5±2.0的ph值的0.001至200mm的组氨酸缓冲剂,以及10至400mm的α,α-海藻糖,并任选包括1至50mm的甲硫氨酸。
34.根据权利要求33所述的药物组合物,包括120±18mg/ml的抗her2抗体或免疫检查点抗体、1,500至12,000单位/ml的ph20变体、0.1%至0.5%(w/v)的基于泊洛沙姆的表面活性剂、提供5.5±2.0的ph值的10至30mm的组氨酸缓冲剂,以及180至230mm的α,α-海藻糖,并且还任选地包括8至15mm的甲硫氨酸。
35.根据权利要求1至34中任一项所述的药物组合物,其中,所述药物组合物在40±2℃下7天后剩余酶活性为20%或更多。
36.一种用于皮下给药的制剂,其包括根据权利要求1到35中任一项所述的药物组合物。
37.根据权利要求36所述的制剂,其中,所述制剂以立即给药的即用型形式提供而无需额外的稀释过程。
38.根据权利要求37所述的制剂,其中,所述制剂被包装在预填充注射器、玻璃安瓿、塑料容器、可佩戴装置或自动注射器中。
技术总结本发明涉及一种药物组合物,其包括(a)药物,(b)PH20或其变体,和(c)基于泊洛沙姆的表面活性剂。根据本发明的药物组合物中所包含的人PH20变体包括在选自具有SEQ IS NO:1的氨基酸序列的野生型人PH20上的α螺旋8序列(S347‑C381)和α螺旋7和α螺旋8之间的接头区(A333‑R346)的一个或多个位置处的氨基酸置换,并且任选在位于N‑末端和/或C‑末端区域的氨基酸处被切割。此外,根据本发明的药物组合物还可以包括药学上可接受的添加剂,特别是稳定剂。由于人PH20或其变体的优势,根据本发明的药物组合物可以展现出与其一起使用的药物的最大治疗效果。技术研发人员:朴淳宰,金奎完,南基硕,宋炯枏受保护的技术使用者:阿特根公司技术研发日:技术公布日:2024/9/26本文地址:https://www.jishuxx.com/zhuanli/20240929/312054.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表