一种基于过滤原理的胶内蛋白酶解前处理方法
- 国知局
- 2024-11-06 15:09:31
本发明属于生物,具体涉及一种基于过滤原理的胶内蛋白酶解前处理方法。
背景技术:
1、胶内酶解(in-gel digestion)是目前蛋白质化学或蛋白质组学研究中的一种主流前处理方法。该方法涉及将蛋白通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sds-page)分离并染色,然后切下条带,并使用蛋白酶将胶内的蛋白水解成多肽。随着近些年来大规模蛋白质组学的快速发展,前处理技术也有了长足的进步。虽然溶液内酶解以及基于滤膜或磁珠的酶解方法在蛋白质组学研究中的应用日益增多,但胶内酶解依然是最为经典且无法替代的前处理方法。
2、胶内酶解方法的建立可以追述到上世纪90年代matthias mann组在nature杂志上发表的关于使用纳升电喷雾离子源质谱测序丙烯酰胺胶中的蛋白序列,该方法可适用于考马斯亮蓝或银染色的胶。经过十年时间的上千次反复实践及淬炼,matthias mann组于2006年在nature protocol杂志上发表了题为《in-gel digestion for mass spectrometriccharacterization of proteins and proteomes》的论文。该文章详细阐述了进行胶内酶解实验的试剂仪器、实验步骤方法,以及可能出现的问题和解决策略。这篇文章所记录的实验方法被蛋白质化学及组学的研究者广泛使用,并被奉为行业内经典。之后虽然也有关于胶内酶解方法改进的工作,但主要是针对使用试剂以及反应步骤时间的调整,整体实验还都是在ep管里进行,实验框架并没有很大改动。
3、在离心管内进行胶内酶解的方法,进行样品前处理时需要人工对每个样品多次吸取废液,耗费实验耗材,实验时间较长,并且不易实现自动化。此外,在多次转移和处理过程中,对于性状软的蛋白胶,吸取废液时可能会堵住枪头或者将胶体吸走,导致样品损失;性状硬而脆的蛋白胶容易破裂并产生碎胶小颗粒,这些碎片同样可能被误吸走导致损失。因此,亟需研发一种操作简便、耗时更短、更易实现自动化的胶内蛋白酶解前处理方法。
技术实现思路
1、本发明的目的在于解决现有技术中的不足,并提供一种基于过滤原理的胶内蛋白酶解前处理方法。
2、本发明所采用的具体技术方案如下:
3、本发明提供一种基于过滤原理的胶内蛋白酶解前处理方法,具体步骤如下:
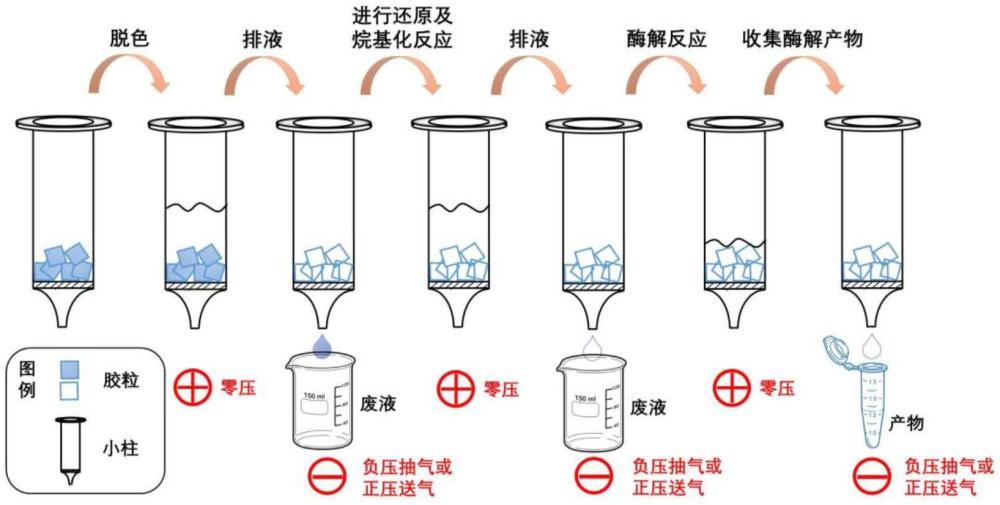
4、s1:将样品蛋白通过凝胶电泳分离并对蛋白胶染色脱色后,切下目标条带并切成胶粒;
5、s2:将步骤s1得到的胶粒转移至含有滤膜或筛板的过滤装置中,在过滤装置下方设置抽吸设备或者上方设置正压送气设备;所述过滤装置中的滤膜或筛板孔径小于胶粒的尺寸;用水冲洗胶粒后,利用抽吸设备或者正压送气设备排干水分,保持胶粒位于过滤装置的滤膜或筛板上;
6、s3:向步骤s2中的过滤装置中加入脱色液,进行震荡脱色,脱除样品蛋白上的染色液;每次震荡脱色后,利用抽吸设备或正压送气设备排干脱色液,直至胶粒脱色完全;
7、s4:向步骤s3中的过滤装置中加入有机溶剂润洗胶粒,胶粒完全脱水干燥后,利用抽吸设备或正压送气设备排干有机溶剂;
8、s5:向步骤s4中的过滤装置中加入没过胶粒的蛋白酶溶液,进行酶解反应,得到肽段溶液;利用抽吸设备或正压送气设备将肽段溶液转移至其它容器中,用于后续研究。
9、作为优选,对步骤s4脱水干燥后的胶粒进行二硫键还原和烷基化修饰,具体如下:
10、向步骤s4中的过滤装置中加入没过胶粒的二硫苏糖醇溶液或三(2-羧乙基)膦溶液,在24-55℃进行还原反应20-60分钟,还原蛋白中的二硫键;排去还原反应后的废液,加入有机溶剂润洗胶粒,胶粒完全脱水后,排走有机溶剂;
11、随后加入没过胶粒的氯乙酰胺溶液、碘乙酰胺溶液、碘乙酸溶液或n-乙基马来酰亚胺溶液,在室温或室温避光条件下对还原巯基进行烷基化修饰20-30分钟;排走烷基化修饰反应后的废液,加入有机溶剂润洗胶粒,胶粒完全脱水后,排走有机溶剂;
12、所述有机溶剂采用100%乙腈溶液、甲醇溶液或乙醇溶液。
13、进一步的,所述二硫苏糖醇溶液中的二硫苏糖醇浓度为25mm;所述三(2-羧乙基)膦溶液中的三(2-羧乙基)膦浓度为20mm;所述氯乙酰胺溶液中的氯乙酰胺浓度为55mm;所述碘乙酰胺溶液中的碘乙酰胺浓度为55mm;所述碘乙酸溶液中的碘乙酸浓度为55mm;所述n-乙基马来酰亚胺溶液中的n-乙基马来酰亚胺浓度为55mm;
14、所述二硫苏糖醇溶液、三(2-羧乙基)膦溶液、氯乙酰胺溶液、碘乙酰胺溶液或碘乙酸溶液的溶剂采用50mm碳酸氢铵溶液、10mm磷酸盐缓冲液、100mm碳酸氢三乙基铵溶液或20mm 4-羟乙基哌嗪乙磺酸溶液。
15、作为优选,步骤s1中所述样品蛋白的质量为0.01-200μg;所述染色采用考马斯亮蓝染色或银染色。
16、作为优选,所述抽吸设备或正压送气设备为真空泵;步骤s2中,采用胶粒1-3倍体积的水清洗胶粒2遍,并用真空泵排干水分。
17、作为优选,步骤s3中所述的脱色液中含有30%~50%的乙腈、甲醇或乙醇,还含有50mm碳酸氢铵、10mm磷酸盐、100mm碳酸氢三乙基铵或20mm 4-羟乙基哌嗪乙磺酸;
18、加入脱色液的体积为胶粒的1-3倍;所述震荡脱色在25-37℃恒温混匀仪中进行,震荡速率为500-1000rpm,每次震荡脱色时间为15-40分钟。
19、作为优选,步骤s4中加入有机溶剂的体积为胶粒的1-3倍,浸泡润洗胶粒多次,每次5-15分钟,直至胶粒完全变白变硬;采用真空泵,在氮气保护下排走有机溶剂;所述有机溶剂采用100%乙腈溶液、甲醇溶液或乙醇溶液。
20、作为优选,步骤s5中所述酶解反应前,先将胶粒置于蛋白酶溶液中,于0-5℃条件下浸泡0.1-3小时,随后在蛋白酶具有活性的温度下进行酶解反应1-16小时;所述蛋白酶溶液采用浓度为1-50ng/μl的胰蛋白酶。
21、作为优选,步骤s5中酶解反应完成后,加入酸控制ph值在1-3,终止酶解反应。
22、作为优选,步骤s5中酶解反应完成后,加入没过胶粒的萃取液提高肽段的回收率;所述萃取液采用含有30-50%乙腈和0.1%甲酸的水溶液、含有30-50%甲醇和0.1%甲酸的水溶液或者含有30-50%乙醇和0.1%甲酸的水溶液。
23、本发明相对于现有技术而言,具有以下有益效果:
24、(1)本发明提供的胶内蛋白酶解前处理方法能够缩短实验时间,节省实验耗材:
25、蛋白胶内酶解前处理实验的操作步骤重复且繁多,尤其是弃废液的操作。采用传统离心管的方式进行样品前处理时,每个样品人工吸取废液的次数为14-17次;若是银染胶块则吸取废液的次数更多。在样品数目多的情况下(如20个以上),处理完所有样品的时间更会成倍增加。如果采用本发明的过滤装置进行胶内蛋白酶解前处理,可以同时一次弃去所有样品的废液,省去人工依次对每个样品重复吸弃废液的过程,从而大大缩短实验时间,同时节省实验耗材(如枪头)等。
26、(2)本发明提供的胶内蛋白酶解前处理方法更加适用于不同性状的蛋白胶样品:
27、目前可以用于跑蛋白电泳的胶有市面上可售的预制胶和实验室自制胶,由于丙烯酰胺浓度以及所用缓冲盐的不同,每种胶的性状都有差异,软硬程度也不同。对于只跑浓缩胶的样品,蛋白胶样性状偏软,有的胶和水融为一体。在用传统离心管处理此类样品时,吸取废液时容易堵住枪头,增加实验操作难度;或者把胶误吸走,损失样品。也有一些胶偏硬偏脆、容易破裂,在用传统离心管处理此类样品时,实验过程中会产生一些小的碎胶颗粒,吸取废液时容易把碎胶吸走;酶解完萃取肽段时,也会增加吸到碎胶的风险;以至于旋干复溶上机时,这些残留下来的极小碎胶会造成质谱上样采集时仪器捕集柱和分析柱堵塞的风险。采用本发明提出的过滤装置进行胶内蛋白酶解前处理,选择孔径大小合适的装置,可以完全避免以上风险的发生。
本文地址:https://www.jishuxx.com/zhuanli/20241106/325585.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。