延迟定时释放的药物组合物及其制备方法和应用与流程
- 国知局
- 2024-07-12 10:23:23
本发明涉及生物制药领域,具体涉及一种延迟定时释放的药物组合物及其制备方法和应用。
背景技术:
1、帕金森病是一种进行性的神经退行性疾病,它是由于大脑中产生多巴胺的细胞丧失而导致的。多巴胺是一种天然存在于大脑和脊髓中的物质,帮助大脑中的神经细胞正确控制运动功能。随着大脑中多巴胺水平的降低,帕金森病(parkinson’s disease,pd)的症状出现了,例如肌肉僵硬、运动缓慢以及难以保持平衡。多巴胺不能穿透血脑屏障(blood-brain barrier,bbb),这是其口服剂型不起作用的原因。左旋多巴是多巴胺的前体,它可以通过血脑屏障并在脑组织中转化为多巴胺。左旋多巴疗法是治疗帕金森病的“金标准”,几乎所有pd患者到达疾病的某个阶段都必须接受左旋多巴的治疗。然而,大多数左旋多巴在到达大脑之前脱羧成多巴胺。因此,左旋多巴通常与脱羧酶抑制剂如卡比多巴或苄丝肼联合给药以防止外周多巴胺的形成,增加脑内多巴胺的含量,减轻由于左旋多巴在外周脱羧而导致的不良反应。
2、在下述的文献中描述帕金森病、帕金森病晨僵症状及其已有治疗方案的不足:
3、(1)j jankovic.parkinson’s disease:clinical features anddiagnosis.journal of neurology,neurosurgery&psychiatry,2008;79:368-376
4、(2)nb mercuri.limitations of current parkinson's disease therapy.annneurol 2003;53:s3–s15.
5、(3)k ray chaudhuri dsc.non-motor symptoms of parkinson's disease:dopaminergic pathophysiology and treatment.the lancet neurology 2009;8:464-474.
6、(4)nb mercuri.2005the'magic'of l-dopa:why is it the gold standardparkinson's disease therapy?trends in pharmacological sciences,2005;26:341-344.
7、(5)nicola t,simone s,pasquale n,et al.morning akinesia in parkinson'sdisease-challenges and solutions.journal of parkinsonism and restless legssyndrome.2016;6:57–63.
8、(6)rizos a,martinez-martin p,odin p,et al.characterizing motor andnon-motor aspects of early-morning off periods in parkinson’s disease:aninternational multicenter study.parkinsonism relat disord.2014;20(11):1231–1235.
9、(7)chapuis s,ouchchane l,metz o,gerbaud l,durif f.impact of the motorcomplications of parkinson’s disease on the quality of life.mov disord.2005;20(2):224–230.
10、(8)factor sa,mcalarney t,sanchez-ramos jr,weiner wj.sleep disordersand sleep effect in parkinson’s disease.mov disord.1990;5(4):280–285.
11、(9)garcia-borreguero d,larrosa o,bravo m.parkinson’s disease andsleep.sleep med rev.2003;7(2):115–129.
12、(10)pfeiffer rf.gastrointestinal,urological,and sexual dysfunction inparkinson’s disease.mov disord.2010;25:94–97.
13、(11)heetun zs,quigley emm.gastroparesis and parkinson’s disease:asystematic review.parkinsonism relat disord.2012;18(5):433–440.
14、(12)kurlan r,rothfield kp,woodward wr,et al.erratic gastric emptyingof levodopa may cause“random”fluctuations of parkinsonianmobility.neurology.1988;38(3):419–421.
15、(13)jost wh.gastrointestinal motility problems in patients withparkinson’s disease.effects of antiparkinsonian treatment and guidelines formanagement.drugs aging.1997;10:249–258.
16、(14)apokyn package insert
17、(15)stuart i,mark l,william o,et al.apomorphine subcutaneousinjection for the management of morning akinesia in parkinson’s disease.movdisord 2016:doi:10.1002/mdc3.12350
18、(16)neupro package insert
19、(17)claudia t,bryan k,et al.rotigotine effects on early morning motorfunction and sleep in parkinson’s disease:a double-blind,randomized,placebo-controlled study(recover).mov disord,2011;26(1):90-99.
20、(18)inbrija package insert
21、(19)robert a.hauser,et al.orally inhaled levodopa(cvt-301)for earlymorning off periods in parkinson's disease.parkinsonism and relateddisorders,https://doi.org/10.1016/j.parkreldis.2019.03.026.
22、(20)zibetti m,rizzone m,merola a,et al.sleep improvement withlevodopa-carbidopa intestinal gel infusion in parkinson disease.acta neurolscand 2013:127:e28–e32 doi:10.1111/ane.12075.)
23、如文献5-11显示随着帕金森病病程进展,患者在清晨会出现严重的晨僵症状(morning akinesia),这是因为夜间多巴胺储存不足。晨僵症状是pd患者最常见、最早发生的运动并发症,出现于约60%接受多巴胺治疗的pd患者,尤其是中晚期帕金森病,即hoehn-yahr分级为2.5-3的患者。晨僵症状的发生严重影响pd患者的日常活动,例如起床、穿衣、如厕、洗漱、服药等。晨僵还与餐后腹胀、腹部不适、早饱、恶心、呕吐、体重减轻和营养不良有关,以及产生胃肠功能失调,表现为口干、流涎、吞咽困难、食管动力紊乱、胃食管反流、胃瘫、便秘和排便障碍等。这些症状显著影响了pd患者的生活质量。
24、如文献12报道胃瘫会导致左旋多巴延迟输送到十二指肠,导致临床上出现左旋多巴用药后的延迟起效(on)现象。因此,我们可以推断,夜间无左旋多巴血药浓度导致多巴胺能功能下降、不足,从而产生晨僵症状和其他相关症状,如胃瘫,胃瘫又使得晨起服用左旋多巴延迟吸收起效,产生恶性循环。如文献13表明其他帕金森治疗药物如多巴胺能激动剂(普拉克索、罗替高汀、罗匹尼罗)、抗胆碱能药物(金刚烷胺),单胺氧化酶抑制剂(司来吉兰、雷沙吉兰、沙芬酰胺)、comt抑制剂(托卡朋、恩他卡朋)均会导致胃肠功能失调。
25、晨僵症状的现有治疗方案为清晨给予患者一个快速、有效的左旋多巴血药浓度,能缓解晨僵症状。但因胃排空时间、左旋多巴仅在胃肠道上段吸收、与氨基酸竞争性跨血脑屏障等药效学和药代动力学的原因,现有常规左旋多巴制剂由于半衰期短、不规则胃肠吸收以及竞争性通过血脑屏障等原因不能很好解决pd晨僵症状的治疗问题。
26、如文献14-15显示皮下注射阿朴吗啡制剂2004年在美国上市,用于帕金森病人出现的off发作的紧急、间歇治疗,对晨僵症状有一定作用,但因为晨僵状态导致患者运动功能受损,很难自行给药。给药后起效时间在30-60分钟,严重影响患者的生活自理。此外,皮下注射的常见副作用是发展出结节,其经常会受到感染,从而必须进行抗生素治疗或外科清创,且阿朴吗啡会引起呕吐,给药前常规需要加用止吐药。
27、如下文献16显示阿朴吗啡舌下膜剂2020年5月刚刚在美国上市,也是用于帕金森病人出现的off发作的紧急、间歇治疗。恶心、口咽部软组织水肿、疼痛和麻痹的不良反应发生率高。
28、如文献17-18显示罗替戈汀透皮贴剂2007年在美国上市,2018年在中国上市。作为多巴胺受体激动剂,罗替戈汀透皮贴剂对缓解晨僵症状和改善睡眠有一定的效果。但是,恶心、呕吐、嗜睡、皮肤过敏等不良反应限制了其使用。
29、如文献19-20显示左旋多巴吸入剂2018年在美国上市,fda批准可用于治疗off发作的紧急治疗,但因为需要使用特殊装置口吸,自行用药也有困难,并且其生物利用度低,根据说明书其cmax仅为口服速释制剂的50%,呼吸道不良反应发生率高达35%,且由于其有诱发支气管痉挛的风险,因此禁用于患有哮喘、慢阻肺(copd)或慢性肺部疾病的患者。
30、理论上,患者起床前需要一个较高浓度的左旋多巴,可以减少晨僵症状的发生。在现有条件下,如患者前一晚服用常规左旋多巴制剂(如),不仅无法维持有效血药浓度至清晨起床,而且因为快速释放产生的高浓度左旋多巴有一定的兴奋作用,可能影响患者的入睡。
31、临睡前给与左旋多巴可能影响入睡,但是入睡后提供一定浓度的左旋多巴可以缓解肌肉紧张僵直,对于提高睡眠质量可能有帮助。因此,需要一个延迟释放的控释剂型,保证患者晨起时达到左旋多巴有效血药浓度,减少晨僵症状的发生,并且能改善夜僵症状,从而改善患者的睡眠质量。虽然,如文献21显示持续左旋多巴十二指肠灌注(duodopa/duopa)对晨僵症状有一定治疗效果。但是,连续输注左旋多巴水凝胶2-4个月,pdss-2(pd-sleep-scale-version-2)总分和“睡眠障碍”、“夜间运动症状”和“夜间pd症状”的分项评分都显著降低,日间嗜睡的ess(epworth-sleeping-scale)值也有所改善。另外,该治疗对人体创伤太大,需要手术经由一根试管直接泵入上部小肠持续灌注,且治疗费用昂贵,患者适用范围比较窄。目前该药仅用于日间16个小时给药,夜间不给药。
32、因此,对于患者来讲,最理想的治疗方案还是非侵入性疗法。因此,临床急需开发一种非侵入性的延迟定时释放的控释产品,在晨起阶段提供pd患者有效的左旋多巴血药浓度缓解晨僵现象,使患者晨醒时处于“on”状态而不是“off”病状。
技术实现思路
1、本发明所要解决的技术问题是为了克服现有的含左旋多巴的控释型药物无法实现有效的延迟和延迟后持续释放,进而无法在晨起时维持左旋多巴有效血药浓度、缓解晨僵症状以及由此引起的其他相关症状的缺陷,为此,而提供了一种延迟定时释放的药物组合物及其制备方法和应用。本发明的药物组合物可以实现1-3小时的时滞后释放药物活性成分,并6-10小时达到峰浓度的效果;较佳地,还可实现2小时的时滞后释放药物活性成分,6-8小时达到峰浓度的效果,减少了晨僵的发生以及由此引起的其他相关症状。
2、本发明通过以下技术方案解决上述技术问题的。
3、本发明提供了一种药物组合物,其包括片芯,所述的片芯包括含药层和叠放在含药层上的助推层;所述的含药层包括药物活性成分;
4、所述的含药层中,所述的药物活性成分的含量为5-72.5wt%,所述的含量为药物活性成分在所述的含药层中的重量百分比;
5、所述的含药层中,所述的药物活性成分为左旋多巴或其衍生物、或、“左旋多巴或其衍生物”与多巴脱羧酶抑制剂的混合物;
6、当所述的药物活性成分为“左旋多巴或其衍生物”和多巴脱羧酶抑制剂的混合物时,所述的多巴脱羧酶抑制剂的含量为≤14.5wt%,但不为0,所述的含量为该组分在所述的含药层中的重量百分比;
7、所述的药物组合物的剂型为胶囊形片剂。
8、本发明中,所述的含药层中,所述的药物活性成分的含量优选为30-72.5wt%,例如31.5wt%、50wt%、53wt%、58wt%、59.6wt%、63wt%或68.1wt%。
9、本发明中,所述的含药层中,所述的左旋多巴或其衍生物的含量可以为本领域此类制剂中的常规含量,还可为27-63wt%,例如27.7wt%、31.5wt%、41.7wt%、46.9wt%、50wt%、51.1wt%、53.6wt%、55.5wt%或63wt%,所述的含量为该组分在所述的含药层中的重量百分比。
10、本发明中,所述的含药层中,所述的左旋多巴的衍生物可以为左旋多巴水合物、左旋多巴烷基酯、左旋多巴药学上可接受的盐、氘代左旋多巴烷基酯或氘代左旋多巴烷基酯的药学上可接受的盐。
11、本发明中,所述的含药层中,所述的多巴脱羧酶抑制剂的种类可以为卡比多巴水合物、卡比多巴药学上可接受的盐、苄丝肼或苄丝肼药学上可接受的盐,优选为,例如卡比多巴1水合物。
12、本发明中,所述的含药层中,当所述的药物活性成分为“左旋多巴或其衍生物”与多巴脱羧酶抑制剂时,所述的多巴脱羧酶抑制剂的含量可以为3.7-14.5wt%,例如3.75wt%、6.91wt%、7.5wt%、11.3wt%、12.7wt%或14.5wt%,所述的含量为该组分在所述的含药层中的重量百分比。
13、本发明中,所述的含药层还可包括药用辅料。所述的药用辅料可以此类制剂所用常规的药用辅料。
14、在本发明一优选实施方案中,所述的药用辅料可包括药物载体、填充剂、表面活性剂、润滑剂和抗氧化剂中的一种或多种,还可以包括“药物载体和润滑剂”、“药物载体、填充剂和润滑剂”、“药物载体、填充剂、表面活性剂和润滑剂”或“药物载体、填充剂、表面活性剂、抗氧化剂和润滑剂”。
15、其中,所述的药物载体的种类和含量可以为本领域此类制剂中的常规药物载体的种类和含量,所述的含量为该组分在所述的含药层中的重量百分比。
16、所述的药物载体可为聚维酮、共聚维酮、卡波姆、羟丙甲纤维素、羟丙纤维素、羟乙基纤维素、聚氧乙烯和海藻酸钠中的一种或多种,还可为聚维酮和羟丙纤维素的混合物或羟丙纤维素。
17、当所述的含药层包括药用辅料,所述的药用辅料包药物载体时,所述的药物载体的含量可为≤40wt%,但不为0,还可为10-40wt%,例如15wt%、16wt%、29.5wt%、30.0wt%、31wt%或38.5wt%。
18、当所述的药物载体为聚维酮和羟丙纤维素的混合物时,所述的羟丙纤维素与所述的聚维酮的重量比优选为(1-8):1,例如2.1:1、2.2:1、3.1:1、3.5:1或、7.1:1。
19、其中,所述的填充剂的种类和含量均可以为本领域此类制剂中的常规的种类和含量,所述的含量为该组分在所述的含药层中的重量百分比。
20、所述的填充剂可为自乳糖、淀粉、预胶化淀粉、糊精、甘露醇、山梨醇和微晶纤维素中的一种或多种,还可为山梨醇和乳糖的混合物、山梨醇和甘露醇的混合物、山梨醇或甘露醇。
21、当所述的含药层包括药用辅料,所述的药用辅料包括填充剂时,所述的填充剂的含量可为≤51wt%,但不为0,还可为5-51wt%,例如5wt%、8.5wt%、10wt%、15wt%、18wt%、19wt%、19.5wt%、20wt%、32wt%、41.5wt%或51wt%。
22、较佳地,所述的含药层中,当所述的药用辅料包括药物载体和填充剂时,所述的填充剂与所述的药物载体的重量比可以为(1-6):1,还可以为(1-2):1。
23、更佳地,当所述的药物载体为聚维酮和羟丙纤维素的混合物或羟丙纤维素,所述的填充剂为山梨醇、山梨醇和乳糖的混合物或山梨醇和甘露醇的混合物时,所述的填充剂中的山梨醇与所述的药物载体中的羟丙纤维素的重量比优选为(1-2):1,例如1:1、1.95:1或2:1。
24、其中,所述的表面活性剂的种类和含量均可以为本领域中此类制剂中常规的种类和含量,所述的含量均为该组分在所述的含药层中的重量百分比。
25、所述的表面活性剂可为聚山梨酯、泊洛沙姆、脂肪酸甘油酯、十二烷基苯磺酸钠和十二烷基硫酸钠的一种或多种,例如泊洛沙姆(407)。
26、当所述的含药层包括药用辅料,所述的药用辅料包括表面活性剂时,所述的表面活性剂的含量可为≤19wt%,但不为0,还可为5-19wt%,例如5wt%、10wt%或19wt%。
27、其中,所述的润滑剂的种类和含量均可以为本领域中此类制剂中常规的种类和含量,所述的含量均为该组分在所述的含药层中的重量百分比。
28、所述的润滑剂优选为硬脂酸、二氧化硅、硬脂酸镁、硬脂酸钙、聚乙二醇和硬脂富马酸钠的一种或多种,更优选为硬脂酸镁和/二氧化硅。
29、当所述的含药层包括药用辅料,所述的药用辅料包括润滑剂时,所述的润滑剂的含量可为≤2.5wt%,但不为0,还可为1-2.5wt%,例如1wt%或2.5wt%。
30、其中,所述的抗氧化剂的种类和含量均可以为本领域中此类制剂中常规的种类和含量,所述的含量均为该组分在所述的含药层中的重量百分比。
31、所述的抗氧化剂可为二丁基羟基甲苯、丁基羟基茴香醚、特丁基对苯二酚、没食子酸丙酯、维生素c和维生素e中的一种或多种,例如二丁基羟基甲苯。
32、当所述的含药层包括药用辅料,所述的药用辅料包括抗氧化剂时,所述的抗氧化剂的含量可为≤1.0wt%,但不为0,还可为0.1-0.5%,例如0.33wt%。
33、在本发明一优选方案中,所述的含药层包括如下任一组的组分:
34、(1)上述的药物活性成分、上述的药物载体和上述的润滑剂;
35、(2)上述的药物活性成分、上述的药物载体、上述的填充剂和上述的润滑剂;
36、(3)上述的药物活性成分、上述的药物载体、上述的填充剂、上述的表面活性剂和上述的润滑剂;
37、(4)上述的药物活性成分、上述的药物载体、上述的填充剂、上述的表面活性剂、上述的抗氧化剂和上述的润滑剂;
38、各组分的用量均同本发明所述。
39、在本发明一优选方案中,所述的含药层由如下任一组的组分组成:
40、(1)卡比多巴1水合物14.5wt%、左旋多巴53.6wt%、羟丙纤维素31.0wt%和硬脂酸镁1.0wt%;
41、(2)卡比多巴1水合物12.7wt%、左旋多巴46.9wt%、羟丙纤维素31wt%、甘露醇8.5wt%和硬脂酸镁1wt%;
42、(3)卡比多巴1水合物11.3wt%、左旋多巴41.7wt%、羟丙纤维素31wt%、甘露醇15wt%和硬脂酸镁0.5wt%;
43、(4)左旋多巴50wt%、羟丙纤维素31.0wt%、甘露醇18wt%和硬脂酸镁1wt%;
44、(5)左旋多巴63wt%、羟丙纤维素11wt%、山梨醇10.0wt%、聚维酮5wt%、泊洛沙姆10wt%和硬脂酸镁1wt%;
45、(6)左旋多巴31.5wt%、羟丙纤维素20wt%、山梨醇19wt%、聚维酮9.5wt%、泊洛沙姆19wt%和硬脂酸镁1wt%;
46、(7)左旋多巴31.5wt%、羟丙纤维素29wt%、山梨醇19wt%、聚维酮9.5wt%、泊洛沙姆10wt%和硬脂酸镁1wt%;
47、(8)左旋多巴63wt%、羟丙纤维素10wt%、山梨醇19.5wt%、泊洛沙姆5wt%、二氧化硅0.5wt%和硬脂酸镁2wt%;
48、(9)左旋多巴31.5wt%、乳糖31wt%、羟丙纤维素10wt%、山梨醇20wt%、泊洛沙姆(407)5wt%、二氧化硅0.5wt%和硬脂酸镁2wt%;
49、(10)卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素11wt%、山梨醇20wt%、泊洛沙姆(407)5wt%和硬脂酸镁1wt%;
50、(11)左旋多巴63.0wt%、羟丙纤维素14.8wt%、山梨醇14.8wt%、泊洛沙姆4075wt%、二氧化硅0.5wt%和硬脂酸镁2.0wt%;
51、(12)左旋多巴63.0wt%、羟丙纤维素11.8wt%、山梨醇17.7wt%、泊洛沙姆4075wt%、二氧化硅0.5wt%和硬脂酸镁2.0wt%;
52、(13)卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素10wt%、泊洛沙姆407 10wt%、山梨醇10wt%、聚维酮4.5wt%、硬脂酸镁2.0wt%和二氧化硅0.5wt%;
53、(14)卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素15wt%、山梨醇15wt%、聚维酮4.17wt%、二丁基羟基甲苯0.33wt%、硬脂酸镁2.0wt%和二氧化硅0.5wt%;
54、(15)卡比多巴1水合物6.91wt%、左旋多巴51.1wt%、羟丙纤维素30wt%、山梨醇5wt%、聚维酮4.19wt%、二丁基羟基甲苯0.31wt%、二氧化硅0.5wt%和硬脂酸镁2wt%;
55、(16)卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素10wt%、山梨醇10wt%、泊洛沙姆(407)10wt%、聚维酮4.17wt%、二丁基羟基甲苯0.33wt%、硬脂酸镁2.0wt%和二氧化硅0.5wt%;
56、(17)卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素15wt%、山梨醇15wt%、聚维酮4.17wt%、二丁基羟基甲苯0.33wt%、硬脂酸镁2.0wt%和二氧化硅0.5wt%;
57、(18)卡比多巴1水合物3.75wt%、左旋多巴27.7wt%、甘露醇31.5wt%、羟丙纤维素10wt%、泊洛沙姆(407)10wt%、山梨醇10wt%、聚维酮4.5wt%、二氧化硅0.5wt%和硬脂酸镁2wt%;
58、(19)卡比多巴1水合物3.75wt%、左旋多巴27.7wt%、羟丙纤维素10wt%、泊洛沙姆(407)10wt%、山梨醇41.5wt%、聚维酮4.5wt%、二氧化硅1.5wt%和硬脂酸镁2wt%。
59、本发明中,所述的助推层还可包括膨胀剂、渗透压促进剂、润滑剂和着色剂中的一种或多种,还可包括膨胀剂、渗透压促进剂、着色剂和润滑剂。
60、所述的膨胀剂、所述的渗透压促进剂、所述的着色剂和所述的润滑剂中的组分和含量均可以为本领域此类试剂的常规组分和含量,所述的含量为该组分在所述的助推层中的重量百分比。本发明特别优选如下的组分和含量:
61、其中,所述的膨胀剂可以为羧甲基淀粉钠、羟丙甲纤维素、羟丙纤维素、羧甲基纤维素钠(例如羧甲基纤维素钠(9h4xf))、羟乙基纤维素、卡波姆、海藻酸钠、卡拉胶和聚氧乙烯中的一种或多种,例如羧甲基纤维素钠和羟丙纤维素。
62、当所述的膨胀剂为羧甲基纤维素钠和羟丙纤维素时,所述的羧甲基纤维素钠与所述的羟丙纤维素的质量比优选为(2-4):1,例如2.5:1或3.5:1。
63、其中,所述的膨胀剂的含量可为25-89wt%,例如89wt%或69wt%。
64、其中,所述的渗透压促进剂可以为氯化钠、氯化钾、氯化镁、硫酸钠、硫酸镁、抗坏血酸、酒石酸、甘露醇、山梨醇、木糖醇、葡萄糖、乳糖和蔗糖中的一种或多种,例如山梨醇。
65、其中,所述的渗透压促进剂的含量可为10-70wt%,还可为10-30wt%,例如30wt%,所述的含量为该组分在所述的助推层中的重量百分比。
66、其中,所述的润滑剂可为硬脂酸、硬脂酸镁、硬脂酸钙、聚乙二醇和硬脂富马酸钠的一种或多种,例如硬脂酸镁。
67、其中,所述的润滑剂的含量可为0.1-3wt%,例如0.5wt%,所述的含量为该组分在所述的助推层中的重量百分比。
68、其中,所述的着色剂可为氧化铁红、氧化铁黄、氧化铁紫和氧化铁黑的一种或多种,例如氧化铁红。
69、其中,所述的着色剂的含量可为0.1-2wt%,例如0.5wt%,所述的含量为该组分在所述的助推层中的重量百分比。
70、在本发明一优选方案中,所述的助推层的由如下组的组分组成:
71、(1)羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
72、(2)羧甲纤维素钠69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
73、本发明中,所述的含药层与所述的助推层的重量比可以为(0.5-4):1,还可以为(2-3):1,例如2:1、2.5:1或2.8:1。
74、在本发明一优选方案中,所述的片芯包括如下任一组的组分:
75、(1)所述的含药层中:上述的药物活性成分、上述的药物载体和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;
76、(2)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;
77、(3)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的表面活性剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;
78、(4)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的表面活性剂、上述的抗氧化剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;
79、各组分的含量均同前所述。
80、在本发明一优选方案中,所述的片芯由如下任一组的组分组成:
81、(1)含药层中:卡比多巴1水合物14.5wt%、左旋多巴53.6wt%、羟丙纤维素31.0wt%和硬脂酸镁1.0wt%;
82、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
83、(2)含药层中:卡比多巴1水合物12.7wt%、左旋多巴46.9wt%、羟丙纤维素31wt%、甘露醇8.5wt%和硬脂酸镁1wt%;
84、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
85、(3)含药层中:卡比多巴1水合物11.3wt%、左旋多巴41.7wt%、羟丙纤维素31wt%、甘露醇15wt%和硬脂酸镁0.5wt%;
86、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
87、(4)含药层中:左旋多巴50wt%、羟丙纤维素31.0wt%、甘露醇18wt%和硬脂酸镁1wt%;
88、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
89、(5)含药层中:左旋多巴63wt%、羟丙纤维素11wt%、山梨醇10.0wt%、聚维酮5wt%、泊洛沙姆10wt%和硬脂酸镁1wt%;
90、羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
91、(6)含药层中:左旋多巴31.5wt%、羟丙纤维素20wt%、山梨醇19wt%、聚维酮9.5wt%、泊洛沙姆19wt%和硬脂酸镁1wt%;
92、助推层中:羧甲纤维素钠69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
93、(7)含药层中:左旋多巴31.5wt%、羟丙纤维素29wt%、山梨醇19wt%、聚维酮9.5wt%、泊洛沙姆10wt%和硬脂酸镁1wt%;
94、羧甲纤维素钠69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
95、(8)含药层中:左旋多巴31.5wt%、羟丙纤维素20wt%、山梨醇19wt%、聚维酮9.5wt%、泊洛沙姆19wt%和硬脂酸镁1wt%;
96、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
97、(9)含药层中:左旋多巴31.5wt%、羟丙纤维素29wt%、山梨醇19wt%、聚维酮9.5wt%、泊洛沙姆10wt%和硬脂酸镁1wt%;
98、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
99、(10)含药层中:左旋多巴63wt%、羟丙纤维素10wt%、山梨醇19.5wt%、泊洛沙姆5wt%、二氧化硅0.5wt%和硬脂酸镁2.0wt%;
100、助推层中:羧甲纤维素钠69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
101、(11)含药层中:左旋多巴31.5wt%、乳糖31wt%、羟丙纤维素10wt%、山梨醇20wt%、泊洛沙姆(407)5wt%、二氧化硅0.5wt%和硬脂酸镁2wt%;
102、助推层中:羧甲纤维素钠(9h4xf)69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
103、(12)含药层中:卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素11wt%、山梨醇20wt%、泊洛沙姆(407)5wt%和硬脂酸镁1wt%;
104、助推层中:羧甲纤维素钠(9h4xf)69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
105、(13)左旋多巴63.0wt%、羟丙纤维素14.8wt%、山梨醇14.8wt%、泊洛沙姆4075wt%、二氧化硅0.5wt%和硬脂酸镁2.0wt%;
106、助推层中:羧甲纤维素钠69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%;
107、(14)左旋多巴63.0wt%、羟丙纤维素11.8wt%、山梨醇17.7wt%、泊洛沙姆4075wt%、二氧化硅0.5wt%和硬脂酸镁2.0wt%;
108、助推层中:羧甲纤维素钠69wt%、山梨醇10wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
109、(15)卡比多巴1水合物7.50wt%、左旋多巴55.51wt%、羟丙纤维素10wt%、泊洛沙姆407 10wt%、山梨醇10wt%、聚维酮4.50wt%、硬脂酸镁2.0wt%和二氧化硅0.5wt%;
110、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
111、(16)卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素15wt%、山梨醇15wt%、聚维酮4.17wt%、二丁基羟基甲苯0.33wt%、硬脂酸镁2.0wt%和二氧化硅0.5wt%;
112、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
113、(17)卡比多巴1水合物6.91wt%、左旋多巴51.1wt%、羟丙纤维素30wt%、山梨醇5wt%、聚维酮4.19wt%、二丁基羟基甲苯0.31wt%、二氧化硅0.5wt%和硬脂酸镁2wt%;
114、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
115、(18)卡比多巴1水合物7.5wt%、左旋多巴55.5wt%、羟丙纤维素10wt%、泊洛沙姆10wt%、山梨醇10wt%、聚维酮4.17wt%、二丁基羟基甲苯0.33wt%、硬脂酸镁2wt%和二氧化硅0.5wt%;
116、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
117、(19)卡比多巴1水合物7.5wt%、左旋多巴55wt%、羟丙纤维素15wt%、山梨醇15wt%、聚维酮4.17wt%、二丁基羟基甲苯0.33wt%、二氧化硅0.5wt%和硬脂酸镁2wt%;
118、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
119、(20)卡比多巴1水合物3.75wt%、左旋多巴27.7wt%、甘露醇31.5wt%、羟丙纤维素10wt%、泊洛沙姆(407)10wt%、山梨醇10wt%、聚维酮4.5wt%、二氧化硅1.5wt%和硬脂酸镁2wt%;
120、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
121、(21)卡比多巴1水合物3.75wt%、左旋多巴27.7wt%、羟丙纤维素10wt%、泊洛沙姆(407)10wt%、山梨醇41.5wt%、聚维酮4.5wt%、二氧化硅1.5wt%和硬脂酸镁2wt%;
122、助推层中:羧甲纤维素钠49wt%、山梨醇30wt%、羟丙纤维素20wt%、氧化铁红0.5wt%和硬脂酸镁0.5wt%。
123、本发明中,所述的片芯可以为双层片(由一层含药层和一层叠放在含药层上的助推层组成)或三层片(依次由一层空白层、一层含药层和一层助推层组成),例如双层片。
124、本发明中,所述的片芯上还可包括包裹在片芯上的控释膜包衣。
125、其中,所述的控释膜包衣还可有一至多个释药孔(释药孔采用激光打孔法或机械打孔法打孔,例如1个释药孔、2个释药孔或3个释药孔)。较佳地,所述的释药孔的孔径为0.3mm-1.2mm,例如1.0mm。
126、其中,所述的控释膜包衣为半透衣膜,所述半透衣膜的成膜材料可为醋酸纤维素、乙基纤维素和丙烯酸树脂的一种或多种,例如为醋酸纤维素。所述的成膜材料的含量可为50-90wt%,还可为60-90wt%(例如60wt%、65wt%、70wt%或90wt%),所述的含量为该组分占所述的控释膜包衣的重量百分比。
127、较佳地,所述的半透衣膜还可包括致孔剂和增塑剂。
128、其中,所述的致孔剂可为聚乙二醇、甘油、聚维酮、共聚维酮和羟丙纤维素中的一种或多种,例如共聚维酮和羟丙纤维素(羟丙纤维素hxf)。
129、其中,所述的增塑剂可为聚乙二醇、邻苯二甲酸甲酯、邻苯二甲酸乙酯、癸二酸二丁酯、柠檬酸三乙酯、柠檬酸三丁酯、乙酰基柠檬酸三丁酯、甘油醋酸酯和蓖麻油中的一种或多种,例如聚乙二醇或柠檬酸三乙酯。
130、其中,所述的半透衣膜可包括醋酸纤维素和共聚维酮的混合物、“醋酸纤维素、羟丙纤维素hxf和柠檬酸三乙酯”的混合物、或、“醋酸纤维素和柠檬酸三乙酯”的混合物。
131、其中,所述的控释膜包衣与所述的片芯的重量比可为本领域常规的重量比,可为(2.0%-15.0%):1(例如6.6%:1、6.9%:1、7.0%:1、7.4%:1、7.6%:1、7.7%:1、7.8%:1、8.0%:1或8.4%:1);还可为(6.6%-8.4%):1,又可为(7.4%-7.8%):1。
132、本发明中,所述的片芯和所述的控释膜包衣之间还可包含一隔离衣层(隔离衣层包裹在所述片芯上,控释膜包衣包裹在所述隔离衣层上)
133、其中,所述的隔离衣层的成膜材料可为羟丙纤维素ef。
134、其中,所述的隔离衣层与所述的片芯的重量比可为本领域常规的重量比,可为(3.0%-5.0%):1例如4.0%:1。
135、本发明中,所述的药物组合物还可含有包覆于控释膜包衣外的含有药物活性成分的速释层。所述的药物组合物还可包括速释层。所述的速释层优选包括药物活性成分、粘合剂和抗氧化剂。所述的速释层还优选包括药物活性成分、增塑剂、抗氧剂和粘合剂。所述的速释层还优选为由药物活性成分抗氧剂和粘合剂组成、或者、由药物活性成分、增塑剂、抗氧剂和粘合剂组成。
136、当所述的速释层包括增塑剂时,所述的增塑剂的含量为本领常规的含量,优选为1-2-wt%。
137、当所述的速释层包括增塑剂时,所述的增塑剂可为聚乙二醇、邻苯二甲酸甲酯、邻苯二甲酸乙酯、癸二酸二丁酯、柠檬酸三乙酯、柠檬酸三丁酯、乙酰基柠檬酸三丁酯、甘油醋酸酯和蓖麻油中的一种或多种,例如柠檬酸三丁酯。
138、当所述的速释层包括抗氧剂时,所述的抗氧剂的含量为本领常规的含量,优选为3-4wt%,例如3.38wt%或3.81wt%。
139、当所述的速释层包括抗氧剂时,所述的抗氧剂可为二丁基羟基甲苯、叔丁基对羟基茴香醚、二丁基苯酚、维生素c、维生素e和亚硫酸钠中的一种或多种,例如二丁基羟基甲苯。
140、所述的粘合剂的含量为本领常规的含量,优选为10-20wt%。
141、所述的粘合剂可以为聚维酮、共聚维酮、羟丙纤维素和羟丙甲纤维素中的一种或多种,例如羟丙纤维素和共聚维酮(二者重量比例如1:1)的混合物或羟丙纤维素。
142、当所述的速释层包括药物活性成分时,所述的药物活性成分的含量为本领常规的含量,优选为70-90wt%,例如74.7wt%、75.7wt%、86.2wt%或85.3wt%。
143、当所述的速释层包括药物活性成分时,所述的药物活性成分包括多巴脱羧酶抑制剂。较佳地,所述的多巴脱羧酶抑制剂为卡比多巴水合物、卡比多巴药学上可接受的盐、苄丝肼或苄丝肼药学上可接受的盐,优选为卡比多巴水合物,例如卡比多巴1水合物。
144、在本发明一优选方案中,所述的速释层由如下任一组的组分组成:
145、(a)一水卡比多巴86.2wt%、羟丙纤维素10.0wt%和二丁基羟基甲苯3.84wt%;
146、(b)一水卡比多巴85.3wt%、羟丙纤维素10.0wt%、枸橼酸三乙酯1.02wt%和二丁基羟基甲苯3.81wt%;
147、(c)一水卡比多巴74.7wt%、羟丙纤维素10.0wt%、共聚维酮10.0、枸橼酸三乙酯2.00wt%和二丁基羟基甲苯3.38wt%;
148、(d)一水卡比多巴75.7wt%、羟丙纤维素10.0wt%、共聚维酮10.0wt%、枸橼酸三乙酯1.00wt%和二丁基羟基甲苯3.38wt%。
149、本发明中,所述的药物组合物还可含有包覆于控释膜包衣或速释层外的肠溶层。所述的肠溶层的材料可以为丙烯酸树脂或纤维素衍生物。所述的丙烯酸树脂优选为甲基丙烯酸和丙烯酸乙酯按照重量比1:1共聚而成的共聚物、甲基丙烯酸和甲基丙烯酸甲酯按照重量比1:1共聚而成的共聚物、甲基丙烯酸和丙烯酸乙酯按照重量比1:2共聚而成的共聚物、甲基丙烯酸、丙烯酸甲酯和甲基丙烯酸甲酯按照重量比1:1:1共聚而成的共聚物中的一种或多种。所述的纤维素衍生物优选为邻苯二甲酸醋酸纤维素、羟丙基甲基纤维素钛酸酯和醋酸羟丙基甲基纤维素琥珀酸酯中的一种或多种。
150、本发明中,所述的胶囊形片剂的形状可以为通过长径方向压片形成的胶囊形状或通过与长径垂直的方向压片形成的胶囊形状,例如通过长径方向压片形成的胶囊形状。
151、本发明中,所述的胶囊形片剂的横截面的形状可以为圆形或非圆形,例如圆形。
152、其中,当所述的胶囊形片剂的横截面的形状为圆形时,所述的圆形的直径可以为5-10mm(例如6mm、7mm或8mm),高度可为4-30mm(例如14.90mm、15.24mm、16.42mm或16.76mm);还可为,截面直径为5-7.5mm,高度为10-20mm。
153、其中,当所述的胶囊形片剂的横截面的形状为非圆形时,所述的非圆形可为具有对称轴的非圆形。所述的具有对称轴的非圆形的长轴的长度可为10-25mm,短轴的长度可为5-25mm;所述的具有对称轴的非圆形长轴的长度还可为16-19mm,短轴的长度还可为7-7.5mm。
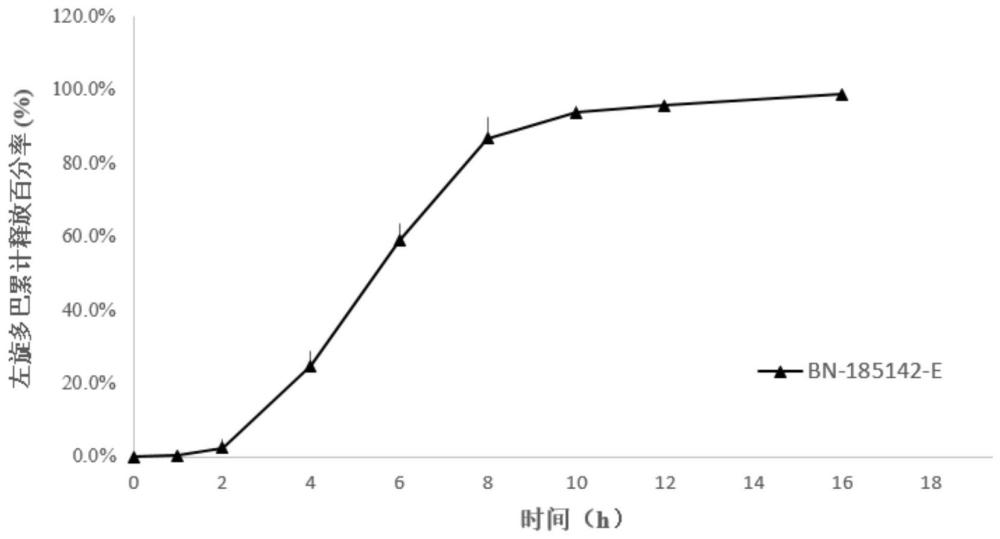
154、在本发明一优选方案中,所述的药物组合物为如下任一组:
155、(1)所述的含药层中:上述的药物活性成分、上述的药物载体和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;所述的胶囊形片剂的横截面的形状为非圆形(或者所述的胶囊形片剂的形状为通过与长径垂直的方向压片形成的胶囊形状);
156、(2)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;所述的胶囊形片剂的横截面的形状为非圆形(或者所述的胶囊形片剂的形状为通过与长径垂直的方向压片形成的胶囊形状);
157、(3)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的表面活性剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;所述的胶囊形片剂的横截面的形状为非圆形(或者所述的胶囊形片剂的形状为通过与长径垂直的方向压片形成的胶囊形状);
158、(4)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的抗氧化剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;所述的胶囊形片剂的横截面的形状为非圆形(或者所述的胶囊形片剂的形状为通过与长径垂直的方向压片形成的胶囊形状);
159、(5)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;所述的胶囊形片剂的横截面的形状为圆形(或者所述的胶囊形片剂的形状为通过长径方向压片形成的胶囊形状);
160、(6)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的表面活性剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;所述的胶囊形片剂的横截面的形状为圆形(或者所述的胶囊形片剂的形状为通过长径方向压片形成的胶囊形状);
161、(7)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的表面活性剂、上述的抗氧化剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;所述的胶囊形片剂的横截面的形状为圆形(或者所述的胶囊形片剂的形状为通过长径方向压片形成的胶囊形状);
162、各组分的含量均同前所述。
163、在本发明一优选方案中,所述的药物组合物为如下组(i)或(ii):
164、(i)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的抗氧化剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;
165、所述的速释层中:所述的药物活性成分、所述的粘合剂和所述的氧化剂;
166、所述的胶囊形片剂的横截面的形状为圆形(或者所述的胶囊形片剂的形状为通过长径方向压片形成的胶囊形状);
167、(ii)所述的含药层中:上述的药物活性成分、上述的药物载体、上述的填充剂、上述的抗氧化剂和上述的润滑剂;所述的助推层中:上述的膨胀剂、上述的渗透压促进剂、上述的着色剂和上述的润滑剂;
168、所述的速释层中:所述的药物活性成分、所述的粘合剂、所述的氧化剂和所述的增塑剂;
169、所述的胶囊形片剂的横截面的形状为圆形(或者所述的胶囊形片剂的形状为通过长径方向压片形成的胶囊形状)。
170、在本发明一优选方案中,所述的含药层中,所述的药物活性成分为左旋多巴;所述的左旋多巴的含量为27.7-63wt%;
171、所述的多巴脱羧酶抑制剂为卡比多巴或其水合物;所述的多巴脱羧酶抑制剂的含量为7.5-14.5wt%;
172、所述的含药层包括药用辅料,所述的药用辅料包括“药物载体、填充剂和润滑剂”、“药物载体、填充剂、表面活性剂和润滑剂”或“药物载体、填充剂、表面活性剂、抗氧化剂和润滑剂”;
173、所述的药物载体为“聚维酮和羟丙纤维素的混合物”或羟丙纤维素;所述的药物载体的含量为10-40wt%;所述的填充剂为山梨醇和乳糖的混合物、山梨醇和甘露醇的混合物或山梨醇;所述的填充剂的含量为8.5-20wt%;所述的填充剂中的山梨醇与所述的药物载体中的羟丙纤维素的重量比为(1-2):1;
174、所述的表面活性剂为泊洛沙姆;所述的表面活性剂的含量为5-19wt%;
175、所述的润滑剂为硬脂酸镁和/二氧化硅;所述的润滑剂的含量为1-2.5wt%;
176、所述的抗氧化剂为二丁基羟基甲苯;所述的抗氧化剂的含量为0.1-1.0%;
177、所述的胶囊形片剂的形状为通过长径方向压片形成的胶囊形状(或者所述的胶囊形片剂的横截面的形状为圆形)。
178、较佳地,所述的控释膜包衣与所述的片芯的重量比为(7.0%-8.0%):1,还可为:(7.4%-7.8%):1。
179、本发明中,所述的胶囊形片剂优选为控释片剂,例如渗透泵片。所述的控释片剂中的左旋多巴优选为125mg/片、150mg/片、250mg/片、375mg/片或500mg/片。本发明中,所述的药物组合物优选采用临睡前服药并服药后卧位的服药方式。
180、在本发明一优选方案中,所述的药物组合物,所述的含药层由上述的药物活性成分和上述的药用辅料组成。
181、本发明还提供了一种所述的药物组合物的制备方法,其包括下述步骤:
182、将所述的含药层的原料颗粒和所述助推层的原料颗粒叠放复合压制,形成所述的片芯,即可;
183、当所述的片芯上还包裹有控释膜包衣时,在所述的片芯上进行包衣,在所述的片芯上包裹所述控释膜包衣,在所述的含药层一侧的控释膜包衣上打孔形成释药孔。
184、当所述的药物组合物还可包括速释层时,在包裹所述控释膜包衣的胶囊形片剂上包裹所述的速释层包衣。
185、当所述的药物组合物还包含一隔离衣层时,先在所述片芯上包裹所述隔离衣层,然后在所述隔离衣层上包裹所述的包衣。
186、其中,所述的复合压制可以通过长径方向进行压制或者通过与长径方向垂直的方向进行压制。
187、其中,所述的含药层的原料颗粒可经本领域常规的制粒方法获得,例如采用干法制粒、湿法制粒、热熔制粒或流化床制粒得到所述的含药层的原料颗粒。
188、其中,所述的助推层的原料颗粒可经本领域常规的制粒方法获得,例如采用干法制粒、湿法制粒或流化床制粒得到所述的含药层的原料颗粒。
189、本发明还提供了一种上述的药物组合物在制备用于预防或治疗晨僵的药物中的应用。
190、所述的应用中,所述的晨僵优选为由帕金森病导致的晨僵。
191、所述的药物组合物型较佳地在1-3小时时滞后开始释放药物活性成分,所述的药物活性成分6-10小时达到峰浓度,血药浓度维持在50%峰浓度以上的时间达到5小时以上;更佳地在2小时时滞后开始释放药物活性成分,所述的药物活性成分6-10小时达到峰浓度,血药浓度维持在50%峰浓度以上的时间达到7小时以上。
192、所述的药物组合物的释放特征较佳地为:在开始释放前具有1-3小时的时滞(在这段时间,所述的药物活性成分的累计释放率≤10%);在开始释放后,所述的药物活性成分具有6-10小时累计85%以上释放率在(包括85%);更佳地在开始释放前,所述的药物活性成分具有2小时的延迟(在这段时间,药物活性成分的累计释放率≤10%);在开始释放后,所述的药物活性成分具有8小时累计85%以上释放率在(包括85%)。
193、本发明还提供了一种延迟定时释放的药物组合物,所述的物组合物的剂型为控释片;
194、所述的物组合物包括药物活性成分,所述的药物活性成分为左旋多巴或其衍生物、或、“左旋多巴或其衍生物”与多巴脱羧酶抑制剂的混合物;所述的组合物的释放(体外)特征为:在开始释放前,所述的药物活性成分具有1-3小时的时滞;在开始释放后,所述的药物活性成分具有6-10小时累计85%以上释放率在(包括85%);所述的时滞是指在这段时间,所述的药物活性成分的累计释放率≤10%。
195、较佳地,所述的药物活性成分的血药浓度维持在50%峰浓度以上的时间达到5小时以上;更佳地,所述的药物活性成分的血药浓度维持在50%峰浓度以上的时间达到7小时以上。
196、所述的药物组合物的释放特征较佳地为:在开始释放前,所述的药物活性成分具有2小时的时滞;在开始释放后,所述的药物活性成分具有8小时累计85%以上释放率在(包括85%)。
197、其中,所述的药物组合物优选采用临睡前服药并服药后卧位的服药方式。所述的药物组合物优选为上述的药物组合物。所述的药物组合物优选用于预防或治疗晨僵。所述的晨僵优选为帕金森病导致的晨僵。
198、其中,所述的药物组合物的组分均同前所述。
199、本发明还提供了一种预防或治疗晨僵的方法,其包括向受试者实施有效量的上述的药物组合物。
200、所述的方法中,所述的晨僵优选为帕金森病导致的晨僵。所述的药物组合物优选采用临睡前服药并服药后卧位的服药方式。
201、本发明中,“长径方向”是指与胶囊形片剂的对称轴中最长对称轴平行的方向。
202、本发明中,“横截面”是指与含药层和助推层形成的界面的平行面。
203、在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
204、本发明所用试剂和原料均市售可得。
205、本发明的积极进步效果在于:本发明的药物组合物具有如下优秀的控释效果:体外1-3小时的延迟,药物活性成分的累计释放率在10%以下;持续释放6-10小时,6-10小时累计释放率在85%以上,进一步地实现了体外2小时的延迟;药物活性成分的累计释放率在10%以下,持续释放8-10小时,8-10小时累计释放率在85%以上;
206、体内1-3小时的滞后,6-10小时达到峰浓度,血药浓度维持在50%峰浓度以上的时间达到5小时以上,尤其是时滞2小时后开始释放;
207、本发明的药物组合物能够实现了患者在前一天晚上睡前自行服药,晨起前血药浓度维持在最低有效浓度之上,使患者晨醒时处于“on”状态而不是“off”病状,减少晨僵的发生以及由此引起的其他相关症状。
本文地址:https://www.jishuxx.com/zhuanli/20240614/86627.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。