制备全基因组R-loop测序文库的方法
- 国知局
- 2024-06-20 11:24:43
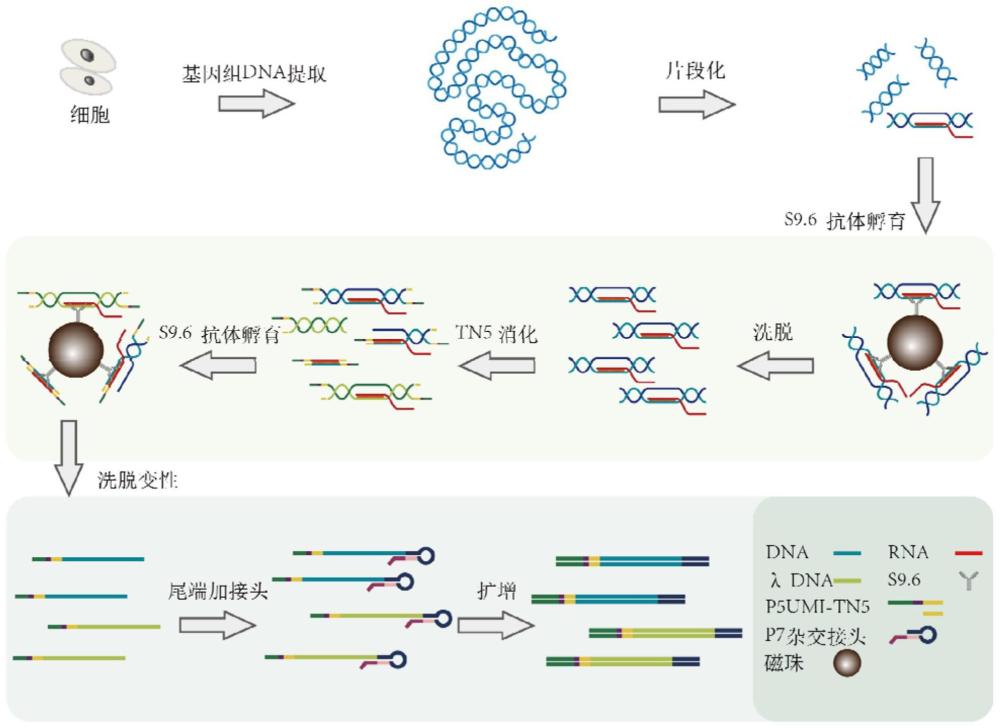
本发明涉及生物,具体涉及一种制备全基因组r-loop测序文库的方法、全基因组r-loop检测方法。
背景技术:
1、r-loop是一种特殊的核酸结构,区别于常见的双链dna以及单链rna,r-loop包含三条链:在一条双链dna的某个区域发生解链,其中一条dna链与互补的单链rna结合形成了dna/rna杂交链,而另一条dna链则处于单链状态,这个区域被称为r-loop。r-loop广泛存在于大多数生物的基因组中,例如在哺乳动物基因组中,r-loop占比可高达5%,并维持着相对的稳态(sanz l a,hartono s r,lim y w,et al.prevalent,dynamic,and conservedr-loop structures associate with specific epigenomic signatures in mammals[j].mol cell,2016,63(1):167-78.)。相较于常规的双链dna,dna/rna杂交链有着更高的稳定性,同时r-loop能提供单链dna和dna/rna杂交链,具备召集与其特异性结合的蛋白质的潜能。已有的研究显示r-loop具有维持基因组的稳定性,维持染色体的结构,维持重编程的稳态,调节基因转录等多种生物学过程。r-loop的多样性功能使其成为当前生物学研究的热点之一,对于进一步理解生命活动的分子机制和疾病的发生和发展具有重要意义。
2、为了研究r-loop的功能,需要对其进行建库测序,一个合适的建库方案对数据分析来说非常关键,这代表着数据能否贴近真实,因此需要尽可能高效高特异为目标进行建库方案的开发。r-loop建库始于2012年,ginno等人首次采用s9.6抗体进行免疫沉淀,捕获r-loop并构建双链dna文库(ginno p a,lott p l,christensen h c,et al.r-loopformation is a distinctive characteristic of unmethylated human cpg islandpromoters[j].mol cell,2012,45(6):814-25.)。随着技术发展,基于s9.6抗体的r-loop建库出现了使用重亚硫酸盐转换r-loop单链dna中的c为u,并在建库时切除产生链特异性的bisdrip-seq;使用r-loop中的rna进行rna建库的dripc-seq;基于dripc-seq使用rnase i处理的rdip-seq;使用s1核酸酶去除单链的s1-drip-seq;以及使用单链dna建库的ssdrip-seq。除了s9.6抗体,失活的rnase h也可以进行r-loop捕获,并衍生出了对应常规drip-seq的drive-seq;体内预表达失活rnase h的r-chip;预表达并使用mnase片段化的mapr;以及加上重亚硫酸盐转换的bismapr。此外还有结合tn5的cut&tag(周劲聪,王文杰,孙前文.三链染色质结构r-loop的研究进展:从检测方法到生物学功能[j].中国科学:生命科学,2023,53(3):289-303.)。但它们都存在一定的缺陷,drip-seq/s9.6-chip-seq/bischip-seq/s1-drip-seq/drive-seq/cut&tag皆采用双链dna建库方案,在r-loop位点会因为rna的存在出现信号丢失。dripc-seq/rdip-seq采用rna建库,但dsrna能被非特异性捕获,且难以去除,造成假阳性信号。r-chip/mapr/biasmapr在细胞内预表达失活rnase h,难以排除干扰细胞正常生命活动的可能。ssdrip-seq采用限制性酶切片段化dna,存在序列偏好,同时常规单链dna建库试剂盒效率较低。此外s9.6抗体存在非特异性结合dsdna的情况,易造成背景噪音。上述方案未涉及材料获取,部分样品杂质多,dna含量少,难以执行建库。
3、由于已有的方法存在各式各样的缺陷,它们产出的高通量r-loop数据也存在显著的差异,可信度和精确度仍待提高,严重影响了r-loop的分析(chen.j-y,lim.d-h,chen.l.systematic evaluation of different r-loop mapping methods:achievingconsensus,resolving discrepancies and uncovering distinct types of rna:dnahybrids[j].biorxiv,2022.)。因此,亟需建立一种新的r-loop建库方案,用以解决上述问题。
技术实现思路
1、本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提供一种制备全基因组r-loop测序文库的方法以及全基因组r-loop检测方法,本发明方法设计了链特异性建库方案,保留r-loop的方向信息,尽可能地提高建库效率,减少随机误差。
2、为此,本发明第一方面提供一种制备全基因组r-loop测序文库的方法。根据本发明的实施方案,所述方法包括:
3、(1)提取待测样本的基因组dna,纯化获得含有r-loop结构的dna样本;
4、(2)对所述dna样本进行一次片段化处理,获得片段化dna样本;
5、(3)对所述片段化dna样本进行一次免疫沉淀处理,获得纯化样本1;
6、(4)利用tn5酶对所述纯化样本1进行消化处理,二次片段化并连接p5接头;
7、(5)对经消化处理的样本进行二次免疫沉淀处理,获得纯化样本2;
8、(6)在所述纯化样本2中核酸的末端连接p7接头;
9、(7)对连接有p5、p7接头的dna样本进行pcr扩增,完成文库构建,
10、其中,所述一次免疫沉淀处理和二次免疫沉淀处理各自独立地利用失活rnase h或s9.6抗体与片段化dna样本中核酸结合。
11、本发明提供的制备全基因组r-loop测序文库的方法,采用两次免疫沉淀处理,相比采用一次ip,进一步降低了非特异性结合。一次ip能够去除绝大部分的不含有r-loop的dna,极大降低了tn5酶的用量,在利用tn5酶对样本进行消化处理后,进行二次ip能够去除非特异性结合的双链dna片段(不包含r-loop的片段)。
12、本发明提供的制备全基因组r-loop测序文库的方法,利用tn5酶对经一次ip纯化后的样本进行进一步的片段化处理,同时在5’端加上带umi的接头,用于测序后分析。
13、根据本发明的实施方案,步骤(1)中,在提取待测样本的基因组dna时,采用含有310-500mm氯化钠的裂解液与蛋白酶k进行待测样本的裂解处理,所述裂解液的ph为7-8。
14、发明人验证,在提取待测样本的基因组dna时,裂解液中加入310-500mm氯化钠,使得rnase a特异性消化单链rna,而不会消化r-loop。从而进一步提升构建的r-loop测序文库的质量。
15、根据本发明的实施方案,在提取待测样本的基因组dna时,采用含有盐酸胍的beads wash buffer进行洗脱。
16、发明人进一步开发了提取待测样本的基因组dna时的beads wash buffer,通过buffer中添加的盐酸胍,使得磁珠纯化能根据杂质含量增加洗涤次数而不损耗样品。
17、本发明通过进一步的对提取待测样本的基因组dna时的裂解液组分的优化和开发的beads wash buffer,使得本发明的构建文库的方法可以更广泛的兼容各种材料,优化后的极低损耗率可以兼容更少的投入量,同时搭配极高的特异性与随机片段化能更准确的检测r-loop的位点。
18、本发明通过对提取待测样本的基因组dna时的试剂与流程进行进一步的优化,使得该方法更加适合r-loop测序文库的构建,当在样本杂质很高,dna含量很低的情况下,经优化后的提取基因组dna的方式还能够提取出纯度较高的dna,同时能够保证极高的效率,能够去除非r-loop的rna(磁珠大小分选去除双链rna),能够保证更高的纯净度,可多次重复洗涤,且效率不变。
19、根据本发明的实施方案,所述盐酸胍的浓度为3-6m。
20、根据本发明的实施方案,所述裂解液进一步包括盐酸胍、tris-hcl、edta、tween-20以及triton x-100。
21、根据本发明的实施方案,所述裂解液进一步包括700-900mm盐酸胍、20-40mmtris-hcl、20-50mm edta、4-6%v/v tween-20以及0.3-0.7%v/v triton x-100。
22、根据本发明的实施方案,所述beads wash buffer进一步包括氯化钠、tris-hcl、edta、tween-20以及peg8000。
23、根据本发明的实施方案,所述beads wash buffer进一步包括0.5-1.25m氯化钠、5-20mm tris-hcl、0.5-5mm edta、0-0.05%v/v tween-20以及8-12%wt peg8000。
24、根据本发明的实施方案,步骤(2)中,对所述dna样本进行片段化时采用具有随机打断功能的片段化酶。
25、根据本发明的实施方案,所述待测样本包括未经交联、固定或冷冻处理的培养细胞样本、组织样本,或经过交联、固定或冷冻处理的培养细胞样本、组织样本。
26、根据本发明的实施方案,所述一次免疫沉淀处理和二次免疫沉淀处理中,采用结合有失活rnase h或s9.6抗体的磁珠与片段化的dna/rna杂交链结合。
27、根据本发明的实施方案,步骤(4)进一步包括:利用tn5酶对所述纯化样本1进行消化处理后,进一步片段化的dna的5’端加上了带umi的p5接头。
28、根据本发明的实施方案,步骤(6)进一步包括:
29、1)向所述纯化样本2中加入polyn-tn5-p7引物、dna连接酶以及5’脱腺苷酶;
30、2)将1)中反应体系在20-30℃条件下孵育1-2h;
31、3)向孵育结束后的体系中加入dnaclean beads,通过磁珠纯化处理以便获得连接有p5、p7接头的目标dna/rna杂交链。
32、根据本发明的实施方案,步骤(6)进一步包括:
33、a.将所述纯化样本2变性成单链,加入p7-hybrids-loop接头、atp、dna连接酶buffer、peg8000、rnase抑制剂以及splintr ligase,反应12-18h;
34、b.向反应结束后的体系中加入dna clean beads,利用磁珠纯化处理以便获得连接有p5、p7接头的目标单链dna,
35、其中,所述p7-hybrids-loop接头为茎环结构,包括固定序列、随机序列以及茎环序列,所述茎环序列与所述随机序列、固定序列顺次相连。
36、根据本发明的实施方案,所述随机序列长度为4-8nt。
37、根据本发明的实施方案,所述固定序列长度为8-16nt,所述固定序列不与单链dna模板配对结合。
38、本发明第二方面提供一种全基因组r-loop检测方法。根据本发明的实施方案,包括:
39、a.利用第一方面所述的制备全基因组r-loop测序文库的方法完成文库构建;
40、b.对构建的文库进行测序处理,并进行分析。
41、本发明建立了一个能广泛兼容各类材料,并准确且稳定的检测r-loop位点的建库方案。本发明开发了一个高效提基因组方案,能去除双链及单链rna,大量杂质,同时保留r-loop,并具有极高得率;本发明的建库方法选择恰当的片段化方案,减少序列偏好与样品损耗;本发明进一步优化了免疫沉淀流程,保证得率的同时尽可能地减少s9.6抗体非特异性结合;本发明设计了单链建库方案,保留链特异性,尽可能地提高建库效率,减少随机误差。
42、本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
本文地址:https://www.jishuxx.com/zhuanli/20240619/1491.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。