用类器官扩增肿瘤反应性免疫群体的方法
- 国知局
- 2024-06-20 11:31:21
背景技术:
1、癌症治疗范式现在成功地利用了抗肿瘤免疫。与对传染性病原体的强烈免疫反应相比,肿瘤浸润性淋巴细胞(til)和其他肿瘤驻留免疫细胞可能功能受损和失调,这种情况称为“t细胞耗竭”,其可以通过程序性细胞死亡-1(pd-1)和其他标记物如lag-3、tim-3和tigit的表达来举例说明,这些标记物也用作抑制性免疫检查点。黑色素瘤和各种其他癌症已经通过免疫检查点阻断(icb)进行治疗,对抗因pd-1和ctla-4而产生的免疫逃逸。
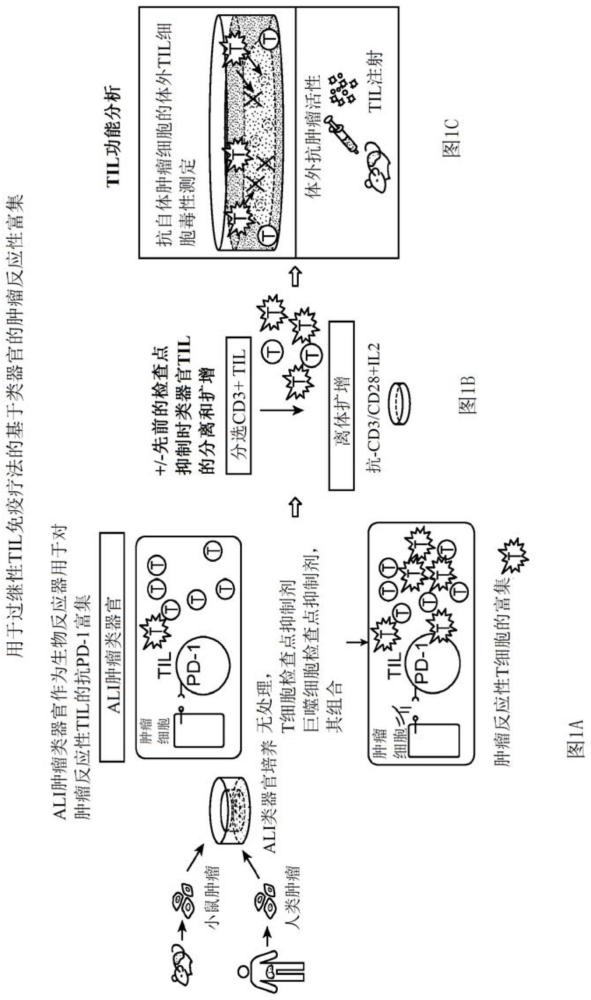
2、与此同时,用于实体瘤的过继性细胞转移(act)方法利用了肿瘤反应性t细胞的输注,t细胞受体(tcr)识别mhc结合的肽肿瘤抗原,尽管带有嵌合抗原tcr的car-t细胞的过继性转移尚未在实体瘤中显示出显著的成功。相比之下,从肿瘤提取til、体外扩增并自体再输注到患者体内的批量til方法在包括抗pd-1耐药患者和宫颈癌的未曾治疗和/或难治性黑色素瘤中表现出令人振奋的活性。然而,目前的批量til疗法不能选择性地富集肿瘤反应性til,而这是可以增强疗效的操作。同时努力表达肿瘤反应性tcr(tcr til)或通过增加新生抗原识别来富集肿瘤反应性til。
3、适当的体外系统将大大加快探索改善的免疫疗法。然而,利用肿瘤上皮和免疫间质两者进行体外肿瘤建模是一个艰巨的挑战,因为需要包括天然浸润性til和非淋巴细胞组分,如巨噬细胞和nk细胞。来自血液或患者肿瘤的免疫细胞仅用传统的非同基因2d癌细胞系重建为传统的单层或球体。最近的进展允许使用浸没的人工基质胶方法和外源生长因子将人类肿瘤生长为3d“类器官”,但此类类器官仅由肿瘤上皮组成,不包括肿瘤间质,除非用癌症相关成纤维细胞(caf)进行重建,并且不含有免疫细胞。
4、已将外周血淋巴细胞(pbl)用于得到对原发性肿瘤类器官培养物有反应性的t细胞系。另选地,已经将鼠巨噬细胞和其他人类免疫细胞类型与肿瘤细胞在短期培养中一起生长,或者在定制的微流体装置中生长为源自人类肿瘤悬浮物的微球体。然而,这些方法通常需要在肿瘤与免疫细胞之间进行人工重建,不表现出肿瘤微环境(tme)内免疫细胞(即t、b、巨噬细胞、nk)的完整多样性,并且通常不显示出抗肿瘤免疫。体内免疫疗法模型由于需要在免疫缺陷小鼠宿主中生长人类肿瘤(因此缺乏所研究的免疫组分)而受到阻碍。另选地,可以用人类免疫细胞重建免疫缺陷小鼠,尽管是以不完全和/或非同基因的方式。
5、本公开提供了用于产生三维气液界面类器官系统的方法,该系统将肿瘤与其内源性免疫细胞整体培养,并允许所存在的免疫细胞扩增。
技术实现思路
1、提供了用于产生和扩增肿瘤特异性免疫细胞的培养系统和方法。将源自患者的肿瘤类器官(pdo)与同源免疫细胞一起培养,为肿瘤反应性t细胞的功能富集提供生物反应器。在一些实施方案中,提供了用于培养通过体外免疫检查点抑制剂(ici)处理而活化的肿瘤反应性免疫细胞并与pdo一起培养的方法,该活化的细胞可以进一步扩增以用作免疫治疗剂,例如用于癌症的治疗。培养物还可以提供用于在肿瘤微环境中鉴定t细胞受体克隆型(tcr)的方法。
2、用于产生pdo的组织样品可以是从肿瘤活组织检查中采集的。产生用于本发明方法的活组织检查的肿瘤的癌症包括但不限于:实体瘤,例如透明细胞肾细胞癌、壶腹癌、皮肤scc、黑色素瘤、肺腺癌、非小肺细胞癌、胃肠癌、胰腺癌、结肠直肠癌、肝细胞癌、胆管癌、混合型肝细胞胆管癌、barrett食管癌、肠癌、前列腺癌、膀胱癌、乳腺癌、胶质母细胞瘤、皮肤鳞状细胞癌等。
3、本文描述的方法利用源自肿瘤活组织检查的组织的液气界面(ali)类器官体外培养物,其中培养物包含肿瘤细胞和从肿瘤活组织检查培养的免疫间质。在支持肿瘤和免疫细胞两者维持和活性的培养基上将组织进行培养。本公开的气液界面(ali)类器官可以包含用于启动培养的来自肿瘤组织的上皮和间质组分。ali方法允许将上皮和间质一起培养为内聚型三维单元,其再现了起源器官的功能和显微解剖结构,并且包括内源性免疫细胞。在ali中,充分的充氧是通过在转移小室(trans-well)(“内皿”)内培养包埋在胶原基质中的组织的微小碎片实现的,在转移小室中,从顶部获得直接的空气暴露;同时与包含在“外皿”中的组织培养基接触,经由转移小室渗透膜从底部获得。
4、培养物包含免疫细胞,特别是t细胞。感兴趣的t细胞亚群包括但不限于:cart细胞,初始cd8+t细胞,细胞毒性cd8+t细胞,初始cd4+t细胞,辅助性t细胞,例如th1、th2、th9、th11、th22、tfh;调节性t细胞(treg),例如tr1、自然treg、诱导型treg;记忆性t细胞,例如中央记忆性t细胞、干细胞记忆性t细胞(tscm)、效应记忆性t细胞、nk t细胞、γδt细胞等。在一些实施方案中,细胞包含免疫细胞的复杂混合物,例如从需要治疗的个体分离的肿瘤浸润性淋巴细胞(til)。
5、培养物可以包含添加用于活化培养物中存在的t细胞的外源性剂。活化t细胞并且可以添加到培养物中的剂可以包括例如:免疫检查点抑制剂,例如抑制以下项的活性的抗体的剂:ctla4(细胞毒性t淋巴细胞相关蛋白4,cd152)、pd1(又称为pd-1;程序性死亡因子1受体)、pd-l1、pd-l2、lag-3(淋巴细胞活化基因-3)、ox40、a2ar(腺苷a2a受体)、b7-h3(cd276)、b7-h4(vtcn1)、btla(b和t淋巴细胞衰减因子,cd272)、ido(吲哚胺2,3-双加氧酶)、kir(杀伤细胞免疫球蛋白样受体)、tim3(t细胞免疫球蛋白结构域和粘蛋白结构域3)、vista(t细胞活化的v结构域ig抑制因子)、il-2r(白细胞介素-2受体)、具有免疫球蛋白和itim结构域的t细胞免疫受体(tgit)等。在一些实施方案中,将活化t细胞的剂的组合添加到培养物中。剂的组合可以包括上文所列的任何剂中的两种或更多种的组合。活化策略可以包括逆转t细胞耗竭的方案,例如脉冲刺激、添加激酶抑制剂如达沙替尼等。t细胞可以通过预先阻断巨噬细胞吞噬抑制途径(即,“不要吃我”的信号)而被间接活化和扩增。因此,阻断巨噬细胞吞噬抑制分子如cd47和sirpα的相互作用的抗体可以增强对肿瘤细胞的吞噬作用,增加抗原向t细胞的呈递,从而间接活化和扩增t细胞。
6、当将pdo与直接或间接活化t细胞的剂一起培养时,可以将它们培养持续被认为是活化t细胞所必需的任何时间段。与活化t细胞的剂一起培养的时间可以至多2天、至多3天、至多4天、至多5天、至多6天、至多7天、至多8天、至多9天、至多10天或多于10天。与一种或多种t细胞活化剂培养后,可以对t细胞活化进行评估。活化的t细胞可以基于许多标准来鉴定和任选地定量。标准包括但不限于以下项的表达:cd3、cd25、cd69、cd137、cd107a、颗粒酶b(gzmb)、穿孔素1(prf1)等。可以基于这些活化标记物的表达来分离活化的t细胞。未活化的pdo培养物(即,未用t细胞活化剂处理的培养物)可以用作对照。
7、活化之后,t细胞可以进一步扩增。在一些实施方案中,t细胞的扩增通过使用快速扩增方案而发生。在一些实施方案中,快速扩增方案包括在非ali培养物中培养t细胞,例如在包含il-2、抗cd3抗体和辐照的同种异体基因外周血单核细胞(pbmc)饲养细胞的培养物中。在一些实施方案中,抗cd3抗体是单克隆okt3抗体。在一些实施方案中,使用快速扩增程序将t细胞扩增至多7天、至多8天、至多9天、至多10天、至多11天、至多12天、至多13天、至多14天、至多15天、至多16天、至多17天、至多18天、至多19天、至多20天、至多21天或更长时间。一旦扩增,接下来可以将有效剂量的t细胞施用于患者,包括但不限于从其得到pdo的患者,其中有效剂量可以是至少约102个细胞、至少约103个细胞、至少约104个细胞、至少约105个细胞、至少约106个细胞、至少约107个细胞或更多,可以通过肿瘤内注射等进行全身递送。
8、在一些实施方案中,对扩增的t细胞进行功能活性测定。如本领域已知的,功能活性测定包括但不限于t细胞毒性测定、il-2应答等。另选地,评估t细胞是否存在指示活化的标记物,例如cd3、cd25、cd69、cd137、cd107a、颗粒酶b(gzmb)、穿孔素1(prf1)的表达等。还可以在施用前对t细胞进行活化表型选择。
9、在一些实施方案中,提供了一种用于治疗个体中的癌症的方法,该方法包括在一种或多种t细胞活化剂的存在下,将源自患者的肿瘤类器官(pdo)与同源免疫细胞一起培养;活化之后扩增t细胞;以及将活化的t细胞施用于个体。在一些实施方案中,t细胞是自体的,在其他实施方案中,使用同种异基因的t细胞。在一些实施方案中,t细胞是肿瘤浸润性t细胞。在一些实施方案中,在施用前对t细胞进行选择以便活化。
本文地址:https://www.jishuxx.com/zhuanli/20240619/1642.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。