用纤连蛋白III型样结构域分子的靶向的制作方法
- 国知局
- 2024-07-27 12:28:18
相关申请的交叉引用
本申请要求2018年12月14日提交的美国临时申请号us62/598,652的优先权,其通过引用以其整体结合到本文中。
对电子提交的序列表的引用
本申请包含序列表,其通过efs-web作为ascii格式的序列表电子提交,序列表的文件名称为“689303.7wosequencelisting”,创建日期为2018年12月13日,并具有58kb的大小。通过efs-web提交的序列表是说明书的一部分,并且通过引用以其整体结合到本文中。
领域
本发明的实施方案涉及使用人纤连蛋白iii型样(fn3)结构域分子和/或结合epcam的fn3结构域分子来靶向递送治疗剂。在一些实施方案中,所述实施方案涉及fn3结构域分子用于递送核酸有效负载(缀合物)或其它药物活性有效负载的用途。核酸或其它有效负载被包封在与fn3结构域分子缔合的纳米颗粒中或与所述纳米颗粒缔合,或直接缀合至fn3结构域分子,以能够进行细胞特异性递送。
发明背景
核酸治疗剂是一类新的药物,有希望成为小分子、蛋白和疫苗之后的下一种主要治疗形式。核酸治疗剂包含各种寡核苷酸和多核苷酸有效负载以及必要的递送技术。迄今为止已经开发了多种核酸有效负载以导致基因敲减(例如,短干扰rna、dicer底物rna、短发夹rna、微小rna、反义寡核苷酸、u1衔接子等)、基因编辑(例如,剪接调节寡核苷酸、crispr/cas)和基因表达或上调(例如,mrna、pdna、mcdna等的递送)。本领域通常认为,为了实现其治疗潜力的形式,需要成功递送核酸有效负载到靶细胞的细胞质或细胞核内。将这样的有效负载靶向细胞表面抗原以便随后内化是一种进行有效细胞内递送的有希望的方法。短干扰rna(sirna)是具有治疗和预防多种疾病的巨大潜力的核酸治疗剂的实例。sirna是独特的,这是因为它们可被设计以匹配和沉默细胞内的任何基因。沉默基因可在生病组织中具有显著的治疗作用,范围从抗炎作用到完全消除肿瘤细胞。尽管临床前数据表明sirna将是一种治疗疾病的有力新方法,但体内递送这些sirna分子到生病组织具有挑战性以及对治疗功效的较大限制。
几个关键的属性限制核酸治疗剂的体内递送:(1)差的血清稳定性,(2)缺少膜通透性,和(3)免疫原性。由于这些限制,核酸通常与补充递送平台配对。例如,核酸(例如sirna和mrna)与纳米颗粒的配对已成为广泛采用的策略以体内保护核酸有效负载,同时改进它们到生病组织的递送,并且已见到sirna临床试验的显著增加(drugdiscovtodaytechnol.2012summer;9(2):e71-e174.)。
尽管纳米颗粒-sirna复合物已在临床前和早期临床试验中显示一定前景,但由于sirna递送至靶细胞的细胞内空间的效率低,它们的功效有限。进一步增强sirna-纳米颗粒的递送的新方法是用靶结合配体装饰纳米颗粒以增加sirna-np的特异性和加速细胞内化。这样的方法已证明在递送负载小分子的纳米颗粒中有效(procnatlacadsciusa.2006apr18;103(16)6315-20)和具有在sirna递送中提供类似益处的潜力。
最近,利用在纳米颗粒中包封的mrna的递送的临床候选物已进入临床试验,所述纳米颗粒提供保护免于在全身循环中有效负载的降解。然而,这种方法迄今为止主要受限于肝脏递送,突出了对于能够递送mrna到肝外组织中的下一代靶向平台的需要。
或者,已证实在生物流体中的稳定性的化学修饰的单链或双链寡核苷酸分子可用于制备具有靶向结构域的直接缀合物。递送这样的缀合物,包括sirna、反义寡核苷酸和微小rna模拟物和拮抗剂,已使用galnac,一种特异性结合无唾液酸糖蛋白受体(epcam)的糖分子(j.am.chem.soc.2014dec10;136(49)16958-16961)或肽(nucl.acidsres.2014oct;42(18)11805-11817)得到证实。最近,抗体rna缀合物已用一系列结合细胞表面受体并通过其内化的抗体进行研究(nucl.acids.res.2014dec30epub)。
用于递送核酸-缀合物或核酸-纳米颗粒复合物的理想的靶向配体具有几个关键的属性,包括但不限于高亲和力、高特异性、高稳定性、高效和位点特异性化学缀合和小尺寸。因此,对于递送核酸-缀合物或核酸-纳米颗粒复合物至靶细胞的改进方法和/或组合物,存在需要。
附图简述
本申请的优选实施方案的前面概述以及随后的详细描述,当结合附图阅读时将得到更好理解。然而应理解,本申请不限于附图中显示的准确实施方案。
专利或申请文件含有至少一幅彩色绘制的图。具有彩图的本专利或专利申请的副本将根据请求并支付必要的费用后由专利局提供。
图1a-1d显示流式细胞术直方图,证实了在h292细胞中tencon25(对照)-超顺磁氧化铁纳米颗粒(spion)、83v10-spion、83v12-spion和83v15-spion的结合,以及与tencon25对照或空白细胞相比,对应于83v10、83v12和83v15的向右正转移的峰。
图2显示所有四种样品(tencon25-spion、83v10-spion、83v12-spion和83v15-spion)的结合的定量比较。
图3显示通过与纳米颗粒偶联的fn3结构域分子的egfr磷酸化的抑制。
图4显示碘乙酰胺peg–mmaf的结构。
图5显示流式细胞术直方图,证实了抗-psma抗体与细胞系lncap、vcap、mda-pca-2b和pc3的结合。
图6显示每分子具有1、2、3或4个药物的抗-egfrcentyrin药物缀合物在nci-h292(上)和nci-h1573(下)肿瘤细胞中的体外细胞毒性。
图7显示用非靶向或靶向的centyrin药物缀合物或媒介物给药后h292-肿瘤异种移植物的生长动力学。
图8显示sec纯化后af647-标记的peg-plga-纳米颗粒的尺寸分布。
图9显示af647标记的83-centyrin靶向peg-plganp的受体密度依赖性和剂量依赖性结合和内化。
图10显示af647标记-83-centyrin(60x)至egfr-表达细胞系hcc827的细胞结合和内化。
图11显示malat1aso–centyrin缀合物的lcms表征结果。
图12显示在通过自由摄取用aso或centryin-aso处理的a431细胞中通过rt-pcr测量的malat1基因表达。
图13显示malat1-cd8368centyrin缀合物的lc-ms。
图14显示在通过自由摄取用aso或centryin-aso缀合物处理的原代t细胞中通过rt-pcr测量的malat1基因表达。
概述
本发明的实施方案提供了包含细胞相关靶向配体的fn3结构域分子的组合物,其可用于例如递送核酸治疗剂有效负载或其它有效负载;和产生这样的fn3结构域分子的方法。在一些实施方案中,活性部分是含有核酸分子的纳米颗粒,和fn3结构域分子与纳米颗粒直接或间接,例如通过共价键连接。在另一个实施方案中,活性部分是化学修饰的核酸分子,其经改造以共价连接至fn3结构域分子。
fn3结构域分子可基于来自人生腱蛋白(来自tenconfn3结构域,如美国专利号8,278,419中所述,通过引用以其整体并入本文;来自稳定的tenconfn3结构域,如美国专利号8,569,227中所述,通过引用以其整体并入本文;或来自具有可选结合表面的tencon分子,如美国专利号9,200,273中所述,通过引用以其整体并入本文)或来自其它纤连蛋白结构域(共有fn3结构域,如美国专利号8,293,482中所述,通过引用以其整体并入本文)的fn3结构域的共有序列。
在一些实施方案中,纳米颗粒包含环糊精纳米颗粒,所述环糊精纳米颗粒包含含有环糊精或改性的环糊精的聚合物。在其它实施方案中,纳米颗粒由聚合物基质组成,所述聚合物基质由两种或更多种聚合物组成。在又一个实施方案中,共聚物是plga或pla和peg的共聚物。在又一个实施方案中,聚合物基质包含plga或pla以及plga或pla和peg的共聚物。在一些实施方案中,纳米颗粒是脂质纳米颗粒或聚合物纳米颗粒。在一些实施方案中,纳米颗粒包含脂质体,其中脂质体双层膜含有用亲水聚合物衍生的囊泡形成脂质。在另一个实施方案中,纳米颗粒包含用亲水聚合物包覆的超顺磁氧化铁芯。在另一个实施方案中,纳米颗粒包含树枝状聚体。在进一步的实施方案中,纳米颗粒是包含至少一种脂质和乳化剂的固体脂质纳米颗粒。
在另一个实施方案中,fn3结构域分子是半胱氨酸改造的纤连蛋白iii型(fn3)结构域(如美国申请系列号14/512,801中所述,通过引用以其整体并入本文)。
本发明的另一方面是通过连接对细胞靶标具有结合特异性的fn3结构域分子与含有具有治疗活性的sirna分子的纳米颗粒并给予受试者或患者所述组合物来靶向细胞配体的方法。
在一些实施方案中,纳米颗粒是cdp或改性的cdp或固体脂质纳米颗粒,fn3结构域分子靶向前列腺特异性膜抗原(psma)或表皮生长因子受体(egfr),并且sirna对雄激素受体(ar)、egfr、kras或plk-1有活性。在一个特定的实施方案中,纳米颗粒是cdp或改性的cdp或固体脂质纳米颗粒,fn3结构域分子靶向psma,并且sirna对ar有活性。在另一个特定的实施方案中,纳米颗粒是cdp或改性的cdp或固体脂质纳米颗粒,fn3结构域分子靶向egfr或psma,并且sirna对egfr、kras或ar有活性。在又一个特定的实施方案中,缀合物是化学修饰的sirna,fn3结构域靶向egfr或psma,并且sirna对plk-1有活性。在一些实施方案中,fn3结构域是结合psma、egfr、epcam、cd22、bcma、cd33、cd71和/或cd8的结构域。在一些实施方案中,fn3结构域含有对不同分子具有特异性的多个结构域。
fn3结构域分子非常适合缀合,这是因为它们不含有半胱氨酸残基。因此,独特的半胱氨酸可通过定点诱变加入fn3结构域分子并使用简单的充分确立的化学用于位点特异性缀合。对于纳米颗粒靶向或核酸缀合物,位点特异性偶联是重要优点,这是因为它保证了靶向配体的定位,这对于适当的靶接合是关键的。对于靶向纳米颗粒,此处描述的三种技术(sirna、纳米颗粒、fn3结构域分子)的结合预期产生高度特异性的有效治疗剂用于基因沉默或基因递送。对于靶向核酸缀合物,优化的rna化学和fn3结构域分子的组合预期产生高度特异性的有效治疗剂用于基因沉默。
详细描述
如本文所用,术语“纤连蛋白iii型(fn3)样结构域”(fn3结构域)是指在蛋白中频繁出现的结构域,所述蛋白包括纤连蛋白、生腱蛋白、细胞内细胞骨架蛋白、细胞因子受体和原核酶(bork和doolittle,procnatacadsciusa89:8990-8994,1992;meinke等人,jbacteriol175:1910-1918,1993;watanabe等人,jbiolchem265:15659-15665,1990)。示例性fn3结构域是存在于人生腱蛋白c中15个不同的fn3结构域、存在于人纤连蛋白(fn)中15个不同的fn3结构域、以及非天然合成fn3结构域,如例如美国专利公布2010/0216708中所述。单独的fn3结构域通过结构域编号和蛋白名称来表示,例如,生腱蛋白的第三fn3结构域(tn3),或纤连蛋白的第十fn3结构域(fn10)。
如本文所用,术语“取代”或“取代的”或“突变”或“突变的”是指在多肽或多核苷酸序列中改变、缺失或插入一个或多个氨基酸或核苷酸以生成该序列的变体。
如本文所用,术语“使随机化”或“随机化的”或“多样化的”或“使多样化”是指在多核苷酸或多肽序列中进行至少一处取代、插入或缺失。
如本文所用,“变体”是指因一处或多处修改(例如取代、插入或缺失)而不同于参考多肽或参考多核苷酸的多肽或多核苷酸。
如本文所用,术语“特异性地结合”或“特异性结合”是指本发明的fn3结构域以1×10-6m或更低(例如1×10-7m或更低、1×10-8m或更低、1×10-9m或更低、1×10-10m或更低、1×10-11m或更低、1×10-12m或更低、或1×10-13m或更低)的解离常数(kd)结合到预定抗原的能力。通常,本发明的fn3结构域以其对于非特异性抗原(例如bsa或酪蛋白)的kd的至多1/10的kd结合到预定抗原,如通过使用例如proteon仪器(biorad)的表面等离子体共振所测得。
术语“文库”是指变体的集合。文库可由多肽或多核苷酸变体构成。
如本文所用,术语“稳定性”是指在生理条件下分子保持折叠状态以使得其保持至少一种其正常功能活性例如结合到预定抗原的能力。
如本文所用,“tencon”是指具有美国专利号8,278,419中所述的序列的合成纤连蛋白iii型(fn3)结构域。
术语“载体”是指能够在生物系统内复制或可以在此类系统间移动的多核苷酸。载体多核苷酸通常含有诸如复制起点、聚腺苷酸化信号或选择标记之类的元件,其功能是促进这些多核苷酸在生物系统中的复制或保持。此类生物系统的示例可包括细胞、病毒、动物、植物和用能够复制载体的生物组分再造的生物系统。包含载体的多核苷酸可为dna或rna分子或这些分子的杂合分子。
术语“表达载体”是指可用于在生物系统或再造生物系统中指导由存在于表达载体中的多核苷酸序列所编码的多肽的翻译的载体。
术语“多核苷酸”是指包含由糖-磷酸主链或其它等同的共价化学方式所共价连接的核苷酸链的分子。双链dna和单链dna以及双链rna和单链rna是多核苷酸的典型示例。
术语“多肽”或“蛋白”是指包含至少两个由肽键连接以形成多肽的氨基酸残基的分子。少于约50个氨基酸的小多肽可以称作“肽”。
如本文所用,“价”是指在分子中存在对于抗原为特异性的结合位点的指定数目。因此,术语“单价”、“二价”、“四价”、和“六价”分别是指在分子中存在对于抗原为特异性的一个、两个、四个和六个结合位点。
如本文所用,“混合物”是指未共价连接在一起的两个或更多个fn3结构域的样品或制备物。混合物可由两个或更多个相同fn3结构域或不同fn3结构域组成。
为了本发明的目的,纳米颗粒可包含聚合物基质。在一个实施方案中,聚合物基质包含两种或更多种聚合物。在另一个实施方案中,聚合物基质包含聚乙烯、聚碳酸酯、聚酐、聚羟基酸、聚丙基富马酸酯、聚己内酯、聚酰胺、聚缩醛、聚醚、聚酯、聚(原酸酯)、聚氰基丙烯酸酯、聚乙烯醇、聚氨酯、聚磷腈、聚丙烯酸酯、聚甲基丙烯酸酯、聚氰基丙烯酸酯、聚脲、聚苯乙烯或聚胺或其组合。在又一个实施方案中,聚合物基质包含一种或多种聚酯、聚酐、聚醚、聚氨酯、聚甲基丙烯酸酯、聚丙烯酸酯或聚氰基丙烯酸酯。在另一个实施方案中,至少一种聚合物是聚亚烷基二醇。在又一个实施方案中,至少一种聚合物是聚酯。在另一个实施方案中,聚酯选自plga、pla、pga和聚己内酯。在另一个实施方案中,聚合物基质可由cdp或改性的cdppeg聚合物组成。在另一个实施方案中,纳米颗粒可包含脂质分子。在另一个实施方案中,纳米颗粒可包含固体脂质纳米颗粒。
物质组合物
本发明提供了单特异性和多特异性(例如,双特异性)fn3结构域,其具有对细胞靶标的结合特异性,并键合至含有活性sirna分子的cdp或改性的cdp或固体脂质纳米颗粒,或者直接缀合至化学修饰的sirna分子。
从基于tencon序列的文库分离fn3结构域
tencon是由来自人生腱蛋白-c的十五个fn3结构域的共有序列设计的非天然存在的纤连蛋白iii型(fn3)结构域(jacobs等人,proteinengineering,design,andselection,25:107-117,2012;美国专利公开号2010/0216708)。tencon的晶体结构示出六个表面暴露环,这些环连接七个β-链作为fn3结构域的特性,所述β-链称为a、b、c、d、e、f和g,并且所述环称为ab、bc、cd、de、ef和fg环(bork和doolittle,procnatlacadsciusa89:8990-8992,1992;美国专利号6,673,901)。这些环或每个环中所选择的残基可随机化,以便构建可用于选择新型分子的纤连蛋白iii型(fn3)结构域文库,所述新型分子结合可用于活性剂(例如含有sirna的cdp或改性的cdppeg或固体脂质纳米颗粒)的靶向的细胞蛋白和核苷酸。
基于tencon序列的文库设计因此可具有随机化的fg环或随机化的bc和fg环,诸如文库tcl1或tcl2,如下所述。tenconbc环的长度为7个氨基酸,因此1、2、3、4、5、6或7个氨基酸可在bc环处多样化的文库中随机化并且根据tencon序列设计。tenconfg环的长度为7个氨基酸,因此1、2、3、4、5、6或7个氨基酸可在fg环处多样化的文库中随机化并且根据tencon序列设计。tencon文库中的环处的进一步多样性可通过环处残基的插入和/或缺失来实现。例如,fg和/或bc环可延伸1-22个氨基酸,或减少1-3个氨基酸。tencon中的fg环的长度为7个氨基酸,而抗体重链中的相应环在4-28个残基的范围内。为了提供最大的多样性,fg环在序列以及长度方面可为多样化的以对应于4-28个残基的抗体cdr3长度范围。例如,fg环在长度方面可通过将环延伸额外的1、2、3、4或5个氨基酸进一步多样化。
根据tencon序列的文库设计也可具有随机化可选表面,所述表面形成在fn3结构域的侧面上并且包含两条或更多条β链,以及至少一个环。一个这样的可选表面由cβ-链和fβ-链以及cd环和fg环中的氨基酸形成(c-cd-f-fg表面)。
基于tencon序列设计的文库还包括基于tencon变体设计的文库,诸如在第11位、第14位、第17位、第37位、第46位、第73位或第86位残基处具有取代的tencon变体,并且所述变体显示出改善的热稳定性。示例性tencon变体在美国专利公开号2011/0274623中有所描述,并且包括tencon27,与基础tencon序列相比时,所述tencon27具有取代e11r、l17a、n46v、e86i。
表1
可使用随机的或定义的氨基酸集合在所选残基位置处使基于tencon和其它fn3序列的文库随机化。例如,可使用nnk密码子(其编码所有20种天然存在的氨基酸)产生具有随机取代的文库中的变体。在其它多样化方案中,dvk密码子可用于编码氨基酸ala、trp、tyr、lys、thr、asn、lys、ser、arg、asp、glu、gly和cys。另选地,nns密码子可用于产生所有20种氨基酸残基并同时降低终止密码子的频率。可例如使用slonomics®技术(http:_//www_sloning_com)来合成在待多样化的位置具有偏向氨基酸分布的fn3结构域文库。这种技术使用预先制备的双链三体的文库,其用作对于成千上万的基因合成工艺而言为足够的通用构建模块。该三体文库代表对构建任何期望的dna分子所必需的所有可能的序列组合。密码子命名根据熟知的iub密码。
特异性地结合用于靶向的细胞蛋白或核苷酸的fn3结构域可通过以下所述分离:使用顺式展示产生fn3文库(诸如tencon文库)以将编码骨架蛋白的dna片段连接至编码repa的dna片段,从而生成在体外翻译之后形成的蛋白-dna复合物池,其中每种蛋白与编码其的dna稳定关联(美国专利号7,842,476;odegrip等人,procnatlacadsciusa101,2806-2810,2004);以及通过本领域已知以及实施例中描述的任何方法针对与目的蛋白或核苷酸的特异性结合对文库进行分析。可被使用的示例性熟知的方法为elisa、夹心免疫测定以及竞争性和非竞争性测定(参见例如ausubel等人编辑,1994,currentprotocolsinmolecularbiology,第1卷,johnwiley&sons,inc.,newyork)。所识别的特异性地结合目的蛋白或核苷酸的fn3结构域针对其活性进一步表征。
可使用任何fn3结构域作为模板以生成文库,并使用本文中提供的方法筛选文库中特异性地结合目的蛋白或核苷酸的分子,从而生成特异性地结合目的蛋白或核苷酸的fn3结构域。可被使用的示例性fn3结构域为生腱蛋白c的第三fn3结构域、fibcon以及纤连蛋白的第十fn3结构域。标准的克隆和表达技术用于将文库克隆到载体中或合成文库的双链cdna盒,以在体外表达或翻译文库。可使用例如核糖体展示(hanes和pluckthun,procnatlacadsciusa,94,4937-4942,1997)、mrna展示(roberts和szostak,procnatlacadsciusa,94,12297-12302,1997)或其它无细胞系统(美国专利号5,643,76)。fn3结构域变体的文库可表达为展示在例如任何合适的噬菌体的表面上的融合蛋白。用于在噬菌体的表面上展示融合多肽的方法是熟知的(美国专利公开号2011/0118144、国际专利公开号wo2009/085462、美国专利号6,969,108、美国专利号6,172,197、美国专利号5,223,409、美国专利号6,582,915、美国专利号6,472,147)。
特异性地结合目的蛋白或核苷酸的fn3结构域可被修饰以改善其特性,诸如改善热稳定性以及热折叠和解折叠的可逆性。多种方法已应用于增加蛋白和酶的表观热稳定性,包括基于与高度相似的热稳定序列比较的合理设计、稳定二硫桥的设计、增加α-螺旋倾向的突变、对盐桥进行工程改造、蛋白表面电荷的改变、定向进化和共有序列的构成(lehmann和wyss,curropinbiotechnol,12,371-375,2001)。高度的热稳定性可增加所表达蛋白的产量、改善溶解度或活性、降低免疫原性并且使生产中对冷链的需要最小化。可被取代以改善tencon的热稳定性的残基为第11位、第14位、第17位、第37位、第46位、第73位或第86位残基,并且在美国专利公开号2011/0274623中有所描述。对应于这些残基的取代可结合到fn3结构域或包含fn3结构域的双特异性分子中。
蛋白稳定性和蛋白易变性的测量可视为蛋白完整性的相同或不同方面。蛋白对由热、由紫外线或电离辐射、环境同渗容摩和ph(如果在液体溶液中)的变化、由小孔径过滤施加的机械剪切力、紫外线辐射、电离辐射(诸如由γ辐射)、化学或热脱水或任何其它可造成蛋白结构破坏的作用或力引起的变性敏感或“易变”。可使用标准方法测定分子的稳定性。例如,可通过使用标准方法测量热熔融(“tm”)温度,即一半的分子变为解折叠的以摄氏度(℃)表示的温度来测定分子的稳定性。通常,tm越高,分子越稳定。除了热之外,化学环境也改变蛋白的稳定性以维持特定的三维结构。
在一个实施方案中,由tm的增加所测得,与工程改造之前的相同结构域相比,结合目的蛋白或核苷酸的fn3结构域表现出稳定性增加至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%或更多。
化学变性同样可通过多种方法测量。化学变性剂包括盐酸胍、硫氰酸胍、脲、丙酮、有机溶剂(dmf、苯、乙腈)、盐(硫酸铵、溴化锂、氯化锂、溴化钠、氯化钙、氯化钠)、还原剂(例如,二硫苏糖醇、β-巯基乙醇、二硝基硫苯和氢化物,诸如硼氢化钠)、非离子型和离子型去污剂、酸(例如,盐酸(hcl)、乙酸(ch3cooh)、卤代乙酸)、疏水性分子(例如,磷脂)和靶向变性剂。变性程度的定量可依赖于功能特性的丧失,诸如结合靶分子的能力,或通过物理化学特性定量,诸如聚集的趋势、先前溶剂不可及的残基的暴露或者二硫键的破坏或形成。
在一个实施方案中,如通过使用盐酸胍作为化学变性剂所测得,与工程改造之前的相同骨架相比,结合目的蛋白或核苷酸的fn3结构域表现出至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%或更多的增加的稳定性。使用熟知的方法,在用增加浓度的盐酸胍处理后,增加的稳定性可被测量为降低的色氨酸荧光的函数。
fn3结构域可以单体、二聚体或多聚体,例如作为增加化合价和因此靶分子结合的亲和力的方式,或作为产生同时结合两种或多种不同的靶分子双特异性或多特异性骨架的方式生成。二聚体和多聚体可由例如通过纳入氨基酸接头如含有聚甘氨酸、甘氨酸和丝氨酸或丙氨酸和脯氨酸的接头而连接单特异性、双特异性或多特异性蛋白骨架来生成。示例性接头包括(gs)2接头、(ggggs)5接头、(ap)2接头、(ap)5接头、(ap)10接头、(ap)20接头、a(eaaak)5aaa接头。二聚体和多聚体可沿n-方向至c-方向彼此连接。使用天然存在的以及人工肽接头将多肽连接成新型连接的融合多肽在文献中是熟知的(hallewell等人,jbiolchem264,5260-5268,1989;alfthan等人,proteineng.8,725-731,1995;robinson和sauer,biochemistry35,109-116,1996;美国专利号5,856,456)。另外,fn3结构域可使用相同或类似的材料和方法与含有sirna的纳米颗粒连接,如本领域已知的。
包含fn3结构域的分子的变体在本发明的范围内。例如,取代可在包含fn3结构域的分子中进行,只要所得变体在与亲本分子相比时保持对目的蛋白或核苷酸的相似选择性和功效。示例性修饰为例如保守取代,其将导致变体具有与亲本分子的那些变体相似的特性。保守置换是在其侧链中相关的氨基酸家族内发生的那些。基因编码的氨基酸可被分为四类:(1)酸性(天冬氨酸、谷氨酸);(2)碱性(赖氨酸、精氨酸、组氨酸);(3)非极性(丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸);以及(4)非荷电极性(甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸)。苯丙氨酸、色氨酸和酪氨酸有时被共同分类为芳族氨基酸。另选地,氨基酸所有组成成分可以分组为:(1)酸性(天冬氨酸、谷氨酸);(2)碱性(赖氨酸、精氨酸、组氨酸)、(3)脂族的(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸),其中丝氨酸和苏氨酸任选地分别分组为含羟基脂族的;(4)芳族(苯丙氨酸、酪氨酸、色氨酸);(5)酰胺(天冬酰胺、谷氨酰胺);和(6)含硫(半胱氨酸和甲硫氨酸)(stryer(编辑),biochemistry,第2版,whfreemanandco.,1981)。可对包含fn3结构域的分子进行非保守取代,这涉及取代不同种类的氨基酸之间的氨基酸残基以改善双特异性分子的特性。可以使用本文描述的测定通过评估修饰的多肽或片段以类似于未经修饰的多肽或片段的方式产生应答的能力,容易地测定多肽或其片段的氨基酸序列中的变化是否导致功能同系物。其中已发生超过一个置换的肽、多肽或蛋白可以容易地以相同方式进行测试。
半衰期延长部分
包含fn3结构域的分子可例如通过共价相互作用结合其它亚基。在本发明的一个方面,包含fn3结构域的分子还包含半衰期延长部分。示例性半衰期延长部分为白蛋白、白蛋白-结合蛋白和/或结构域、转铁蛋白或转铁蛋白结合结构域及其片段和类似物,以及fc区。
抗体恒定区结构域的全部或一部分可被附接到本发明的分子以赋予抗体样特性,特别是与fc区域相关联的那些特性,诸如fc效应子功能诸如clq结合、补体依赖性细胞毒性(cdc)、fc受体结合、抗体依赖性细胞介导的细胞毒性(adcc)、吞噬作用、细胞表面受体(例如,b细胞受体;bcr)的下调,并且可通过对负责这些活性的fc中的残基进行修饰来进一步修饰(用于综述;参见strohl,curropinbiotechnol.20,685-691,2009)。
另外的部分可结合到本发明的双特异性分子中,诸如用于期望特性的聚乙二醇(peg)分子,如peg5000或peg20,000;不同链长的脂肪酸和脂肪酸酯,如月桂酸酯、肉豆蔻酸酯、硬脂酸酯、花生酸酯、二十二烷酸酯、油酸酯、花生四烯酸、辛二酸、十四烷二酸、十八烷二酸、二十二烷二酸等、聚赖氨酸、辛烷、糖类(葡聚糖、纤维素、寡糖或多糖)。这些部分可与蛋白骨架编码序列直接融合并且可通过标准的克隆和表达技术产生。另选地,熟知的化学偶联方法可用于将这些部分附接到本发明的重组制备分子。
可通过使用熟知的方法将半胱氨酸残基结合到分子的c-端并将peg基团附接到半胱氨酸来将peg部分例如添加到fn3结构域分子。
多核苷酸、载体、宿主细胞
本发明以分离的多核苷酸或表达载体的部分或线性dna序列的部分的形式提供编码fn3结构域的核酸,包括用于体外转录/翻译的线性dna序列,与组合物或其定向诱变剂的原核、真核或丝状噬菌体表达、分泌和/或展示相容的载体。
在一些实施方案中,分离的多核苷酸编码本文提供的fn3结构域。在一些实施方案中,fn3是结合epcam的fn3结构域。在一些实施方案中,fn3结构域包含如本文所述的seqid:1-6、8-11、14-38和40-46的氨基酸序列或其变体。在一些实施方案中,结合epcam的fn3结构域包含14-38的序列或其变体。
多核苷酸可以通过化学合成(诸如在自动化多核苷酸合成仪上的固相多核苷酸合成)来生产,并装配成完整的单链或双链分子。另选地,多核苷酸可以通过其它技术来制备,诸如pcr之后进行常规克隆。制备或获得具有给定的已知序列的多核苷酸的技术是本领域熟知的。
多核苷酸可包含至少一个非编码序列,诸如启动子或增强子序列、内含子、聚腺苷酸化信号、促进repa结合的顺式序列等。多核苷酸序列还可包含编码另外的氨基酸的另外的序列,其编码例如标记或标签序列诸如组氨酸标签或ha标签以促进蛋白的纯化或检测、信号序列、融合蛋白配偶体诸如repa、fc或噬菌体外壳蛋白诸如pix或piii。
本发明的另一个实施方案是包含至少一种多核苷酸的载体。此类载体可以是质粒载体、病毒载体、用于杆状病毒表达的载体、基于转座子的载体或任何其它适于通过任何方式将多核苷酸引入给定生物体或遗传背景的载体。此类载体可以是包含可控制、调节、引起或允许由这种载体编码的多肽的表达的核酸序列元件的表达载体。此类元件可包含转录增强子结合位点、rna聚合酶起始位点、核糖体结合位点以及有利于编码的多肽在给定表达系统中的表达的其它位点。此类表达系统可以是本领域熟知的基于细胞的系统或无细胞系统。
本发明的另一个实施方案是包含本发明载体的宿主细胞。本发明的包含fn3结构域的分子可任选地由细胞系、混合细胞系、无限增殖化细胞或无限增殖化细胞的克隆群产生。参见例如ausubel等人编辑,currentprotocolsinmolecularbiology,johnwiley&sons,inc.,ny,ny(1987-2001);sambrook等人,molecularcloning:alaboratorymanual,第2版,coldspringharbor,ny(1989);harlow和lane,antibodies,alaboratorymanual,coldspringharbor,ny(1989);colligan等人编辑,currentprotocolsinimmunology,johnwiley&sons,inc.,ny(1994-2001);colligan等人,currentprotocolsinproteinscience,johnwiley&sons,ny,ny,(1997-2001)。
选择用于表达的宿主细胞可以是哺乳动物起源的或可选自cos-1、cos-7、hek293、bhk21、cho、bsc-1、hepg2、sp2/0、hela、骨髓瘤、淋巴瘤、酵母、昆虫或植物细胞,或它们的任何衍生物、无限增殖化细胞或转化的细胞。另选地,宿主细胞可选自不能够使多肽糖基化的物种或生物体,例如原核细胞或生物体,诸如bl21、bl21(de3)、bl21-gold(de3)、xl1-blue、jm109、hms174、hms174(de3),以及任何天然或改造的大肠杆菌属(e.colispp)、克雷伯氏菌属(klebsiellaspp.)或假单胞菌属(pseudomonasspp)菌株。
本发明的另一个实施方案是产生包含fn3结构域的分子的方法,该方法包括在使得包含fn3结构域的分子得以表达的条件下培养分离的宿主细胞,以及纯化结构域或分子。
包含fn3结构域的分子可通过熟知的方法从重组细胞培养物纯化,例如通过蛋白a纯化、硫酸铵或乙醇沉淀、酸萃取、阴离子或阳离子交换色谱法、磷酸纤维素色谱法、疏水作用色谱法、亲和色谱法、羟基磷灰石色谱法和凝集素色谱法、或高效液相色谱法(hplc)。
施用/药物组合物
对于治疗用途,可将包含fn3结构域的分子制备为药物组合物,该药物组合物包含有效量的结构域或分子作为可药用载体中的活性成分。术语“载体”是指据以施用该活性化合物的稀释剂、辅助剂、赋形剂或媒介物。此类载体可以是液体,诸如水和油,包括那些来源于石油、动物、植物的油或合成的油,诸如花生油、大豆油、矿物油和芝麻油等。例如,可使用0.4%生理盐溶液和0.3%甘氨酸。这些溶液是无菌的,并且通常不含颗粒物。它们可通过熟知的常规灭菌技术(例如过滤)进行灭菌。组合物可根据需要含有可药用辅助物质,以接近生理条件,诸如ph调节剂和缓冲剂、稳定剂、增稠剂、润滑剂和着色剂等。此类药物制剂中的本发明的分子的浓度可广泛改变,即小于约0.5%,通常为或至少约1%至多达15重量%或20重量%,且将根据所选择的具体施用方式,主要基于所需剂量、流体体积、粘度等进行选择。包含其它人蛋白如人血清白蛋白在内的合适的载体和制剂在例如remington:thescienceandpracticeofpharmacy,第21版,troy,d.b.编辑,lipincottwilliamsandwilkins,philadelphia,pa2006,第5部分,pharmaceuticalmanufacturing,第691-1092页中有所描述,特别参见第958-989页。
用于包含fn3结构域的分子的治疗用途的施用方式可以是将药剂递送至宿主的任何合适途径,诸如胃肠外施用,例如,真皮内、肌肉内、腹膜内、静脉内或皮下、肺部;经粘膜(口腔、鼻内、阴道内、直肠);使用在片剂、胶囊、溶液、粉末、凝胶、颗粒中的制剂;以及包含在注射器、植入装置、渗透泵、盒、微型泵中的制剂;或技术人员理解、本领域中熟知的其它方式。可通过例如以下方式实现位点特异性施用:胃肠外、支气管内、腹内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、结肠内、颈管内、胃内、肝内、心脏内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、脊柱内、滑膜内、胸内、子宫内、血管内、膀胱内、病灶内、阴道、直肠、口腔、舌下、鼻内或经皮递送。
因此,本发明的用于肌内注射的药物组合物可经制备以包含1ml无菌缓冲水,以及介于约1ng至约100mg之间的本发明的fn3结构域,例如约50ng至约30mg,或更优选地约5mg至约25mg。类似地,本发明的用于静脉内输注的药物组合物可制成为含有约250ml无菌林格氏溶液,以及约1mg至约30mg、例如约5mg至约25mg的包含fn3结构域的分子。用于制备非肠道施用的组合物的实际方法是众所周知的,并且在例如“remington'spharmaceuticalscience”,第15版,mackpublishingcompany,easton,pa中进行了更详细的描述。
包含fn3结构域的分子可被冻干储存,并且在使用前在合适的载体中重构。此项技术已被证实对常规的蛋白制剂有效,并且可采用本领域已知的冻干和重构技术。
可向受试者以单次剂量施用包含fn3结构域的分子,或者可以例如在一天、两天、三天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月或三个月之后重复施用。重复施用可为相同剂量或不同剂量。施用可重复一次、两次、三次、四次、五次、六次、七次、八次、九次、十次或更多次。
包含fn3结构域的分子可结合第二治疗剂同时、依次或单独地施用。第二治疗剂可为化疗剂、抗血管生成剂或细胞毒性药物。在用于治疗癌症时,包含fn3结构域的分子可与常规癌症疗法结合使用,所述常规癌症疗法诸如手术、放射疗法、化学疗法或它们的组合。
在一些实施方案中,提供包含纤连蛋白iii型(fn3)结构域-纳米颗粒复合物的组合物,其中组合物包含缀合至纳米颗粒的表面的fn3结构域。缀合可以是共价或非共价的,例如通过静电相互作用。在一些实施方案中,fn3结构域缔合、附接或以其它方式连接至纳米颗粒的外表面。在一些实施方案中,fn3结构域分子通过纳米颗粒的表面缔合,类似于跨膜蛋白。在一些实施方案中,fn3结构域分子不横跨(穿过)纳米颗粒的表面。纳米颗粒可如本文所提供,例如脂质纳米颗粒。在一些实施方案中,纳米颗粒是聚乳酸-乙醇酸共聚物(plga)纳米颗粒。在一些实施方案中,纳米颗粒是环糊精纳米颗粒,例如环糊精聚合物纳米颗粒(cdp)。在一些实施方案中,纳米颗粒是聚乙二醇化的。此处某些类型的纳米颗粒的描述仅为实例目的,并且本文公开的其它纳米颗粒或已知的纳米颗粒可用于fn3结构域分子纳米颗粒复合物。
在一些实施方案中,纳米颗粒可包含(含有)多核苷酸。多核苷酸可例如被多核苷酸包封。在一些实施方案中,包含多核苷酸的fn3结构域-纳米颗粒复合物可通过与fn3结构域相互作用而结合细胞,然后通过例如内化到细胞中递送多核苷酸至细胞。多核苷酸可以是任何类型的多核苷酸,例如化学修饰的多核苷酸。在一些实施方案中,多核苷酸是cdna、sirna、mrna、mirna、mirna拮抗剂、dsrna、反义寡核苷酸(aso)、dna、u1衔接子或免疫刺激性多核苷酸或其任何组合。在一些实施方案中,多核苷酸是sirna、反义或mirna。在一些实施方案中,多核苷酸是sirna或mirna。
在一些实施方案中,纳米颗粒包含(含有)或包封活性剂。活性剂可除了多核苷酸之外或代替多核苷酸如本文所提供。在一些实施方案中,活性剂是蛋白、肽、小分子化合物或免疫刺激剂或其任何组合。在一些实施方案中,小分子是治疗剂或毒素,其可递送至与fn3结构域分子结合的细胞类型。
在一些实施方案中,fn3结构域结合psma、egfr、epcam、cd22、bcma、cd33、cd71和/或cd8或其任何组合。psmafn3结构域的实例可见于例如美国申请号15/148312,其通过引用以其整体并入本文。egfrfn3结构域的实例可见于例如美国申请号14/085340和14/086250,其各自通过引用以其整体并入本文。epcamfn3结构域的实例例如在本文提供。egfrfn3结构域的实例可见于例如美国申请号14/085340和14/086250,其各自通过引用以其整体并入本文。egfrfn3结构域的实例可见于例如美国申请号15/839915,其各自通过引用以其整体并入本文。也可使用其它fn3结构域。
如本文提供的,fn3结构域可缀合至纳米颗粒。在一些实施方案中,通过点击型环加成或马来酰亚胺缀合,将纳米颗粒缀合至fn3结构域。
在一些实施方案中,组合物还可包含二苯并环辛炔(dbco)部分。
在一些实施方案中,提供了制备fn3结构域-纳米颗粒复合物的方法。在一些实施方案中,所述方法包括(i)用目的蛋白或核苷酸淘选fn3结构域文库;(ii)回收结合至目的蛋白或核苷酸的fn3结构域分子;和(iii)缀合fn3结构域分子与纳米颗粒。
在一些实施方案中,提供了制备fn3结构域-纳米颗粒复合物的方法。在一些实施方案中,所述方法包括在足以缀合fn3结构域至纳米颗粒以形成纳米颗粒复合物的条件下使fn3结构域与纳米颗粒接触。在一些实施方案中,纳米颗粒包含多核苷酸。在一些实施方案中,多核苷酸选自sirna、mrna、mirna、反义寡核苷酸(aso)、dna、u1衔接子和免疫刺激性寡核苷酸。在一些实施方案中,多核苷酸是治疗活性的。在一些实施方案中,复合物包含如本文提供的活性剂。
在一些实施方案中,提供了包含缀合至缀合物的纤连蛋白iii型(fn3)结构域的组合物。缀合物也可称为递送至细胞的有效负载。递送可以在内部通过例如fn3结构域内化到细胞中,或可以是外部的,并且缀合物可与fn3结构域结合的细胞相互作用。在一些实施方案中,缀合物(有效负载)如本文所提供。在一些实施方案中,缀合物是毒素。在一些实施方案中,毒素是mmaf或mmae。在一些实施方案中,fn3结构域结合psma、egfr、epcam、cd22、bcma、cd33、cd71和/或cd8。在一些实施方案中,fn3结构域结合epcam。在一些实施方案中,结合epcam的fn3结构域包含在一个或多个选自tyr25、arg26、pro27、leu81、pro82和tyr85的位置处的取代。在一些实施方案中,fn3结构域是包含选自seqidno:1-6、8-11、14-38和40-46的氨基酸序列的fn3结构域。在一些实施方案中,fn3结构域包含如本文所述的seqid:1-6、8-11、14-38和40-46的氨基酸序列或其变体。在一些实施方案中,结合epcam的fn3结构域包含14-38的序列或其变体。
在一些实施方案中,提供了包含fn3结构域的肽,其结合epcam。在一些实施方案中,fn3结构域特异性结合epcam。在一些实施方案中,fn3结构域包含seqidno:1-6、8-11、14-38和40-46的序列或由其组成。在一些实施方案中,fn3结构域包含如本文所述的seqid:1-6、8-11、14-38和40-46的氨基酸序列或其变体。在一些实施方案中,结合epcam的fn3结构域包含14-38的序列或其变体。在一些实施方案中,结合epcam的fn3结构域包含与seqidno:1-6、8-11、14-38和40-46的氨基酸序列之一具有62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。同一性百分比可使用通过ncbi网站可获得的blastp,使用默认参数以比对两个序列来确定。
在一些实施方案中,序列如下所示:
在一些实施方案中,fn3结构域含有本文提供的序列的1-5个取代或突变。在一些实施方案中,蛋白包含seqidno:1-6、8-11、14-38和40-46的序列,其中在对应于位置6、8、10、11、14、15、16、20、30、34、38、40、41、45、47、48、53、54、59、60、62、64、70、88、89、90、91和93的残基的位置处,至少一个残基被半胱氨酸取代。在一些实施方案中,在对应于位置6、8、10、11、14、15、16、20、30、34、38、40、41、45、47、48、53、54、59、60、62、64、70、88、89、90、91和93的残基的位置处,肽包含半胱氨酸。
在一些实施方案中,提供了靶向表达epcam或本文所述的其它fn3结构域的细胞的方法。在一些实施方案中,所述方法包括使细胞与结合epcam或本文提供的其它fn3结构域的fn3结构域接触。在一些实施方案中,结合epcam或其它fn3结构域的fn3结构域缀合至缀合物(有效负载)。除了本文所述的缀合物(有效负载)之外,缀合物还可包括缀合至异源分子的fn3结构域。在一些实施方案中,异源分子是可检测标记或治疗剂,例如但不限于细胞毒性剂。在一些实施方案中,结合epcam的fn3结构域缀合至可检测标记。可检测标记的非限制性实例在本文提供。
在一些实施方案中,提供了缀合至治疗剂的结合epcam的fn3结构域。治疗剂的非限制性实例,例如但不限于细胞毒性剂、多核苷酸或其它类型的治疗剂,例如但不限于本文提供的那些。
缀合至可检测标记的结合epcam的fn3结构域可用于体内或体外评价epcam在样品例如肿瘤组织上的表达。
可检测标记包括组合物,其当缀合至结合epcam的fn3结构域时通过光谱、光化学、生物化学、免疫化学或其它化学方法赋予epcam可检测性。
示例性的可检测标记包括,但不限于放射性同位素、磁珠、金属珠、胶体微粒、荧光染料、电子致密试剂、酶(例如,elisa中常用的酶)、生物素、洋地黄毒苷、半抗原、发光分子、化学发光分子、荧光染料、荧光团、荧光淬灭剂、有色分子、放射性同位素、cintillant、亲和素、链霉亲和素、蛋白a、蛋白g、抗体或其片段、多组氨酸、ni2+、flag标签、myc标签、重金属、酶、碱性磷酸酶、过氧化物酶、萤光素酶、电子供体/受体、吖啶酯和比色底物。
可检测标记可自发地发出信号,例如当可检测标记是放射性同位素时。在一些实施方案中,由于受到外部刺激物(例如磁场或电场或电磁场)刺激,可检测标记发出信号。
示例性的放射性同位素可以是γ-发射、auger-发射、β-发射、α-发射或正电子-发射的放射性同位素。示例性的放射性同位素包括3h、11c、13c、15n、18f、19f、55co、57co、60co、61cu、62cu、64cu、67cu、68ga、72as、75br、86y、89zr、90sr、94mtc、99mtc、115in、123i、124i、125i、131i、211at、212bi、213bi、223ra、226ra、225ac和227ac。
示例性的金属原子是原子序数大于20的金属,例如钙原子、钪原子、钛原子、钒原子、铬原子、锰原子、铁原子、钴原子、镍原子、铜原子、锌原子、镓原子、锗原子、砷原子、硒原子、溴原子、氪原子、铷原子、锶原子、钇原子、锆原子、铌原子、钼原子、锝原子、钌原子、铑原子、钯原子、银原子、镉原子、铟原子、锡原子、锑原子、碲原子、碘原子、氙原子、铯原子、钡原子、镧原子、铪原子、钽原子、钨原子、铼原子、锇原子、铱原子、铂原子、金原子、汞原子、铊原子、铅原子、铋原子、钫原子、镭原子、锕原子、铈原子、镨原子、钕原子、钷原子、钐原子、铕原子、钆原子、铽原子、镝原子、钬原子、铒原子、铥原子、镱原子、镥原子、钍原子、镤原子、铀原子、镎原子、钚原子、镅原子、锔原子、锫原子、锎原子、锿原子、镄原子、钔原子、锘原子或铹原子。
在一些实施方案中,金属原子可以是原子序数大于20的碱土金属。
在一些实施方案中,金属原子可以是镧系元素。
在一些实施方案中,金属原子可以是锕系元素。
在一些实施方案中,金属原子可以是过渡金属。
在一些实施方案中,金属原子可以是贫金属。
在一些实施方案中,金属原子可以是金原子、铋原子、钽原子和钆原子。
在一些实施方案中,金属原子可以是原子序数为53(即,碘)至83(即,铋)的金属。
在一些实施方案中,金属原子可以是适合磁共振成像的原子。
金属原子可以是呈+1、+2或+3氧化态的形式的金属离子,例如ba2+、bi3+、cs+、ca2+、cr2+、cr3+、cr6+、co2+、co3+、cu+、cu2+、cu3+、ga3+、gd3+、au+、au3+、fe2+、fe3+、f3+、pb2+、mn2+、mn3+、mn4+、mn7+、hg2+、ni2+、ni3+、ag+、sr2+、sn2+、sn4+和zn2+。金属原子可包含金属氧化物,例如氧化铁、氧化锰或氧化钆。
合适的染料包括任何市售可得的染料,例如5(6)-羧基荧光素、irdye680rd马来酰亚胺或irdye800cw、钌多吡啶染料等。
合适的荧光团是异硫氰酸荧光素(fitc)、荧光素氨基硫脲、若丹明、德克萨斯红、cy染料(例如,cy3、cy5、cy5.5)、alexafluor(例如,alexa488、alexa555、alexa594、alexa647)、近红外(nir)(700-900nm)荧光染料以及羰花青和氨基苯乙烯基染料。
可使用缀合至可检测标记的结合epcam的fn3结构域,例如作为成像剂以评价肿瘤分布、诊断肿瘤细胞的存在和/或肿瘤复发。
在一些实施方案中,结合epcam的fn3结构域缀合至治疗剂,例如但不限于细胞毒性剂。
在一些实施方案中,治疗剂是化学治疗剂、药物、生长抑制剂、毒素(例如,细菌、真菌、植物或动物来源的酶活性毒素,或其片段)或放射性同位素(即,放射性缀合物)。
本文公开的缀合至治疗剂的结合epcam的fn3结构域可用于靶向递送治疗剂至表达epcam的细胞(例如肿瘤细胞)并在其中进行细胞内积聚。尽管不受限于任何具体的理论,但在全身给予这些未缀合的试剂可对正常细胞导致不可接受水平的毒性时,这种类型的递送可能是有帮助的。
在一些实施方案中,治疗剂可通过机制,例如但不限于微管蛋白结合、dna结合、拓扑异构酶抑制、dna交联、螯合、剪接体抑制、nampt抑制和hdac抑制,引发其细胞毒性和/或抑制细胞生长作用。
在一些实施方案中,治疗剂是剪接体抑制剂、nampt抑制剂或hdac抑制剂。在一些实施方案中,所述试剂是免疫系统激动剂,例如tlr7,8,9、rig-i(dsrna)和sting(cpg)激动剂。在一些实施方案中,所述试剂是柔红霉素、多柔比星、甲氨蝶呤、长春地辛、细菌毒素例如白喉毒素、蓖麻毒素、格尔德霉素、美登素类化合物或卡奇霉素。
在一些实施方案中,治疗剂是酶活性毒素,例如白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌(pseudomonasaeruginosa))、蓖麻毒素a链、相思豆毒素a链、蒴莲根毒素a链、α-sarcin、油桐(aleuritesfordii)蛋白、石竹素蛋白、美洲商陆(phytolacaamericana)蛋白(papi、papii和pap-s)、苦瓜(momordicacharantia)抑制剂、麻疯树毒蛋白、巴豆毒素、sapaonariaofficinalis抑制剂、白树毒素、mitogellin、局限曲菌素、酚霉素、依诺霉素或单端孢霉烯。
在一些实施方案中,治疗剂是放射性核素,例如212bi、131i、131in、90y或186re。
在一些实施方案中,治疗剂是多拉司他汀或多拉司他汀肽类似物和衍生物、澳瑞他汀或单甲基澳瑞他汀苯丙氨酸。示例性的分子公开于美国专利号5,635,483和5,780,588。多拉司他汀和澳瑞他汀已显示干扰微管动力学、gtp水解以及细胞核和细胞分裂(woyke等人(2001)antimicrobagentsandchemother.45(12):3580-3584)并具有抗癌和抗真菌活性。多拉司他汀或澳瑞他汀药物部分可通过肽药物部分的n(氨基)末端或c(羧基)末端(wo02/088172),或通过改造到fn3结构域中的任何半胱氨酸,附接至fn3结构域。
在一些实施方案中,治疗剂可以是例如,澳瑞他汀、喜树碱、倍癌霉素、依托泊苷、美登素和美登素类化合物、紫杉烷、苯并二氮杂䓬类或含有苯并二氮杂䓬的药物(例如,吡咯并[1,4]-苯并二氮杂䓬类(pbd)、二氢吲哚苯并二氮杂䓬类和噁唑烷苯并二氮杂䓬类)或长春花生物碱。
在一些实施方案中,结合epcam的fn3结构域缀合至治疗化合物,其可例如用于治疗癌症、肠的自身免疫疾病、肺疾病等。自身免疫疾病的实例包括但不限于自身免疫肝炎、原发性硬化性胆管炎、1型糖尿病、移植或gvhd,所述方法包括给予受试者权利要求1的任何治疗化合物以治疗自身免疫肝炎、原发性硬化性胆管炎、1型糖尿病、移植或gvhd。在一些实施方案中,自身免疫疾病包括但不限于炎性肠病、克罗恩氏病、溃疡性结肠炎。自身免疫疾病的其它实例包括但不限于1型糖尿病、多发性硬化、心肌炎、白癜风、脱发、炎性肠病(ibd,例如克罗恩氏病或溃疡性结肠炎)、斯耶格伦氏综合征、局灶性节段性肾小球硬化(fsgs)、硬皮病/全身性硬化症(ssc)或类风湿性关节炎等。
在一些实施方案中,癌症或肿瘤是乳腺癌、肺癌、结肠癌或卵巢癌。在一些实施方案中,癌症是上皮癌。
“治疗(treat)”或“治疗(treatment)”是指治疗性治疗和预防措施,其中目的是预防或减慢(减轻)不需要的生理学变化或障碍,例如癌症的发展或散布。在一些实施方案中,有益或需要的临床结果包括但不限于症状的减轻、疾病程度减小、疾病状态稳定(即,不恶化)、疾病进展的延迟或减慢、疾病状态的改善或减轻、和缓解(无论是部分还是全部的),无论是可检测还是不可检测的。“治疗”也可意味着与如果不接受治疗的预期存活相比延长存活。需要治疗的那些包括已经具有病况或障碍的那些以及倾向于具有病况或障碍的那些或其中将要预防病况或障碍的那些。
“治疗有效量”是指以必要的剂量和时间段有效实现所需的治疗结果的量。结合epcam或本文所述的其它蛋白的fn3结构域的治疗有效量可根据因素例如疾病状态,个体的年龄、性别和体重而变化。有效的结合epcam或本文所述的其它蛋白的fn3结构域的示例性指示物是患者健康改善、肿瘤尺寸减小或收缩、肿瘤生长停止或减慢和/或癌细胞没有转移到身体其它位置。
在一些实施方案中,本文提供的用于治疗疾病或病况的化合物是核酸分子,例如但不限于寡核苷酸、rna干扰分子或反义构建体。在一些实施方案中,rna干扰分子是小干扰rna分子或短发夹rna干扰分子。在一些实施方案中,rna干扰分子是抗病毒剂,例如通过干扰病毒在宿主中自我复制的能力,或本文描述的其它多核苷酸。
特异性结合epcam的fn3结构域可使用已知方法缀合至可检测标记。在一些实施方案中,可检测标记与螯合剂复合。在一些实施方案中,可检测标记通过接头缀合至结合epcam的fn3结构域。
可检测标记、治疗化合物或细胞毒性化合物可使用已知方法直接或间接连接至结合epcam的fn3结构域。合适的接头是本领域已知的,和包括例如,辅基、非酚型接头(n-琥珀酰亚胺基-苯甲酸酯的衍生物;十二硼酸酯)、大环和非环状螯合剂二者的螯合部分,例如1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)的衍生物、二亚乙基三胺五乙酸(dtpa)的衍生物、s-2-(4-异硫氰酸合苄基)-1,4,7-三氮杂环壬烷-1,4,7-三乙酸(nota)的衍生物和1,4,8,11-四氮杂环十二烷-1,4,8,11-四乙酸(teta)的衍生物、n-琥珀酰亚胺基-3-(2-吡啶基双硫醇)丙酸酯(spdp)、亚胺基硫杂环戊烷(it)、亚胺酸酯的双官能衍生物(例如己二亚胺酸二甲酯hcl)、活性酯(例如二琥珀酰亚胺基辛二酸酯)、醛(例如戊二醛)、双-叠氮基化合物(例如双(p-叠氮基苯甲酰基)己二胺)、双-重氮衍生物(例如双-(p-重氮苯甲酰基)-乙二胺)、二异氰酸酯(例如甲苯2,6-二异氰酸酯)和双-活性氟化合物(例如1,5-二氟-2,4-二硝基苯)和其它螯合部分。合适的肽接头是众所周知的。
在一些实施方案中,结合epcam的fn3结构域通过肾清除从血液除去。
如本文提供的,在一些实施方案中,缀合物(有效负载)连接至纳米颗粒的表面。纳米颗粒可以是本文所述用于任何本文提供的方法的任何纳米颗粒。在一些实施方案中,缀合物是靶向蛋白降解的复合物。在一些实施方案中,缀合物是对于e3泛素连接酶的结合部分。在一些实施方案中,结合部分是protac结构域,其结合通过接头连接的e3泛素连接酶和靶蛋白。
在一些实施方案中,被靶向的细胞是表达epcam的细胞。在一些实施方案中,细胞是乳腺细胞、肺细胞、结肠细胞、卵巢细胞。在一些实施方案中,细胞是上皮细胞。
在一些实施方案中,提供了治疗患者的癌症的方法,所述方法包括给予患者本文所述的组合物或肽以治疗癌症。在一些实施方案中,癌症是乳腺癌、肺癌、结肠癌或卵巢癌。在一些实施方案中,癌症是上皮癌。在一些实施方案中,癌症是表达或过表达epcam或本文所述的其它fn3结构域的癌症。
在一些实施方案中,提供了包含结合epcam的fn3结构域或本文提供的复合物的试剂盒。所述试剂盒可用于治疗用途和作为诊断试剂盒。
在一些实施方案中,所述试剂盒包含结合epcam或本文所述的其它蛋白的fn3结构域和用于检测fn3结构域或递送复合物或fn3结构域至fn3结构域所靶向的细胞的试剂。所述试剂盒可包括一个或多个其它元件,包括:使用说明书;其它试剂,例如标记、可用于螯合或以其它方式偶联的试剂、放射性保护组合物;用于制备结合epcam的fn3结构域为成像、诊断或治疗目的而给予的装置或其它材料;药学上可接受的载体;和用于给予受试者的装置或其它材料。
在一些实施方案中,所述试剂盒包含fn3结构域,其包含seqidno:1-6、8-11、14-38和40-46之一的氨基酸序列。在一些实施方案中,fn3结构域包含本文所述的seqid:1-6、8-11、14-38和40-46的氨基酸序列或其变体。在一些实施方案中,结合epcam的fn3结构域包含14-38的序列或其变体。
在一些实施方案中,在本文提供的组合物或方法中使用的fn3结构域包含seqidno:1-6、8-11、14-38和40-46的氨基酸序列或变体。在一些实施方案中,结合epcam的fn3结构域包含14-38的序列或其变体。
本文提供的序列可包括在蛋白的n-或c-末端的his标签或his-c标签。可除去并且不包括这些n-或c-末端序列。例如,seqidno:40显示为mlpapknlvvsevtcdsarlswddpwafyesfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvhnvykdtnmrglplsaifttgghhhhhh,并且在一些实施方案中,除去6-his标签以提供mlpapknlvvsevtcdsarlswddpwafyesfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvhnvykdtnmrglplsaifttgg(seqidno:49)。不能包括c-末端标签,或c-末端标签可用于纯化或检测目的。
虽然已在某些方面描述了实施方案,但是实施方案还包括以下实施例,所述实施例不应理解为限制权利要求的范围。
实施例1:tencon文库的构建
tencon是由来自人生腱蛋白-c的十五个fn3结构域的共有序列设计的免疫球蛋白样骨架纤连蛋白iii型(fn3)结构域(jacobs等人,proteinengineering,design,andselection,25:107-117,2012)。tencon的晶体结构示出连接七个β-链的六个表面暴露环。这些环或每个环内所选择的残基可随机化,以便构建可用于选择结合特异性靶标的新型分子的纤连蛋白iii型(fn3)结构域文库。
tencon:
lpapknlvvsevtedslrlswtapdaafdsfliqyqesekvgeainltvpgsersydltglkpgteytvsiygvkgghrsnplsaeftt(seqidno39)。
tcl1文库的构建
被设计为仅使tencon的fg环随机化的文库tcl1被构建用于与顺式-展示系统一起使用(jacobs等人,proteinengineering,design,andselection,25:107-117,2012)。在该系统中,制备单链dna,该单链dna包含用于tac启动子的序列、tencon文库编码序列、repa编码序列、顺式元件和ori元件。在体外转录/翻译系统中表达时,产生顺式结合到dna的tencon-repa融合蛋白复合物,其被该dna编码。然后分离结合到靶分子的复合物,并通过聚合酶链反应(pcr)进行扩增,如下所述。
用于与顺式展示一起使用的tcl1文库的构建通过连续多轮pcr来实现以制备两半的最终线性双链dna分子;5’片段包含启动子和tencon序列,而3’片段包含repa基因以及顺式元件和ori元件。这两半通过限制酶切消化来结合以便产生整个构建体。tcl1文库被设计为仅在tencon,kgghrsn(seqidno:50)的fg环中并入随机氨基酸。nns密码子用于该文库的构建,从而导致可能将全部20个氨基酸以及一个终止密码子并入fg环中。tcl1文库包含六个单独的子文库,每个具有不同的随机化fg环长度(7至12个残基),以便进一步增加多样性。基于tencon的文库的设计示于表2中。
表2:
*tapdaafd(seqidno:51):残基22-28;
**kgghrsn(seqidno:50):
x是指由nns密码子编码的简并氨基酸。
#是指文本中描述的“氨基酸的设计分布”。
为了构建tcl1文库,执行连续多轮pcr以附加tac启动子,将简并性构建到f:g环中,并添加必要的限制性酶切位点以进行最终组装。首先,通过pcr以两个步骤生成包含fg环的启动子序列和tencon序列5’的dna序列。对应于全tencon基因序列的dna用作具有引物pop2220以及tc5’至fg的pcr模板。来自该反应的所得pcr产物用作模板以用于利用引物130mer和tc5’至fg的下一轮pcr扩增,以完成将5’和启动子序列附加到tencon。接下来,通过以下所述将多样性引入到f:g环中:扩增在第一步骤中用正向引物pop2222和反向引物tcf7、tcf8、tcf9、tcf10、tcf11或tcf12制备的dna产物,其包含简并核苷酸。对于每个子文库执行至少八次100µlpcr反应以使pcr循环最小化并且使文库的多样性最大化。该pcr产物中的至少5µg被凝胶纯化并且与引物pop2222和pop2234一起用于随后的pcr步骤中,从而导致将6xhis标签和noti限制性酶切位点附接到tencon序列的3’端。该pcr反应使用仅15个pcr循环以及至少500ng的模板dna进行。将所得pcr产物凝胶纯化,用noti限制性酶消化,并且通过qiagen柱纯化。
文库的3’片段是包含用于展示的元件的恒定dna序列,所述元件包括pspomi限制性酶切位点、repa基因的编码区、以及顺式元件和ori元件。pcr反应使用包含该具有m13正向引物和m13反向引物的dna片段的质粒(pcr4blunt)(invitrogen)来执行。所得pcr产物使用pspomi消化过夜并进行凝胶纯化。为了将文库dna的5’部分连接到包含repa基因的3’dna,在noti和pspomi酶以及t4连接酶的存在下将2pmol的5’dna连接到等摩尔量的3’repadna。在37℃下过夜连接之后,将小部分的连接dna在凝胶上运行以检查连接效率。将连接的文库产物分成12个pcr扩增,并且用引物对pop2250和didligrev运行12次循环pcr反应。tcl1文库的每个子文库的dna产率在32-34µg的范围内。
为了评估文库的质量,将小部分的工作文库用引物tcon5new2和tcon6扩增,并且通过连接酶非依赖性克隆将其克隆到经修饰的pet载体中。将质粒dna转化到bl21-gold(de3)感受态细胞(stratagene)中,并使用t7启动子引物对96个随机挑取的菌落进行测序。未发现重复序列。总而言之,大约70%-85%的克隆具有完整启动子和未发生移码突变的tencon编码序列。功能序列速率介于59%和80%之间,其排除带有终止密码子的克隆。
tcl2文库的构建
构建tcl2文库,其中将tencon的bc和fg环随机化,并且严格控制每个位置处的氨基酸分布。表3示出在tcl2文库中的所需环位置处的氨基酸分布。所设计的氨基酸分布具有两个目标。首先,文库朝向残基偏置,基于tencon晶体结构的分析和/或者根据同源性建模,这些残基被预测为在结构上对于tencon折叠和稳定性很重要。例如,第29位被固定为仅仅疏水性氨基酸的亚群,因为该残基被包埋在tencon折叠的疏水核心中。设计的第二层包括使氨基酸分布偏压,该偏压朝向优先存在于抗体重链hcdr3中的残基,以有效地产生高亲和力结合物(birtalan等人,jmolbiol377:1518-28,2008;olson等人,proteinsci16:476-84,2007)。针对该目标,表3的“设计的分布”是指如下的分布:6%丙氨酸、6%精氨酸、3.9%天冬酰胺、7.5%天冬氨酸、2.5%谷氨酸、1.5%谷氨酰胺、15%甘氨酸、2.3%组氨酸、2.5%异亮氨酸、5%亮氨酸、1.5%赖氨酸、2.5%苯丙氨酸、4%脯氨酸、10%丝氨酸、4.5%苏氨酸、4%色氨酸、17.3%酪氨酸和4%缬氨酸。该分布缺乏甲硫氨酸、半胱氨酸和终止密码子。
表3:
tcl2文库的5’片段包含启动子和tencon的编码区,其被化学合成为文库池(sloningbiotechnology)。该dna池包含至少1×1011个不同成员。在该片段的末端,bsai限制性酶切位点包括在用于连接到repa的设计中。
文库的3’片段是包含用于展示的元件的恒定dna序列,所述元件包括6xhis标签、repa基因的编码区、以及顺式元件。通过pcr反应使用现有的dna模板(上述)、以及引物ls1008和didligrev来制备dna。为了组装完整的tcl2文库,将总共1µg的bsai-消化5’tencon文库dna连接到通过用相同酶的限制酶切消化制备的3’片段。过夜连接之后,通过qiagen柱纯化dna,并通过测量260nm处的吸光度来定量dna。通过12次循环pcr反应用引物对pop2250和didligrev来扩增所连接的文库产物。总共进行72次反应,每次包含50ng的连接dna产物作为模板。tcl2工作文库dna的总产率为约100µg。对小部分的工作文库进行亚克隆和测序,如上文针对文库tcl1所述。未发现重复序列。约80%的序列包含完整启动子和未发生移码突变的tencon编码序列。
tcl14文库的构建
顶部(bc、de和fg)和底部(ab、cd和ef)环,例如fn3结构域中报道的结合表面被形成fn3结构中心的β-链分隔。驻留在具有与仅由环形成的表面不同形状的fn3结构域的两个“侧面”上的可供选择的表面在fn3结构域的一个侧面上通过两个反平行β-链(cβ-链和fβ-链)以及cd环和fg环形成,并且在本文中称为c-cd-f-fg表面。
使tencon的可供选择的表面随机化的文库通过随机化选择c链和f链的表面暴露残基,以及cd环和fg环的部分而生成。使用tencon变体tencon27来生成文库,该变体与tencon相比具有以下取代:e11rl17a、n46v、e86i。用于构建该文库的方法的全部说明在美国专利申请序列号13/852,930中有所描述。
实施例2:结合细胞靶标的纤连蛋白iii型(fn3)结构域的选择
文库筛选
各种方法可用于淘选本文所述的任何fn3结构域文库以获得fn3结构域,其结合目的蛋白或核苷酸用于本发明的靶向用途。例如,顺式-展示可用于从tcl1和tcl2文库选择fn3结构域。重组人蛋白,可能融合至igg1fc,可用于标准淘选方法。
抗-hegfrfn3结构域分子g3的选择
顺式-展示用于选择egfr结合的fn3结构域分子,如美国专利申请系列号13/852,930中所述。简言之,融合至人igg1的fc结构域的包括残基25-645的重组人egfr-ecd购自r&dsystems并生物素化用于选择。对于体外转录和翻译(itt),将2-3µg的tcl14dna用0.1mm完整氨基酸、1xs30预混组分和15µls30提取物(promega)在50µl的总体积中温育并且在30℃下温育。在1小时之后,添加450µl阻断溶液(pbsph7.4,补充有2%牛血清白蛋白、100µg/ml鲱鱼精子dna和1mg/ml肝素),并且将该反应物在冰上温育15分钟。通过将重组人egf(r&dsystems)与生物素化重组egfr-fc在阻断溶液中于室温下混合1小时,而以摩尔比为1:1的egfr与egf组装egfr-fc:egf复合物。对于结合,将500µl阻断的itt反应物与100µlegfr-fc:egf复合物混合并且在室温下温育1小时,之后将结合的复合物用中和亲和素磁珠或链霉抗生物素蛋白磁珠(seradyne)拉下。通过用pbst和pbs连续洗涤来移除未结合的文库成员。在洗涤之后,通过加热到75℃并持续10分钟来从结合的复合物洗脱dna,并将该dna进行pcr扩增,并且通过限制酶切消化和连接来附接到编码repa的dna片段以用于进一步轮次的淘选。通过在每轮期间将靶egfr-fc的浓度从500nm连续降低到2.5nm以及增加洗涤严格性来分离高亲和力结合物。在第6轮和第7轮中,通过在200倍摩尔过量的非生物素化egfr-fc的存在下在pbst中洗涤1小时来移除未结合和弱结合的centyrin。在第8轮和第9轮中,通过在2000倍摩尔过量的非生物素化egfr-fc的存在下在pbst中洗涤1小时来移除未结合和弱结合的centyrin。将fn3结构域克隆至表达载体中并如所述的,筛选与hegfr的结合。
实施例3:fn3结构域的改造
fn3结构域可经改造以增加各分子的构象稳定性。突变l17a、n46v和e86i(描述于美国专利公开号2011/0274623)可通过dna合成结合到分子中。在pbs中的差示扫描量热法可用于评价各突变体的稳定性以将其与相应母体分子的稳定性进行比较。
实施例4:fn3结构域的半胱氨酸改造
fn3结构域的半胱氨酸突变体由基础tencon分子及其变体制成,其变体不具有半胱氨酸残基。这些突变可使用本领域中已知的标准分子生物学技术来进行,以将独特的半胱氨酸残基结合到基础tencon序列或其它fn3结构域中,用作用于小分子药物、荧光标签、聚乙二醇或任意数量的其它化学实体的化学缀合位点。待选择的突变位点应满足某些标准。例如,突变为包含游离半胱氨酸的tencon分子应当:(i)在大肠杆菌中高度表达,(ii)维持高水平的溶解性和热稳定性,并且(iii)在缀合后维持与靶抗原结合。由于tencon骨架仅具有约90-95个氨基酸,因此可易于在骨架的每个位置处构建单一半胱氨酸变体以严格地确定化学缀合的理想位置。
实施例5:通过独特的半胱氨酸置换用fn3结构域分子靶向纳米颗粒
为了建立fn3结构域在靶向纳米药物中的功用,进行实验以显示由fn3结构域分子提供的用于靶标接合和纳米颗粒-fn3结构域偶联反应的益处。对于初始缀合和靶向实验,产生egfr-靶向fn3结构域(p54ar4-83v2)的6种变体,其中单个独特的半胱氨酸被置于蛋白内的不同位置,用于与纳米颗粒偶联,如美国专利申请系列号14/512,801中所述。这些蛋白称为83v10、83v11、83v12、83v13、83v14和83v15。这些蛋白各自的氨基酸序列如下:
83v10=e15c(seqidno:40)
mlpapknlvvsevtcdsarlswddpwafyesfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvhnvykdtnmrglplsaifttgghhhhhh
83v11=e12c(seqidno:41)
mlpapknlvvscvtedsarlswddpwafyesfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvhnvykdtnmrglplsaifttgghhhhhh
83v12=r19c(seqidno:42)
mlpapknlvvsevtedsaclswddpwafyesfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvhnvykdtnmrglplsaifttgghhhhhh
83v13=e54c(seqidno:43)
mlpapknlvvsevtedsarlswddpwafyesfliqyqesekvgeaivltvpgscrsydltglkpgteytvsiygvhnvykdtnmrglplsaifttgghhhhhh
83v14=k63c(seqidno:44)
mlpapknlvvsevtedsarlswddpwafyesfliqyqesekvgeaivltvpgsersydltglcpgteytvsiygvhnvykdtnmrglplsaifttgghhhhhh
83v15=c-末端(seqidno:45)
mlpapknlvvsevtedsarlswddpwafyesfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvhnvykdtnmrglplsaifttgghhhhhhc
g3=c-末端(seqidno:46)
mlpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglkpgteytvsingvkggtrswslsaifttgghhhhhhc
缀合
合成超顺磁氧化铁纳米颗粒(spion)并用胺化学处理进行表面官能化用于与靶向元件下游缀合。从该纳米颗粒储液,将50μl的1mgfe/mlspion等分到6个单独的eppendorf管中。将各fn3结构域分子加入spion样品,使得实现最终50:1摩尔比的fn3结构域分子:spion。允许样品在rt下在恒温混匀仪上以1250rpm反应4小时。4小时后通过磁力纯化在macsls柱上纯化样品。然后使用来自millipore的microcon30kda柱,用单次5分钟旋转(5500xrcf)浓缩样品。
在建立上述缀合反应后不久,注意到两个缀合物样品已沉淀。具体地,83v11和83v14沉淀。这留下三个样品83v10、83v12和83v15作为潜在的稳定缀合物。
对于剩余的可溶样品,进行铁浓度测试。具体地,10μl的spion样品与10μl的3%h2o2和1ml的6mhcl一起在暗处温育10分钟。然后评价样品在410nm的吸光度。将吸光度测量与溶解的铁的标准曲线比较以确定mg/ml浓度。此外,假定平均铁芯尺寸为5nm和大致球形的颗粒,使用113,008g/摩尔作为spio纳米颗粒的估计分子量,将铁的mg/ml浓度转化为摩尔浓度。浓度如表4所示计算:
表4:centryin-spio纳米颗粒的浓度
细胞结合测定
为了确定新近产生的fn3结构域分子-spion的活性,体外建立细胞靶向测定。使用hank无酶解离缓冲液(invitrogen-13150-016)将h292细胞从t-150细胞培养瓶解离。将细胞和解离缓冲液在细胞培养箱中温育15分钟。将培养瓶轻轻敲打以解离任何残留结合的细胞,并将缓冲液和细胞转移至15ml圆锥管。将细胞以1,000rcf离心2分钟。轻轻除去上清液,小心考虑不干扰沉淀的细胞。剩余的细胞沉淀在1.5ml的含10%fbs的无酚红rpmi1640培养基中重新构成。测定悬浮液含有大约1.5x10^6个细胞。将100μl的该悬浮液加入96-孔板的各孔。fn3结构域分子-spion样品浓度在上文列出。根据这些已知的浓度,将fn3结构域分子-spion加入各孔,使得fn3结构域分子-spion与细胞的最终浓度是100μg/mlfe。将样品一式三份置于板中,和温育30分钟,然后通过以1,000xrcf离心3x纯化并重悬浮于dpbsph7.2中。样品以终体积300μl悬浮和移至透明的平底96-孔板中用于在guavahts流式细胞仪上分析。对于各样品计数总共8,000个细胞。流动后,使用flowjo分析群体样品。门控各样品,使得仅评价活细胞的荧光。获得直方图,其中黑色峰(图形左侧的峰)是获自未标记的h292细胞的自发荧光。蓝色峰(图形右侧的峰)对应于直方图上方的样品标题。与tencon25对照或空白细胞相比,83v10、83v12和83v15正转移(图1a-1d)。柱状图显示所有样品的单次定量比较(图2)。所有样品通过从各样品的平均荧光强度减去空白细胞自发荧光来标准化。当与tencon25-spion样品比较,发现83v10-spion、83v12-spion和83v15-spion的统计学显著性(p<0.005)。
fn3结构域分子-纳米颗粒细胞结合评价
除了靶标特异性结合之外,选择一些fn3结构域分子以通过抑制配体结合来阻断生物学途径。为了评价在缀合至纳米颗粒后fn3结构域分子活性是否保留,使用以下方案和设定,对于egfr-靶向的纳米颗粒建立活性评价:
细胞制备
在96孔板中以20k/孔将a431细胞置于板中。在24小时温育后,将板培养基更换为无血清rpmi+glutamax。将细胞温育过夜。在第二天,细胞板使用blockera缓冲液在rt摇动下以设定2阻断1小时。然后将细胞饥饿20-24小时和通过抽吸从细胞除去细胞培养基。
fn3结构域分子-spion细胞处理
将抑制剂(83v11-spion、空白spion和83v2)在无血清培养基中稀释至最终测定浓度。将100ul的各抑制剂以在下方板图中指示的稀释度加入细胞。细胞与抑制剂在37°c温育1小时。
egf刺激
根据msd方案制备裂解缓冲液和在冰上储存。也以2x浓度在无血清培养基中制备生长因子。将最终浓度50ng/ml的egf加入各细胞孔。对于饥饿对照,使用无血清培养基。
总之,在完成抑制剂温育时将100ul的egf加入各孔,除了饥饿对照,其接受100ul无血清培养基。将样品在37°c温育15分钟。
细胞裂解
在15分钟温育后,通过抽吸从细胞除去培养基。将100ul的之前制备的msd裂解缓冲液加入细胞板的各孔。将板在室温下摇动10分钟。在细胞正在裂解时,通过用150ul的tris洗涤缓冲液洗涤4x准备msd板。在洗涤msd板后,将30ul的裂解细胞转移至洗涤的msd板。
加入抗体
制备抗体溶液,在暗处和低温保持,用150ultris洗涤缓冲液洗涤msd板四次,在吸收纸上敲打以除去所有痕量的洗涤缓冲液。将25ul的抗体溶液加入各孔。用150ultris洗涤缓冲液洗涤msd板四次,在吸收纸上敲打以除去所有痕量的洗涤缓冲液。
读取板
制备msd读取缓冲液:10ml读取缓冲液在30mldih2o中。
加入150ul读取缓冲液到各孔,小心不产生气泡。
在msdsectorimager上读取板。
在板读取后,收集数据和使用graphpadprism软件处理。具体地,靶向83v11-spion针对其母体fn3结构域分子(83v2)和非靶向spion作图。如图3的曲线图所示,fn3结构域分子在它们与纳米颗粒偶联后保持其活性,这是因为83v11-spion能够有效抑制egfr磷酸化,类似于未偶联的83v2fn3结构域分子。
实施例6:通过egfr或psma-结合centyrin细胞内递送细胞毒性有效负载
试剂和构建体:
编码金黄色葡萄球菌分选酶a的基因通过dna2.0产生并亚克隆至pjexpress401载体(dna2.0)中用于在t5启动子下表达。用于可溶性表达的分选酶构建体缺少天然蛋白的由25个氨基酸组成的n-末端结构域,因为该结构域是膜缔合的(ton-that等人,procnatlacadsciusa96:12424-12429,1999)。分选酶用n-末端his6-标签修饰以供纯化,接着tev蛋白酶位点用于标签去除(enlyfqs,seqid12)。该基因还包括来自天然序列的5个突变,已报道其增加酶的催化效率(chen等人,procnatlacadsciusa108:11399-11404,2011)(seqid13)。将质粒转化到大肠杆菌bl21gold细胞(agilent)中用于表达。挑出单菌落并在补充有卡那霉素的luria肉汤(teknova)中生长和在37°c250rpm下温育18h。将250ml的补充有卡那霉素的terrific肉汤(teknova)从这些传代培养物接种和在37°c下生长~4h,同时摇动。用1mmiptg诱导蛋白表达,和蛋白在30°c下表达18h。通过6000g离心收获细胞和在-20c下储存直到纯化。将冷冻的细胞团在室温下融化30分钟和以5ml/克细胞糊悬浮在补充有1ul/30ml的重组溶菌酶(emdmillipore)的bugbusterht蛋白提取试剂(emdmillipore)中,并在摇动器上在室温下温育30分钟。裂解产物通过以74600g离心30分钟澄清。
将上清液施加到填装有3ml的qiagensuperflowni-nta树脂的重力柱上,所述柱用缓冲液a(50mm磷酸钠缓冲液ph7.0,含有0.5mnacl和10mm咪唑)预平衡。加载后,柱用100ml的缓冲液a洗涤。蛋白用补充有250mm咪唑的缓冲液a洗脱并加载到在pbs(gibco)中平衡的制备型凝胶过滤柱tskgelg3000sw21.5x600mm(tosoh)上。凝胶过滤色谱在室温下在pbs中使用akta-avant色谱系统以流速10ml/min进行。纯化的分选酶然后用tev蛋白酶消化以除去his6标签。28mg的分选酶以10ml用3000单位的actev蛋白酶(invitrogen)在补充有1mmdtt的提供缓冲液中在30c下温育2小时。无标签分选酶用ni-nta树脂纯化。使用pd-10柱(gehealthcare)将反应物交换到tbs缓冲液(50mmtrisph7.5,150mmnacl)中和施加到填装有0.5ml的qiagensuperflowni-nta树脂的重力柱上,所述重力柱用缓冲液a预平衡。收集流通物和用3ml的缓冲液a洗涤树脂,其添加到流通物中。含有分选酶的流通物在具有10kda截止的amicon15浓缩器(emdmillipore)中浓缩至~0.5ml。加入另外的tbs缓冲液和将样品再次浓缩(重复两次)以交换缓冲液为tbs。加入1/3体积的40%甘油(终浓度10%甘油),和分选酶在-20ºc下储存供短期使用或在-80ºc下储存供长期使用。
centyrin的大规模表达、纯化和缀合
如之前或上文所述(us2014/0155326a1)发现结合psma或egfr的centyrin,并克隆到pet15b载体中用于在t7启动子下表达,或通过dna2.0产生并亚克隆至pjexpress401载体(dna2.0)中用于在t5启动子下表达。将得到的质粒转化到大肠杆菌bl21gold(agilent)或bl21de3gold(agilent)中用于表达。挑出单菌落和在补充有卡那霉素的luria肉汤(teknova)中生长和在37°c250rpm下温育18h。1升补充有卡那霉素的terrific肉汤(teknova)从这些传代培养物接种和在37°c下生长4h,同时摇动。在600nm光密度达到1.0时用1mmiptg诱导蛋白表达。蛋白在37°c下表达4h或在30°c下表达18h。通过6000g离心收获细胞和在-20c下储存直到纯化。将冷冻的细胞团(~15-25g)在室温下融化30分钟和以5ml/克细胞糊悬浮在补充有0.2mg/ml重组溶菌酶(sigma)的bugbusterht蛋白提取试剂(emdmillipore)中,并在摇动器上在室温下温育1h。裂解产物通过74600g离心25min澄清。使用aktaavant色谱系统以流速4ml/min将上清液施加到浸没在冰中的5mlqiagenni-nta柱上。所有其它ni-nta色谱步骤以流速5ml/min进行。ni-nta柱在25.0ml的含有0.5mnacl和10mm咪唑的50mmtris-hcl缓冲液ph7.0(缓冲液a)中平衡。加载后,柱用100ml的缓冲液a,接着100ml的含有10mm咪唑、1%chaps和1%n-辛基-β-d-吡喃葡萄糖苷去垢剂的50mmtris-hcl缓冲液ph7.0和100ml缓冲液a洗涤。蛋白用补充有250mm咪唑的缓冲液a洗脱和加载到在pbs(gibco)中平衡的制备型凝胶过滤柱tskgelg3000sw21.5x600mm(tosoh)上。凝胶过滤色谱在室温下在pbs中使用akta-avant色谱系统以流速10ml/min进行。
作为受体介导的细胞内递送的度量,通过连接微管破坏药物至psma或egfr结合centyrin制备centyrin缀合物。由于微管破坏药物在细胞质中有活性,有效细胞内递送可使用细胞毒性测定评价。将抗-psmacentyrin通过分选酶标签缀合至vc-mmaf。对于缀合至分选酶标签,将细菌团融化,重悬和在补充有重组人溶菌酶(emd,catalog#71110)的bugbusterht(emdcatalog#70922)中裂解。裂解在室温下以轻轻搅动进行,之后将板转移至42°c以沉淀宿主蛋白。通过离心沉淀碎片,和将上清液转移至新的阻断板用于分选酶-催化的标记。含有gly3-vc-mmaf(concortis)、无标签分选酶a和分选酶缓冲液(tris、氯化钠和氯化钙)的主混合物以2x浓度制备和以等体积加入裂解产物上清液。标记反应在室温下进行2小时,之后使用ni-ntamulti-traphp板(gecatalog#28-4009-89)纯化蛋白。蛋白缀合物通过用含有咪唑的洗脱缓冲液(50mmtrisph7.5,500mmnacl,250mm咪唑)分级洗脱回收,过滤除菌和直接用于基于细胞的细胞毒性测定。
二价抗-egfrcentyrin通过遗传上连接用肽接头分开的两个拷贝的抗-egfrcentyrin,p155r8-g3(seqid1)至具有1-4个半胱氨酸残基的白蛋白结合结构域(abdcon12,seqid7)(us2013/0316952a1)编码。将表5中列出的centyrin缀合至碘乙酰基-peg4-mmaf(iaa-mmaf,图4,concortis)。对于缀合,将centyrin在pbs中稀释至100um和用10mmtcep还原。蛋白然后用硫酸铵沉淀,用另外的硫酸铵洗涤以确保tcep去除和再次溶解于pbs。还原的蛋白与4-8倍过量的iaa-mmaf/半胱氨酸在室温下在100mm硼酸盐缓冲液(ph=9.0)中反应4.5h。通过加入n-乙基马来酰亚胺以封端任何未反应的半胱氨酸来淬灭反应,和蛋白在nickelntasuperflow树脂(qiagen)上通过重力流纯化,用zeba柱(thermo)交换至pbs中;内毒素用endobindr树脂(biodtech)除去。
表5:egfrcentyrin药物缀合物
细胞系中psma表达的定量
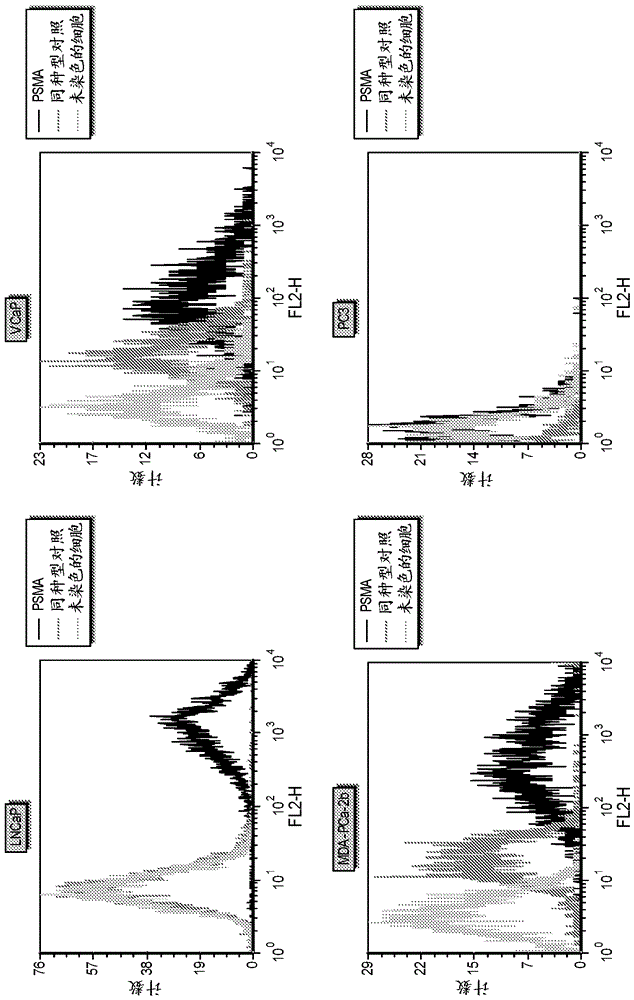
前列腺癌细胞系(lncap、vcap、mda-pca-2b和pc3)获自atcc(manassas,va)和使用推荐的生长培养基培养。psma表达水平通过流式细胞术定量。用accutase(mpbiomedicals,santaana,ca)将细胞从基底上离解并用饱和水平的缀合至pe的抗-psma抗体(clonegcp-05,20ug/ml,abcam,cambridge,ma)或同种型对照(r&dsystems,minneapolis,mn)染色1h。洗掉过量的抗体并使用bdfacscalibur记录荧光。抗体结合使用quantibrite珠(bdbiosciences,sanjose,ca)按制造商的指导定量。psma表达通过从对于psma特异性抗体测量的信号减去来自同种型对照的背景信号测定(假定各抗体可结合2个psma受体)。图5显示代表性直方图和表4概述了在四种细胞系中的psma定量。
表6:前列腺癌细胞系中的psma水平
抗-psmacentyrin药物缀合物对psma+细胞的选择性细胞毒性
在lncap、vcap、mda-pca-2b和pc3细胞中体外评价centyrin-vcmmaf缀合物的细胞毒性。在96孔黑色板中将细胞置于板中24h,然后用可变剂量的centyrin-vcmmaf缀合物处理。使细胞与centyrin药物缀合物(cdc)一起温育66-72h。根据制造商的说明书,celltiterglo(promega,madison,wi)用于评价毒性。将发光值输入excel和粘贴到prism中用于图形分析。使用x=log(x)转化数据,然后应用3-参数模型,使用非线性回归分析以确定ic50。
表7显示在细胞系小组中对于数种缀合至vcmmaf的centyrin的ic50值。cdc在lncap细胞(一种已知表达高水平的psma的细胞系)中是最有效的。cdc在mda-pca-2b和vcap细胞(具有低水平的psma的前列腺癌细胞系)中也具有活性。在pc3细胞(一种psma阴性细胞系)中未观察到活性,证实了选择性。ic50与各细胞上存在的抗原数量相关,在lncap(具有最多psma表达的细胞系)上观察到最佳活性。
表7:psma-结合centyrin药物缀合物的细胞毒性。数据提供了一次和九次曲线拟合之间的平均值。数据作为平均值±sem提供。
抗-egfrcentyrin药物缀合物对egfr+细胞的细胞毒性
在nci-h292和nci-h1573细胞中体外评价centyrin-peg4-mmaf缀合物的细胞毒性。在96孔黑色板中将细胞置于板中24h,然后用可变剂量的centyrin-peg4-mmaf缀合物处理。使细胞与centyrin药物缀合物(cdc)一起温育66-72h。celltiterglo用于评价毒性。将发光值输入excel和粘贴到prism中用于图形分析。使用x=log(x)转化数据,然后应用3-参数模型,使用非线性回归分析。
图6显示在具有1、2、3或4个药物分子的centyrin-药物缀合物处理后在a)nci-h292或b)nci-h1573细胞中的相对细胞存活。所有缀合物导致细胞死亡,并且毒性程度与药物数量/分子相关。
在h292肿瘤异种移植物中的体内功效
nci-h292细胞在rpmi+10%fbs中生长和皮下植入(在50%基质胶中稀释的2x106个细胞)雌性charlesriverscid浅褐色小鼠(n=8/组)。当肿瘤达到~200mm3时,静脉内给予小鼠4.7mg/kgcentyrin或centyrin-药物缀合物。各centyrin含有白蛋白结合结构域用于半衰期延长。在一周的时间内在第1、3、6天将总共三个剂量注入小鼠。使用卡尺每周两次测量肿瘤,当肿瘤大于2000mm3时处死。当超过4只或更多只小鼠剩余时报告组肿瘤测量。
图7显示各治疗组的平均肿瘤体积。非靶向centyrin-药物缀合物或者未缀合的centyrin都未显著影响肿瘤体积。相比之下,在用抗-egfrcentyrin-药物缀合物处理的小鼠中见到显著的肿瘤生长抑制。对于用抗-egfrcentyrin药物缀合物处理的组,开始给药后观察到肿瘤消退或生长抑制大于4周。
实施例7:通过用egfr结合centyrin靶向来细胞内递送peg-plga纳米颗粒
聚(乳酸-乙醇酸)共聚物(plga)纳米颗粒(np)显示生物相容性和功效,这是由于它们成功治疗感染性疾病和癌症[1-7]。plga与聚(γ-谷氨酸)(pga)或聚乳酸(pla)相比显示更大的水解稳定性和更快的降解速率。尽管对于plganp的sirna敲减和治疗功效存在一定成功,但对于特异性靶向和细胞内的内体-逃脱仍存在障碍,这必须被克服以改进效力。peg-plganp已用于递送小分子化学治疗药物以及核酸[8,10]。peg-plganp的靶向应用可用于递送药物和核酸货物,使得该系统在性质上是通用的[11,12]。
合成centyrin-官能化的peg-plganp
合成centyrin-官能化的peg-plganp的步骤如下:
1)用荧光团-af647官能化peg-plga纳米颗粒上的小百分比的胺
2)用叠氮化物官能化剩余的胺
3)用琥珀酸酐消耗任何(未反应的)剩余的胺
4)通过脱盐柱纯化peg-plga纳米颗粒以除去未反应的荧光团和叠氮化物
5)用mal-peg4-dbco缀合centyrin,并通过点击化学缀合centyrin到peg-plga-centyrin纳米颗粒的表面
6)通过superdex200柱纯化最终产物以除去未反应的centyrin
以下是上文步骤的详细概述。
1)用荧光团将胺官能化。将30mol%nh2-peg-plga(phosphorex,inc.)以1:1在50mm碳酸氢钠缓冲液ph8.5中稀释。加入胺反应性荧光团,使得胺与荧光团的最终摩尔比是1:1。在1ml的1.4mg/mpeg-plga中存在1.4mg或93.3纳摩尔的np。样品中的胺百分比是在样品中28纳摩尔的胺(93.3纳摩尔*30%胺化)。为了从20mm贮液实现28纳摩尔的af647,添加1.4ul到1ml悬浮液。将反应物在恒温混匀仪上在室温下温育30分钟,以900rpm摇动。
2)用nhs-peg4-叠氮化物将剩余的胺官能化。在加入叠氮化物之前,来自步骤1的反应物不需要纯化。为了确保反应完成,以原始胺含量的10倍摩尔过量加入叠氮化物。叠氮化物加入的计算为:
28纳摩尔*10倍摩尔过量=需要280纳摩尔的叠氮化物
280纳摩尔/100mm=2.8ul的叠氮化物样品直接加入纳米颗粒悬浮液
将2.8ul的叠氮化物交联剂加入纳米颗粒反应物并使反应在室温下运行1小时,以900rpm摇动。
3)将琥珀酸酐加入以除去任何残余的胺。加入1ul的1m琥珀酸酐到peg-plga-af647-centyrin反应物并在室温下在恒温混匀仪上温育30分钟,以950rpm摇动。
4)peg-plga-af647-centyrin通过脱盐纯化。当前具有gehiprep26/10脱盐柱的aktaavant用于此步骤。
5)centyrin用dbco-peg-马来酰亚胺官能化,接着与centyrin-dbco和np-叠氮化物进行点击反应。
a.在常规还原、沉淀和与交联剂反应后进行centyrin官能化步骤。centyrin-dbco缀合物在10kdamwcoamicon上浓缩至7-10mg/ml最终浓度。对于此步骤的计算,假定存在30mol%叠氮化物以确保加入足够的centyrin-dbco。另外,推荐加入~3倍摩尔过量的dbco产物至纳米颗粒。存在28纳摩尔的叠氮化物(来自1.4毫克制备物的30mol%叠氮化物)。如果centyrin-dbco是7mg/ml(~570um),加入84纳摩尔的centyrin以实现3倍摩尔过量(84纳摩尔/570um=加入147ul的centyrin)。使用gehiprep26/10脱盐柱用于从缀合的centyrin纯化过量dbco交联剂。
b.centyrin/peg-plga点击反应。使用50-100kdamwcoamicon来使peg-plga颗粒回到其初始体积(2500xrcf旋转5-10分钟通常足够)。获得1ml的纳米颗粒样品并转移至新的eppendorf管。反应可在室温下进行~4小时或在4-10c下进行过夜。选择前一选项。
6)纯化最终产物
小的制备级superdex200柱用于从未反应的centyrin-dbco分离靶向np的混合物的组分。选择含有np的级分,合并和直接用于实验。假定np收率损失20%。比较所有np的荧光并标准化以确保荧光准确指示浓度。
(图8:sec纯化后af647-标记的peg-plga-np的尺寸分布)
定量评价centyrin-靶向peg-plganp的结合和内化
peg-plga纳米颗粒用83-centyrin官能化。np完整性和尺寸通过动态光散射证实(图8)。np尺寸范围是100-120nm(z-平均直径)。
靶向np结合受体的特异性通过以各种受体密度测量83-靶向peg-plganp对egfr-表达细胞系小组的相对结合评价(小组包括阴性细胞系h520)。对照np包括非靶向(无centryin)np。获自atcc的细胞系是扁平上皮癌a431(>1,000,000个受体/细胞)、h358细支气管肺泡癌(~100k个受体/细胞)、肺腺癌hcc827(~800k个受体/细胞)、h292肺腺癌(~200k个受体/细胞)和h520肺癌(阴性细胞系)。程序包括在100ulrpmi培养基中以1e6个细胞/ml获得细胞并加入np,在37°c下温育1小时。将板置于旋转下。温育后,样品在facs缓冲液中洗涤和重悬用于流式细胞术分析。各细胞系通过fsc/ssc门控。对于各细胞系的门(认为可行和适合分析的细胞区域)是相同的。通过fl-4通道对于af647分析细胞。增加的af647信号指示更大的结合和内化事件。图9显示83-centyrin靶向np剂量依赖性结合和内化到egfr-表达细胞系。此外,这种剂量依赖性结合与egfr受体密度相关。靶向np不显示与阴性的非egfr表达细胞系h520的结合。此外,非靶向np不显示与细胞系的任何结合。
图9显示在37℃温育1小时后af647标记的83-centyrin靶向peg-plganp对egfr-表达细胞系小组的受体密度依赖性和剂量依赖性结合和内化。facs用于定量测量来自centyrin-np的af647信号。
通过成像定量评价centyrin-靶向peg-plganp的结合和内化
本实验的目的是通过使用opera共焦成像系统成像egfr+细胞系,检查centyrin-标记的np的内化。具体地,荧光83v2-peg-plganp与a431、hcc827、h292、h358和h520一起温育(用于基于facs的定量的相同细胞小组)。5种细胞系各自在t150瓶中培养和从37°c培养箱取出。细胞培养基是rpmi+10%fbs。除去细胞培养基并用1xdpbs将瓶轻轻冲洗。之后,细胞使用快速暴露于5ml0.25%胰蛋白酶解离,直到发现细胞已从其t150瓶底部移出(大约2-7分钟)。观察到松散的细胞时,将8ml的细胞培养基(rpmi1640+glutamax,10%fbs)加入瓶中。将细胞转移至15ml圆锥管和在rt下以1000rpm旋转5分钟。吸出管中的上清液并将剩余的细胞重悬于5ml的rpmi1640缓冲液中用于计数。进行细胞计数,并在96-孔板中将细胞稀释至各种浓度。选择10000个细胞/孔的细胞密度,使得在处理之前在温育20小时后细胞覆盖70%的表面。第二天吸出培养基,首先加入稀释的样品至其孔中并使用rpmi1640细胞培养基使体积达到100μl。样品在37°c下温育4小时,覆盖以防止光漂白。温育时间后,将板在4℃下以1500rpm旋转3分钟,用冷facs缓冲液洗涤2x。用hoechst染色细胞~20分钟以允许细胞核染色。此后,洗涤细胞1x和重悬于150ul的facs缓冲液中,然后成像。
图10:af647标记-83-centyrin(60x)的细胞结合和内化显示centyrin特异性结合egfr-表达细胞系hcc827。20x:c2f3,c5f1,c8f2;60x:c2f7,c5f2,c8f。
蓝色=100-2000(0.5),红色=10-100(0.5),减弱红色=10-2000(0.5)。
成像数据证实83centyrin-靶向np结合和内化到egfr-表达细胞系hcc827。靶向np不显示结合到阴性细胞系h520,证实了特异性。此外,非靶向np不显示结合到hcc827细胞系或阴性细胞系。较低受体数细胞系h292显示少得多的af647信号。
实施例8:egfrcentyrin缀合的反义寡核苷酸(aso)的制备和选择性细胞内递送
centyrin可用于通过受体介导的摄取使寡核苷酸特异性靶向目的靶细胞。如本文所述,将数种centyrin缀合至第二代2’o甲基gapmeraso并对于体外基因敲减,表征得到的缀合物。centyrin包括针对egfr受体和cd8受体的靶标。用centyrin靶向摄取aso的目的是通过受体介导的摄取,减少非特异性ps-aso介导的摄取和增强aso的效力。
方法:
合成和表征centyrin-aso缀合物
表8:具有点击处理和gapmer构型的malat1靶向aso
aso序列来源
malat1-seq.1
/5dbcon/mu*mg*mc*mc*mu*t*t*a*g*g*a*t*t*c*t*ma*mg*ma*mc*ma(integrateddnatechnologies(idt))(seqidno:47)
malat1-seq.2
mc*mc*ma*mg*mg*c*t*g*g*t*t*a*t*g*a*mc*mu*mc*ma*mg(integrateddnatechnologies(idt))(seqidno:48)
m=2’o甲基,*指示硫代磷酸酯键。dbco和aso通过磷酸二酯键连接(不存在*)。
缀合物通过点击化学缀合合成,其中dbco端基在malat1aso的5’末端和具有叠氮化物官能团的centyrin在c末端。呈gapmer构型的2’o甲基psaso获自integrateddnatechnologies(idt)以及centyrin根据goldberg等人[1]表达和纯化。加入到各蛋白的aso的量根据单个aso:两个centyrin摩尔比计算,其中起始aso质量为~2.0mg。对于tencon-malat1aso,阴离子交换captoq柱用于纯化。在aktaavant上制备1mlcaptoq柱(hitrapcaptoq1ml,gehealthcarelifesciences,17-5470-51)。细节是柱体积为0.962ml,缓冲液a为20mmtrisph6.5和缓冲液b为20mmtrisph6.5,2mnacl。用于纯化的方法:a.用5cv的缓冲液a以1ml/min平衡柱,b.使用样品泵注入样品,c.使用20%b(5cv)的分级梯度、经35cv线性梯度至70%b、100%(5cv)的分级梯度和最终0%(8cv)的分级梯度洗脱样品,d.在96孔板中收集所有级分1ml。通过负离子lc-ms分析级分,以分析确定单独的aso、aso缀合物和centyrin级分。合并含缀合物材料的相关级分和通过针对1mm磷酸钠(ph7.0)透析4小时进行缓冲液交换,在-80℃冷冻过夜和冻干2-3天。对于83-malat1aso,采用两步纯化方法,即首先用阴离子交换captoq柱,接着以高咪唑浓度洗脱的his-捕获纯化方法。阴离子纯化方法与对于tencon-malat1缀合物相同。his-捕获纯化方法利用hitrapbluehp1ml(gehealthcarelifesciences,17-0412-01),柱体积为0.962ml,缓冲液a为50mmtrisph7.5,500mmnacl,10mm咪唑,和缓冲液b为250mm咪唑。洗脱方案包括经20cv的100%缓冲液b,接着经5cv的100%b的分级梯度,其中在96孔深板中收集1.0ml级分。分析收集的级分、透析和冻干方法在上文详述。对于cd8-368-malat1aso,采用his-捕获的一步纯化,其细节在上文列出。对于该缀合物,如上所述合并级分,透析和冻干。
粗产物、来自纯化的级分和最终纯化材料通过lc-ms负离子表征分子量的准确性。在agilentmodelg6230ms-tof质谱仪上进行分析。该仪器以负电喷雾电离模式操作和从m/z700至3200扫描。在agilentinfinityii1290仪器上进行lc条件和包括:watersxbridgec8,2.5µm颗粒,2.1x50mm;柱温度75℃,缓冲液a=25mm三乙胺,570mm1,1,1,3,3,3,-六氟-2-丙醇,10%甲醇,缓冲液b=乙腈;流速=0.3ml/min;梯度0-2min1%b,2-12min150%b,12-15min75%b。质谱仪设置包括:负极性,700-3200amu质量范围;喷雾电压3750v;源温度350℃;干燥气流12l/min;喷雾器35psi;保护气体300℃;保护气流11l/min;喷嘴电压1200v;碎裂电压250v。ms光谱在7000-33000da之间使用最大熵算法手动解卷积。所有蛋白缀合物在负离子lc-ms上分析。lc-ms光谱显示对于tencon-malat1aso在5.659min具有质量19121.29da(6.5e6),对于83-malat1aso在6.02min具有质量19214.45da(3.2e6),和对于cd8-368malat1aso在4.851min具有质量7574.05da(2e4)和在6.094min具有质量18318.5da(1e7)。
图11:a)malat1-83缀合物的lc-ms显示19214da的准确分子量和单一物质,b)malat1-tencon缀合物的lc-ms显示19121.3da的准确分子量和单一物质。
图13:malat1-cd8368缀合物的lc-ms显示18318.5da(理论质量=18320da)的准确分子量和单一物质。
在a431细胞中使用centyrin-malat1aso缀合物的malat1mrna沉默
a431获自janssen的细胞库系统和在含hepes和10%fbs的rpmi中生长。细胞以2500个细胞/孔接种到96孔平底板中,在用aso和centyrin-aso缀合物处理之前持续24小时。使用第6和7代的细胞,其成活力大于90%。对于pcr,细胞使用pla试剂盒(proteinquantsamplelysiskit(pla),25ml.#partno.4448536,lot.no.00358254,到期:2017-02-02)裂解。对于cdna合成,将2ul的裂解产物与18ul的cdna合成混合物(highcapacitycdnareversetranscriptionkit,lifetechnologies:10xrt(partno.4368813lotno.002837)混合。一旦获得cdna,将其在4℃储存和用于pcr步骤。对于pcr,在384-孔板中使用viia7一式两份分析样品。对于pcr,将2.5ul的cdna与7.5ul的pcr混合物(taqman®fastgeneexpressionmastermix#4444557,lifetechnologies,lot1504065,到期24apr16)和用于ppib(20xppibvic引物-appliedbiosystems#hs00168719pn4448490750ul20x,lot150715-001h03,exp.07/2017)、持家基因和malat1(20xmalat1fam标记引物,pn4351370,exp.01/202268g12,lot.p170113-003g11)的引物混合,扩增靶基因。qpcr循环参数是40个循环,1个循环的顺序为50°c120秒,94.5°c10分钟,95°c15秒,接着60°c1分钟。△△ct方法用于测量malat1的基因敲减,其中30%cv标准应用于技术重复。阈值设定为0.2(扩增曲线的指数期)。
图12:通过rt-pcr在用aso或centryin-aso通过自由摄取处理的a431细胞中测量的malat1基因表达。处理后72小时测量pcr。来自两次生物实验的重复进行平均。
对于具有cd8-368靶向centyin的malat1kd,使用活化原代t细胞。t细胞获自janssen的细胞库系统和在含hepes和10%热灭活fbs的rpmi中生长。人cd3+t细胞(获自hemacare,catpb08nc-3,lot17041560)每1-2周使用il-2(终浓度20u/ml)活化。接种90%成活力的细胞并在同一天处理(从悬浮细胞开始)。细胞接种密度100,000个细胞/孔用于确保足够的pcr信号(t细胞中mrna含量低于其它细胞系)。pcr方法类似于a431细胞,不同之处在于持家基因为gapdh(20xgapdh20xgapdhvic标记引物hs02758991_g1,appliedbiosystems)。
图14:通过rt-pcr在用aso或centryin-aso通过自由摄取处理的原代t细胞中测量的malat1基因表达。处理后96小时测量pcr。从单次实验获得数据。
实施例9:选择和表征结合人epcam的centyrin和其缀合物
淘选结合人epcam的centyrin
cis展示用于从tcl7、tcl9和tcl14文库选择epcam-结合centyrin。对于体外转录和翻译(itt),3μg的文库dna在30°c下与0.1mm完整氨基酸、1xs30预混合组分和15μl的s30提取物(promega)一起温育,总体积为50μl。1小时后,加入375μl的阻断溶液(1xtbsph7.4,0.01%i-block(lifetechnologies,#t2015),100ug/ml鲱鱼精dna)和将反应物在冰上温育15分钟。itt反应物与融合至fc结构域的生物素化重组人epcam(r&dsystemscatalog#xxx)一起温育。生物素化重组蛋白和结合的文库成员在中性亲和素或链霉亲和素包被的磁珠上捕获。未结合的文库成员通过用tbst和tbs连续洗涤除去。洗涤后,通过加热至85°c持续10分钟从靶蛋白洗脱dna,并通过pcr扩增用于进一步轮次的淘选。通过在各轮次期间从400nm至100nm连续降低靶epcam的浓度和增加洗涤严格性,分离高亲和力结合剂。
淘选后,选择的fn3结构域通过pcr扩增,亚克隆至pet载体中,所述载体经修饰以包括连接酶非依赖性克隆位点,和转化到bl21-gold(de3)(stratagene)细胞中用于使用标准分子生物学技术在大肠杆菌中可溶性表达。将编码c-末端多组氨酸标签的基因序列加入各fn3结构域以能够纯化和检测。培养物在补充有100μg/ml羧苄青霉素的tb培养基中在1-ml96-孔模块中在37°c下生长至光密度0.6-0.8,然后加入iptg至1mm,此时温度降低至30°c。随后大约16小时通过离心收获细胞和在-20°c下冷冻。通过在0.6ml的bugbuster®ht裂解缓冲液(novagenemdbiosciences)中在室温下温育各沉淀45分钟,同时摇动进行细胞裂解。
基于细胞的筛选
还对于结合a431细胞(一种以高水平表达epcam的癌细胞系),筛选在淘选中鉴定的centyrin。centyrin裂解产物以1:100在2%fbs-pbs中稀释并加入含有8x104个解离的a431细胞的96孔板。在冰上1hr温育后,除去培养基和将细胞重悬于100ul2%fbs-pbs。然后加入抗centyrin兔抗体pab25至10ug/ml和在冰上温育1hr。除去培养基并将细胞重悬于100ul2%fbs-pbs中,和以1:200稀释度加入驴-抗-兔-f(ab')2-pe缀合物(jacksonimmunoresearchcatalog#711-116-152)。在冰上1hr温育后,除去培养基和将细胞重悬于250ul2%fbs-pbs中。结合在bdfacscalibur仪器上通过流式细胞术分析。具有超过背景(仅具有pab25和第二抗体的细胞)超过10x的mfi的centyrin被分类为细胞结合剂。
针对epcam来自淘选的三种centyrin被选择用于根据筛选数据、蛋白表达和生物物理表征(表x)的组合评价靶向递送。
编码3种用c-末端半胱氨酸修饰的centyrin的基因获自dna2.0并用于表达和纯化蛋白,如上所述。通过半胱氨酸-马来酰亚胺化学(brinkley,bioconjugatechemistry3:2-13,1992)将centyrin缀合至vc-mmaf。centyrin-vcmmaf缀合物的细胞毒性在a431、ht29和lncap细胞中体外评价。在96-孔黑色板中将细胞置于板中24h,然后用可变剂量的centyrin-vcmmaf缀合物处理。细胞与centyrin药物缀合物(cdc)一起温育66-72h。celltiterglo用于评价毒性,如上所述。将发光值输入excel,从其中拷贝它们并粘贴到prism中用于图形分析。使用x=log(x)转化数据,然后应用3-参数模型,使用非线性回归分析以确定ic50。
表9:epcam-结合centyrin作为药物缀合物测试
随后对于作为cdc的活性,评价45种centyrin的另外小组。获得编码具有c-末端分选酶标签的centyrin的基因,并表达和纯化蛋白。使用分选酶和gly3-vcmmaf通过高通量缀合将centyrin缀合至vcmmaf。cdc的细胞毒性在colo205细胞中使用上述celltiterglo测定评价。在3个浓度(20、2和0.2nm)下测试各cdc。鉴定具有与isop130r5cp6_a06相当或比其更有效的活性的6种cdc。这些在全剂量-响应中进一步表征(表y)。确定centyrinisop130r5cp6_f01和isop130r5cp7_g02比isop130r5cp6_a06更有效。这些,以及isop130r5cp6_e08,还通过差示扫描量热法表征以确定熔解温度。
表10:在cdc筛选中鉴定的epcam结合剂的概述
克隆idseqid%成活
colo205细胞,1nm
抗-epcamcentyrin的改造
编码代表性epcam-结合centyrinisop130r5cp6_a06的“丙氨酸扫描”变体的基因获自dna2.0并用于表达和纯化蛋白,如上所述。在bc和fg环中每个非丙氨酸位置产生单丙氨酸变体,总共15个。通过分选酶反应将centyrin缀合至vcmmaf并如上所述纯化。colo205细胞用缀合物处理~72小时,和用celltiterglo监测细胞毒性。
表11:isop130r5cp6_a06的丙氨酸扫描变体
许多测试的位置耐受突变为丙氨酸,表明对活性的很少影响。在位置tyr25、arg26、pro27、leu81、pro82和tyr85见到最大影响,表明这些氨基酸在epcam结合中起重要作用。在鉴定的epcam结合剂中这些残基在很大程度上是保守的,进一步支持它们在结合epcam中的作用。
序列id
seqidno.1=p155r8-g3
mlpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglkpgteytvsingvkggtrswslsaiftt
seqidno.2=eeb8
mlpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglcpgteytvsingvkggtrswslsaifttapapapapaplpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglkpgteytvsingvkggtrswslsaifttapapapapaptidewllkeakekaieelkkagitsdyyfdlinkaktvegvnalkdeilka
seqidno.3=eeb9
mlpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglcpgteytvsingvkggtrswslsaifttapapapapaplpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglcpgteytvsingvkggtrswslsaifttapapapapaptidewllkeakekaieelkkagitsdyyfdlinkaktvegvnalkdeilka
seqidno.4=eeb11
mlpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglcpgteytvsingvkggtrswslsaifttapcpapapaplpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglcpgteytvsingvkggtrswslsaifttapapapapaptidewllkeakekaieelkkagitsdyyfdlinkaktvegvnalkdeilka
seqidno.5=eeb10
mlpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglcpgteytvsingvkggtrswslsaifttapcpapapaplpapknlvvsrvtedsarlswtapdaafdsfqiyysellsygeaivltvpgsersydltglcpgteytvsingvkggtrswslsaifttapcpapapaptidewllkeakekaieelkkagitsdyyfdlinkaktvegvnalkdeilka
seqidno.6=ecb166
mlpapknlvvsevtedsarlswtapdaafdsfliqyqesekvgeaivltvpgsersydltglcpgteytvsiygvkgghrsnplsaifttapcpapapaplpapknlvvsevtedsarlswtapdaafdsfliqyqesekvgeaivltvpgsersydltglcpgteytvsiygvkgghrsnplsaifttapapapapaptidewllkeakekaieelkkagitsdyyfdlinkaktvegvnalkdeilka
seqidno.7=abdcon12
tidewllkeakekaieelkkagitsdyyfdlinkaktvegvnalkdeilka
seqidno.8=p233fr9p1001_h3-1
lpapknlvvsrvtedsarlswtapdaafdsfpigywewdddgeaivltvpgsersydltglkpgteyhvyiagvkggqwsfplsaiftt
seqidno.9=p234cr9_h01
lpapknlvvsrvtedsarlswewwvipgdfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvnsgqwndtsnplsaiftt
seqidno.10=p233fr9_h10
lpapknlvvsrvtedsarlswtapdaafdsfaigywewdddgeaivltvpgsersydltglkpgteypvyiagvkggqwsfplsaiftt
seqidno.11=p229cr5p819_h11
lpapknlvvsrvtedsarlswdideqrdwfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvyhvyrssnplsaiftt
seqidno.12=分选酶a
mshhhhhhssgenlyfqskphidnylhdkdkdekieqydknvkeqaskdkkqqakpqipkdkskvagyieipdadikepvypgpatreqlnrgvsfaeeneslddqnisiaghtfidrpnyqftnlkaakkgsmvyfkvgnetrkykmtsirnvkptavevldeqkgkdkqltlitcddyneetgvwetrkifvatevk
seqidno.13=无标签分选酶a
skphidnylhdkdkdekieqydknvkeqaskdkkqqakpqipkdkskvagyieipdadikepvypgpatreqlnrgvsfaeeneslddqnisiaghtfidrpnyqftnlkaakkgsmvyfkvgnetrkykmtsirnvkptavevldeqkgkdkqltlitcddyneetgvwetrkifvatevk
seqidno.14=isop130r5cp6_a06_cys
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhggc
seqidno.15=isop130r5cp7_g04_cys
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvaahaipryasnplsaifttgghhhhhhggc
seqidno.16=iso124r5ab_d6_cys
mlpapknlvvsrvtedsarlswhnhrpqfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvaiavpwnyqsnplsaifttgghhhhhhggc
seqidno.17=isop130r5cp7_g02srt
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaiiltvpgsersydltglkpgteytvsiygvvthalptaytsnplsaifttgghhhhhhgglpetggh
seqidno.18=isop130r5cp6_e08srt
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvaalpnnyasnplsaifttgghhhhhhgglpetggh
seqidno.19=isop130r5cp6_a06srt
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.20=isop130r5cp6_f01srt
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsnyisnplsaifttgghhhhhhgglpetggh
seqidno.21=isop130r5cp6_f02srt
mlpapknlvvsrvtedsarlswdqyrkyagfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvthalpqtyqsnplsaifttgghhhhhhgglpetggh
seqidno.22=isop130r5cp7_f11srt
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygviwgalpnsyssnplsaifttgghhhhhhgglpetggh
seqidno.23=isop130r5cp6_a02srt
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvnnalprwyisnplsaifttgghhhhhhgglpetggh
seqidno.24=isop130r5cp6_a06_k23a
mlpapknlvvsrvtedsarlswahyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.25=isop130r5cp6_a06_h24a
mlpapknlvvsrvtedsarlswkayrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.26=isop130r5cp6_a06_y25a
mlpapknlvvsrvtedsarlswkharpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.27=isop130r5cp6_a06_r26a
mlpapknlvvsrvtedsarlswkhyapgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.28=isop130r5cp6_a06_p27a
mlpapknlvvsrvtedsarlswkhyragarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.29=isop130r5cp6_a06_g28a
mlpapknlvvsrvtedsarlswkhyrpaarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.30=isop130r5cp6_a06_r30a
mlpapknlvvsrvtedsarlswkhyrpgaafdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.31=isop130r5cp6_a06_v78a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvatalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.32=isop130r5cp6_a06_t79a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvaalpsyyssnplsaifttgghhhhhhgglpetggh
seqidno.33=isop130r5cp6_a06_l81a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtaapsyyssnplsaifttgghhhhhhgglpetggh
seqidno.34=isop130r5cp6_a06_p82a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalasyyssnplsaifttgghhhhhhgglpetggh
seqidno.35=isop130r5cp6_a06_s83a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpayyssnplsaifttgghhhhhhgglpetggh
seqidno.36=isop130r5cp6_a06_y84a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsayssnplsaifttgghhhhhhgglpetggh
seqidno.37=isop130r5cp6_a06_y85a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyassnplsaifttgghhhhhhgglpetggh
seqidno.38=isop130r5cp6_a06_s86a
mlpapknlvvsrvtedsarlswkhyrpgarfdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvvtalpsyyasnplsaifttgghhhhhhgglpetggh
本文地址:https://www.jishuxx.com/zhuanli/20240726/122079.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表