开发可诱导簇嵌合抗原受体(CCAR)构建体的制作方法
- 国知局
- 2024-09-05 14:40:51
背景技术:
1、几乎所有类型的癌症均会产生耐药性,变得难以治疗。耐药机制数量惊人且种类繁多,包括遗传上不同的癌细胞的克隆进化和竞争性生长、癌细胞的表观遗传适应与细胞状态的转录变化,以及导致药物靶点表达丧失的可变剪接事件。克服癌症耐药机制并为癌症患者(特别是患有播散性癌症的患者)找到治疗方法仍然是一项重大的医疗需求。
2、此外,已知肿瘤细胞通过若干细胞内在机制消除其细胞上的免疫疗法靶点,包括通过转录状态变化和表观遗传适应下调癌细胞表面的靶蛋白、靶蛋白的基因缺失、靶蛋白的突变、通过剪接去除免疫治疗结合位点、通过构象变化掩盖靶点以及生产相关机制。
3、因此,需要特异性针对肿瘤部位递送有效的治疗剂,同时保护正常的非病变组织。这种方法和系统将使得能够有效地施用治疗剂,否则如果全身施用治疗剂将产生很大的毒性。它们也特别具有吸引力,因为大多数肿瘤倾向于成簇生长和转移,而不是均匀地分布在身体各处。
技术实现思路
1、本公开的第一个方面涉及一种包含三种核酸中的至少一种的核酸构建体。第一核酸包含第一启动子,该第一启动子可操作地连接到编码第一嵌合抗原受体(本文也称为“蛋白酶car”)的核酸,该第一嵌合抗原受体包含具有与第一肿瘤相关抗原(taa)结合的第一抗原结合结构域的第一胞外结构域、第一跨膜结构域以及包含第一信号传导结构域和蛋白酶结构域的第一胞内结构域。三种核酸中的第二核酸包含第二启动子,该第二启动子可操作地连接到编码第二car(本文也称为“活化car”)的核酸,该第二car包括包含与taa结合的第二抗原结合结构域的第二胞外结构域、第二跨膜结构域以及包含第二信号传导结构域、蛋白酶识别的切割位点和转录激活因子的第二胞内结构域。三种核酸中的第三核酸包含与转录激活因子结合的转录接纳体、第三启动子以及编码前导肽和可操作地连接到第三启动子的治疗有效载荷的核酸。
2、本公开的另一个方面涉及一种载体,其包含编码蛋白酶car、活化car、第三核酸、三种核酸中的两种的子组合或全部三种核酸的核酸构建体。
3、本公开的又一个方面涉及一种生产遗传修饰免疫细胞的方法。该方法需要将第一核酸构建体、第二核酸构建体和第三核酸构建体引入免疫细胞,其中:第一核酸构建体包含可操作地连接到编码蛋白酶car的核酸的启动子,该蛋白酶car包括包含与第一taa结合的抗原结合结构域的胞外结构域、跨膜结构域以及包含第一信号传导结构域和蛋白酶结构域的胞内结构域;第二核酸构建体包含可操作地连接到编码活化car的核酸的启动子,该活化car包括包含与第二taa结合的抗原结合结构域的胞外结构域、跨膜结构域以及包含第二信号传导结构域、蛋白酶识别的切割位点和转录激活因子的胞内结构域;并且第三核酸构建体包含结合转录激活因子的转录接纳体、第三启动子以及编码前导肽和可操作地连接到第三核酸构建体的启动子的治疗有效载荷的核酸。
4、本公开的又一个方面涉及一种含有第一核酸、第二核酸和第三核酸的遗传修饰免疫细胞。
5、本公开的又一个方面涉及一种药物组合物,其包含治疗有效数量的遗传修饰免疫细胞和药学上可接受的载体。
6、本公开的另一个方面涉及一种治疗癌症的方法。该方法需要向有需要的受试者施用该药物组合物。
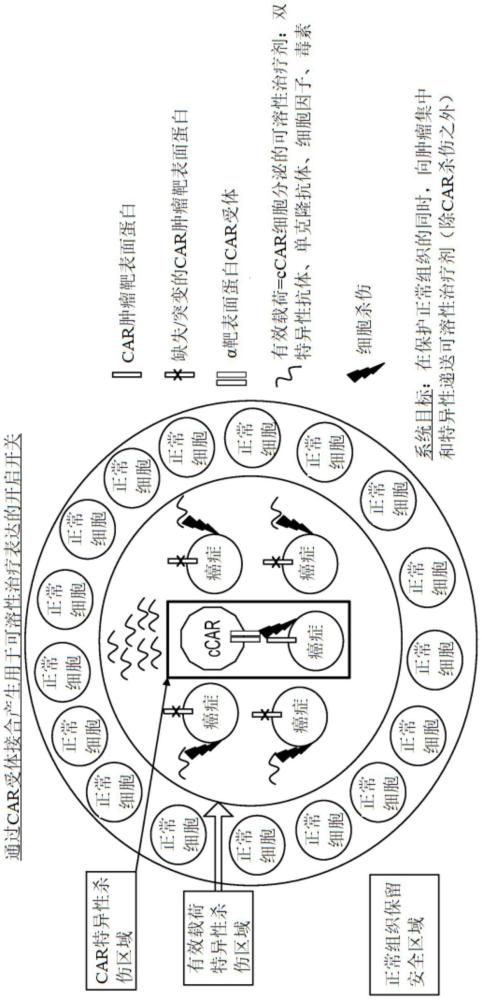
7、在不受操作理论的约束的情况下,本申请人认为,在向癌症患者施用后,遗传修饰免疫细胞通过“簇效应(cluster effect)”实现治疗效力,因为在与癌细胞结合后,免疫细胞(本文称为簇car(ccar)细胞)产生治疗有效载荷以在免疫细胞膜上表达,或释放到细胞外空间,然后与紧邻的其他癌细胞结合并产生治疗效果(例如,杀死)。本文公开的工作实施例展示了适用于免疫细胞(例如,t细胞、nk细胞)的治疗性簇car系统如何有效地将治疗剂输送到肿瘤部位,同时基本上保护健康组织。
技术特征:1.一种核酸构建体,所述核酸构建体包含:
2.根据权利要求1所述的核酸构建体,所述核酸构建体包含所述第一核酸、所述第二核酸和所述第三核酸。
3.根据权利要求1所述的核酸构建体,所述核酸构建体包含所述第一核酸、所述第二核酸和所述第三核酸中的两种。
4.根据权利要求1-3中任一项所述的核酸构建体,其中,所述第一启动子、所述第二启动子或者所述第一启动子和所述第二启动子两者是ef-1α、cmv、pgk、rpbsa、ampr或cag启动子。
5.根据权利要求4所述的核酸构建体,其中,所述第一启动子和所述第二启动子是ef-1α启动子。
6.根据权利要求1所述的核酸构建体,其中,所述第一抗原结合结构域、所述第二抗原结合结构域或者所述第一抗原结合结构域和所述第二抗原结合结构域两者结合b细胞成熟抗原(bcma)、cd19、cd20、cd38、cd138、fcrh5、gprc5d或slamf7。
7.根据权利要求6所述的核酸构建体,其中,所述第一抗原结合结构域和所述第二抗原结合结构域结合bcma。
8.根据权利要求7所述的核酸构建体,其中,所述第一抗原结合结构域或所述第二抗原结合结构域包含vl结构域和vh结构域,所述vl结构域包含氨基酸序列
9.根据权利要求6所述的核酸构建体,其中,所述第一抗原结合结构域或所述第二抗原结合结构域结合cd38。
10.根据权利要求9所述的核酸构建体,其中,所述第一抗原结合结构域或所述第二抗原结合结构域包含vl结构域和vh结构域,所述vl结构域包含氨基酸序列
11.根据权利要求6所述的核酸构建体,其中,所述第一抗原结合结构域或所述第二抗原结合结构域结合slamf7。
12.根据权利要求11所述的核酸构建体,其中,所述第一抗原结合结构域或第二抗原结合结构域包含vl结构域和vh结构域,所述vl结构域包含氨基酸序列
13.根据权利要求6所述的核酸构建体,其中,所述第一抗原结合结构域或所述第二抗原结合结构域结合fcrh5。
14.根据权利要求14所述的核酸构建体,其中,所述第一抗原结合结构域或第二抗原结合结构域包含vl结构域和vh结构域,所述vl结构域包含氨基酸序列
15.根据权利要求1-14中任一项所述的核酸构建体,其中,所述第一抗原结合结构域和所述第二抗原结合结构域结合相同的taa。
16.根据权利要求15所述的核酸构建体,其中,所述第一抗原结合结构域和所述第二抗原结合结构域具有相同的氨基酸序列。
17.根据权利要求1所述的核酸构建体,其中,所述第一跨膜结构域或所述第二跨膜结构域源自cd3、cd8α、cd28或cd137。
18.根据权利要求17所述的核酸构建体,其中,所述第一跨膜结构域和所述第二跨膜结构域源自cd28。
19.根据权利要求18所述的核酸构建体,其中,所述第一跨膜结构域和所述第二跨膜结构域具有氨基酸序列
20.根据权利要求1所述的核酸构建体,其中,所述第一胞外结构域还包含设置在所述第一抗原结合结构域和所述第一跨膜结构域之间的第一铰链结构域,并且其中所述第二胞外结构域还包含设置在所述第二抗原结合结构域和所述第二跨膜结构域之间的第二铰链结构域。
21.根据权利要求20所述的核酸构建体,其中,所述第一铰链结构域和所述第二铰链结构域源自cd8α、igg1或igg4。
22.根据权利要求21所述的核酸构建体,其中,所述第一铰链结构域和所述第二铰链结构域源自cd8α。
23.根据权利要求22的所述核酸构建体,其中,所述第一铰链结构域和所述第二铰链结构域包含氨基酸序列
24.根据权利要求1所述的核酸构建体,其中,所述第一信号传导结构域、所述第二信号传导结构域、或所述第一信号传导结构域和所述第二信号传导结构域两者包含主要信号传导结构域、共刺激信号传导结构域、或主要信号传导结构域和共刺激信号传导结构域两者。
25.根据权利要求24所述的核酸构建体,其中,所述第一信号传导结构域包括cd3ζ主要信号传导结构域,所述第二信号传导结构域包括cd28主要信号传导结构域。
26.根据权利要求24所述的核酸构建体,其中,所述第一信号传导结构域、所述第二信号传导结构域、或所述第一信号传导结构域和所述第二信号结构域两者包括cd3ζ主要信号传导结构域和4-1bb共刺激信号传导结构域、或cd28共刺激信号传导结构域、或4-1bb共刺激信号传导结构域和cd28共刺激信号传导结构域两者。
27.根据权利要求26所述的核酸构建体,其中,所述第一信号传导结构域和所述第二信号传导结构域包含cd3ζ主要信号传导结构域以及4-1bb共刺激信号传导结构域和cd28共刺激信号传导结构域。
28.根据权利要求27所述的核酸构建体,其中,所述cd3ζ主要信号传导结构域包含氨基酸序列
29.根据权利要求1所述的核酸构建体,其中,所述第一car还包含与蛋白酶结构域的n末端相连的第一接头,并且其中所述第二car还包含与切割位点的n末端相连的第二接头。
30.根据权利要求1的所述核酸构建体,其中,所述蛋白酶结构域源自烟草蚀刻病毒蛋白酶(tevp),并且所述切割位点包含可被tevp切割的序列。
31.根据权利要求30所述的核酸构建体,其中,所述切割位点包含氨基酸序列enlyfqm(seq id no:83)。
32.根据权利要求1所述的核酸构建体,其中,所述转录激活因子包含gal4-vp64融合蛋白,并且所述转录接纳体包含gal4结合位点,其中所述第三启动子是修饰的cmv启动子。
33.根据权利要求1所述的核酸构建体,其中,所述治疗有效载荷包含抗体片段、细胞因子、可溶性细胞因子受体、趋化因子、可溶性趋化因子受体、rna或寡肽疫苗、或表面受体。
34.根据权利要求33所述的核酸构建体,其中,所述治疗剂包含结合cd3、cd19、cd20、hla-e、tgfβ、pd-l1、egfr、nkg2a、tigit、lag3或ctla4的抗体片段。
35.根据权利要求34所述的核酸构建体,其中,所述治疗有效载荷包含双特异性抗体片段或双特异性t细胞接合剂。
36.根据权利要求35所述的核酸构建体,其中,所述治疗有效载荷包括双特异性抗体片段,所述双特异性抗体片段包含结合cd3的scfv和结合bcma、cd19、cd20、cd33、cd38、cd138、egfr、fcrh5、flt3、gpcr5d、psma或slamf7的scfv。
37.根据权利要求36所述的核酸构建体,其中,所述治疗有效载荷包含双特异性抗体片段,所述双特异性抗体片段包含结合cd19的scfv和结合cd3的scfv。
38.根据权利要求37所述的核酸构建体,其中,所述治疗有效载荷包含双特异性抗体片段,所述双特异性抗体片段包含氨基酸序列diqltqspaslavslgqratisckasqsvdydgdsylnwyqqipgqppklliydasnlvsgipprfsgsgsgtdftlnihpvekvdaatyhcqqstedpwtfgggtkleikggggsggggsggggsqvqlqqsgaelvrpgssvkisckasgyafssywmnwvkqrpgqglewigqiwpgdgdtnyngkfkgkatltadessstaymqlsslasedsavyfcarretttvgryyyamdywgqgttvtvssggggsdiklqqsgaelarpgasvkmscktsgytftrytmhwvkqrpgqglewigyinpsrgytnynqkfkdkatlttdkssstaymqlssltsedsavyycaryyddhycldywgqgttltvssveggsggsggsggsggvddiqltqspaimsaspgekvtmtcrasssvsymnwyqqksgtspkrwiydtskvasgvpyrfsgsgsgtsysltissmeaedaatyycqqwssnpltfgagtklelk(seq id no:120)。
39.根据权利要求36所述的核酸构建体,其中,所述治疗有效载荷包含双特异性抗体片段,所述双特异性抗体片段包含结合cd20的scfv和结合cd3的scfv。
40.根据权利要求36所述的核酸构建体,其中,所述治疗有效载荷包含双特异性抗体片段,所述双特异性抗体片段包含结合fcrh5的scfv和结合cd3的scfv。
41.根据权利要求40所述的核酸构建体,其中,所述治疗有效载荷包含双特异性抗体片段,所述双特异性抗体片段包含氨基酸序列diqmtqspsslsasvgdrvtitckasqdvrnlvvwfqqkpgkapklliysgsyrysgvpsrfsgsgsgtdftltisslqpedfatyycqqhysppytfgqgtkveikggggsggggsggggsevqlvesgpglvkpsetlsltctvsgfsltrfgvhwvrqppgkglewlgviwrggstdynaafvsrltiskdnsknqvslklssvtaadtavyycsnhyygssdyaldnwgqgtlvtvssggggsevqlvqsgaevkkpgasvkvsckasgftftsyyihwvrqapgqglewigwiypendntkynekfkdrvtitadtststaylelsslrsedtavyycardgysryyfdywgqgtlvtvssggggsggggsggggsdivmtqspdslavslgeratinckssqsllnsrtrknylawyqqkpgqspklliywtstrksgvpdrfsgsgsgtdftltisslqaedvavyyckqsfilrtfgqgtkveik(seq id no:121)。
42.根据权利要求33所述的核酸构建体,其中,所述治疗有效载荷包含结合细胞因子、细胞因子受体、趋化因子或趋化因子受体的抗体片段。
43.根据权利要求42所述的核酸构建体,其中,所述抗体片段结合il-6或il-6r。
44.根据权利要求33所述的核酸构建体,其中,所述治疗有效载荷包含细胞因子、可溶性细胞因子受体、趋化因子或可溶性趋化因子受体。
45.根据权利要求44所述的核酸构建体,其中,所述细胞因子或趋化因子是ifnγ、il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10或tgfβ。
46.根据权利要求45所述的核酸构建体,其中,所述细胞因子或趋化因子是ifnγ、il-2或tgfβ。
47.根据权利要求45所述的核酸构建体,其中,所述可溶性细胞因子受体或所述趋化因子受体是可溶性ifnγr或可溶性il-2r。
48.根据权利要求33所述的核酸构建体,其中,所述治疗有效载荷包含rna或寡肽疫苗。
49.根据权利要求46所述的核酸构建体,其中,所述rna或寡肽疫苗针对存活蛋白、wt1、muc1、mage-a3或ct7。
50.根据权利要求33所述的核酸构建体,其中,所述治疗有效载荷包含表面受体。
51.根据权利要求50所述的核酸构建体,其中,所述表面受体包含car、ctla-4、pd1、pd-l1、pd-l2。
52.根据权利要求29-51中任一项所述的核酸,其中,所述第一接头、所述第二接头、或所述第一接头和所述第二接头两者包含氨基酸序列gggx、ggggx(seq id no:89)或gssgsx(seq id no:90),其中x为c或s。
53.根据权利要求52所述的核酸,其中,所述接头具有氨基酸序列ggggsggggsggggsggggs(seq id no:94)、
54.一种载体,其包含权利要求1-53中任一项所述的核酸构建体。
55.根据权利要求54所述的载体,其是慢病毒载体。
56.一种生产遗传修饰免疫细胞的方法,其包括:
57.根据权利要求56所述的方法,其中,所述第一car还包含与蛋白酶结构域的n末端相连的第一信号传导结构域和第一接头,并且其中所述第二car还包含与切割位点的n末端相连的第二信号传导结构域和第二接头。
58.根据权利要求56所述的方法,其中,所述第一核酸构建体、所述第二核酸构建体和所述第三核酸构建体经由一个载体引入所述免疫细胞。
59.根据权利要求56所述的方法,其中,所述第一核酸构建体、所述第二核酸构建体和所述第三核酸构建体中的两种经由第一载体引入所述免疫细胞,并且所述三种核酸构建体中的第三种经由第二载体引入所述免疫细胞。
60.一种遗传修饰免疫细胞,其包含:
61.根据权利要求60所述的免疫细胞,其中,所述第一car还包含与所述蛋白酶结构域的n末端相连的第一信号传导结构域和第一接头,并且其中所述第二car还包含与切割位点的n末端相连的第二信号传导结构域和第二接头。
62.根据权利要求60所述的免疫细胞,其中,所述第一核酸构建体、所述第二核酸构建体和所述第三核酸构建体设置在一个载体中。
63.根据权利要求60所述的免疫细胞,其中,所述第一核酸构建体、所述第二核酸构建体和所述第三核酸构建体中的两种设置在第一载体中,并且所述三种核酸构建体中的第三种设置在第二载体中。
64.根据权利要求60-63中任一项所述的免疫细胞,其中,所述免疫细胞是t细胞。
65.根据权利要求64所述的免疫细胞,其中,所述免疫细胞是cd8+t细胞。
66.根据权利要求60-63中任一项所述的免疫细胞,其中,所述免疫细胞是nk细胞。
67.一种药物组合物,其包含治疗有效数量的权利要求63-66中任一项所述的免疫细胞,和药学上可接受的载体。
68.一种治疗癌症的方法,其包括:
69.根据权利要求68的方法,其中,所述受试者先前接受过car-t细胞疗法或bite疗法。
70.根据权利要求68所述的方法,其中,所述癌症的特征是实体肿瘤。
71.根据权利要求70所述的方法,其中,以实体肿瘤为特征的癌症是乳腺癌、膀胱癌、卵巢癌、胰腺癌、肺癌、肝癌、前列腺癌、脑癌、胃肠道癌、睾丸癌、子宫癌和儿童癌症。
72.根据权利要求68所述的方法,其中,所述癌症是血液系统癌症。
73.根据权利要求72所述的方法,其中,所述血液系统癌症是多发性骨髓瘤、白血病或淋巴瘤。
技术总结公开了簇CAR和治疗有效载荷核酸、包含它们的免疫细胞以及它们用于可控过继细胞疗法和杀死CAR T细胞耐药肿瘤细胞的用途。技术研发人员:J·G·洛尔,B·克诺切尔受保护的技术使用者:丹娜-法伯癌症研究院技术研发日:技术公布日:2024/9/2本文地址:https://www.jishuxx.com/zhuanli/20240905/287615.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表