一种用于外泌体源性mRNA测量的SERS传感芯片、制备方法及应用
- 国知局
- 2024-09-11 14:52:40
本发明涉及生物检测,尤其涉及一种用于外泌体源性mrna测量的sers传感芯片、制备方法及应用。
背景技术:
1、外泌体是由细胞分泌的纳米级膜性小囊泡,富含来源细胞的蛋白质、脂质、dna和rna(microrna、mrna、lncrna、circrna),外泌体携带着这些信息物质在细胞间通讯中起中介作用。由于外泌体特殊的膜结构能够保护其源性部的rna免受酶的降解,因此,外泌体中各类rna的含量相对于体液rna来说更为稳定,浓度更高。有研究表明,外泌体rna能够影响肿瘤的发生发展、转移、侵袭及肿瘤微环境。
2、目前,外泌体源性mrna的检测需要对外泌体进行提取、分离、裂解,从而获得mrna,这种方法操作步骤复杂,耗时较长,且在多步操作过程中容易造成样品交叉污染以及含量的缺失,容易导致检测结果的不准确。此外,由于外泌体源性mrna的丰度较低,现有的方法很难达到高灵敏度的检测结果。因此,迫切需要开发一种快速、可靠、简便的外泌体源性mrna的检测方法。
3、表面增强拉曼散射光谱(surface enhanced raman scattering,sers)技术作为一种新兴的生物标记手段,是当前国际上备受瞩目的研究热点。sers一方面继承了拉曼光谱的诸多优点,如光信号不易漂白、对生物组织损伤小、光谱信息丰富等;另一方面,它弥补了传统拉曼散射信号强度弱、不利于检测的缺点。sers光谱的“指纹”特性使人们能在复杂的生物环境中跟踪、检测目标分子。此外,sers效应巨大的增强作用使基于sers的光谱检测具有超高的灵敏度,甚至可实现单分子水平的分析研究。sers效应产生在纳米尺度粗糙的金属表面,纳米技术的飞速发展为构筑多功能化的sers纳米探针提供了丰富的技术途径。这些基于sers光谱技术的纳米探针在生物成像、核酸或蛋白检测、肿瘤识别、药物输运等诸多生物医学领域展现出了优异的应用前景。
技术实现思路
1、本发明所要解决的技术问题是提供一种用于外泌体源性mrna测量的sers传感芯片、制备方法以及利用sers技术对外泌体源性mrna进行定性定量检测的方法。
2、为了解决上述问题,本发明提出以下技术方案:
3、第一方面,本发明提供一种用于外泌体源性mrna测量的sers传感芯片,包括衬底层,形成于所述衬底层表面的金属增强层,以及形成于所述金属增强层表面的修饰层;
4、所述修饰层含有识别所述外泌体的受体蛋白或抗体、功能化的银纳米粒子和dna链;
5、所述功能化的银纳米粒子表面修饰4-巯基苯甲酸和亲和素;
6、所述dna链的核苷酸序列的5’端偶联巯基,3’端偶联生物素;
7、所述dna链的核苷酸序列的3’端与所述功能化的银纳米粒子通过生物素-亲和素连接;所述dna链的核苷酸序列的5’端与所述金属增强层通过巯基-金属共价连接;
8、所述dna链的核苷酸序列能够特异性与外泌体源性的mrna核苷酸序列彼此形成互补双链连接。
9、进一步地,所述dna链的核苷酸序列为:
10、5'-hs-(ch2)6-tttcatctcttctccgagccggtcgaaatagtgagt-biotin teg-3';
11、所述mrna核苷酸序列为:caacgtgtcagugguggaccu。
12、可以理解地,基于dna杂交链完全碱基互补配对的原则,本发明提供的dna链核苷酸序列并不唯一。任意基于外泌体源性的mrna设计的dna链均可以作为所述修饰层上的dna链,特异性与外泌体源性的mrna核苷酸序列形成互补双链连接。
13、进一步地,所述衬底层选自ito导电玻璃,所述金属增强层为金层或银层。
14、进一步地,所述受体蛋白或抗体为cd9、cd63、cd81中的至少一种。
15、第二方面,本发明提供一种如第一方面所述的用于外泌体源性mrna测量的sers传感芯片的制备方法,包括以下步骤:
16、s1、制备银纳米粒子,在所述银纳米粒子表面修饰亲和素和4-巯基苯甲酸,得到功能化的银纳米粒子;
17、s2、将衬底清洗干净后进行羟基化处理,在羟基化的衬底表面镀制金属增强层,得到芯片;
18、s3、将所述芯片进行羧基化处理,活化,与含有识别所述外泌体的受体蛋白或抗体的第一修饰液进行恒温孵育,孵育完成后清洗;然后将其与含有所述dna链核苷酸序列的第二修饰液进行恒温孵育,孵育完成后清洗,氮气吹干,得到功能化的芯片;
19、s4、将所述功能化的芯片与含有所述功能化的银纳米粒子溶液进行恒温孵育,孵育完成后清洗,氮气吹干,得到所述用于外泌体源性mrna测量的sers传感芯片。
20、进一步地,本发明银纳米粒子的制备:称取硝酸银粉末0.015~0.019g,溶解于100ml去离子水中,搅拌并加热至100~120℃,冷凝回流;当溶液微沸时加入2.6~3.4ml质量分数为1%的柠檬酸钠溶液,待溶液颜色保持不变,继续煮沸10~30min,停止加热,冷却,得到银纳米粒子溶液。
21、进一步地,所述步骤s1中,在所述银纳米粒子表面修饰亲和素和4-巯基苯甲酸的具体操作包括:
22、向含有银纳米粒子的溶液中加入edc和nhs溶液进行活化,活化完成后加入亲和素、4-巯基苯甲酸进行修饰,得到含有功能化的银纳米粒子溶液。
23、进一步地,步骤s2的具体操作包括:将衬底切割成尺寸为2cm×2cm,对切割好的衬底进行超声清洗,清洗的顺序为去离子水、乙醇、丙酮、乙醇和去离子水,在每种溶剂中超声清洗5~10min。清洗干净的衬底进行氮气吹干。然后进行羟基化处理:将清洗干净的衬底置于羟基化的溶液中,待无气泡产生后将其加热煮沸,直到溶液中完全没有气泡冒出时停止加热;然后将玻璃片用大量去离子水多次清洗去除残余的羟基化溶液。然后采用真空蒸镀的方法,在羟基化的衬底表面蒸镀金属增强层。
24、一些实施例中,羟基化溶液为,体积比:h2o2:h2so4=3:7,h2o2水溶液的质量分数为30%,h2so4水溶液的质量分数为98%。
25、进一步地,金属增强层的厚度为80~120nm。
26、进一步地,所述步骤s3中,将所述芯片进行羧基化处理,活化的具体操作包括:
27、将所述芯片常温下浸泡在巯基十一烷酸溶液中,1-3小时后氮气吹干;随后浸泡在含有edc和nhs的溶液进行活化。
28、需要说明的是,本发明的制备方法中,所用的溶液如巯基十一烷酸溶液、edc和nhs等,其浓度和用量均可根据常规实验操作进行配制,本发明对此不做限定。
29、所述第一修饰液为识别所述外泌体的受体蛋白或抗体与缓冲溶液配制得到,受体蛋白或抗体的浓度为5~15μg/ml。根据具体的检测方法、外泌体与抗体的反应活性、分析精度要求不同、所测试样本不同等,可以适当调整所述第一修饰液中的受体蛋白或抗体的浓度,同时,第一修饰液添加量也可适应性调整,本发明对此不做具体限定。
30、所述第二修饰液为所述dna链核苷酸序列与缓冲溶液配制得到,所述dna链的浓度为2~5μm。根据具体的检测方法、检测环境、反应活性、分析精度要求不同等,可以适当调整所述第二修饰液中的dna链浓度,同时,第二修饰液的添加量也可适应性调整,本发明对此不做具体限定。
31、进一步地,所述缓冲溶液为硼酸盐标准缓冲溶液、磷酸缓冲溶液、碳酸盐标准缓冲溶液、醋酸盐标准缓冲溶液中的任一种。需要说明的是,所用缓冲溶液也不仅限于上述缓冲溶液,可以使用医学上允许的任意缓冲溶液。
32、第三方面,本发明提供一种检测外泌体源性mrna的方法,包括:
33、向sers传感芯片中滴加待测试样本,进行第一次孵育;孵育结束后,向sers传感芯片施加电压,通电结束后,进行第二次孵育;利用拉曼光谱仪测定sers传感芯片中的sers信号;
34、通过对sers信号进行定量或定性分析,确定待测试样本中的mrna或其浓度;
35、所述sers传感芯片为第一方面所述的用于外泌体源性mrna测量的sers传感芯片,或者采用第二方面所述方法制得的用于外泌体源性mrna测量的sers传感芯片;
36、所述待测样本为外泌体溶液。
37、进一步地,所述通过对sers信号进行定量分析,确定待测试样本中的mrna浓度,具体操作包括:预先制作所述sers传感芯片的sers信号与mrna浓度的标准曲线,根据待测样本中的sers信号与标准曲线进行计算,确定待测试样本中的mrna浓度。
38、进一步地,所述通过对sers信号进行定性分析,确定待测试样本中是否含有mrna的具体操作包括,根据待测样本的sers信号与空白样本的sers信号进行比较,sers信号变弱,表明待测样本中含有mrna。且,sers信号越弱,表明mrna的浓度越高。
39、进一步地,施加的电压为50-100mv,持续时间为300-800s。
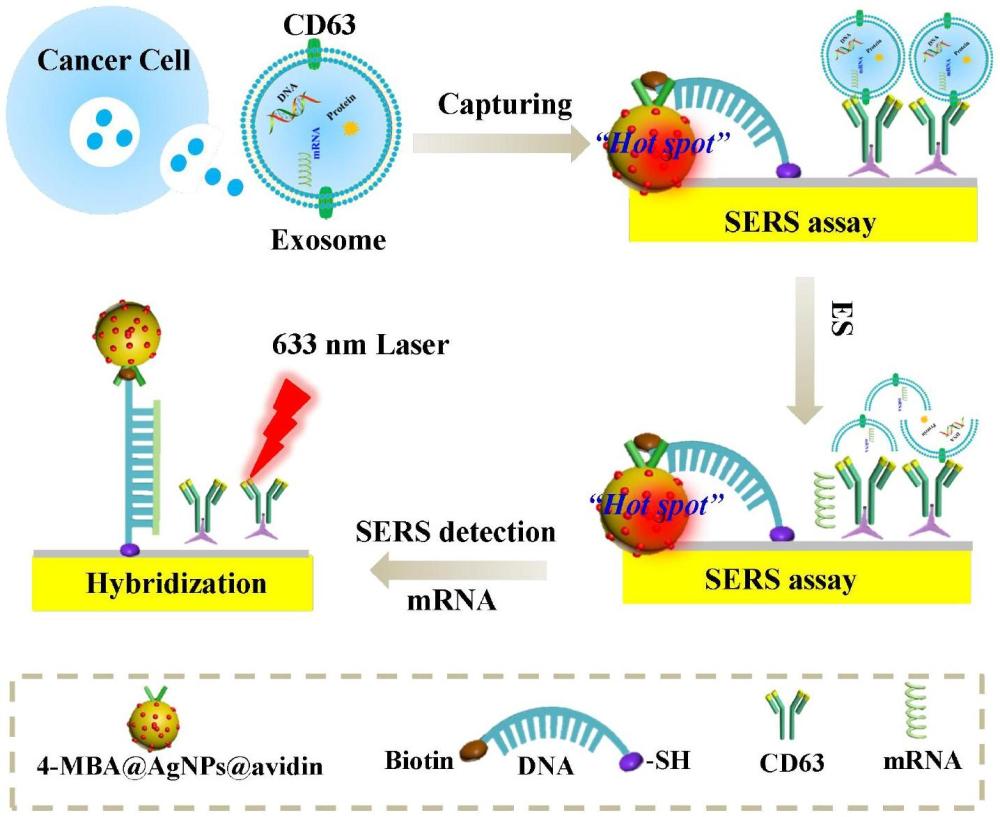
40、进一步地,所述第一次孵育的温度为36-38℃,时间为4-8h;所述第二次孵育的温度为36-38℃,时间为4-8h。
41、第四方面,本发明提供检测外泌体源性mrna的方法,所述外泌体来源于细胞在应激过程中释放的外泌体,所述方法包括:
42、在sers传感芯片表面种植待测细胞,然后进行第一次通电刺激,通电结束后进行第一次孵育;孵育结束,清洗所述sers传感芯片,进行第二次通电刺激,通电结束后进行第二次孵育;利用拉曼光谱仪测定传感芯片的sers信号;
43、通过对sers信号进行分析,确定待测试细胞释放的外泌体中的外泌体源性mrna浓度;
44、所述sers传感芯片为第一方面所述的用于外泌体源性mrna测量的sers传感芯片,或者采用第二方面所述方法制得的用于外泌体源性mrna测量的sers传感芯片。
45、进一步地,第一次通电刺激的电压为50-100mv,持续时间为300-800s,第二次通电刺激的电压为50-100mv,持续时间为300-800s;所述第一次孵育的温度为36-38℃,时间为24-48h;所述第二次孵育的温度为36-38℃,时间为4-8h。
46、可以理解地,第一次通电刺激是为了刺激细胞,使细胞在应激条件下释放更多的外泌体,第二次通电刺激为了破坏外泌体结构,释放外泌体源性mrna。
47、癌细胞或正常细胞在应激条件下能释放更多的外泌体,从而具有更多含量的外泌体源性mrna。基于本发明的sers传感芯片能够原位捕获外泌体,在通电刺激细胞释放外泌体后,对捕获的外泌体进一步通电破坏其结构,获得外泌体源性mrna的释放,能够根据细胞释放的外泌体含量对外泌体源性mrna进行测量。
48、本发明外泌体源性mrna的检测方法原理见图1,本发明利用居具有dna功能化的sers传感芯片进行外泌体源性mrna的检测,传感芯片上的dna链与功能化的银纳米粒子通过生物素-亲和素连接,当mrna不存在时,由于dna链为单链,具有柔性,使得功能化的银纳米粒子与金属增强层相互接触,从而产生明显的sers热点,拉曼信号增强。当mrna存在时,基于dna杂交链完全碱基互补配对的原则,传感芯片上的dna链与mrna结合,形成dna双链,而双链具有刚性,会导致功能化的银纳米粒子与金属增强层之间的距离增加,sers热点减弱,从而导致sers信号降低。因此,本发明可以通过sers信号的变化来实现对mrna的定性定量检测。
49、与现有技术相比,本发明所能达到的技术效果包括:
50、本发明提供的用于外泌体源性mrna测量的sers传感芯片,利用sers技术所具有的灵敏度高、快速和无损等优势,通过修饰层含有的受体蛋白或抗体,对样本中的外泌体进行原位特异性捕获;根据dna杂交链完全碱基互补配对的原则,通过修饰层含有的dna链能够特异性与外泌体源性的mrna杂交配对,形成双链结构,引起芯片的sers信号发生变化,从而实现快速高灵敏度的外泌体源性mrna的检测。
51、本发明提供的用于外泌体源性mrna测量的sers传感芯片的制备方法,利用生物分子自组装的方法,操作简单,易于实现芯片的批量化制备。
52、本发明提供的检测外泌体源性mrna的方法,利用制得的sers传感芯片,实现了外泌体的原位特异性捕获以及分离。检测时,通过对该sers传感芯片施加电压以实现外泌体结构的破坏,释放外泌体内的物质,再利用sers传感芯片上的dna序列实现与外泌体源性mrna的碱基互补配对,捕获目标物mrna。本发明提供的检测方法利用sers传感芯片实现在电场刺激下,外泌体内mrna的快速释放以及精准检测,解决了现有技术中检测外泌体源性mrna时需要对外泌体裂解以及多步处理造成样品含量污染以及缺失等问题,提高了分析检测的准确性。同时芯片内高sers热点结构的分布,有助于提高检测的灵敏度。
本文地址:https://www.jishuxx.com/zhuanli/20240911/292433.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表