疟疾疫苗制剂的制作方法
- 国知局
- 2024-09-19 14:25:29
本公开涉及用于诱导对疟原虫属(plasmodium)寄生虫产生免疫应答的组合物和方法。
背景技术:
1、疟疾是儿童死亡的主要原因。截至2019年,全球估计有2.29亿例疟疾病例。2019年,409,000人死于疟疾。仅有一种获批用于预防疟疾的疫苗,即rts,s/as01(rts,s)rts,s提供的对疟疾的保护作用随时间减弱。本领域需要用于预防疟疾的新疫苗和方法。
技术实现思路
1、本公开提供了用于诱导对疟疾产生免疫应答的免疫原性组合物。本公开还提供了施用所述免疫原性组合物的新方法。
2、在实施方案中,本文提供了免疫原性组合物,其包含疟原虫属寄生虫的抗原。在实施方案中,本文提供了刺激受试者对疟原虫属寄生虫产生免疫应答的方法,其包括施用该免疫原性组合物。在实施方案中,该疟原虫属寄生虫是恶性疟原虫(plasmodiumfalciparum)、三日疟原虫(plasmodium malariae)、间日疟原虫(plasmodium vivax)、卵形疟原虫(plasmodium ovale)或诺氏疟原虫(plasmodium knowlesi)。在实施方案中,该抗原包含环子孢子(cs)蛋白或其片段。在实施方案中,该cs蛋白来自恶性疟原虫。在实施方案中,该抗原包括乙型肝炎表面抗原(hbsag)或其片段。在实施方案中,该抗原包含seq idno:1的氨基酸序列,或与seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列。在实施方案中,该免疫原性组合物包含佐剂。在实施方案中,该佐剂包含至少两种iscom颗粒,其中:第一iscom颗粒包含皂树(quillaja saponaria molina)的级分a并且不包含皂树的级分c;和第二iscom颗粒包含皂树的级分c并且不包含皂树的级分a。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的约85重量%和约15重量%。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的约92重量%和约8重量%。在实施方案中,佐剂以约50μg的剂量施用。
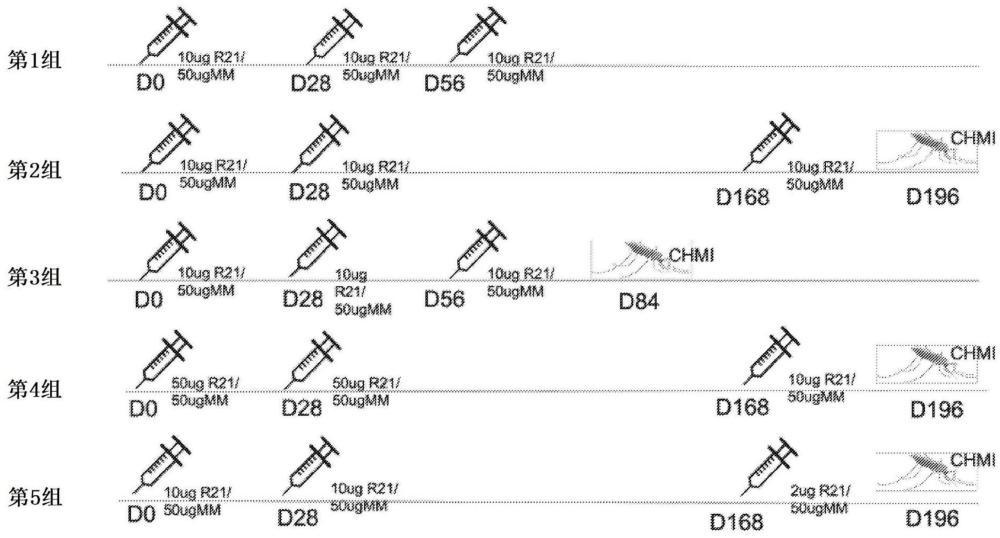
3、在实施方案中,刺激对疟原虫属寄生虫产生免疫应答的方法包括施用约0.1μg至约100μg的抗原。在实施方案中,刺激对疟原虫属寄生虫产生免疫应答的方法包括施用约0.1μg至约10μg的抗原。在实施方案中,刺激对疟原虫属寄生虫产生免疫应答的方法包括施用约0.1μg至约5μg的抗原。在实施方案中,刺激对疟原虫属寄生虫产生免疫应答的方法包括施用约0.1μg至约3μg的抗原。在实施方案中,刺激对疟原虫属寄生虫产生免疫应答的方法包括施用约0.1μg至约2μg的抗原。在实施方案中,该方法包括施用第一剂量和第二剂量的免疫原性组合物。在实施方案中,该方法包括施用第三剂量的免疫原性组合物。在实施方案中,第二剂量中抗原的剂量小于第一剂量中抗原的剂量。在实施方案中,第三剂量中抗原的剂量小于第一剂量中抗原的剂量。在实施方案中,第一和第二剂量包含相同量的抗原。在实施方案中,第二剂量和第三剂量包含相同量的抗原。在实施方案中,第一剂量和第三剂量包含相同量的抗原。在实施方案中,第三剂量包含第一剂量中抗原的约90%、约80%、约70%、约60%、约50%、约40%、约30%、约20%或约10%。在实施方案中,第二剂量包含第一剂量中抗原的约90%、约80%、约70%、约60%、约50%、约40%、约30%、约20%或约10%。在实施方案中,在第一剂量后约28天施用第二剂量。在实施方案中,在第一剂量后约56天施用第三剂量。在实施方案中,在第一剂量后约168天施用第三剂量。
4、在实施方案中,本文提供了刺激受试者对疟原虫属寄生虫产生免疫应答的方法,其包括施用:
5、(i)第一剂量的包含疟原虫属寄生虫的抗原的免疫原性组合物;其中该第一剂量包含约10μg的抗原;
6、(ii)第二剂量的免疫原性组合物,其中该第二剂量包含约10μg的抗原;和
7、(iii)第三剂量的免疫原性组合物,其中该第三剂量包含约2μg的抗原。
8、在实施方案中,在第一剂量后约28天施用第二剂量。在实施方案中,在第一剂量后约56天施用第三剂量。在实施方案中,在第一剂量后约168天施用第三剂量。在实施方案中,该疟原虫属寄生虫是恶性疟原虫、三日疟原虫、间日疟原虫、卵形疟原虫或诺氏疟原虫。在实施方案中,该抗原包含环子孢子(cs)蛋白或其片段。在实施方案中,该cs蛋白来自恶性疟原虫。在实施方案中,该抗原包括乙型肝炎表面抗原(hbsag)或其片段。在实施方案中,该抗原包含seq id no:1的氨基酸序列,或与seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列。在实施方案中,该免疫原性组合物包含佐剂。在实施方案中,该佐剂包含至少两种iscom颗粒,其中:第一iscom颗粒包含皂树的级分a并且不包含皂树的级分c;和第二iscom颗粒包含皂树的级分c并且不包含皂树的级分a。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的约85重量%和约15重量%。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的约92重量%和约8重量%。在实施方案中,佐剂以约50μg的剂量施用。
9、在实施方案中,本文提供了刺激受试者对疟原虫属寄生虫产生免疫应答的方法,其包括施用包含疟原虫属寄生虫的抗原的免疫原性组合物,其中该抗原包含环子孢子(cs)蛋白或其片段和乙型肝炎表面抗原(hbsag)或其片段。在实施方案中,该疟原虫属寄生虫的抗原包含seq id no:1或seq id no:2的氨基酸序列,或与seq id no:1或seq id no:2具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或至少99.5%同一性的氨基酸序列。在实施方案中,该免疫原性组合物包含佐剂。在实施方案中,该免疫原性组合物包含约1μg至约100μg的佐剂。在实施方案中,该免疫原性组合物包含约25μg至约75μg的佐剂。在实施方案中,该免疫原性组合物包含约50μg的佐剂。在实施方案中,该免疫原性组合物包含约25μg的佐剂。在实施方案中,该佐剂包含至少两种iscom颗粒,其中:第一iscom颗粒包含皂树的级分a并且不包含皂树的级分c;和第二iscom颗粒包含皂树的级分c并且不包含皂树的级分a。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的50-96重量%和剩余部分。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的至少75重量%和剩余部分。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的约85重量%和约15重量%。在实施方案中,皂树的级分a和皂树的级分c分别占佐剂中皂树的级分a和皂树的级分c的重量总和的约92重量%和约8重量%。在实施方案中,该方法包括在预装注射器中施用免疫原性组合物。在实施方案中,施用的抗原的剂量为约0.1μg至约100μg;约0.1μg至约10μg;约0.1μg至约5μg;约0.1μg至约3μg;约0.1μg至约2μg;约2μg至约10μg;或约2μg至约5μg。在实施方案中,该免疫原性组合物包含约2μg的抗原。在实施方案中,该免疫原性组合物包含约5μg的抗原。在实施方案中,该免疫原性组合物包含约10μg的抗原。在实施方案中,该免疫原性组合物包含约50μg的抗原。在实施方案中,该方法包括施用第一剂量和第二剂量的免疫原性组合物。在实施方案中,该方法包括施用第三剂量的免疫原性组合物。在实施方案中,该方法包括施用第四剂量、第五剂量、第六剂量、第七剂量、第八剂量、第九剂量或第十剂量的免疫原性组合物。在实施方案中,第二剂量中抗原的量小于第一剂量中抗原的量。在实施方案中,第三剂量中抗原的量小于第一剂量中抗原的量。在实施方案中,第一剂量和第二剂量包含约相同量的抗原。在实施方案中,第二剂量和第三剂量包含约相同量的抗原。在实施方案中,第一和第三剂量包含约相同量的抗原。在实施方案中,第一、第二和第三剂量包含约相同量的抗原。在实施方案中,第一、第二、第三和第四剂量包含约相同量的抗原。在实施方案中,第三剂量或第四剂量或第五剂量或第六剂量或第七剂量或第八剂量或第九剂量或第十剂量包含第一剂量中抗原的约90%、约80%、约70%、约60%、约50%、约40%、约30%、约20%或约10%。在实施方案中,第二剂量包含第一剂量中抗原的约90%、约80%、约70%、约60%、约50%、约40%、约30%、约20%或约10%。在实施方案中,该方法包括在第一剂量后约1个月施用第二剂量。在实施方案中,该方法包括在第一剂量后约28天施用第二剂量。在实施方案中,该方法包括在第一剂量后约56天施用第三剂量。在实施方案中,该方法包括在第一剂量后约2个月施用第三剂量。在实施方案中,该方法包括在第一剂量后约168天施用第三剂量。在实施方案中,该方法包括在第一剂量后约6个月施用第三剂量。在实施方案中,该方法包括在施用第一剂量后12个月至约16个月施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第一剂量后约15个月施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第一剂量后约421天施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第三剂量后约一年施用第四剂量的免疫原性组合物。在实施方案中,该方法包括施用:(i)第一剂量的免疫原性组合物;其中该第一剂量包含约10μg的抗原;(ii)第二剂量的免疫原性组合物,其中该第二剂量包含约10μg的抗原;和(iii)第三剂量的免疫原性组合物,其中该第三剂量包含约2μg的抗原。在实施方案中,该方法包括施用:(i)第一剂量的免疫原性组合物;其中该第一剂量包含约50μg的抗原;(ii)第二剂量的免疫原性组合物,其中该第二剂量包含约50μg的抗原;和(iii)第三剂量的免疫原性组合物,其中该第三剂量包含约10μg的抗原。在实施方案中,该方法包括施用:(i)第一剂量的免疫原性组合物;其中该第一剂量包含约10μg的抗原;(ii)第二剂量的免疫原性组合物,其中该第二剂量包含约10μg的抗原;和(iii)第三剂量的免疫原性组合物,其中该第三剂量包含约10μg的抗原。在实施方案中,该方法包括施用:(i)第一剂量的免疫原性组合物;其中该第一剂量包含约5μg的抗原;(ii)第二剂量的免疫原性组合物,其中该第二剂量包含约5μg的抗原;和(iii)第三剂量的免疫原性组合物,其中该第三剂量包含约5μg的抗原。在实施方案中,该方法包括施用第四剂量、第五剂量或两者的免疫原性组合物。在实施方案中,该方法包括在第一剂量后约一个月施用第二剂量并且在第二剂量后约两个月施用第三剂量。在实施方案中,该方法包括在第一剂量后约一个月施用第二剂量并且在第二剂量后约六个月施用第三剂量。在实施方案中,该方法包括在施用第一剂量的免疫原性组合物后约9个月至约两年施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第一剂量的免疫原性组合物后约9个月、约10个月、约11个月、约12个月、约13个月、约14个月、约15个月、约16个月、约17个月、约18个月、约19个月、约20个月、约21个月、约22个月、约23个月或约24个月施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第一剂量的免疫原性组合物后约十个月施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第一剂量的免疫原性组合物后约十二个月施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第一剂量的免疫原性组合物后约十四个月施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第一剂量的免疫原性组合物后约十五个月施用第四剂量的免疫原性组合物。在实施方案中,该方法包括在施用第四剂量的免疫原性组合物后约9个月、约10个月、约11个月、约12个月、约13个月、约14个月、约15个月、约16个月、约17个月、约18个月、约19个月、约20个月、约21个月、约22个月、约23个月或约24个月施用第五剂量的免疫原性组合物。在实施方案中,该疟原虫属寄生虫是恶性疟原虫、三日疟原虫、间日疟原虫、卵形疟原虫或诺氏疟原虫。在实施方案中,该cs蛋白来自恶性疟原虫。在实施方案中,该方法在施用免疫原性组合物后以约50%至约99%、约50%至约95%、约50%至约90%、约50%至约85%、约50%至约80%、约60%至约99%、约65%至约95%、约65%至约90%、约65%至约85%、约69%至约81%、约60%至约95%、约60%至约90%、约60%至约85%、约60%至约80%、约40%至约99%、约40%至约95%、约40%至约90%、约40%至约85%、约40%至约80%、约40%至约75%、约40%至约70%、约40%至约65%、约40%至约55%、或约40%至约50%的功效预防疟疾或疟原虫属寄生虫感染至多约2个月、至多约2.5个月、至多约3个月、至多约3.5个月、至多约4个月、至多约4.5个月、至多约5个月、至多约5.5个月、至多约6个月、至多约6.5个月、至多约7个月、至多约7.5个月、至多约8个月、至多约8.5个月、至多约9个月、至多约9.5个月、至多约10个月、至多约10.5个月、至多约11个月、至多约11.5个月、至多约12个月、至多13个月、至多14个月、至多15个月、至多16个月、至多17个月、至多18个月、至多19个月、至多20个月、至多21个月、至多22个月、至多23个月或至多24个月。在实施方案中,该方法在施用免疫原性组合物后以约50%至约99%、约50%至约95%、约50%至约90%、约50%至约85%、约50%至约80%、约60%至约99%、约65%至约95%、约65%至约90%、约65%至约85%、约69%至约81%、约60%至约95%、约60%至约90%、约60%至约85%、约60%至约80%、约40%至约99%、约40%至约95%、约40%至约90%、约40%至约85%、约40%至约80%、约40%至约75%、约40%至约70%、约40%至约65%、约40%至约55%、或约40%至约50%的功效预防疟疾或疟原虫属寄生虫感染至少约2个月、至少约2.5个月、至少约3个月、至少约3.5个月、至少约4个月、至少约4.5个月、至少约5个月、至少约5.5个月、至少约6个月、至少约6.5个月、至少约7个月、至少约7.5个月、至少约8个月、至少约8.5个月、至少约9个月、至少约9.5个月、至少约10个月、至少约10.5个月、至少约11个月、至少约11.5个月、至少约12个月、至少13个月、至少14个月、至少15个月、至少16个月、至少17个月、至少18个月、至少19个月、至少20个月、至少21个月、至少22个月、至少23个月或至少24个月。在实施方案中,该方法以约69%的功效预防疟疾至多约12个月。在实施方案中,该方法以约69%的功效预防疟疾至少约12个月。在实施方案中,该方法以约77%的功效预防疟疾至多约12个月。在实施方案中,该方法以约77%的功效预防疟疾至少约12个月。在实施方案中,该方法以约77%的功效预防疟疾至多约24个月。在实施方案中,该方法以约77%的功效预防疟疾至少约24个月。在实施方案中,该方法以约81%的功效预防疟疾至多约12个月。在实施方案中,该方法以约81%的功效预防疟疾至少约12个月。在实施方案中,该方法以约78%的功效预防疟疾至多约12个月。在实施方案中,该方法以约78%的功效预防疟疾至少约12个月。
本文地址:https://www.jishuxx.com/zhuanli/20240919/297997.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。