BaEV逆转录病毒载体包装细胞株及其制备方法和应用与流程
- 国知局
- 2024-11-21 11:42:06
本发明涉及细胞治疗领域,尤其涉及baev逆转录病毒载体包装细胞株及其制备方法和应用。
背景技术:
1、目前,car-t、car-nk产品的开发在底层技术上,主要面临的挑战有:转导效率低、扩增倍数差以及冻存效果不好,其中nk细胞的高效转导是car-nk开发的瓶颈。nk细胞作为一道天然免疫屏障,天生抗感染,不易被病毒转导。目前市面上常用慢病毒载体来进行nk细胞的转导,而慢病毒载体通常都是采用vsv-g(水疱性口炎病毒囊膜糖蛋白)包膜,vsv-g包膜的受体低密度脂蛋白(ldl)虽然在激活的t细胞上大量表达,但是在激活的nk细胞上表达较低。目前应用成熟的vsv-g慢病毒不足以解决上述转导、遗传操作难题,有大量研究表明,vsv-g慢病毒转导nk细胞的效率极低(仅为5~10%),导致这种现象的原因极有可能是因为nk细胞具有天然的抗病毒能力。针对vsv-g包膜慢病毒载体转导nk效率低下,有研究利用小分子抑制剂上调nk细胞表面ldl-r(低密度脂蛋白受体)的表达增加vsv-g包膜慢病毒的转导效率,也有研究利用bx795来抑制nk的抗病毒信号来增加nk的转导效率,但都面临着car阳性率不稳定,且毒性大不利于car-nk细胞扩增,无法大规模且稳定地应用于临床的缺点。尤其是bx795会对nk细胞的杀伤功能及增殖能力带来一定的影响,这显然不符合临床应用的要求。也有研究表明一些逆转录病毒可高效的转导nk细胞,但逆转录病毒插入位点的安全性存在着一定风险。
2、专利wo2013/045639a1公布了改造后的包装有狒狒内源性逆转录病毒(baboonendogenous virus,baev)囊膜糖蛋白的慢病毒(baev慢病毒)可以高效转导t细胞及b细胞。虽然baev囊膜糖蛋白(baev-g)具有极高的应用价值,但baev囊膜糖蛋白难以生产出高滴度的假病毒颗粒。cn117467705 a公开了一种高效的baev囊膜病毒包装方法,向靶细胞中导入baev囊膜糖蛋白或包含baev囊膜糖蛋白编码核酸的载体,目的基因编码核酸及病毒包装元件;或构建稳定表达baev囊膜糖蛋白的细胞系,并向所述细胞系导入目的基因编码核酸及病毒包装元件。
3、为了提高nk细胞的转导效率,目前最常见的方法是使用其他包膜蛋白来构建慢病毒载体,已有研究证明baev包膜糖蛋白假型慢病毒载体(baev-lv)可显著提高nk细胞的转导效率,其转导效率要优于vsv-g-lv载体。
4、目前baev包膜慢病毒载体和baev包膜逆转录病毒载体大多数只能通过将表达质粒和包装质粒瞬时转染hek293t细胞的方法进行假病毒的生产,效率低且存在dna残留等问题,导致后续纯化工艺繁琐且每批次间病毒滴度和病毒质量也不稳定。这种瞬时转染制备baev假病毒的方法不能大量且稳定的生产高质量假病毒,难以进行大规模工业化应用,导致假病毒制备的前期研发和工业化成本很高。
5、目前用于慢病毒包装的baev囊膜糖蛋白主要以下几种形式:1、野生型baev-wt;2、baev-rless,即无融合抑制性r肽(fusion restrictiverpeptide)的baev囊膜糖蛋白形式;3、baev/tr,即将野生型baev-wt胞尾结构域替换为mlv囊膜糖蛋白胞尾结构域的baev囊膜糖蛋白形式。baev/tr形式相对于baev-rless,细胞毒性大大降低,大幅度减少了病毒包装过程中合胞体的出现,但病毒滴度低于baev-rless形式。据报道,baev-rless与野生型baev-wt相比,可提高原代细胞的转导效率。“baevrless”和“baev/tr”的具体形式详细描述于中国专利cn104080917b中。
6、目前市面上存在一种pg13稳定包装逆转录病毒细胞系,能够大批量且稳定制备逆转录病毒载体,病毒包膜为galv(长臂猿白血病病毒)。该体系制备的galv逆转录病毒载体对于t细胞转导效率可达到60%以上,但对于nk细胞的转导效率只有20%左右且受限于目的基因的大小和结构复杂度。因此不能完全满足细胞治疗领域对于t细胞和nk细胞等其他难转导原代免疫细胞的高效转导的要求。
技术实现思路
1、为了解决上述问题,本发明提供一种baev逆转录病毒载体包装细胞株,所述细胞株命名为baev-packrv,于2024年7月17日保藏于广东省微生物菌种保藏中心,保藏编号:gdmcc no:64874。
2、在一种实施方式中,提供上述细胞株在制备稳定表达目标序列的baev逆转录病毒载体包装细胞系的应用。
3、在一种实施方式中,所述稳定表达目标序列是cd19 car、cd22 car、cd38car或者bcmacar的序列。
4、在一种实施方式中,稳定表达目标序列的baev逆转录病毒载体包装细胞系所产生的逆转录病毒载体用于转导nk细胞、巨噬细胞、中性粒细胞、或者t细胞。
5、在一种实施方式中,所述方法包括:构建同时敲除asct-1和asct-2受体蛋白的hek293t细胞系或其衍生细胞系,然后将baev包膜转入所述hek293t细胞系或其衍生细胞系,得到所述的baev逆转录病毒载体包装细胞株。
6、在一种实施方式中,hek293t衍生细胞系包括hek293h、hek293f、hek293s或hek293f。
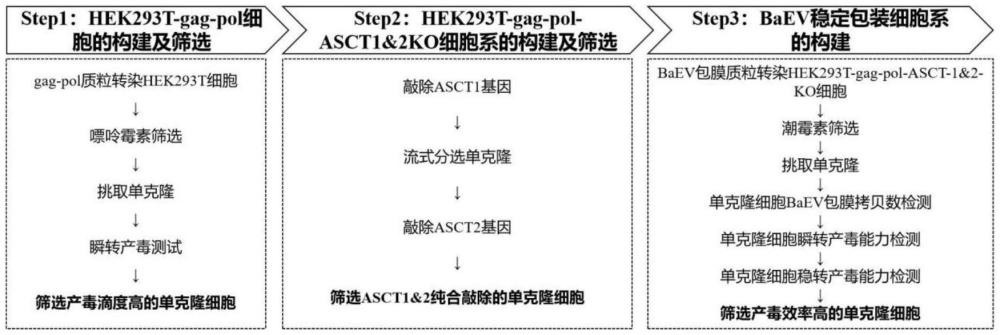
7、在一种实施方式中,所述方法包括以下步骤:
8、步骤1:将构建逆转录病毒制备所需的结构蛋白gag-pol蛋白转进hek293t细胞系或其衍生细胞系,得到相应含结构蛋白gag-pol蛋白的细胞系;
9、步骤2:在步骤1得到的细胞系基础上,构建同时敲除asct-1和asct-2受体蛋白的hek293t细胞系或其衍生细胞系,得到相应敲除asct-1和asct-2受体蛋白的细胞系;
10、步骤3:将baev包膜转入步骤2得到的细胞系,得到所述的baev逆转录病毒载体包装细胞株。
11、在一种实施方式中,所述步骤1包括:
12、步骤11,用gag-pol质粒转染hek293t细胞系或其衍生细胞系;
13、步骤12,转染后,加入抗生素,筛选高表达gag-pol目的基因的hek293t细胞系或其衍生细胞系;
14、步骤13,消化步骤12得到的hek293t细胞系或其衍生细胞系,培养所述消化后的细胞,挑选单克隆细胞;
15、步骤14,对步骤13得到的单克隆细胞进行瞬转产毒滴度测试,筛选产毒滴度高的单克隆细胞,得到相应含结构蛋白gag-pol蛋白的细胞系。
16、在一种实施方式中,所述步骤2包括:
17、步骤21,敲除步骤1得到的含结构蛋白gag-pol蛋白的细胞中的asct-1基因;
18、步骤22,将步骤21得到的细胞进行流式分选和培养,得到单克隆细胞;
19、步骤23,挑选步骤22得到的单克隆细胞,进行打靶检测,得到纯合敲除asct-1基因的单克隆细胞;
20、步骤24,将步骤23得到的单克隆细胞进行asct-2基因的两个外显子的敲除,并进一步挑选单克隆细胞,得到敲除asct-1和asct-2受体蛋白的细胞。
21、在一种实施方式中,所述步骤3包括:
22、步骤31,用野生型baev包膜质粒转染所述步骤2得到的敲除asct-1和asct-2受体蛋白的细胞;
23、步骤32,转染后,加入抗生素,筛选高表达baev包膜的逆转录病毒载体包装细胞系;
24、步骤33,消化步骤32得到的baev包膜的逆转录病毒载体包装细胞系,培养所述消化后的细胞,挑选单克隆细胞;
25、步骤34,对步骤33得到的单克隆细胞进行瞬转产毒滴度测试,筛选产毒滴度高的单克隆细胞,得到所述的baev逆转录病毒载体包装细胞株。
26、本发明首次将逆转录病毒制备所需的结构蛋白gag-pol、baev包膜蛋白转进hek293t细胞,使其稳定表达。
27、本发明首次将hek293t细胞的asct-1/2受体敲除,一方面解决了baev包膜诱导的细胞间融合和合胞体形成的问题,使细胞可以正常产毒;另一方面,避免了baev病毒反复感染细胞本身,造成细胞死亡。敲除asct1/2受体后,细胞不再受到病毒感染的影响,可持续生长,持续产毒。
28、本发明开发出一种能稳定且大批量生产baev逆转录病毒载体的稳定包装细胞株(baev-packrv),此包装细胞株已提供逆转录病毒gag、pol和包膜蛋白(baev),介导对目的基因的包装和转录。先将含目的基因的质粒瞬时转染phoenix-ampho,收集上清转导baev-packrv,进而得到稳定产毒的生产细胞株。因此,仅在第一步瞬时转染时使用少量质粒用于逆转录病毒载体的生产,省却了大量的质粒制备和纯化的工艺。后续制备病毒,只需要将产毒细胞系复苏培养,收集细胞培养上清,即为所需要的逆转录病毒载体。将baev包膜稳定产毒细胞株作为逆转录病毒载体的生产原料,大大降低了病毒制备的成本;减少杂质和下游纯化工艺,将细胞治疗产品病毒制备成本降低10倍以上。
29、此外,nk细胞上的包膜受体表达水平与病毒整合效率相关,baev包膜受体是中性氨基酸转运蛋白asct-1和asct-2(asct-1/2),这两者在活化的nk细胞上都高度表达,便于病毒高效感染nk细胞从而提升nk细胞的转导效率。
30、本发明制备了一种baev逆转录病毒稳定包装细胞株(baev-packrv),用于低成本、高质量且高效的大规模工业化制备假病毒及其在细胞治疗产品上的高效转导的应用。相较于瞬时转染的baev慢病毒,无需进行多质粒转染即可产生高滴度病毒载体,制作工艺更简化,成本更低,可以更好地控制产品质量并进行大规模的生产;相较于能够稳定包装的galv逆转录病毒,可以在较低moi下实现nk细胞、t细胞等难转导的原代免疫细胞的高效转导,转导阳性率可高达90%且维持稳定,超高的转导效率也不影响nk细胞和t细胞的活率与扩增。
本文地址:https://www.jishuxx.com/zhuanli/20241120/332464.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。