用于分离与检测循环肿瘤细胞的两级分选微流控芯片及其制备方法与应用
- 国知局
- 2024-11-21 11:48:56
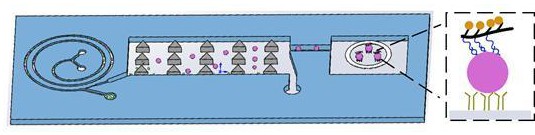
本发明涉及微流控设备和循环肿瘤细胞检测,具体涉及一种用于分离与检测循环肿瘤细胞的两级分选微流控芯片及其制备方法与应用。
背景技术:
1、ctc是自发地由原发病灶脱落进入外周血液循环的肿瘤细胞,其可以逃避免疫系统的攻击实现快速增殖,从而引起肿瘤的转移,成为肉眼可见的肿瘤病灶。因此ctc的检测是一种对实体肿瘤的“液体活检”技术,为肿瘤患者的实时监测提供了新的选择。ctc是血液中极其罕见的一类细胞,正常人每毫升血液中含有白细胞106个,红细胞109个,而ctc含量仅为2-5个,所以从全血中分离出ctc对于后续检测分析至关重要。因此,亟需开发一种ctc有效分离有灵敏检测技术,为基于ctc的癌症早期诊断和预后提供新思路。目前,ctc分离策略可分为抗原依赖性分离和无标记分离(包括细胞大小、可变形性、密度等)。基于上皮细胞粘附分子(epcam)的ctc分离技术作为典型的抗原依赖性分离方法使用最多,但是其存在没有通用的ctc抗原,且抗原的异质性导致ctc亚型的丢失等问题。
2、无标记分离策略可能为分离不同亚型的ctc提供了一种极具吸引力的选择,同时对细胞损失最小。微流体技术作为无标记分离的重要策略,通过微流体通道的几何形状和固有的水动力来区分ctc。如螺旋芯片具有低成本、高通量、高回收率等特点;确定性横向位移(dld)具有较高的分离精度,已广泛应用于白细胞、干细胞、细菌、外泌体、dna等生物颗粒的浓缩与分离。但是,单一的分离技术存在固有的局限性,如螺旋芯片高通量处理样本的同时,必然存在分离ctc纯度低的缺点。
3、中国专利cn107084916a公开了一种循环肿瘤细胞分离微流控芯片装置及其使用方法。该发明基于循环肿瘤细胞和血细胞核质比和表面电荷上的差异,在微流控芯片上采用流体力学实现对样品中循环肿瘤细胞的非抗体依赖的分离富集,实现对肿瘤细胞非抗体依赖的循环肿瘤细胞快速高通量分离,具有操作简单、自动化程度高等优的特点。但该发明依旧是基于单一螺旋芯片对ctc进行分离,在高通量处理样本时,依旧存在分离ctc纯度低的缺点。
4、因此,有必要研发一种用于分离与检测循环肿瘤细胞的两级分选微流控芯片,以解决上述问题。
技术实现思路
1、针对现有技术中的不足之处, 本发明的目的是提供一种用于分离与检测循环肿瘤细胞的两级分选微流控芯片,该两级分选微流控芯片具有高通量处理样本、高回收率、高纯度的ctc分离优势,结合杂交链式反应(hcr)电化学信号放大检测,集分离与检测为一体,具有灵敏度高、检测限低的优点。
2、为实现上述目的,本发明采用如下技术方案:
3、一种用于分离与检测循环肿瘤细胞(ctc)的两级分选微流控芯片,包括螺旋芯片及与所述螺旋芯片适配的确定性横向位移(dld)芯片,所述螺旋芯片包括2个入口、9/4圈螺旋通道和设置于所述螺旋通道末端的y型出口,2个入口包括靠近螺旋内壁的pbs入口和靠近螺旋外壁的样本入口,所述y型出口包括ctc收集液出口和废液出口;
4、所述dld芯片包括芯片基底、设置于所述芯片基底上的芯片微柱阵列、与所述ctc收集液出口连通的芯片入口、及芯片出口;
5、其中,所述dld芯片的柱间间隙为24~36μm。
6、进一步地,所述螺旋芯片还包括设置于所述螺旋通道与所述y型出口之间的直流道,所述直流道由所述螺旋通道沿切线方向延长形成,所述直流道的长度为28 mm,所述ctc收集液出口的流道宽度为170μm,所述废液出口的流道宽度为330μm。
7、优选地,所述芯片微柱阵列由若干三角形的微柱组成,所述柱间间隙为32μm。
8、本发明提供如上所述的用于分离与检测ctc的两级分选微流控芯片的制备方法,包括如下步骤:
9、s1、设计如上所述的螺旋芯片和dld芯片;
10、s2、设置所述dld芯片的芯片微柱间间隙分别为24μm、28μm、32μm、36μm,进行仿真模拟,优化柱形形貌,得到两级分选微流控芯片的设计方案;
11、s3、根据所述设计方案,利用软光刻的方法制作芯片模具;
12、s4、对所述芯片模具进行疏水处理,将 pdms基底与固化剂按10:1的比例混合并去除气泡,浇在所述芯片模具上,80℃固化过夜,从所述芯片模具上切割出pdms模板,去除边缘pdms后进行打孔,通过表面氧等离子体处理,将玻片与pdms紧密结合,形成封闭的芯片。
13、进一步地,步骤s2中,所述优化仿真包括如下操作:基于设定好的多组芯片微柱间间隙值,采用仿真软件fluent运用离散模型进行双向连续相与离散相的二维耦合模拟,其中连续相以纳维-斯托克斯方程计算流场,流体不可压缩,将细胞作为圆形小球处理,不考虑细胞的变形;采用超细化网格进行模型划分,得到仿真模型,通过所述仿真模型分别对三角形和圆形微柱形貌进行仿真模拟,优化柱形形貌。
14、进一步地,步骤s3中,所述芯片模具的制备过程使用su-8 2075光刻胶,光刻胶的涂覆厚度为150μm,曝光过程中紫外灯曝光能量为260 mj/cm2。
15、本发明还提供一种应用如上所述的两级分选微流控芯片进行分离与检测ctc的方法,包括如下步骤:
16、s1、制备检测芯片和杂交链式反应(hdr)组装体,并将所述检测芯片的入口与两级分选微流控芯片的出口连接,组成检测系统,所述检测芯片包括玻碳电极(gce)和固定在所述玻碳电极上的ctc捕获抗体,所述hdr组装体包括三种特异性癌症适配体和电化学信号分子;
17、s2、将含有ctc的血样与pbs缓冲液以1:3的流速比通入所述检测系统,血样依次通过两级分选微流控芯片和检测芯片,血细胞被两级分选微流控芯片截留,90%以上的ctc进入检测芯片被检测芯片上的抗体捕获,通入pbs清洗未捕获的ctc,加入bsa溶液排除非特异性结合;
18、s3、在检测芯片中通入hdr组装体,孵育1 h后清洗进行电化学检测,通过电化学信号,进行ctc的检测与定量分析。
19、进一步地,制备所述检测芯片的方法为:玻碳电极裸电极电镀多巴胺后,进一步经过酰胺化反应修饰上链霉亲和素,再通过生物素biotin与链霉亲和素sa的特异性作用,将biotin-cd146与biotin-epcam固定在玻碳电极的表面,得到所述检测芯片。
20、进一步地,所述hdr组装体由ctc检测适配体与电化学信号二茂铁进行hcr组装制得。
21、优选地,所述电化学检测采用脉冲伏安法dpv,在pbs缓冲溶液中进行,电位扫描范围为-0.3-0.6 v,脉冲振幅为0.05 v,脉冲宽度为0.05 s,脉冲周期为0.2 s。
22、本发明的有益效果在于:
23、1、本发明设计与制备的dld芯片,具有分选精度高的优势,能够将ctc与大部分的血细胞分离,显著提高ctc的纯度。
24、2、与传统的单一分选芯片相比,本发明提出的两级细胞分选微流控芯片,能够突破单一分选技术的局限,将螺旋芯片与dld芯片的优点综合,同时实现高通量样本处理、ctc高回收率和高纯度ctc分离。
25、3、本发明提出的两级分选芯片为无标记分离策略,对ctc损伤小,不依赖ctc表面抗原,能够获得具有代表性的不同亚型的ctc。
26、4、选用三种特异性癌症适配体和电化学信号分子进行hcr组装,实现特异性识别ctc与产生电信号进行ctc灵敏检测双功能。
27、上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
本文地址:https://www.jishuxx.com/zhuanli/20241120/332838.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表