一种提高NK细胞转染效率的方法与流程
- 国知局
- 2024-11-21 12:07:12
本发明属于生物医学,具体地,涉及一种提高nk细胞转染效率的方法。
背景技术:
1、自然杀伤细胞(natural killer cells,简称nk细胞)是固有免疫防线的一部分,也是先天淋巴细胞的重要成员,在免疫细胞中数量占比为1%,占淋巴细胞数量的2%;nk细胞具有天然的细胞毒性,能够通过多种途径非特异性识别和杀伤病毒感染细胞和肿瘤细胞,这一特性使得nk细胞在肿瘤免疫治疗方面颇具前景。
2、目前,fda批准的免疫细胞治疗手段主要是car(chimeric antigen receptor,嵌合抗原受体)-t细胞治疗,在特定血液瘤的治疗上取得了显著的疗效。但目前car-t细胞治疗只能局限于自体来源的t细胞改造,并且可能产生细胞因子风暴、神经毒性等安全性问题。相比之下,nk细胞杀伤作用不依赖于mhc分子,并且安全性更高,因此,能显著降低成本,并提高安全性,具有更为广阔的发展前景。
3、目前,car-nk细胞已有多项研究进入临床研究,nk细胞来源较为广泛,包括脐血来源、外周血来源、ips来源及nk92细胞系来源等。针对car-nk细胞的制备,为使外源car基因在细胞中表达时间更为长久,慢病毒载体成为目前nk细胞中常用的外源基因递送手段,它可以有效地将外源基因整合到宿主细胞的基因组中,从而实现长期的基因表达。目前,慢病毒侵染nk细胞的效率相对较低,限制了car-nk细胞的应用,因此,开发全新的能够显著提高nk细胞转染效率的方法具有重要的临床意义。
技术实现思路
1、有鉴于此,为了克服上述现有技术中存在的慢病毒侵染nk细胞的侵染效率较低、操作步骤较为复杂这一技术问题,本发明的目的在于提供一种提高nk细胞转染效率的方法。
2、本发明通过摸索侵染时添加物的种类、细胞侵染时的细胞密度、培养基中的白介素-2的浓度、侵染病毒moi、侵染时离心力大小、离心时间、侵染后换液时间,最后得到最优条件,极大地提高了侵染效率,简化了操作步骤,在car-nk细胞制备这一技术领域具有广阔的应用前景。
3、本发明的上述发明目的通过以下技术方案得以实现:
4、本发明的第一方面提供了一种提高nk细胞转染效率的方法。
5、进一步,所述方法包括使用聚凝胺、bx795和vectofusin-1提高nk细胞的转染效率。
6、进一步,所述方法包括如下步骤:
7、(1)在nk细胞培养液中加入聚凝胺和bx795;
8、(2)取所得nk细胞培养液与vectofusin-1混合,得到混合液;
9、(3)将包含外源基因的病毒载体浓缩液加入到所述混合液中,混匀后,进行侵染。
10、进一步,步骤(1)中所述nk细胞的细胞密度为20-100万/ml;
11、可选地,步骤(1)中所述nk细胞的细胞密度为20万/ml或100万/ml;
12、可选地,步骤(1)中所述聚凝胺的使用浓度为(1-20)μg/ml;
13、可选地,步骤(1)中所述聚凝胺的使用浓度为8μg/ml;
14、可选地,步骤(1)中所述bx795的使用浓度为(1-20)μm;
15、可选地,步骤(1)中所述bx795的使用浓度为6μm;
16、可选地,步骤(1)中所述nk细胞培养液中的培养基包括α-mem完全培养基、rpmi1640培养基、advanced培养基和/或opti-mem培养基;
17、可选地,所述α-mem完全培养基包含胎牛血清、马血清、肌醇、β-巯基乙醇、叶酸、白介素-2;
18、可选地,所述胎牛血清、马血清的含量为各(2-20)%;
19、可选地,所述胎牛血清、马血清的含量为各10%;
20、可选地,所述肌醇的含量为(0.05-1)mm;
21、可选地,所述肌醇的含量为0.2mm;
22、可选地,所述β-巯基乙醇的含量为(0.05-1)mm;
23、可选地,所述β-巯基乙醇的含量为0.1mm;
24、可选地,所述叶酸的含量为(0.005-0.1)mm;
25、可选地,所述叶酸的含量为0.02mm;
26、可选地,所述白介素-2的含量为200-800iu/ml;
27、可选地,所述白介素-2的含量为400iu/ml;
28、可选地,所述nk细胞包括nk-92细胞、pb-nk细胞、cb-nk细胞和/或干细胞衍生的nk细胞。
29、进一步,步骤(2)中所述vectofusin-1的使用剂量为(5-15)μl;
30、可选地,步骤(2)中所述vectofusin-1的使用剂量为10μl;
31、可选地,步骤(2)中所述nk细胞培养液和步骤(3)中所述包含外源基因的病毒载体浓缩液等体积。
32、进一步,步骤(3)中所述包含外源基因的病毒载体包括慢病毒载体、腺病毒载体、逆转录病毒载体、腺相关病毒载体、疱疹病毒载体、痘病毒载体和/或乳头瘤病毒载体;
33、可选地,步骤(3)中所述病毒侵染moi为20-60;
34、可选地,步骤(3)中所述病毒侵染moi为40;
35、可选地,步骤(3)中所述侵染次数为1-2次;
36、可选地,步骤(3)中所述侵染次数为2次。
37、进一步,第一次侵染后,第二天重复侵染一次;
38、可选地,在第一次侵染后,离心后继续培养,6-16h后换液,第二天重复侵染一次;
39、可选地,所述离心的条件为室温、1000-1800g离心1h;
40、可选地,所述培养的条件为37℃条件下培养。
41、在一些实施方案中,所述聚凝胺,同polybrene,又名溴化己二甲铵、海美溴铵,cas号为28728-55-4。聚凝胺是一种多聚阳离子聚合物。在本发明的具体实施方案中,所述聚凝胺购于santa cruz公司。
42、在一些实施方案中,所述bx795,是一种有效的、选择性的pdk1抑制剂,ic50为6nm,比pka、pkc、c-kit、gsk3β的选择性高50多倍,cas号为702675-74-9。在本发明的具体实施方案中,所述bx795购于mce公司。
43、在一些实施方案中,所述vectofusin-1,是一种合成的、无细胞毒性的阳离子多肽,在本发明的具体实施方案中,所述vectofusin-1购于miltenyi公司。
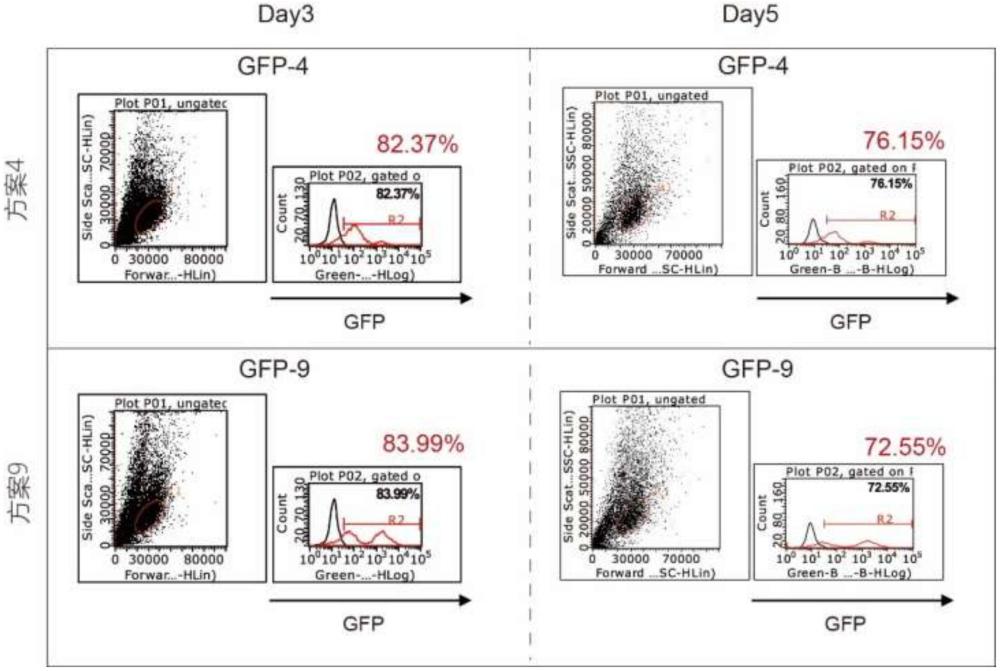
44、在本发明中,发明人通过大量对比实验首次发现单加bx795对慢病毒侵染nk细胞的效率无增强作用,而bx795+聚凝胺+vectofusin-1三者联合的效果显著优于聚凝胺+vectofusin-1两者联合(阳性率:82.37% vs 74.78%),也即本发明提供的上述全新的提高nk细胞转染效率的方法取得了本领域技术人员所预料不到的技术效果。
45、在一些实施方案中,所述nk细胞培养液中的培养基并无特别限制,包括但不限于:α-mem完全培养基、rpmi 1640培养基、advanced培养基、xvivo 15培养基、aim-v培养基和/或opti-mem培养基,在本发明的具体实施方案中,所述培养基为α-mem完全培养基,所述α-mem完全培养基包含胎牛血清和马血清各10%、0.2mm肌醇、0.1mmβ-巯基乙醇、0.02mm叶酸、200-800iu/ml白介素-2。
46、在一些实施方案中,所述病毒载体并无特别限制,包括但不限于:慢病毒载体、腺病毒载体、逆转录病毒载体、腺相关病毒载体、疱疹病毒载体、痘病毒载体和/或乳头瘤病毒载体。在本发明的具体实施方案中,所述病毒载体为慢病毒载体。
47、在一些实施方案中,所述nk细胞并无特别限制,包括但不限于:nk-92细胞、pb-nk细胞(外周血来源的nk细胞)、cb-nk细胞(脐血来源的nk细胞)、nk-92mi细胞、ips来源的nk细胞和/或干细胞衍生的nk细胞,在本发明的具体实施方案中,所述nk细胞为nk-92细胞。
48、在一些实施方案中,所述方法还包括慢病毒包装,具体地,所述慢病毒包装包括:细胞铺板、质粒转染、收集病毒上清等步骤,本发明对所述慢病毒包装这一过程并无特别限制,本领域技术人员可采用本领域公开的常规的慢病毒包装步骤进行慢病毒的包装。
49、本发明的第二方面提供了采用本发明第一方面所述的方法制备得到的nk细胞产品;
50、可选地,所述产品包括car-nk细胞。
51、在一些实施方案中,本发明对所述的nk细胞产品并无特别限制,任何采用本发明第一方面所述的方法制备得到的能够表达外源基因的nk细胞产品均在本发明的保护范围内,包括但不限于:car-nk细胞。
52、本发明的第三方面提供了聚凝胺、bx795和vectofusin-1联合在提高nk细胞的转染效率中的应用;
53、可选地,所述聚凝胺的使用浓度为(1-20)μg/ml;
54、可选地,所述聚凝胺的使用浓度为8μg/ml;
55、可选地,所述bx795的使用浓度为(1-20)μm;
56、可选地,所述bx795的使用浓度为6μm;
57、可选地,所述vectofusin-1的使用剂量为(5-15)μl;
58、可选地,所述vectofusin-1的使用剂量为10μl;
59、可选地,采用本发明第一方面所述的方法提高nk细胞的转染效率。
60、在本发明中,发明人通过科学的实验验证首次发现聚凝胺、bx795和vectofusin-1三者联合能够显著提高nk细胞的转染效率,因此,其在提高体外nk细胞的转染效率这一领域具有广泛的应用前景。
61、本发明的第四方面提供了聚凝胺、bx795和vectofusin-1联合在制备病毒载体转染nk细胞的转染提升剂中的应用;
62、可选地,所述聚凝胺的使用浓度为(1-20)μg/ml;
63、可选地,所述聚凝胺的使用浓度为8μg/ml;
64、可选地,所述bx795的使用浓度为(1-20)μm;
65、可选地,所述bx795的使用浓度为6μm;
66、可选地,所述vectofusin-1的使用剂量为(5-15)μl;
67、可选地,所述vectofusin-1的使用剂量为10μl;
68、可选地,采用本发明第一方面所述的方法提高nk细胞的转染效率。
69、在一些实施方案中,所述转染提升剂还可包含其他能够用于提高和/或辅助提高nk细胞转染效率的物质。
70、本发明的第五方面提供了一种用于提高nk细胞的转染效率的组合物。
71、进一步,所述组合物包含本发明第三方面或本发明第四方面中所述的聚凝胺、bx795和vectofusin-1。
72、在一些实施方案中,所述组合物还可包含其他能够用于提高和/或辅助提高nk细胞转染效率的物质。
73、相对于现有技术,本发明具有的有益效果如下:
74、(1)本发明首次发现单加bx795对慢病毒侵染nk细胞的效率无增强作用,而bx795+聚凝胺polybrene+vectofusin-1三者联合的效果显著优于聚凝胺polybrene+vectofusin-1两者联合(阳性率:82.37% vs 74.78%),也即本发明提供的全新的提高nk细胞转染效率的方法取得了本领域技术人员所预料不到的技术效果。
75、(2)本发明通过一系列对比实验,为慢病毒侵染nk细胞提供了大量可选的方案,并且阐明了不同添加物对慢病毒侵染nk细胞的效率的影响,这些方案均能取得很好的侵染效果,在这些方案中,本发明发现了两种最优方案:
76、方案一:细胞密度为20万/ml、侵染两次、当天铺板、1000g离心、6h后换液。该方案对病毒量要求少,所需细胞数较少,并且更能维持阳性率在较高水平;
77、方案二:细胞密度为100万/ml、侵染两次、当天铺板、1800g离心、16h后换液。该方案侵染效果最好,强阳性细胞占比更大,但对病毒和细胞量需求较大。
本文地址:https://www.jishuxx.com/zhuanli/20241120/334421.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。