一种注射用β-阻滞剂的制备方法与流程
- 国知局
- 2024-11-25 15:08:39
本申请属于药物药物制剂,特别涉及一种注射用β-阻滞剂的制备方法。
背景技术:
1、注射用盐酸兰地洛尔是由日本小野制药开发的一款用于治疗快速性心律失常的注射药物制剂,是一种新型的超短效肾上腺素β受体阻滞药。超短效肾上腺素β受体阻滞药由于起效快、代谢快、停药后β受体阻滞作用消失快,在新发生的快速性心律失常的治疗中发挥重要且不可替代的作用。临床适用于1、手术过程中发生的下列快速性心律失常的紧急治疗:心房纤颤、心房扑动、窦性心动过速;2、手术后循环系统动态监护时发生的快速性心律失常的紧急治疗:心房纤颤、心房扑动、窦性心动过速;3、心功能不全患者发生下列快速性心律失常的治疗:心房纤颤、心房扑动。
2、专利cn101732319b公开了含有盐酸兰地洛尔活性成分的注射用药物组合物及其制备方法,是通过冷冻干燥得到了注射用盐酸兰地洛尔冻干制剂。
3、专利cn102475706a公开了一种供注射用盐酸兰地洛尔药物组合物及其制备方法,该方法涉及将兰地洛尔、依地酸钙钠和乳糖混合使用,并通过冷冻干燥技术制备出注射用的盐酸兰地洛尔冻干剂型。
4、cn102232930a公开了盐酸兰地洛尔药物组合物及其制备方法,是通过氨基酸作为赋形剂,控制注射用水温度和溶液ph值得到盐酸兰地洛尔冻干制剂。
5、上述专利中所述内容均旨在解决注射用盐酸兰地洛尔的稳定性问题,但其所能达到的效果是有限的。
技术实现思路
1、为解决现有技术中存在的问题,本发明提供了一种注射用β-阻滞剂的制备方法,包括如下步骤:
2、1)配液:将处方量盐酸兰地洛尔、处方量冻干保护剂和部分溶剂混合,搅拌溶解,使用氢氧化钠溶液调节药液ph值,并用所述溶剂定容至预定体积,得到盐酸兰地洛尔药液;
3、2)过滤:将步骤1)得到的所述盐酸兰地洛尔药液用滤膜过滤;
4、3)灌装:将步骤2)过滤后的所述盐酸兰地洛尔药液灌装到注射剂瓶中,得到盐酸兰地洛尔产品1;
5、4)半压塞:对所述盐酸兰地洛尔产品1进行半压塞处理,得到盐酸兰地洛尔产品2;
6、5)冻干:通过预冻、一次干燥和两次解析干燥工序对所述盐酸兰地洛尔产品2进行冷冻干燥,得到盐酸兰地洛尔产品3;
7、6)充氮、压塞、出箱:在真空状态下对所述盐酸兰地洛尔产品3进行充氮处理,然后在冻干机中进行压塞处理后出箱;
8、7)轧盖:将步骤6)得到的产品进行轧盖处理,得到最终盐酸兰地洛尔产品4。
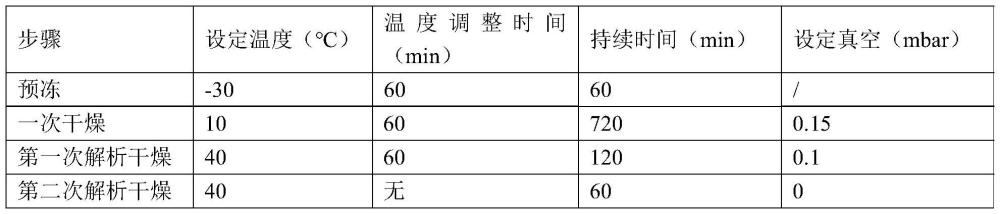
9、进一步地,步骤5)中所述预冻工序为:将所述盐酸兰地洛尔产品2放入冻干箱,设定导热液温度为-30℃,并在60分钟内将所述盐酸兰地洛尔产品2温度降至-30℃±5℃,之后在该温度范围内保持60~120分钟。
10、进一步地,步骤5)中所述一次干燥工序为:所述预冻工序结束后,当冻干箱内的真空度应达到0.15mbar时,开始升温,使导热液温度缓慢升至10~15℃,升温时间控制在60分钟内,之后在该温度下保温180~720分钟。
11、进一步地,步骤5)中所述两次解析干燥工序为:第一次解析干燥:所述一次干燥工序结束后,启动传热系统,使导热液温度升温至30~40℃,升温时间控制在60分钟内,之后在该温度下保温60~120分钟,同时,保持冻干箱内的真空度为0.1mbar;第二次解析干燥:所述第一次解析干燥结束后,逐渐将冻干箱内的真空度调整至0mbar,在调整真空度的同时,保持导热液温度在30~40℃,保温60~120分钟。
12、进一步地,所述第一次解析干燥中的所述导热液温度和所述第二次解析干燥中的所述导热液温度相同。
13、进一步地,所述盐酸兰地洛尔药液ph值为5.5~6.5。
14、进一步地,所述注射用β-阻滞剂的组成包括:盐酸兰地洛尔50~55份、冻干保护剂50~55份、氢氧化钠适量和溶剂适量。
15、进一步地,所述冻干保护剂为d-甘露醇。
16、进一步地,所述溶剂用于将所述盐酸兰地洛尔和所述冻干保护剂混合物定容至每支制剂的预定体积。
17、另一方面,本发明提供了一种根据上述方法制备的注射用β-阻滞剂,所述注射用β-阻滞剂优选为注射用盐酸兰地洛尔,剂型为注射用无菌粉末。
18、与现有技术相比,本发明的注射用β-阻滞剂(以下称为“注射用盐酸兰地洛尔”)的制备方法具有以下优势:
19、(1)通过改进冻干工艺,本发明的制备方法能够显著提高盐酸兰地洛尔注射剂的稳定性。冻干过程中,通过精确控制温度和时间等参数,减少药物分子在冻干过程中的结构变化,从而保持其药效。
20、(2)优化的冻干工艺使得制得的注射剂具有更长的保质期。这得益于冻干过程中水分的去除和药物的稳定化处理,减少了药物在储存过程中的降解速率。
21、(3)改进后的冻干工艺显著提升了盐酸兰地洛尔在水或其他溶剂中的溶解性。冻干后的药物呈现出疏松多孔的结构,这一特性大幅增加了药物与溶剂的接触面积,从而极大促进了药物的快速且完全溶解。得益于此,采用本发明制备方法得到的盐酸兰地洛尔注射剂能够实现迅速复溶,这一点在紧急用药情况下尤为重要,确保了治疗的高效性和及时性。
技术特征:1.一种注射用β-阻滞剂的制备方法,其特征在于,包括如下步骤:
2.根据权利要求1所述的注射用β-阻滞剂的制备方法,其特征在于,步骤5)中所述预冻工序为:将所述盐酸兰地洛尔产品2放入冻干箱,设定导热液温度为-30℃,以在60分钟内将所述盐酸兰地洛尔产品2温度降至-30℃±5℃,之后在该温度范围内保持60~120分钟。
3.根据权利要求2所述的注射用β-阻滞剂的制备方法,其特征在于,步骤5)中所述一次干燥工序为:所述预冻工序结束后,当冻干箱内的真空度应达到0.15mbar时,开始升温,使导热液温度缓慢升至10~15℃,升温时间控制在60分钟内,之后在该温度下保温180~720分钟。
4.根据权利要求3所述的注射用β-阻滞剂的制备方法,其特征在于,步骤5)中所述两次解析干燥工序为:第一次解析干燥:所述一次干燥工序结束后,启动传热系统,使导热液温度升温至30~40℃,升温时间控制在60分钟内,之后在该温度下保温60~120分钟,同时,保持冻干箱内的真空度为0.1mbar;第二次解析干燥:所述第一次解析干燥结束后,逐渐将冻干箱内的真空度调整至0mbar,在调整真空度的同时,保持导热液温度在30~40℃,保温60~120分钟。
5.根据权利要求4所述的注射用β-阻滞剂的制备方法,其特征在于,所述第一次解析干燥中的所述导热液温度和所述第二次解析干燥中的所述导热液温度相同。
6.根据权利要求5所述的注射用β-阻滞剂的制备方法,其特征在于,所述盐酸兰地洛尔药液ph值为5.5~6.5。
7.根据权利要求1~6任一项所述的注射用β-阻滞剂的制备方法,其特征在于,所述注射用β-阻滞剂的组成包括:盐酸兰地洛尔50~55份、冻干保护剂50~55份、氢氧化钠适量和溶剂适量。
8.根据权利要求7所述的注射用β-阻滞剂的制备方法,其特征在于,所述冻干保护剂为d-甘露醇。
9.根据权利要求8所述的注射用β-阻滞剂的制备方法,其特征在于,所述溶剂用于将所述盐酸兰地洛尔和所述冻干保护剂混合物定容至每支制剂的预定体积。
10.权利要求1~9任一项所述方法制备的注射用β-阻滞剂,所述注射用β-阻滞剂优选为注射用盐酸兰地洛尔,剂型为注射用无菌粉末。
技术总结本申请公开了一种注射用β‑阻滞剂的制备方法,包括如下步骤:1)配液:将处方量盐酸兰地洛尔、处方量冻干保护剂和部分溶剂混合,搅拌溶解,使用氢氧化钠溶液调节药液pH值,并用溶剂定容至预定体积,得到盐酸兰地洛尔药液;2)过滤;3)灌装;4)半压塞;5)冻干:通过预冻、一次干燥和两次解析干燥工序对所述盐酸兰地洛尔产品进行冷冻干燥3;6)充氮、压塞、出箱;7)轧盖,得到最终盐酸兰地洛尔产品;本申请得到的注射用盐酸兰地洛尔稳定性良好,并且复溶时间短。技术研发人员:靳育山,陈久博,罗桓,李春雪受保护的技术使用者:北京阳光诺和药物研究股份有限公司技术研发日:技术公布日:2024/11/21本文地址:https://www.jishuxx.com/zhuanli/20241125/336394.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表