一种将人多能干细胞诱导分化为胰腺前体细胞的方法
- 国知局
- 2024-06-20 10:57:25
本发明涉及生物,具体的,本发明涉及一种将人多能干细胞诱导分化为胰腺前体细胞的方法。
背景技术:
1、糖尿病,一种以持续高血糖为标志的全球性慢性疾病,主要由胰岛素分泌不足或对胰岛素的抵抗引起。长期的高血糖环境可能导致包括心脏、血管、肾脏、眼睛和神经在内的多种组织受损和功能障碍。目前的治疗策略,如外源性胰岛素注射和胰岛细胞移植,虽能缓解糖尿病症状,但存在准确性不足、低血糖风险和供体细胞短缺等问题。随着干细胞技术的发展,特别是通过体外定向分化技术从人类多能干细胞(如人胚胎干细胞和人诱导多能干细胞)获得具有分泌胰岛素能力的β样细胞和类胰岛结构的策略,为糖尿病提供了新的治疗可能。
2、从人多能干细胞(包括人胚胎干细胞和人诱导多能干细胞)起始,通过添加小分子和重组蛋白调节信号通路模仿体内胰腺谱系的发育过程,最终获得包含分泌胰岛素的β样细胞的类胰岛组织。目前普遍认为这一过程主要是通过逐步诱导为定型内胚层(definitive endoderm,de)、原始肠管(primitive gut tube,pgt)、后前肠(posteriorforegut,pf),胰腺内胚层(pancreatic endoderm,pe)或胰腺前体细胞(pancreaticprogenitor,pp)以及内分泌前体细胞(endocrine progenitor,ep),最终获得包含β样细胞的类胰岛组织。其中诱导出优质的胰腺前体细胞对于后续内分泌细胞的分化效率和功能是至关重要的。由于目前对人类胰腺发育的了解有限,定向分化的线索主要来自于动物模型,特别是小鼠。虽然针对上述阶段有对应的特异性基因或蛋白来判断分化效率,但整个过程中的分化路径和细胞状态缺乏全面的评估方法,其与人类体内真实发育过程的异同仍不明了。因此,根据人类胰腺谱系的分化路径和调控网络,以及物种间胰腺谱系发育调控的保守性和特异性,来指导起始于人多能干细胞分化为优质胰腺前体细胞是极其重要的。
3、目前现有方案通过逐步利用不同小分子化合物组合和处理顺序,以及不同的培养时长,在一定程度上获得了表达pp细胞特征基因pdx1和nkx6-1的诱导细胞,并在此基础上获得一定比例且具有一定功能的β样细胞,但同时也会产生较高比例的多激素细胞(胰岛素和胰高血糖素共表达)或α样细胞(分泌胰高血糖素)。造成当前诱导方案分化效率和纯度有限的主要原因是对于人体胰腺谱系分化过程的理解不够完全,缺少单细胞水平上的基于体内分化过程对体外分化路径和诱导细胞状态的系统评价,欠佳的早期分化流程和pp细胞状态可能是导致后续分化问题的原因之一。
技术实现思路
1、针对现有技术中存在的问题,本发明深入分析了小鼠和人类胰腺发育的过程,发现发育路径具有物种间的保守性但在调控网络上具有一定的特异性。从发育路径上看,胰腺前体细胞pp具有腹侧和背侧胰腺内胚层(vpe和dpe)两个起源,分别从de细胞经历胰腺分化命运的al细胞(al-p)和胰腺分化命运的mg细胞(mg-p)而来。比较人类和小鼠的pp细胞发育路径发现,在人类中,腹侧路径(al-p和vpe)与pp细胞的相似性超过背侧路径(mg-p和dpe),这表明了更高的分化效率,而小鼠中这一现象不明显。通过基因共表达网络分析进一步确认了,从de到内分泌谱系的精细分化过程包含三个关键基因模块,其中pp细胞处在连接前两个模块的关键位置。
2、发明人随后对现有诱导方案过程进行全局的单细胞水平解析,鉴定了现有方案的细胞性质、分化路径和调控网络。通过与体内细胞分化过程进行比较,发明人发现与体内不同的主要两点:一是未建立稳定的类似体内发育的基因共表达网络。当前体外从de到内分泌细胞的分化过程分为四个基因模块,而非体内的三个模块,其中早期的基因模块并未稳定的建立。二是现有方案中pp细胞的形成未能模拟人体内腹侧分化路径的高效过程,导致转化为pp细胞的过渡状态与人体内al-p细胞相似度不足。
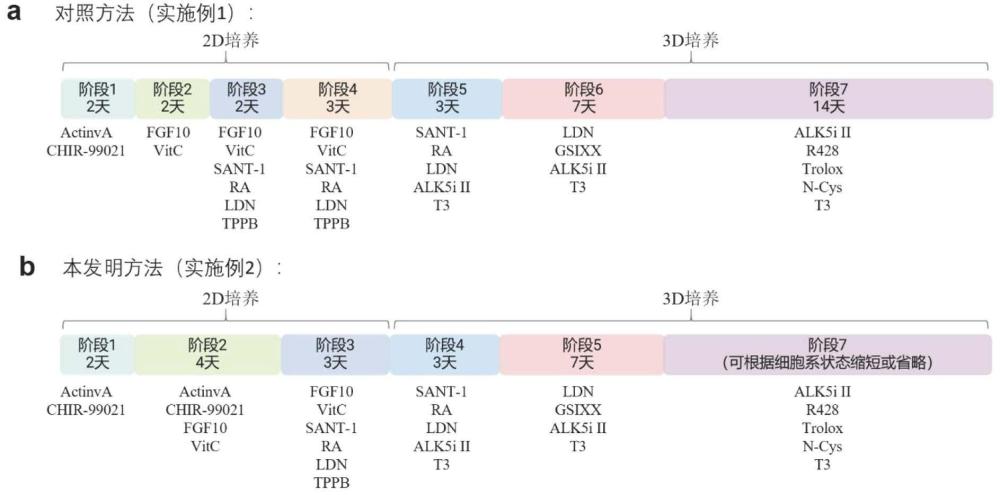
3、鉴于此,本发明提出了一种改进的方法:通过延长s2阶段的诱导时长,促进早期基因网络的形成,并仿照人类胚胎发育中腹侧胰腺内胚层向pp细胞的自然转化过程(de–al-p–vpe–pp),通过加入特定信号物质激活tgf-βnodal通路(添加activin a)和wnt通路(添加chir-99021),促进al-p状态细胞的生成。在此基础上,可以将对照方法的s3和s4诱导时期进行简并,并降低fgf10的使用浓度,实现pp细胞质量的提高。在不改变对照方法s5和s6诱导方案的条件下仍可显著提升β样细胞比例,降低多激素或α样细胞比例。对诱导不同时期移植到动物体内的类胰岛进行分析表明,对照方法最后一个诱导阶段(s7)在本流程中可以省略,使得整个诱导过程缩短至19天的5个阶段,移植后的类胰岛能有效维持血糖稳定。
4、具体的,本发明提供如下的技术方案:
5、本发明的第一个方面,提供一种将人多能干细胞诱导分化为胰腺前体细胞的方法,所述方法包括以下步骤:
6、s1:同时激活tgf-βnodal通路和wnt通路;
7、s2:同时激活fgf通路、tgf-βnodal通路、wnt通路和添加终浓度0.25mm维生素c;
8、s3:同时激活fgf通路、抑制shh通路、激活retinoic acid(ra)通路、抑制bmp通路、激活pkc和添加终浓度0.25mm维生素c;
9、s4:同时抑制shh通路、激活retinoic acid(ra)通路、抑制bmp通路、抑制tgf-βri激酶和添加终浓度1μm甲状腺素t3;
10、s5:同时抑制bmp通路、激活notch通路、抑制tgf-βri激酶和添加终浓度1μm甲状腺素t3。
11、在一种实施方式中,所述方法的步骤具体为:
12、将人多能干细胞培养在添加终浓度10μm y-27632的mtesr1多能干细胞培养基中,24小时后起始诱导分化:
13、s1历时2天:在培养基中添加终浓度100ng/ml activin a和chir-99021,第一天使用终浓度3μm,第二天使用终浓度0.3μm;
14、s2历时4天:在培养基中添加终浓度50ng/ml fgf10、10ng/ml activin a、0.3μmchir-99021和0.25mm维生素c;
15、s3历时3天:在培养基中添加终浓度2ng/ml fgf10、0.25μm sant-1、1μm ra、100nmldn-193189、200nm tppb和0.25mm维生素c;
16、s4历时3天:在培养基中添加终浓度0.25μm sant-1、0.05μm ra、100nm ldn-193189、10μm alk5i ii、1μm甲状腺素t3;
17、s5历时7天:在培养基中添加终浓度100nm ldn-193189、100nm gsixx、10μmalk5iii、1μm甲状腺素t3;
18、其中,s1和s2中所用的基础培养基为mcdb 131培养基,额外添加终浓度1.5g/lnahco3,1×glutamax,10mm d-葡萄糖,0.5%bsa,100u/ml青霉素-链霉素;
19、s3中所用的基础培养基为:mcdb 131培养基,额外添加终浓度2.5g/l nahco3,1×glutamax,10mm d-葡萄糖,2%bsa,0.5×its-x,100u/ml青霉素-链霉素;
20、s4-s5中所用的基础培养基为:mcdb 131培养基,额外添加终浓度1.5g/l nahco3,1×glutamax,20mm d-葡萄糖,2%bsa,0.5×its-x,10μm znso4,10μg/ml肝素,100u/ml青霉素-链霉素。
21、本发明的第二个方面,提供上述方法在诱导类胰岛组织中的应用。
22、在一种实施方式中,所述应用包括如下步骤:
23、s6历时3-14天:在培养基中添加终浓度10μm alk5i ii、2μm r428、10μm维生素e类似物trolox、1mm n-乙酰半胱氨酸、1μm甲状腺素t3;s6中所用的基础培养基为:mcdb 131培养基,额外添加终浓度1.5g/l nahco3,1×glutamax,20mm d-葡萄糖,2%bsa,0.5×its-x,10μm znso4,10μg/ml肝素,100u/ml青霉素-链霉素。
24、本发明的第三个方面,提供一种评估体外细胞分化过程的方法,所述方法包括如下步骤:1)首先为了平衡路径上不同细胞群内的细胞数量,我们对每群细胞进行降抽样,原则上使细胞数接近且后续分析的网络稳定;
25、2)对于降抽样过的数据集,计算所有转录因子基因之间的相关系数,以转录因子基因为节点,相关系数的值为边的权重,建立全连接的网络;
26、3)将切断90-95%的低权重的边,删除在降抽样数据集的细胞中表达比例过低(<5-10%)或过高(>80-95%)的节点,进行网络的稀疏化,保留稀疏化后最大的子网络;
27、4)用算法对剩下的网络进行聚类,如louvain算法,去除与细胞周期、批次效应相关的社区(community),并根据相似性合并剩下的社区,得到网络的多个模块;
28、5)通过分析判断体外分化过程是否建立体内分化过程的三模块共表达网络结构,从而评估体外分化过程的分化效率和细胞特性。
29、相较于现有技术,本发明展现了如下显著的技术进步和有益效果:
30、1)通过延长第二阶段(s2)诱导时长至4-6天,本方法有效促进s2细胞达到与人体内al-p细胞相似的状态,并建立稳定的基因网络。测试发现4天的诱导时间对h1胚胎干细胞系(h1 esc)最优。
31、2)本发明在延长s2诱导时长的基础上,通过添加activin a和chir-99021分别激活tgf-βnodal通路和wnt通路,加强了s2诱导细胞的胰腺发育潜力,提高了其与人体内al-p细胞的相似度。对于h1 esc,推荐activin a和chir-99021的最终浓度分别为10ng/ml和0.3μm。
32、3)本发明用调整后的s3诱导方案代替了对照方法中s3和s4共5天的诱导期,并且将fgf10浓度从对照方法的50ng/ml降低到2ng/ml。这一改进不仅缩短了诱导时长,降低了成本,还促进了和体内更相似的pp细胞的产生,相对于对照方法建立更接近体内pp细胞的基因调控网络并消除了其向其他内胚层细胞谱系分化的潜能。
33、4)从s1至s3的诱导过程不仅优化了胰腺前体细胞(pp)的生成,还直接影响了随后ep细胞的分化路径和效率,与对照方法相比,获得了更高比例的β样细胞及其前体细胞,并显著减少了多激素或α样细胞的产生。
34、5)利用本发明诱导出的pp细胞形成的类胰岛组织,在糖尿病小鼠模型中表现出优异的疗效,显著改善了高血糖症状。
35、6)通过对在诱导不同时期移植的类胰岛进行移植后的检测发现,本发明可将整个诱导流程缩减至5个阶段共19天,且移植后类胰岛仍能有效调控血糖水平,说明对照诱导方法的最后阶段在本流程中可以省略。
36、7)通过对移植物进行单细胞转录组检测,发现本发明可将移植物中β细胞比例提升至最高60%-70%,远高于对照方法移植物中的β细胞比例,并且在移植后细胞功能进一步成熟。
37、8)本发明深入分析了人体胰腺分化的路径和调控机制,特别是通过建立稳定的三模块基因共表达网络,为评估体外诱导的效果提供了一种新的标准,从而提高了方法的准确性和可靠性。
本文地址:https://www.jishuxx.com/zhuanli/20240619/744.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表