分子纳米标签的制作方法
- 国知局
- 2024-07-27 12:15:32
本申请要求2016年10月21日提交的美国临时申请号62/411,324的权益,所述申请通过引用结合入本文。
对政府支持的致谢
本发明是由美国国立卫生研究院(nationalinstitutesofhealth)、美国国家癌症研究所(nationalcancerinstitute)在项目编号为z01bc011502的政府支持下做出的。美国政府在本发明中享有某些权益。
本公开涉及纳米级分子标签及它们在例如流式细胞仪中用于检测靶的用途。
背景技术:
用于单个纳米粒子检测、分辨(resolution)和/或分选(sorting)的改进方法和装置对于临床目的和研究目的两者而言都是有利的。例如,它们可用于鉴定和分析细胞外囊泡(ev)和由细胞释放的其它纳米级粒子,所述细胞外囊泡和由细胞释放的其它纳米级粒子具有重要的生物学功能且在用作治疗剂、靶或生物标志物方面具有显著生物医学潜能。普遍接受的是,ev的组成组分和生物学功能根据产生这些ev的细胞类型以及这些ev的生产条件的不同而不同(raposo和stoorvogel,jcellbiol200(4):373-383,2013)。然而,以前不能够以定义细胞谱系和细胞亚群(subset)的方式表征这些粒子的亚群。类似地,以前也难以检测、分选和计数其它纳米级粒子以及这些纳米级粒子的各分子组分。这一技术的障碍在于缺少可利用的工具和试剂以基于特定的属性来分析、分选和从功能上研究各纳米级粒子。
荧光活化细胞分选(facs)自从由herzenberg及其同事于1972年引进以来已经被用于鉴定和分选经标记的细胞亚群(julius等人,procnatlacadsciusa69(7):1934-1938,1972;bonner等人,revsciinstrum43:404-409,1972),但是认为分选亚微米亚种群(subpopulation)对小于约500nm的粒子而言是不可行的。流式细胞术的常规观点认为,来自小于1微米的粒子的信号会被来自样品碎片和电噪声的信号淹没,因此仍然是不可检测的。某些现代的高分辨率仪器将能检测ev的灵敏度范围扩展到约200nmev尺寸和约10个荧光分子的检出限,但是目前没有仪器能够基于单个表位的检测来检测、分析和分选小于200nm的ev。因此,需要在试剂和方法(例如,流式细胞术)方面加强,以允许单分子如ev表面上的单个受体的检测和量化。
技术实现要素:
尽管具有分选能力的流式细胞仪可用于分选和研究单个细胞,但尚未开发出可以以单表位灵敏度检测和分选小于200纳米的纳米材料的流式细胞仪或类似设备。为了填补这一空白,发明人开发了可通过现代高分辨率流式细胞仪分别检测的多参数标记(在本文中称为分子纳米标签),由此使得对于用标准方法检测而言太小或具有太少表位的小ev或其它纳米生物材料(如荧光标记的抗体)的检测和分选成为可能。
本文公开的组合物和方法克服了在纳米级粒子/囊泡的功能分选和单分子的检测方面的现有障碍。本文公开了纳米级分子标签,其使得通过显微术或测量荧光和/或光散射强度(在本文中也称为光散射功率)的高分辨率装置(如流式细胞仪)检测单分子成为可能。例如,所述分子标签可以在被配置用于高分辨率检测的流式细胞仪中使用。例如,参见在美国专利申请公开号20130095575中以及在morales-kastresana等人,scientificreports,7:1878,2017中公开的nanofacs方法。
在一些实施方案中,纳米级分子标签包括直径小于约100nm(例如,直径小于40nm或小于20nm,如约10到100nm、10到50nm或40到80nm,如10nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm或100nm)的芯纳米粒子;任选的包围所述芯的壳;和具有第一部分和第二部分的装甲(armor),其中所述第一部分结合于所述芯纳米粒子的表面,或结合于所述壳(如果存在的话)的表面,并且所述第二部分不结合于所述芯纳米粒子或壳且包括具有固定数目和/或可量化数目(例如,一个)结合位点的官能化末端。所述芯、壳和装甲中的任一者或任何组合对可通过高分辨率装置检测的所述分子标签的荧光性能、光散射性能和/或靶(例如,配体)结合性能有贡献,所述高分辨率装置测量在特定设备的基准噪声水平以上的光散射强度,如在流式细胞仪装置中那样。例如,所公开的分子纳米标签的弹性光散射强度允许所述组装结构在(弹性)光散射(通常称为侧向散射或前向散射)的检出限水平以上是可检测的,且荧光或拉曼散射光强度允许所述组装结构对该设备的非弹性散射光的检出限以上的检测而言具有足够的亮度,且所述靶(例如,配体)特异性允许对广谱的纳米级生物靶进行鉴定和表征。具有那些多参数特征中至少一个的所公开的分子纳米标签允许其作为单独的分子纳米标签被所述设备检测,因此所公开的分子纳米标签可用于检测具有少数如一个表位或配体的ev。
在其它更具体的实施例中,所述纳米级分子标签包括直径小于100nm的芯纳米粒子;任选的壳;和具有第一部分和第二部分的装甲(例如,聚合物)。装甲的第一部分包括将所述装甲连接于芯纳米粒子表面的共价结合位点,其将纳米粒子化合价降低到固定数目(例如,一个)的功能性结合位点;第二部分提供将装甲结合位点与指定或预选靶的功能性配体连接的接头;和指定靶的功能性配体(由蛋白质、核苷酸或其它配体结合元件组成),且其中所述芯、壳和装甲中的任一者或任何组合对可由显微术或测量荧光和光散射强度的高分辨率装置检测的分子标签的荧光性能、光散射性能和/或配体结合性能有贡献。在其它更具体的实施例中,所述芯包含量子纳米晶体(具有任选的壳),所述量子纳米晶体具有对可通过流式细胞仪检测的光散射性能有贡献的高折射率、表面几何形状或其它属性,且所述装甲是能够与结合配偶体或靶配体特异性结合的聚合物。
所公开的分子标签提供检测诸如量子纳米晶体的单个纳米粒子,以及与所述分子标签结合的靶的能力。通过组合不同的分子标签,有可能检测和分选纳米级粒子,并且还有可能检测和计数纳米级粒子的各分子组分,例如细胞或ev上的表面受体。所述分子标签能够具有与感兴趣的各相应靶结合的受控化合价(例如,一价)。这种化合价受控的结合使得能够对所结合分子的数目进行计数,例如在所检测信号的移位峰中,例如在流式细胞仪输出中或使用检测并行的光散射和荧光检测的其它方法时。单分子检测的能力具有广泛的生物医学应用、生物防御应用、工业应用、环境应用和其它应用。例如,所述分子标签可用于检测和确定细胞外微泡和病毒的生物学相关亚群的特定分子数目,具有良好的保真度,且具有分离所述相关亚群的能力。在其它实施例中,可以检测与射线照射、疾病检测、临床预后或治疗法或治疗方案的选择相关的生物标志物(包括生物印记)。
还提供了在能够同时进行光散射和荧光检测的设备(例如,流式细胞仪)中检测靶的方法。所述靶例如可以是样品中的单个靶分子。在一些实施例中,所述方法包括使样品接触本文公开的纳米级分子标签,其中所述纳米级分子标签的官能化末端特异性地结合样品中的靶分子(如果存在的话);和使用为分辨小粒子配置的设备分析样品,以通过检测侧向散射或检测荧光或进行这两个检测来检测与靶分子结合的各纳米级分子标签。
本公开的另一个方面是使用分子纳米标签检测携带肿瘤抗原的细胞外囊泡(ev)或其它亚微米粒子的方法,在所述分子纳米标签中功能性配体对所述肿瘤抗原具有特异性,然后使用显微术或测量荧光和/或光的散射和强度的高分辨率装置检测染色的粒子。作为示例而非限制,所述肿瘤抗原可以是psma、间皮素(mesothelin)、epcam、her2、egrf、cd24、cd133、cd47、cd147、pd-l1、gpc-1或muc-1,或者是随后在发明详述中描述的其它标志物。或者,所述方法使用分子纳米标签检测携带感染性病原体抗原(例如,病毒抗原)的ev或其它亚微米粒子,在所述分子纳米标签中功能性配体对所述病毒抗原具有特异性。作为示例但非限制,所述病毒抗原源自于hiv、丙型肝炎病毒、乙型肝炎病毒、人乳头瘤病毒(hpv)、htlv-i、埃-巴二氏病毒(epstein-barrvirus)或本说明书中随后描述的那些。在其它实施方案中,所述方法检测免疫系统细胞抗原或标志物,其中功能性配体对所述免疫系统抗原或标志物具有特异性。作为示例且非限制,所述免疫系统抗原或标志物为mhcii型抗原、pd-l1、cd80、cd86、cd83、cd11c、cd11b、cd3、cd4、cd8、cd19、cd20或本文所述的其它标志物。在另一个实施方案中,所述方法检测携带疾病抗原或标志物的ev或其它亚微米粒子,所述疾病抗原或标志物例如为,但不限于阿尔茨海默氏病、多发性硬化、类风湿性关节炎、糖尿病、炎症性肠病、风湿性疾病、炎性疾病、内分泌疾病、胃肠疾病、神经病学疾病、自身免疫疾病、心血管疾病或肾疾病的标志物,或者在本说明书中随后描述的其它标志物。
因为所公开的分子纳米标签在它们的设计上是模块化的,可以组装出具有芯、装甲和配体结合组分的模块化组合的一组分子纳米标签,以产生多元(multiplex)分子纳米标签阵列,其中可以使用多种类型的分子纳米标签,各自在弹性和非弹性光散射性能方面具有独特属性且每种类型具有独特的配体特异性,以同时(simultaneously)或同期(contemporaneously)检测多种不同的靶。在与分选型流式细胞仪一起使用时,基于每种分子纳米标签仅对一种特异性配体/表位的特异性结合,所述分子纳米标签能够分选和下游分析ev或其它靶的特定亚种群,以用于另外的下游测定。因此,在一些实施例中,所公开的方法是多元的(multiplexed),因为同时或同期检测几种不同的配体相关ev(例如,可以用所公开的分子纳米标签同时或同期检测在其表面上包含不同靶分子的ev,例如使用多种不同的分子纳米标签群,各自对特定的靶ev群具有特异性)。在某些实施例中,所述方法是多元的,且所公开的方法使用至少2种、至少3种、至少4种、至少5种、至少10种、至少20种、至少30种、至少40种或至少40种不同的分子纳米标签群,例如以检测多种不同的靶(例如,抗原、ev标志物及其组合)。
通过以下发明详述和实施例以及参考附图,本公开的前述和其他目的以及特征将变得更加显而易见,所述发明详述和实施例仅出于说明目的提供。详述的实施例满足使得他人能够实施和使用本发明的要求,而非限制本发明的范围。
附图简述
以下附图中的至少一些是以彩色提交的:
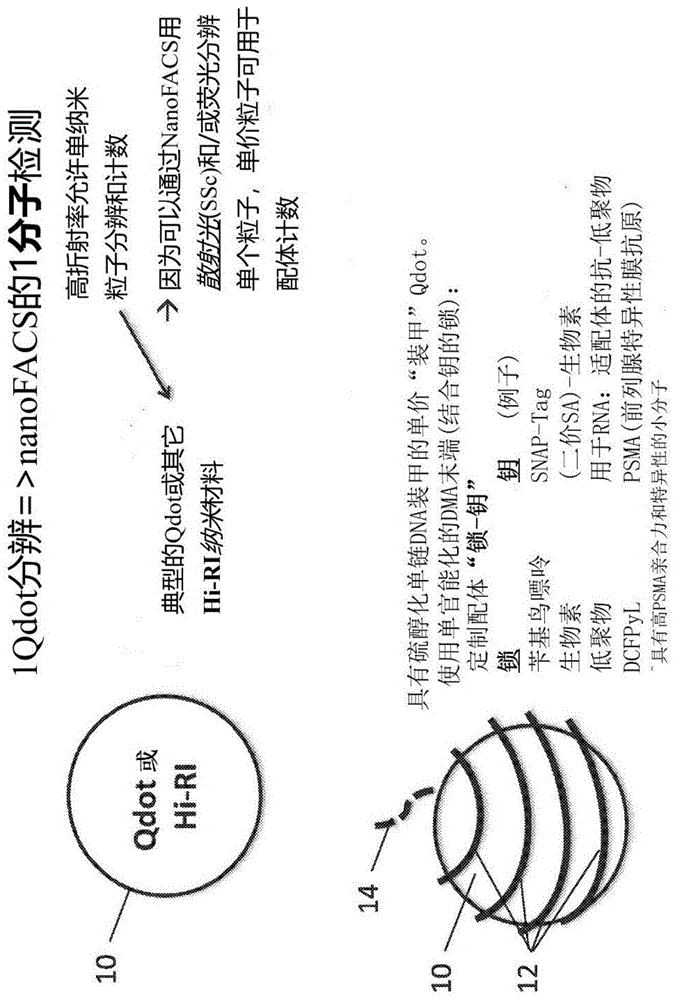
图1a-1b:示例性分子纳米标签的示意图。图1a说明了分子纳米标签包括具有高复折射率(ri)的芯粒子10,如量子纳米晶体或其它高复ri纳米材料(如银或金),和“装甲”12,如具有单官能化dna末端的硫醇化单链dna。所述官能化dna末端14用作“锁(lock)”(或“锁”的结合位点),其可与特定的“钥(key)”结合,例如,靶配体。使用nanofacs方法,通过侧向散射(ssc)和/或荧光可以分辨单粒子,且单价纳米标签使单分子配体计数成为可能。或者,可以通过显微术或其它光学方法(例如,纳米粒子追踪或sers,参见例如stremersch等人,small12:3292-301,2016)使所述单粒子成像。图1b示出了单价装甲的量子纳米晶体(例如,)20的例子,其具有硫醇化单链dna装甲12和单官能化dna末端14。利用互补dna末端,也可以串联使用所述装甲的量子纳米晶体。
图1c示意性说明了公开于farlow等人,nat.methods10(12):1203-1205(2013)的单价量子纳米晶体类型,所述文献通过引用并入本文。fowler等人的单价量子纳米晶体作为单粒子不能被高分辨率流式细胞计如nanofacs检测到。所述粒子只有在大大过量使得它们在激光拦截中作为多个重合粒子的“群(swarms)”被检测时才会被检测到。该图还说明了该现有方法的变化形式,以生产可与靶选择性结合的分子复合结构。
图1d在上图中示意性说明了本公开的分子纳米标签30,其包括具有装甲12的量子纳米晶体10(例如,单价的硫醇化dna装甲、单价的多腺苷化dna装甲(yao等人,npgasiamaterials7:e159,2015);或装甲分子的化学计量比为每总结合的表面分子包括1个功能性配体(例如,参见leduc等人,nanoletters13:1489-94,2013)),所述装甲12在末端14连接于第一结合配偶体16(例如,标记或标签),所述第一结合配偶体16特异性地结合于第二结合配偶体(例如,靶,如蛋白质,如配体)18。该图的下图中还描述了该概念的变体,其中第一装甲的量子纳米晶体40连接于第二量子纳米晶体50,所述第二量子纳米晶体50连接于第一结合配偶体16(例如,标记或标签),所述第一结合配偶体16特异性地结合第二结合配偶体(例如,靶,如蛋白质,如配体)18。在一个实施例中,单价装甲设计确保了一对一的配体-标记结合以及所计的标记数目与所测量的靶(ev表位)数目的对应性。然而,为了检测仅有的一个靶表位,对于所述装甲,可以采用多价表面化学,例如链霉亲和素或硫醇-peg(duchesne等人,langmuir24:13572-80,2008)。
图2:所预测的散射光强度(线,基于米氏理论(mietheory)使用mieplot,philliplaven.com建模)相对于使用为nanofacs而配置的astrios-eq所检测的散射光强度的绘图,其中显示了材料。曲线和左侧轴是基于米氏理论的光散射预测模型,对ev(ri=1.40)、聚苯乙烯珠(ri=1.61)和二氧化硅珠(ri=1.46)使用488nm激光,使用水作为介质(ri=1.33)。曲线上的点代表在astrioseq设备上分析的实际粒子的经验中值(有标准偏差)强度测定,以示出它们与通过米氏模型在数学上预测的散射相比的拟合程度。例如,金粒子(20nm–100nm)具有比诸如聚苯乙烯二氧化硅或ev等材料更高的预测散射强度,因为金材料与入射激光的量子相互作用导致高的复折射率和等离子共振(plasmonicresonance)。
图3:使用nanofacs方法通过荧光和561nmssc和488ssc的侧向散射检测单个的29nmpeg化
图4:所公开的分子纳米标签是一类新的标记,其在一些实施例中包含模块化组分,所述模块化组分包括以弹性方式散射光(以与入射光相同的波长范围)的纳米级光散射元件(在一个描述的实施方案中为芯纳米粒子,例如,图1b中的10),且所述模块化组分可以包括还以特定的非弹性方式散射光的元件(荧光团或拉曼散射分子)(其还可以是对散射强度有贡献的组分,如果所述芯纳米粒子是同时产生弹性和非弹性散射光谱的量子纳米晶体或类似组分),和用于靶检测的单价接头,如在farlow等人,nat.methods10(12):1203-1205(2013)中所述的。所述分子纳米标签允许在单纳米级尺寸的囊泡表面上单分子的检测。29-nmpeg化的检测。当在astrioseq上使用公开的nanofacs方法时,除了通过荧光完全分辨为单个的(单分子)粒子外,在散射光噪声基底及其以上观察到仅使用pbs来描绘设备噪声。还示出了用nanofacs系统测试的peg化的供应商提供的说明书。
图5:通过整体分析(使用基于珠的流式细胞术)和通过单ev分析检测来自前列腺细胞系的细胞外囊泡(ev)上的前列腺特异性膜抗原(psma)表达。
图6a是一系列的四个图,示出了四种代表性的具有独特光散射性能的不同材料的折射率和波长之间的关系。
图6b示出了获自公共数据库(refractiveindex.info)的绘图数据。金是高复折射率材料的一个具体例子,可将其用于分子纳米标签中以提高量子纳米晶体的反射率来增加弹性光散射和改进在背景噪声水平以上的检测。在405nm,折射率是1.5236,消光系数是1.8409。
图7a-7b:(a)金纳米球和金纳米海胆状结构(goldnanourchins)的生产吸收规格。(b)金标准纳米粒子(上图)和金纳米海胆状结构(下图)可以多种尺寸获得,例如从15nm到100nm。金纳米球与金纳米海胆状结构的区别在于它们的表面几何形状以及所述表面如何与光相互作用。金纳米粒子和纳米海胆状结构可用于实现独特的吸收和光散射图样(pattern),这使得这些材料在溶液中是不同颜色的可见外观,尽管它们由相同的材料(金)组成和尽管它们具有相同的平均直径。因为这些材料可以作为单个对象来分辨且因为它们具有独特的光散射光谱,所以它们不仅可以通过直径来区分,而且还可以通过它们的光吸收和散射特征(profile)来区分。因此,可以使用诸如金纳米球或金纳米海胆状结构的纳米材料作为所公开的分子纳米标签中的具有高ri的芯粒子(例如,图1b中的10),它们可以多元方式(multiplexfasion)用于鉴定不同的特异性配体-结合的ev。此外,因为表面几何形状和粒径差异导致不同的光散射性能,在具有不同表位特异性的分子纳米标签中使用这些不同的材料作为芯允许基于芯材料的光散射性能将标记组分层,其方式与基于荧光的分层通常被用于多元标记组测定中的方式相同(krutzkik等人,chapter6,unit6.31,currentprotocolsincytometry,2011)。
图8:金纳米球相对于金纳米海胆状结构的观察到的光学特征的对比。金纳米粒子(左图)、金纳米海胆状结构(中间图)和聚苯乙烯珠(右图)的比较(都是100nm)。通过gardiner等人(jextracellvesicles3:25361,2014,通过引用结合入本文)所述的方法来确定各组分材料在不同波长下的折射率。在这个例子中,以这种方法,金纳米海胆状结构和金纳米球二者都具有约1.4或更高的推导的ri,但是,如在nanosight视频屏截图(下图)中所见,使用金纳米海胆状结构所看到的可见光大于相同尺寸的金纳米球,是因为金纳米海胆状结构表面具有更大的散射光衍射。光衍射的差异导致在这些纳米材料之间的散射光特征中存在一个可见差异,且另一个是图7a中所示的吸光度和等离子共振。
图9:本文公开的分子纳米标签的模块化组分的示意图,在一些实施例中,所述模块化组分包括强荧光组分、光散射组分、和配体特异性结合组分。所述强荧光组分具有例如大于100mesf(等价可溶荧光染料分子数(moleculesofequivalentsolublefluorochrome),一种具有强烈且独特的光散射特征的组分,且可以在流式细胞仪上用fsc或ssc分辨)的荧光,且具有配体-特异性结合组分,例如适配体(aptamer)、affimer、抗体、或小分子配体)。
图10a提供可与所公开的分子纳米标签一起使用的小分子前列腺特异性膜抗原(psma)配体(例如,图1b中的14,参见图11a-11f)。
图10b提供第二合成psma配体,生物素-peg-酰胺-psmaccw-ii-372(例如,图1b中的14)。
图10c提供用于与所公开的分子纳米标签一起使用的由nciimageprobedevelopmentcore合成的第三合成psma配体,生物素-peg8-psmaccw-ii-361(例如,图1b中的14)。
图11a-11f在psma-特异性分子纳米标签的情况下将单价的量子纳米晶体构造(左图)与现有量子纳米晶体-sa-mab(右图)进行对比。作为分子纳米标签构建的这种多价标记(图11f)提供检测ev上单个表位的灵敏度,但无法提供对每个ev进行表位计数或枚举(enumeration)而言最有用的一对一结合化学计量。(a)是通用芯和单价装甲的例子,(b-d)图示说明了作为链霉亲和素的配体起作用的终末端生物素化装甲,用于连接生物素化的靶-结合分子,例如生物素化的抗体(b)、生物素化的适配体(c)、或生物素化的小分子配体(d)。(e)描述了纳米粒子表面上的叠氮化单价聚合物,其通过点击化学(clickchemistry)与psma配体dcbo-teg缀合。(f)示出了用于与生物素化的分子结合的代表性常规多价链霉亲和素qdot,包括结合于ev的抗-psma抗体,如图18中所示。图11b的设计还可以由合成寡核苷酸组成,其中所述psma结合适配体序列与结合于芯表面或壳的装甲化(“armor”-ing)序列是连续的。
图12a描述了用于与分子纳米标签一起使用的三种psma-结合适配体的结构(seqidnos:1-3)。在特定的例子中,psma-结合适配体序列被包括在装甲dna的末端。
图12b示出了使用的添加有5’-teg间隔子的a9g来检测psma的表面表达(右图)。
图12c提供了对a9g进行修饰的示意图,以便用作标记的配体。
图12d提供了将这种a9g适配体作为端配体结合元件14并入到分子纳米标签装甲序列12中的示意图。
图13a-13e显示可以通过将纳米标签的壳深度从小于6nm的常规深度增加到大于10nm(例如,10-20nm)的壳深度来减少分子纳米标签的不完全计数。例子来自single-nqd光致发光研究。(a)根据对典型地>100个单个g-nqd的分析构建的cdse/19cdsg-nqd群的亮态时间(on-time)直方图。在(a)的小图中示出了对于单个cdse/19cdsg-nqd的示例性荧光时间追踪(用于绘制直方图)。(b)对于不同的亮态时间,‘nqd群百分比’对cds壳单层数目的绘图。为10-、16-和19-壳系统进行了两种制备分析的绘图,在(b)中提供实验可变性的指示。(c)光漂白行为:为cdse/5cds(左上图)、cdse/10cds(右上图)、cdse/15cds(左下图)、和cdse/19cds(右下图)芯/壳nqd提供了发光nqd分数随时间的绘图。对于≥99%的观察时间为‘亮态(on)’的nqd(‘非闪烁’群)(d)和≥80%的观察时间为‘亮态’的nqd(‘很大程度上非闪烁’群)(e),百分比-nqd群与壳厚度的比较作为总观察时间(0.5、5和54分钟)的函数。
图14a-14d图示说明了用于实施nanofacs的astrioseq的配置。(a)沿着相应的荧光检测路径(正交而非前向的检测路径为实线)的侧向散射激光轨迹(虚线)。这个示意图显示带有芯流(corestream)和样品粒子(由所述液流中心的点表示)的鞘液流(streamofsheathfluid),被这些研究中使用的四种激光截取。每种激光不仅产生特征衍射环,而且产生模糊的扩散散射光(这里只示出绿激光用于说明)。(b)astrioseq检查室的图像,激光在对齐位置拦截所述流,显示在所述流关闭时存在漫散射的光,在所述流打开时,其沿着激光截取的平面(沿着室壁和门)周围的衍射环,变得更亮。使用led脉冲发生器(c),在隔离的和从未用过的pmt检测器狭缝中使用led脉冲发生器作为光学触发器(固定脉冲频率),对候选触发通道上的本底噪声进行相对比较。(d):为了分析亚微米粒子(100、200和500nm聚苯乙烯珠)和比较每种激光的分辨能力,561ex-ssc通道设置为触发/阈值通道,以允许以每秒10-15k事件(eps),为最大样品eps速率的~10-15%,检测漫散射的光。在这个设备上,侧向散射信号检测显示在488ex-ssc通道上具有最大的小粒子分辨率,而561ex-ssc提供最好的信号:噪声分离。
图15a-15i说明用nanofacs进行的细胞外囊泡(ev)分析、分选和再分析。与用作对比的100nmfluospheres(a)一起,用nanosightnta(b和c)和nanofacs(分别为d、e和f)表征来自树突状细胞系(dc2.4)和乳腺癌细胞系(4t1)的ev。与在高于噪声水平所检测到的事件/材料的数据(绿色-虚线框)一起监测基准噪声(红色-虚线框)。将来自4t1和dc2.4细胞系的肿瘤和免疫ev群分别用羧基荧光素琥珀酰亚胺酯(cfse,invitrogen)和celltrackerviolet(invitrogen)标记。用nap-5(gehealthcare)尺寸排阻色谱除去未结合的标记;将所述ev群混合,然后分析并分选,示出了分选门(sortgates)(g)。通过离心浓缩将所分选的ev样品浓缩(amiconultra-15,10knmwl),并进行再分析(h和i)。再分析显示>95%的纯度(以阳性选择门中的再分析事件数目除以阴性选择门和双阳性选择门的再分析事件的总和来计算),在高于基准噪声只观察到分选的ev,而未观察到阴性选择的ev。
图16a-16e说明了在包括金、银、聚苯乙烯、铂、二氧化钛、氧化铁和铜的多种组成的300-800nm的uv-可见光谱中,(a)20nm、(b)40nm、(c)60nm、(d)80nm和(e)100nm粒子的光谱散射性能。
图17a-17b说明(a)40nm金和银纳米粒子的截面散射特征,其使用米氏理论采用已发表的折射率和消光系数建模。竖线描绘astrioseq流式细胞仪的照射波长。(b)在405、488、561和640nm散射通道上获取的40nm金(蓝色)和40nm银(红色)的原始数据。
图17c说明基于数学模型,如何使用适当的ss检测通道将金和银纳米粒子彼此区分。
图18说明使用流式细胞术对用量子点(qdots)标记的细胞外囊泡(ev)的检测。
图19a-19c说明对(a)荧光阳性的(cfse+)细胞外囊泡(ev)、(b)连接于au纳米标签的cfse+ev的检测,引起cfse+ev事件的488nm散射强度的移位。(c)示出了用ag纳米标签染色的cfse+ev,引起ev的561nm散射强度的移位。
图20说明使用astrios设备或symphony设备检测由金组成的40nm、60nm或80nm的纳米粒子和由聚苯乙烯组成的100nm的纳米粒子所获得的原始数据。
图21说明用于分离、标记和检测ev的流程。
图22a-22b说明使用米氏理论用(a)astrioseq(24a)和(b)facssymphony流式细胞仪的采集光学系统对球形粒子的建模,采用以下折射率:聚苯乙烯(珠ri=1.604)、二氧化硅(珠ri=1.435-1.465)和细胞外囊泡范围(绿色)。每个图上叠加了与所建模的球形粒子相关的所获取的聚苯乙烯和二氧化硅珠数据。y轴代表流式细胞仪的任意单位刻度,将绝对单位的预测数据归一化为任意单位。100nm和1000nm平均ri细胞外囊泡的通道数以黑色虚线示出。突出设备检出限的阈值和系统噪声以红色虚线描绘。
图23a-23d说明通过流式细胞术分析对(a)38种不同的珠群的检测,每种群具有不同的红色和绿色标记量(如p1和p2参数所示)。(b)用38个珠组和对不同ev表位有特异性的标记抗体从血浆捕获和检测ev,以鉴定与具有所述表位的ev结合的三个珠群。(c)说明使用分子纳米标签产生多元ev分析阵列,所述分析阵列实现了单表位和单ev灵敏度。(d)基于ev上psma的检测,比较所分选的ev的mirna分布与整体ev群mirna或psma-阴性ev的mirna。
序列表
核酸序列使用核苷酸碱基的标准字母缩写示出,如37c.f.r.1.822中所定义的。仅显示了每个核酸序列的一个链,但应理解当提及所展示的链时,其互补链也包括在内。在2017年10月23日生成的4.00kb的序列表通过引用结合入本文并一起提交。
seqidno:1是a10-3.2psma适配体序列。
seqidno:2是a9gpsma适配体序列。
seqidno:3是a9g.6psma适配体序列。
对于以下的seqidnos:4-13,硫代磷酸酯dna=a*、g*、c*、t*;rna=ra、rg、rc、ru;硫代磷酸酯rna=ra*、rg*、rc*、ru*;2'o-甲基rna=ma、mg、mc、mu;硫代磷酸酯2'o-甲基rna=ma*、mg*、mc*、mu;锁核酸(lna)=+a、+g、+c、+t(仅在双重标记探针上可利用);3'生物素-teg(四乙二醇)=/3bioteg/;内部的2'-氟化尿嘧啶核苷(internal2'-fluorodinateduridine)=/i2fu/;32fu=3’2-氟尿嘧啶核苷;5biosg–在5’位具有单个二醇接头的生物素;dbco二苯并环辛基=点击附着(clickattachment);混合碱基=大写字母的碱基(还参见www.idtdna.com/pages/support/technical-vault/reading-room/quick-reference/all-modifications)。
发明详述
i.缩写
ev细胞外囊泡(extracellularvesicle)
fsc前向散射(forwardscatter)
nanofacs纳米级荧光活化的细胞分选(nanoscalefluorescenceactivatedcellsorting)
pmt光电倍增管(photomultipliertube)
ps聚苯乙烯(polystyrene)
psma前列腺特异性膜抗原(prostatespecificmembraneantigen)
市售的量子纳米晶体(acommerciallyavailablequantumnanocrystal)
spd小粒子检测器(smallparticledetector)
spo小粒子探测组件(smallparticleoption)
ssc或ss侧向散射(sidescatter)
ii.术语和方法
除非另有说明,根据常规用法来使用各技术术语。常见术语(例如,核苷酸、dna、rna、适配体、探针、细胞外囊泡等)的定义可以在如下文献中找到:benjaminlewin,genesv,牛津大学出版社出版,1994(isbn0-19-854287-9);kendrew等人(eds.),theencyclopediaofmolecularbiology,blackwellscienceltd.出版,1994(isbn0-632-02182-9);和roberta.meyers(ed.),molecularbiologyandbiotechnology:acomprehensivedeskreference,vchpublishers,inc.出版,1995(isbn1-56081-569-8)。
除非另有解释,本文中使用的所有技术和科学术语具有与本公开所属技术领域的普通技术人员通常理解相同的含义。单数术语的“一(a)”、“一个(an)”和“该(the)”包括复数形式,除非上下文明确表明不是这样。“包括a或b(comprisingaorb)”是指包括a或b,或者包括a和b。还应该理解,对于核酸或多肽所给出的所有碱基尺寸或氨基酸尺寸,以及所有的分子量或分子质量值都是近似值,且出于描述目的而提供。尽管可以使用与本文中所述那些相似或等效的方法和材料来实践或检验本公开,以下描述了适合的方法和材料。所有包含的出版物、专利申请、专利和其它参考文献都通过引用全文结合入本文。如果发生矛盾,以本说明书(包括术语解释)为准。另外,所述的材料、方法和例子只是说明性的而非意在限制。
为了便于审阅本公开的各实施方案,提供以下具体术语的解释:
适配体:核酸适配体是可以与预先选择的靶(例如,蛋白质和肽)以高的亲合力和特异性结合的单链dna或rna(ssdna或ssrna)分子。肽适配体是经选择或改造以结合特定靶分子的人工蛋白。
装甲:对于本文公开的分子纳米标签,装甲是指在芯纳米粒子表面上的聚合物,其基本上覆盖所述纳米粒子的表面并通过将不希望结合的其他聚合物排斥在结合之外而保护所述纳米粒子免于与所述其它聚合物结合。在一些情况中,所述排斥是空间排斥。因此,装甲有助于保证具有装甲的纳米粒子的可控化合价,例如一价。
亲和素/链霉亲和素:亲和素对生物素的超常亲合力允许复杂混合物中包含生物素的分子与亲和素不连续地结合。亲和素是在蛋清和鸟类、爬行类和两栖类组织中发现的糖蛋白。它包含四个相同的亚基,具有67,000-68,000道尔顿的总质量。每个亚基由128个氨基酸组成且与一个生物素分子结合。大量化学修饰对亲和素的活性几乎没有影响,使其尤其适合于蛋白质纯化。
另一种生物素-结合蛋白是链霉亲和素,其分离自亲和素链霉菌(streptomycesavidinii)且具有60,000道尔顿的质量。与亲和素相比,链霉亲和素不具有糖类且具有5.5的弱酸性pi。亲和素的另一个形式是质量约为60,000道尔顿的neutravidintm生物素结合蛋白(可获自piercebiotechnology)。
亲和素-生物素复合物是已知最强的蛋白质和配体之间的非共价相互作用(ka=1015m-1)。生物素和亲和素之间的键形成非常迅速,且一旦形成,所述键不受极端的ph、温度、有机溶剂和其它变性剂所影响。
链霉亲和素可以被其它类型的亲和素代替。术语“亲和素”意指亲和素、链霉亲和素和具有类似生物素结合特征的其它形式的亲和素(例如,其衍生物或类似物)。亲和素/链霉亲和素的类似物或衍生物包括但不限于硝基链霉亲和素、非糖基化的亲和素、n-酰基亲和素(例如,n-乙酰基、n-邻苯二甲酰基和n-琥珀酰基亲和素)以及商购产品extravidintm(sigma-aldrich)、neutraliteavidin(southernbiotech)和captavidin(invitrogen)。另外的亲和素/链霉亲和素类似物和衍生物是本领域中已知的(参见例如,美国专利no.5,973,124和美国专利申请公开号no.2004/0191832、2007/0105162和2008/0255004)。
结合配偶体:借助特异性的非共价相互作用而相互作用的一对分子中的一员,所述特异性的非共价相互作用取决于所涉及分子的三维结构。示例性的特异性结合配偶体对包括抗原/抗体、半抗原/抗体、配体/受体、核酸链/互补核酸链、底物/酶、抑制剂/酶、碳水化合物/凝集素、生物素/亲和素(例如,生物素/链霉亲和素)和病毒/细胞受体。
生物标志物:生物体中的可测量物质,其存在指示生物体的可观察特征(表型)。生物标志物可用于测量疾病的存在、疾病的进展和/或治疗效果。多种生物标志物是本领域中已知的,包括循环生物标志物如存在于生物样品中的囊泡、微小rna或蛋白质。对受试者或个体的表型进行表征可包括但不限于疾病或病症的诊断、疾病或病症的预后、疾病阶段或病症阶段的确定、药物效力、生理情况、器官窘迫(organdistress)或器官排斥、疾病或病症进展、与疾病或病症的治疗相关的结合或特定的生理学或生物学状态。
生物素:以高亲合力结合亲和素和链霉亲和素的分子(又名维生素h或维生素b7)。生物素经常用于标记核酸和蛋白质,随后通过与可检测标记(例如荧光或酶报道分子)连接的亲和素或链霉亲和素来检测。分子(例如,抗体或其它蛋白质样品)的生物素化在本领域中通常通过使生物素上的游离羧基与蛋白质上的胺基团(例如,在抗体或蛋白质分析物/类似物中的胺基团)反应来实现。除非另有说明,术语“生物素”包括参与与亲和素的结合反应的衍生物或类似物。生物素类似物和衍生物包括但不限于n-羟基琥珀酰亚胺-亚氨基生物素(nhs-亚氨基生物素)、2-亚氨基生物素的氨基或巯基衍生物、酰胺基生物素、脱硫生物素、生物素砜、己酰基酰胺基生物素和生物胞素、生物素酰基-ε-氨基己酸-n-羟基琥珀酰亚胺酯、磺基琥珀酰亚胺亚氨基生物素、生物素溴乙酰肼、对重氮基苯甲酰基生物胞素、3-(n-马来西安亚氨基丙酰基)生物胞素、6-(6-生物素酰胺基己酰胺基)己酸酯和2-生物素酰胺基乙硫醇。生物素衍生物还可以商购得到,例如dsb-xtm生物素(invitrogen)。另外的生物素类似物和衍生物是已知的(参见例如,美国专利号5,168,049;美国专利申请公开号2004/0024197、2001/0016343和2005/0048012;和pct公开号wo1995/007466)。
生物素结合蛋白:出于预定目的以足够大的亲合力结合生物素的蛋白。生物素结合蛋白的例子是本领域公知的,包括亲和素、链霉亲和素、neutravidintm和特异性结合生物素的单克隆抗体或受体分子。在本公开的情况中,链霉亲和素可以被任何其它生物素结合蛋白或生物素结合蛋白的组合所替代。
点击缀合:利用“点击”化学的缀合,其为描述模块化、范围广泛、收率非常高且只产生无害副产物的化学反应的术语。“点击”反应的一个例子是huisgen铜(i)-催化的叠氮化物-炔1,3-偶极环加成(cuaac),其产生1,4-二取代的五元1,2,3-三唑环。叠氮化物和炔之间的这种反应提供高的产率且涉及可以相对容易地引入到多种分子(例如,合成聚合物、荧光团、小分子)中或引入到生物分子的特定位置中的官能度。对于生物学目的而言这种反应的积极方面在于叠氮化物和炔官能团对于生物分子和水环境基本上是惰性的。新近,无铜的点击缀合已经可利用了,其使用dcbo-teg和叠氮化的接头。
缀合:是指两个分子例如借助共价键结合在一起。缀合物的例子是与可检测标记(例如,荧光团)缀合以形成检测底物的分子(例如,亲和素/链霉亲和素)。
接触:处于直接的物理关联,包括固体形式和液体形式二者。如本文中使用的,“接触”与“暴露”可互换使用。
对照:参考标准,例如阳性对照或阴性对照。已知阳性对照提供阳性的测试结果。已知阴性对照提供阴性的测试结果。然而,所述参考标准可以是理论结果或计算结果,例如在群体中获得的结果。
细胞外囊泡和外来体:如本文中使用的,细胞外囊泡(ev)是从细胞流出的膜囊泡。这种囊泡或膜囊泡包括但不限于:循环微囊泡(cmv)、微囊泡、外来体、纳米囊泡、胞外体(dexosome)、水泡(bleb)、水泡体(blebby)、前列腺小体、微粒子、腔内囊泡、膜碎片、腔内内体囊泡、内体样囊泡、胞吐载体、核内体囊泡(endosomevesicle)、内体囊泡(endosomalvesicle)、凋亡小体、多囊体、分泌囊泡、磷脂囊泡、脂质体囊泡、精小体(argosome)、特克斯体(texasome)、分泌小体(secresome)、耐受素小体(tolerosome)、黑色素小体、癌小体或胞吐载体。囊泡包括球状构造,具有包围内部隔室的类似于细胞膜的脂双分子层,所述内部隔室可以包含可溶成分,有时称为负载体(payload)。循环ev对于诊断目的而言特别有用。
在一些实施方案中,本文公开的方法使用外来体,其是由多种哺乳动物细胞型分泌的直径约40-150nm的小分泌囊泡。截至目前所研究的大多数外来体具有一组进化保守的蛋白质分子和区别由不同细胞类型所分泌的外来体的一组组织/细胞类型-特异性的蛋白质。外来体中的rna分子包括mrna和mirna,其可以从一个细胞穿梭到另一个细胞,影响受体细胞的蛋白质生产。外来体在它们的生物发生方面的特征在于通过核内体的向内萌芽形成管腔内泡(ilv),以形成多泡体(mvb)。这些mvb然后与外细胞膜融合以释放它们的ilv(现在是外来体)运载物(cargo)到细胞外环境。核内体首先经胞吞作用通过细胞膜的向内萌芽形成并导致类脂膜的反转,将一些细胞外环境截留在管腔内侧上。类似地,核内体膜的第二次向内萌芽截留一定量的细胞胞质并导致ilv类脂膜为正向(positiveorientation)。在ilv(现在是外来体)被释放到细胞外环境时,它们具有与细胞膜相同的方向,并且已经显示它们展示许多来自其来源细胞的表面标志物。然而,在ilv形成过程中的膜蛋白质分类过程是一个主动过程,由此,外来体的表面蛋白质并不是来源细胞的表面标志物的简单一对一表现。囊泡是从细胞流出的膜封装结构,其已经在许多体液中发现,包括血液、血浆、血清、母乳、腹腔积液、支气管肺泡灌洗流体和尿。
囊泡可以作为蛋白质、rna、dna、病毒和朊病毒的运输载体而参与细胞之间的沟通。存在于生物样品中的囊泡提供生物标志物的来源,例如存在于囊泡内部的标志物(囊泡负载体),或存在于囊泡表面上的标志物。囊泡的特征(例如,尺寸、表面抗原、来源细胞的确定、负载体)也可以提供关于诊断、预后或治疗的指示。囊泡生物标志物的应用公开在例如美国专利公开号no.20140228233中,其公开了经分离的囊泡的检测,所述囊泡包括一种或多种mrna,例如a2ml1、bax、c10orf47、c10orf162、csda、eifc3、etfb、gabarapl2、guk1、gzmh、hist1h3b、hla-a、hsp90aa1、nrgn、prdx5、ptma、rabac1、rabagap1l、rpl22、sap18、sepw1、sox1或其任何组合。其它囊泡相关的标志物包括ca-125、ca19-9、c反应蛋白(crp)、cd95、fap-1、egfr、egfrviii、epcam、载脂蛋白ai、载脂蛋白ciii、肌红蛋白、肌腱蛋白c、msh6、claudin-3、claudin-4、caveolin-1、凝血因子iii、cd9、cd36、cd37、cd53、cd63、cd81、cd136、cd147、hsp70、hsp90、rab13、desmocollin-1、emp-2、ck7、ck20、gcdf15、cd82、rab-5b、膜联蛋白v、mfg-e8、tim-4、hla-dr、mir200微小rna或其任何组合。
在一些实施例中,囊泡可分离自受试者的生物样品,所述受试者正在进行针对诸如癌症(例如,前列腺癌)的病症的测试,或者已知患有所述病症。或者,囊泡可以分离自包括细胞培养物(例如,包含前列腺细胞的培养物)的生物样品。美国专利公开号20140228233中公开的生物标志物相关内容(具体参见表1和表2)被通过引用结合入本文,us20140162888公开的内容也被通过引用结合入本文,其公开了用于疾病的另外的生物标志物和生物印记,所述疾病例如是乳腺癌、卵巢癌、肺癌、结肠癌、腺瘤/增生性息肉、炎症性肠病、结直癌、前列腺癌、黑素瘤、脑癌、心血管疾病、血液学恶性肿瘤、肝细胞癌、宫颈癌、子宫内膜癌、糖尿病、barrett食管、纤维肌痛、多发性硬化、帕金森氏病、阿尔茨海默氏病、朊病毒病、脓毒病、慢性神经痛、精神分裂症、双相性精神障碍、抑郁症、胃肠基质瘤(gist)、肾细胞癌、肝硬化、食管癌、胃癌、孤独症、器官排斥、甲氧西林耐药性金黄色葡萄球菌、脆性斑块等。结合入本文的所述公开还描述了鉴定生物印记以表征表型的方法,筛选可在囊泡上用作生物标志物的囊泡上的蛋白质的方法,以及通过评价囊泡生物印记表征表型的方法。任何这些方法都可以与本说明书中公开的分子纳米标签结合使用。
关于膜囊泡(包括类型和表征)的综述,还参见thery等人,natrevimmunol.2009august,9(8):581-93。
流式细胞术设备:包括基于粒子特征分析流体混合物中的单个粒子的任何设备,所述粒子特征例如是尺寸或粒子经过一束相干光(例如,通过电子检测装置检测的激光束)时的荧光。它允许每秒对最多数千粒子的物理和化学性质同时进行多参数分析。流式细胞仪可以配置为检测粒子的荧光和光散射功率,并且还可配置为用于高分辨率粒子,例如球形等效直径小于约120或140nm的粒子,或用于检测球形等效直径小于100nm的纳米颗粒。
荧光:由吸收了光或其它电磁辐射的物质发射的光。荧光强度是指强度的量化,其可以通过本领域已知的任何手段测量,例如使用得自美国国立卫生研究院的imagej软件。
荧光团:在通过暴露于特定波长的光而被激发时,例如发射不同波长的光(即,荧光)的化合物。
可在本公开的方法中使用的荧光团的例子在nazarenko等人的美国专利号5,866,366中提供:4-乙酰氨基-4'-异硫氰酸酯基茋-2,2'二磺酸、吖啶及其衍生物(例如,吖啶和吖啶异硫氰酸盐)、5-(2'-氨基乙基)氨基萘-1-磺酸(edans)、4-氨基-n-[3-乙烯基磺酰基)苯基]萘二甲酰亚胺-3,5二磺酸(luciferyellowvs)、n-(4-苯胺基-1-萘基)马来酰亚胺、邻氨基苯甲酰胺、亮黄(brilliantyellow)、香豆素和衍生物(例如,香豆素、7-氨基-4-甲基香豆素(amc、香豆素120)、7-氨基-4-三氟甲基香豆素(香豆素151));四氯四溴荧光素(cyanosine);4',6-二脒基-2-苯基吲哚(dapi);5',5"-二溴焦棓酚-磺酞(溴邻苯三酚红);7-二乙基氨基-3-(4'-异硫氰酸酯基苯基)-4-甲基香豆素;二亚乙基三胺五乙酸盐;4,4'-二异硫氰酸酯基二氢-茋-2,2'-二磺酸;4,4'-二异硫氰酸酯基茋-2,2'-二磺酸;5-[二甲基氨基]萘-1-磺酰氯(dns、丹磺酰氯);4-(4'-二甲基氨基苯基偶氮)苯甲酸(dabcyl);4-二甲基氨基苯基偶氮苯基-4'-异硫氰酸盐(dabitc);曙红和衍生物(例如,曙红和曙红异硫氰酸盐);真曙红(erythrosin)和衍生物(例如真曙红b和真曙红异硫氰酸盐);乙啶;荧光素和衍生物(例如,5-羧基荧光素(fam)、5-(4,6-二氯三嗪-2-基)氨基荧光素(dtaf)、2'7'-二甲氧基-4'5'-二氯-6-羧基荧光素(joe)、荧光素、荧光素异硫氰酸盐(fitc)和qfitc(xritc));荧光胺;ir144;ir1446;孔雀绿异硫氰酸盐;4-甲基伞形酮;邻甲酚酞;硝基酪氨酸;副蔷薇苯胺;酚红;b-藻红蛋白;r-藻红蛋白;邻苯二甲醛;芘和衍生物(例如,芘、丁酸芘和1-芘丁酸琥珀酰亚胺酯;活性红4(reactivered4)(cibacron.rtm.亮红3b-a);罗丹明和衍生物,例如,6-羧基-x-罗丹明(rox)、6-羧基罗丹明(r6g)、丽丝胺罗丹明b磺酰基氯化物、罗丹明(rhod)、罗丹明b、罗丹明123、罗丹明x异硫氰酸盐、磺基罗丹明b、磺基罗丹明101和磺基罗丹明101的磺酰氯衍生物(texasred);n,n,n',n'-四甲基-6-羧基罗丹明(tamra);四甲基罗丹明;四甲基罗丹明异硫氰酸盐(tritc);核黄素;玫红酸和铽螯合物衍生物。
其它适合的荧光团包括在约617nm发射的硫醇反应性螯合物(heyduk和heyduk,analyt.biochem.248:216-27,1997;j.biol.chem.274:3315-22,1999)。
其它适合的荧光团包括gfp、lissaminetm、二乙基氨基香豆素、氯代三嗪基荧光素、萘并荧光素、4,7-二氯罗丹明和氧杂蒽(如lee等人的美国专利5,800,996中所述的)及其衍生物。
荧光蛋白质包括但不限于绿色荧光蛋白质(例如,gfp、egfp、acgfp1、emerald、superfoldergfp、azamigreen、mwasabi、taggfp、turbogfp和zsgreen)、蓝色荧光蛋白质(例如,ebfp、ebfp2、sapphire、t-sapphire、azurite和mtagbfp)、青色荧光蛋白质(例如,ecfp、mecfp、cerulean、cypet、amcyan1、midori-ishicyan、mturquoise和mtfp1)、黄色荧光蛋白质(eyfp、topaz、venus、mcitrine、ypet、tagyfp、phiyfp、zsyellow1和mbanana)、橙色荧光蛋白质(kusabiraorange、kusabiraorange2、morange、morange2和mtangerine)、红色荧光蛋白质(mruby、mapple、mstrawberry、asred2、mrfp1、jred、mcherry、hcred1、mraspberry、dkeima-tandem、hcred-tandem、mplum、aq143、tdtomato和e2-crimson)、橙/红色荧光蛋白质(dtomato、dtomato-tandem、tagrfp、tagrfp-t、dsred、dsred2、dsred-express(t1)和dsred-monomer)及其经修饰的形式。
也可以使用本领域技术人员已知的其它荧光团,例如可从多种来源商购的那些。这些荧光团中的任一种都可以提供所述分子纳米标签的荧光组分的荧光。
nanofacs:用于分析纳米材料的高分辨率流式细胞仪的配置,使得可以检查(interrogated)光散射测量和荧光二者,使用多种激光和与所述多种激光对应的平行检测途径。大多数的流式细胞仪只检查单侧散射通道,但是使用例如beckmancoulterastrioseq,有可能用一个ssc检测通道触发,并从所有其它针孔收集和使用信号事件,包括ssc参数。在使用astrioseq的例子中,通过在中心(七个中的第四个)针孔用561nm激光的ssc检测通道触发、随后在第二针孔用488nm检测通道进行ssc分析实现了最大的ssc信号:噪声分离,这是astrioseq的标准配置。这种方法在488nmssc检测通道上(图14a-14d)以及在其它“平行”通道上实现了“部分传输窗口”,以允许识别和检查事件,以评价以极低强度散射的微粒群的比例,所述极低强度低于应被设置为该平行散射通道上的阈值的水平,如果将该平行通道用作触发通道的话。术语“平行亚阈值”事件用于描述这些事件(无论是噪声事件还是粒子相关事件),它们是在平行通道上被检测到的,但其范围低于将该通道用作触发通道时的阈值,且与平行阈值水平的决定因素具有相同的基准噪声比率。因为在对设备进行设置时在具有主要(触发信号)阈值的通道上设置基准噪声比率,且该比率只设置于鞘液(sheathfluid),因此光:流相互作用产生的散射光构成了基准噪声中的大部分背景噪声事件。以这样的方式,有可能检查来自鞘液的平行亚阈值事件。在只运行鞘液时,平行亚阈值比率大体上等于基准比率,或者在阈值通道检测到的所述流反射走的比率。在运行样品时,随着处于或高于触发通道上阈值水平的粒子相关的光散射事件比率增加,平行亚阈值事件的比率也增加。这在图15a-15i中通过代表性的ev样品来说明。降低阈值以提高基准噪声比率增加了直观化的平行亚阈值粒子(如果存在于样品的话)的比例,因为这一策略提高了事件的检查频率,否则,基于它们各自的散射性能,这些事件不会被检测到。
尽管在561nmssc通道上的触发水平以下有预期的“盲区”,在488nmssc通道上检测到了有信息价值(虽然只是代表性的)的一群平行亚阈值事件。这些事件落入本应该被488nm阈值排除的检测水平(如果将488nmssc通道用作触发通道的话),但它们是基于与处于或高于561nmssc阈值的事件的发生相关联的488nmssc信号的对应关系而被检测到的。因为561nm触发事件可以是噪声事件或是粒子散射事件,所观察到的488nmssc平行亚阈值区域中的样品事件与基准噪声检测区域相重叠,其不仅包括可归因于高于该触发阈值的粒子散射光的信号事件,而且包括由于与来自液流的光反射的重合而被记录到的平行亚阈值信号。在没有粒子在运行而只有鞘液通过该激光检查点时,基准噪声事件的比率(即,由于来自检查室中鞘液流(sheathfluidstream)的散射激光所产生的事件的比率,对于特定的实验而言是具体设备和结构所固有的)保持恒定。在分析非均质样品(例如,血浆)时,该比率经常不是恒定的,已经发现其对于检查平行亚阈值事件和辨别该亚阈值群的属性(例如,比率和分布)而言具有信息价值,尽管目前的软件工具不能将由液流反射的光所产生的各事件与各粒子检测事件加以区分。比较405nm、488nm、561nm和640nmssc检测通道中的每一个,发现对于设置ssc触发的目的而言,561nm通道提供最大的灵敏度,而488nmssc通道作为平行ssc检测通道(与astrioseq上的561nmssc触发组合)提供最佳的信号:噪声分离。使用的术语基准噪声(referencenoise)总的来说是指在阈值/触发信号水平(阈值噪声)的噪声事件与平行亚阈值噪声事件二者。尽管使用这些特定的ssc通道进行例示,但是可以选择其它前向或侧向散射通道作为使用该例示中公开的方法的触发通道和检测通道。
纳米粒子:直径约10到约100纳米(nm)的粒子。所公开的纳米标签可以包括由贵金属,如金或银(或其二者),或不同于贵金属的材料,如tio2、二氧化硅、碳、cdse、zns或石墨,或其任何组合构成的纳米粒子(例如,图1a中的10)。
纳米级:直径为约100nm或更小,例如10-100nm,例如50-100nm。
贵金属:耐受空气中的氧化和腐蚀的金属。它们包括钌、铑、钯、银、锇、铱、铂和金。本文中对贵金属的任何提及还包括这些金属的子集或组合,例如银和金。这些是材料的例子,所述材料可以提供在分子纳米标签中使用的高折射率材料,例如作为量子纳米晶体的壳。
表型:生物体可观察到的特征的组合。
聚合物:由重复单元构成的天然或合成的物质,例如包括重复单体的大分子。聚合物分子包括但不限于核酸分子,如dna、rna、肽核酸(pna)、异种核酸(xna)及其组合;蛋白质聚合物,如微管或胶原;或合成的线状聚合物。核酸聚合物可以是单链的或双链的。所公开的纳米标签可以包括由聚合物构成的装甲(例如,图1a中的12)。
用于由半导体材料构成的微细粒子或纳米晶体的商标名称,通常具有约2-10nm的直径。发射荧光,其颜色依赖于粒子的尺寸。是一种类型的量子纳米晶体的具体例子。“量子点”是经常用于同义指代量子纳米晶体的另一个非注册术语。
折射率:描述光如何传播通过介质的无量纲数。折射率确定光在遇到材料或遇到介质变化时被弯曲或折射的程度。在一些情况中,折射率描述光如何与材料相互作用。材料的折射率根据材料的组成和入射波长而变化(参见图6-8)。许多材料的折射率在本领域中是可得的,且可以例如在互联网上找到,例如网址refractiveindex.info。然而,这些折射率数值对于纳米级材料通常所知很少,且在流式细胞术所检测的相关波长的完整范围内是未知的。在本公开中,使用具有高折射率的纳米粒子。“高”折射率意味着该分子标签由这样的材料制成,所述材料在照射的入射波长可以在设备(例如,流式细胞仪)的噪音以上被解析。
样品:是指任何生物样品(取自生物有机体)或环境样品(取自环境)。生物样品是得自生物学有机体的受试者(例如,人或兽医学受试者)的样品。在本领域已知的具体例子中,生物样品是得自任何体液的生物流体样品,例如外周血、血清、血浆、腹腔积液、尿、脑脊液(csf)、痰液、唾液、骨髓、滑膜液、房水、羊水、耵聍、母乳、支气管肺泡灌洗流体、精液(包括前列腺液)、cowper流体或射精前流体、雌性射出物、汗液、粪便物、毛发、泪液、囊液、胸膜和腹膜液、心包液、淋巴、食糜、乳糜、胆汁、组织间隙液、月经、脓、皮脂、呕吐物、阴道分泌物、粘膜分泌物、便水、胰液、鼻窦腔灌洗流体、支气管肺吸出物或其它灌洗流体。生物样品还可以包括囊胚腔(blastocylcavity)、脐带血或可以是胎儿来源或母体来源的妊娠循环物(maternalcirculation)。所述生物样品还可以是可从中获得囊泡和其它循环生物标志物的组织样品或活检组织(包括细针吸出物)。例如,可以培养来自样品的细胞并从培养物分离囊泡。在不同的实施方案中,可以从这种生物样品直接评价本公开的生物标志物,或者更具体地,评价生物印记。生物印记是多种或多重生物标志物或其功能片段的存在或水平,利用各种方法,例如,从血液、血浆、血清或任何上述生物样品中核酸分子的提取、使用蛋白质或抗体阵列以鉴定多肽(或功能性片段)生物标志物,以及本领域已知用于鉴别和评估核酸和多肽分子的其它阵列、测序、pcr和蛋白质组学技术。关于生物样品、生物标志物和囊泡检测的其他信息可以在美国专利公开号20140228233中找到,其通过引用结合入本文。
散射:由于所通过介质中的局部不均匀性,以一条或多条路径偏离直线轨迹的轨迹(例如,光)偏移。电磁辐射(包括光)的一些类型的散射是被具有不同折射率的小球体所散射。米氏理论描述了电磁的平面波被均质球的散射。光散射与入射波长有关,且在一定波长范围具有材料特异性强度分布。光与不同材料的纳米粒子和/或与不同表面几何形状以不同方式相互作用(图8)。已知有许多不同的装置用于测量光散射强度,包括流式细胞仪和诸如美国专利公开号20090251696中所述的那些装置。
壳:粒子的外周层,例如金或其它贵金属的层,其具有足够高的折射率或光散射能力,以允许组装的粒子在用于检测光散射强度的装置(例如,流式细胞仪)的基准噪声以上是可检测的。或者,壳的表面几何形状或拓扑结构可以增加所散射的光属性,如衍射,且可以改变材料的表面等离子体共振性能,例如纳米海胆状结构的尖锐表面。因此,例如,所公开的纳米标签可以包括壳(其在图1a、1b或1d中都没有示出,但是应该理解,所示出的纳米标签可以包括这样的壳)。
snap-和clip-标签蛋白质标记系统:能够使所选择的分子对感兴趣的蛋白质进行特异性共价连接的构建体。使用所述系统有两个步骤:克隆和表达感兴趣的蛋白质作为snap–融合体,以及用选择的snap-tag底物对所述融合体进行标记。snap-tag是基于人o6-烷基鸟嘌呤-dna-烷基转移酶(hagt,一种dna修复蛋白质)的小蛋白质。snap-tag底物是染料、荧光团、生物素或经由苄基接头缀合于鸟嘌呤或氯嘧啶离去基团的珠。在标记反应中,所述底物的被取代的苄基共价连接于snap-tag。clip-tagtm是snap-tag的修饰版本,经改造与苄基胞嘧啶反应而不是与苄基鸟嘌呤衍生物反应。在与snap-tag结合使用时,clip-tag能够在相同细胞中同时进行两种蛋白质的正交和互补标记。用于实施这些方法的试剂可获自newenglandbiolabs。
受试者:活的多细胞脊椎动物有机体,该类别包括人和非人哺乳动物在内。在特定例子中,受试者是人或兽医学受试者。
肿瘤抗原:在肿瘤细胞中产生的可以刺激肿瘤特异性免疫应答的抗原。示例性的肿瘤抗原包括但不限于甲胎蛋白(afp)、癌胚抗原(cea)、癌症抗原125(ca-125)、muc-1、上皮细胞瘤抗原(eta)、tag-72、未成熟层粘连蛋白受体、hpve6/e7、bing-4、钙活化的氯离子通道2、rage-1、mage-1、mage-2、酪氨酸酶、细胞周期蛋白-b1、9d7、ep-cam、epha3、her2/neu、端粒酶、间皮素(mesothelin)、sap-1、存活素(survivin)、ny-eso-1、melan-a/mart-1、糖蛋白(gp)75、gp100/pmel17、β-连环蛋白、pote、prame、mum-1、wt-1、pr-1bage家族、cage家族、gage家族、mage家族、sage家族、xage家族、trp-1、trp-2、mc1r、psa、cdk4、brca1/2、cml66、纤连蛋白、mart-2、p53、ras、tgf-betarii和muc1。
肿瘤或癌症:瘤形成的产物是赘生物(肿瘤或癌症),是由过度的细胞分裂引起的组织异常生长。不转移的肿瘤被称为“良性的”。侵袭周围组织和/或能转移的肿瘤被称为“恶性的”。瘤形成是增生性病症的一个例子。实体瘤是通常不包含囊肿或液体区域的异常组织块。
实体癌(例如,肉瘤和癌)的例子包括纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨原性肉瘤和其它肉瘤、滑膜瘤、间皮瘤、尤因瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、恶性淋巴瘤、胰腺癌、乳腺癌(例如,腺癌)、肺癌、妇科癌症(例如,子宫的癌症(例如,子宫内膜癌)、子宫颈的癌症(例如,宫颈癌、肿瘤前子宫颈细胞病变)、卵巢的癌症(例如,卵巢癌、浆液性囊腺癌、粘液性囊腺癌、子宫内膜样的肿瘤、腹腔母细胞瘤(celioblastoma)、透明细胞癌、未分类癌、复粒-泡膜细胞瘤、支持-间质细胞瘤、无性细胞瘤、恶性畸胎瘤)、外阴的癌症(例如,鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤、黑素瘤)、阴道的癌症(例如,透明细胞癌、鳞状细胞癌、葡萄样肉瘤)、胚胎性横纹肌肉瘤和输卵管的癌症(例如,癌)、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、乳头状甲状腺癌、嗜铬细胞瘤皮脂腺癌(pheochromocytomassebaceousglandcarcinoma)、乳头状癌、乳头状腺癌、髓样癌、支气管肺癌、肾细胞癌、肝癌、肝细胞瘤、胆管癌、绒膜癌、维尔姆斯瘤、子宫颈癌症、睾丸肿瘤、精原细胞瘤、膀胱癌和cns肿瘤(例如,神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤(craniopharyogioma)、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突胶质细胞瘤、髄膜瘤、黑素瘤、神经母细胞瘤和视网膜母细胞瘤)和皮肤癌(例如,黑素瘤和非黑素瘤)。
血液学肿瘤的例子包括白血病,包括急性白血病(例如,急性淋巴细胞性白血病、急性髓细胞性白血病、急性髓性白血病和髓母细胞性白血病、早幼粒细胞性白血病、髓单核细胞性白血病、单核细胞性白血病和红白血病)、慢性白血病(例如,慢性髓细胞(粒细胞)性白血病、慢性髓性白血病和慢性淋巴细胞性白血病)、真性红细胞增多症、淋巴瘤、何杰金氏病、非何杰金氏淋巴瘤(惰性形式和高度恶性形式)、多发性骨髓瘤、waldenstrom巨球蛋白血症、重链病、脊髓发育异常综合征、毛细胞白血病和脊髓发育不良。
iii.几个实施方案的概述
本文中公开的纳米级分子标签克服了对纳米级粒子进行功能性分选的现有障碍。本文中公开的纳米级分子标签使得能够使用例如显微术或检测荧光和光散射强度的装置(例如,流式细胞仪装置)来检测单分子。所述分子标签允许基于光散射性能和/或荧光性能以功能性形式分选亚微米粒子。所公开的分子纳米标签还允许例如多元检测多种不同的靶,例如,通过使用独特的分子纳米标签群,每个分子纳米标签对于特定的靶具有特异性。
所公开的分子纳米标签是独特的,因为它们可以被分别地检测和量化。也就是说,可以用增量单位来分辨和量化分子纳米标签,以直接确定检测到的靶数量。相比之下,用于流式细胞计的其它检测试剂只能够进行整体检测(例如,在多重标记存在于一个细胞的表面上或细胞之内时)。许多流式细胞仪,包括基于cyttof质谱的系统,都不能够从少于1,000个标记中检测到总的“信号”。被描述为具有单个标签检测能力的一种流式细胞仪是超高灵敏度nanofcm设备(anal.chem.,2009,81(7),pp2555–2563)。然而,所公开的分子纳米标签不局限于被分别检测。
单个分子纳米标签的检测使得能够计数(或确定)每个粒子(例如,细胞、外来体、细胞外囊泡等)所连接的纳米标签的数目。因此,所公开的纳米标签和方法可用于检测具有很少表位的粒子(例如,细胞、外来体、细胞外囊泡等),所述粒子在使用只有在存在许多表位时才能检测到表位的现代流式细胞计量设备时是不可检测到的(nolan等人,platelets.28:256-62)。所述分子纳米标签可具有对一种靶粒子(例如,细胞外来体、细胞外囊泡等)具有特异性一个结合位点。然而,在一些实施例中,不止一个分子纳米标签与所述粒子结合,因为所述粒子可具有不止一个结合位点。如果使用超过两种或更多种不同的分子纳米标签,使得各自具有独特的标记(例如,诸如金或银的独特的芯具有独特的第一结合配偶体,例如一种对靶a具有特异性,而另一种对靶b具有特异性,或其组合),所述两种或更多种不同的分子纳米标签可以结合于感兴趣的粒子并且被检测到,并且在一些实施例中使用例如光谱散射反卷积(spectralscatterdeconvulsion)进行量化。类似地,因不同的芯散射和/或荧光光谱和独特的配体结合性能而彼此不同的多元分子纳米标签可用于标记独特类型的ev(例如,由前列腺细胞或其它表达psma的细胞产生的psma阳性ev可以通过与psma结合的金分子纳米标签来识别,并区别于和分选自由造血来源的细胞产生的cd45阳性ev,其可以通过银分子纳米标签来识别)。在一些实施例中,同时使用至少两个不同的分子纳米标签群,其中第1群对于靶1具有特异性,而第2群对于靶2具有特异性,以此类推。
在一些实施方案中,所述纳米级分子标签包括直径小于约100nm的芯纳米粒子;和具有第一部分和第二部分的装甲,其中所述第一部分结合于所述芯纳米粒子的表面,且第二部分不结合于芯纳米粒子且包括具有固定数目结合位点的官能化末端。例如,参考图1a、1b和1d,所述纳米级分子标签20、40、50包括直径小于约100nm的芯纳米粒子10;和具有第一部分和第二部分的装甲,其中所述第一部分12结合于所述芯纳米粒子的表面,而且第二部分14不结合于芯纳米粒子且包括具有固定数目结合位点(例如,1、2、3或5个结合位点)的官能化末端16。
在一些实施例中,所述纳米级分子标签还包括包围所述芯的壳。在这些实施方案中,所述装甲的第一部分与所述壳而非芯结合,且所述装甲的第二部分不结合于所述壳。在一些实施例中,所述壳是一层金、银、其二者或其它贵金属。在一些实施例中,所述壳包括核酸分子(例如,dna)或peg。
所述芯、壳和装甲中的任一者或任何组合对可通过流式细胞仪检测的分子标签的荧光、光散射和/或配体结合性能有贡献。
在一些实施例中,所述芯纳米粒子的直径为约20到约100nm、约30到约80nm或约40到约60nm。在具体的非限制性实施例中,芯纳米粒子小于约95nm、小于约90nm、小于约85nm、小于约80nm、小于约75nm、小于约70nm、小于约65nm、小于约60nm、小于约55nm或小于约50nm。在这些实施例中,所述芯纳米粒子的直径至少为20nm。在纳米粒子包括任选的壳的那些情况中,所述芯和壳一起的直径为约20到约100nm,或者为本段前述对于芯本身所提及的任何其它尺寸。
在一些实施例中,结合位点的固定数目是1个。在其他实施例中,结合位点的固定数目为2个、3个、4个或5个。在一些实施例中,所述装甲包括对芯和/或壳有亲和力且围绕包裹芯和/或壳的聚合物,以基本上完全排除任何其它分子或聚合物对所述纳米粒子的结合。在一些情况中,所述排除是对其它聚合物的空间排斥或排除构成该装甲的所选聚合物之一。
在一些实施方案中,所述芯纳米粒子由具有高折射率的纳米材料组成,其对可通过测量荧光和/或光散射强度的装置(例如,流式细胞仪)检测到的纳米级分子标签的光散射性能有贡献。在一些实施例中,所述芯纳米粒子包括量子纳米晶体,例如,量子纳米晶体或量子点(例如,)。在一些实施例中,所述芯纳米粒子或其壳包括贵金属,如金或银(或其二者,或不同于贵金属的材料,例如,tio2、二氧化硅、碳、cdse、zns或石墨,或其任何组合组成。
在一些实施方案中,所述芯和任选的壳具有参数nraqd=n折射率、角度和量子性能以及直径,其中nrad大于流式细胞术的检出限(y极限)。所述分子纳米标签的组分的散射和荧光性能、或者所组装的分子纳米标签的光散射和荧光性能可以显示出组分特异性的量子效应,使得nrad可以依赖于材料的量子性能,所述材料与特定波长的光相互作用以产生可以用多参数流式细胞术检测到的增强或降低的信号(散射或荧光)。分子纳米标签材料接近对于所述分子纳米标签而言为固有的或者以其它方式结合于所述分子纳米标签的材料组分(具有靶向表位的外来体,例如,其中在所述靶与分子纳米标签之间存在量子相互作用,其改变被检测到的分子纳米标签的散射或荧光强度)。预期这种量子改变作用对于某些波长的检测移位是依赖性的并且基于所述检测移位而可被检测到,这可以用光谱学方法或其它多参数细胞计数方法进行光谱上的确定。
在一些实施例中,用于分子纳米标签的芯和任选的壳是选择性的(基于检测设备)。例如,如果使用具有405nm散射照射配置的流式细胞仪,在分子纳米标签的芯和任选的壳中使用银与在芯和任选的壳中使用金相比,对于芯直径为10nm到40nm的小分子纳米标签提供更好的基于散射的检测。然而,如果用于检测纳米标签的流式细胞仪或其它装置具有532nm散射照射配置,则由金芯和任选的壳组成的分子纳米标签与银分子纳米标签相比提供更好的基于散射的检测。如果检测装置同时具有405nm和532nm散射照射配置,则用于分子纳米标签的芯和任选的壳可以同时使用金和银(例如,包含金和银二者的一个纳米标签,或独立的纳米标签,一个使用金,另一个使用银)。
在一些实施方案中,所述装甲包括聚合物。在一些实施例中,所述聚合物对分子标签的荧光、光散射和/或配体结合性能有贡献。在一些实施例中,所述聚合物包括核酸,例如,脱氧核糖核酸(dna),例如,单链dna、rna或pna。在具体的非限制性实施例中,dna是单链的硫代磷酸酯dna(ptdna)。
在装甲包括单链dna的具体例子中,所述装甲的第一部分具有约30到约100个核苷酸的长度,例如约40到约90、约50到约80、或约60到约70个核苷酸的长度。在一些实施例中,所述装甲的第一部分均由硫代磷酸腺苷核苷酸组成。
在其中所述装甲包括单链dna的具体例子中,所述装甲的第二部分长度为约10到约30个核苷酸,例如,长度为约15到约25、约18到约22或约20个核苷酸。
在其中装甲包括聚合物的其它例子中,聚合物包括聚乙烯,例如聚乙二醇(peg)或其衍生物。
在一些实施方案中,装甲的官能化末端包括第一结合配偶体,其能够特异性地结合于第二结合配偶体,例如靶(例如,蛋白质,如配体)。在具体的非限制性实施例中,所述第一和第二结合配偶体分别选自苄基鸟嘌呤和snap-tag;苄基鸟嘌呤和clip-tag;生物素和链霉亲和素;单链寡核苷酸和互补的单链寡核苷酸;单链寡核苷酸和适配体;dcfpyl和前列腺特异性膜抗原(pmsa);受体和配体;配体和受体;抗原和抗体(例如与疾病或感染(例如,细菌感染或病毒感染)相关的抗体);或抗体和抗原,例如肿瘤抗原或肽标签(例如,his标签或flag标签)。在一些情况中,所述肿瘤抗原包括pmsa、表皮生长因子受体(egfr)、血管内皮细胞生长因子(vegf)、her1、her-2/neu、上皮细胞黏附分子(epcam)、cd20、cd24、cd25、cd33、cd52、ca125、lewisy、tag72、cd133、cd47、cd147、pd-l1、gpc-1、cea、甲胎蛋白(afp)或muc-1。因此,在一些实施例中,所述纳米级分子标签包括作为第一结合配偶体的对pmsa、egfr、vegf、her1、her-2/neu、epcam、cd20、cd24、cd25、cd33、cd52、ca125、lewisy、tag72、cd133、cd47、cd147、pd-l1、gpc-1、cea、afp或muc-1具有特异性的结合剂(例如,抗体、配体或适配体)。在一个实施例中,所述肿瘤抗原是pmsa,且所述纳米级分子标签包括抗-psma抗体,或psma配体如dcfbc(参见,图10a-10c和11e)。
在一些实施例中,所述纳米级分子标签包括对靶配体具有特异性的结合剂(例如,受体),所述靶配体例如细胞外囊泡上的配体,例如用于检测磷脂酰丝氨酸(ps)的tim-4受体。例如,这种纳米级分子标签可用于监测细胞死亡(例如,常规的细胞死亡、细胞程序死亡、化学品诱导的细胞死亡(例如,由于化疗)或辐射诱导的细胞死亡)。尽管在照射之后预期有高水平的ps,但是所有的ev在磷脂表面具有低或中等水平的ps。tim-4是一种以钙依赖性方式可逆地结合ps的受体,其允许结合后的标记洗脱。可以被靶向以结合本公开的纳米级分子标签的其它囊泡相关的标志物包括(例如,纳米标签可以包括对于以下具有特异性的结合试剂)ca-125、ca19-9、c-反应蛋白(crp)、cd95、fap-1、egfr、egfrviii、epcam、载脂蛋白ai、载脂蛋白ciii、肌红蛋白、肌腱蛋白c、msh6、claudin-3、claudin-4、caveolin-1、凝血因子iii、cd9、cd36、cd37、cd53、cd63、cd81、cd136、cd147、hsp70、hsp90、rab13、desmocollin-1、emp-2、ck7、ck20、gcdf15、cd82、rab-5b、膜联蛋白v、mfg-e8、hla-dr、mir200微小rna。
在一些实施方案中,所述纳米级分子标签包括荧光团,例如本文所列举荧光团中的一种或多种。
在一些实施方案中,所述纳米级分子标签包括直径小于100nm的芯纳米粒子;任选的壳;具有第一部分和第二部分的装甲,例如单链核酸,其中所述第一部分包括与芯纳米粒子的表面结合的硫代磷酸酯dna,其将纳米粒子化合价降低到功能性结合位点的固定数目(例如,1个、2个、3个、4个或5个功能性结合位点);接头,其用于将装甲结合位点连接到指定靶的功能性配体;和指定靶的功能性配体(由蛋白质、核苷酸或其它配体结合元件组成),且其中所述芯、壳和装甲中的任一者或任何组合对可被检测它们的设备检测的分子标签的荧光、光散射和/或配体结合性能有贡献。
在其他实施例中,所述芯是量子纳米晶体,具有被壳包围的荧光芯,所述壳调节荧光且还可以改变结合表面。在其它实施例中,所述装甲可以进一步改变分子标签的荧光和/或结合性能。
本文还提供了在流式细胞仪中检测样品中单个靶分子的方法。在一些实施方案中,所述方法包括使所述样品接触本文中公开的纳米级分子标签,其中所述纳米级分子标签的官能化末端特异性地结合所述样品中的靶分子(如果存在的话);和使用为分辨小粒子配置的设备来分析所述样品,以通过检测侧向散射或检测荧光或其二者来检测与靶分子结合的单个纳米级分子标签。
在一些实施方案中,在流式细胞仪中使用至少两个侧向散射通道来分析样品。在一些实施例中,第一侧向散射通道用作触发通道,且第二侧向散射通道用作检测通道。在一些实施例中,所述方法包括检测平行亚阈值事件。在一些实施例中,使用至少两个侧向散射通道作为检测通道,例如405nm、445nm、488nm、532nm、561nm、592nm和640nm中的两个或更多个。在一些实施例中,使用至少两个侧向散射通道作为检测通道,例如405nm、445nm、488nm、532nm、561nm、592nm和640nm中的两个或更多个。在一些实施例中,使用至少两个侧向散射通道作为检测通道,例如至少405nm和561nm,或者至少488nm和561nm。在一些实施方案中,所述样品是生物样品,例如生物膜,例如包括细胞外囊泡(ev)的样品。在其他实施例中,所述生物样品包括病毒。在其它实施方案中,所述样品是环境样品,例如水、土壤或空气样品。
在所述方法的一些实施例中,所述靶分子包括肿瘤抗原。在具体的非限制性实施例中,所述肿瘤抗原包括pmsa、血管内皮细胞生长因子(vegf)、her1、her-2/neu、上皮细胞黏附分子(epcam)、cd20、cd24、cd25、cd33、cd52、ca125、lewisy、tag72、cd133、cd47、cd147、pd-l1、gpc-1、cea、甲胎蛋白(afp)或muc-1。然而,可以将在本文中或在并入的参考文献中公开的任何标志物用于本说明书公开的方法中。
iv.流式细胞术
流式细胞术是基于激光的生物物理学技术,其通过将细胞悬浮在液流中并使它们通过电子检测装置而在细胞计数、细胞分选、生物标志物检测和蛋白质改造中使用。它允许每秒对高达数千个粒子的物理和化学特征同时进行多参数分析。流式细胞术通常用于健康病症的诊断,尤其是血液癌症,但是在基础研究、临床实践以及临床试验中也有许多其它应用。常见的变化是根据粒子的性能对其进行物理分选,以纯化感兴趣的群。
流式细胞术设备能够每秒对数千个粒子进行“实时”分析,且可以主动分开和分离具有指定性能的粒子。流式细胞仪类似于显微镜,不同在于流式细胞计提供设定参数的“高通量”(对于大量细胞的)自动量化,而不是产生细胞的图像。为了分析固体组织,首先制备单细胞悬浮液。
基本的流式细胞仪具有五个主要部件:
(1)流动室;液流(鞘液),其携带和对齐(align)来自样品的对象(细胞、ev或其它可检测对象),使得它们单个通过光束用于感测;
(2)测量系统;通常使用的是阻抗(或导电率)的测量和产生光信号的光学系统,例如灯(水银、氙)、高功率水冷激光(氩、氪染料激光)、低功率气冷激光(氩(488nm)、红色-hene(633nm)、绿色-hene、hecd(uv))、二极管激光(蓝色、绿色、红色、紫色);
(3)检测器和模拟-数字转换(adc)系统,其把前向散射光(fsc)和侧向散射光(ssc)以及来自光的荧光信号生成为可以由计算机处理的电信号;
(4)放大系统(线性的或对数的);和
(5)用于分析信号的计算机。
使用流式细胞仪从样品收集数据的过程被称为“获取(acquisition)”。获取是由与流式细胞仪物理连接的计算机以及处理与细胞仪的数字界面的软件所介导的。所述软件能够为所试验的样品调节参数(例如,电压和补偿),以及在获取样品数据时显示初始样品信息,以确保参数被正确设置。
目前可用的设备通常具有多种激光和荧光检测器。增加激光和检测器的数目允许多种抗体标记,且可以通过它们的表型标志物更准确地识别靶群。一些设备能够拍取单个细胞的数字图像,允许对细胞内部或细胞表面上的荧光信号位置进行分析。
关于流式细胞术用于纳米材料分析的其他信息可以在美国专利公开号no.21300095575中找到,其通过引用结合入本文。
提供以下实施例用于说明某些特定的特征和/或实施方案。这些实施例不应被解释为将本公开限制于所述特定特征或实施方案。
实施例
实施例1:分子纳米标签
这个实施例描述了使用显微术或测量荧光和/或光散射强度的设备(例如,流式细胞仪)能够实现单分子(例如,ev或病毒表面上的分子)检测的分子纳米标签,例如使用在结合入本文的美国专利公开号20130095575和morales-kastresana等人,scientificreports,7:1878,2017中所述的nanofacs方法。
分子纳米标签由模块化元件组成,所述模块化元件为复合的分子纳米标签赋予靶特异性、荧光和光散射属性,使得可以通过荧光和光散射二者在高分辨率流式细胞仪(例如,astrioseq)上检测单个分子纳米标签(和单个分子纳米标签靶)。分子纳米标签可用作用于鉴定疾病相关的生物标志物(例如,肿瘤来源的细胞外囊泡所携带的肿瘤相关蛋白质)的诊断试剂和预后试剂。
在具体的实施例中,分子纳米标签包含“装甲的”芯纳米粒子,其为单价的且分别通过锁:钥(或“靶:饵”)机制连接于靶配体,例如在细胞外囊泡的表面上。只要有一个组分对可以以单标记分辨率被检测到的弹性或非弹性散射性能有贡献,则添加具有互补属性的另外的组分(例如,向可以分别被检测到的金或银粒子添加荧光标记,无需添加荧光团),这允许多维度的分子纳米标签设计和多元应用,但是对于使用分子纳米标签检测一个表位/配体而言,只需要一个可分辨的组分。
分子纳米标签包括纳米级光散射元件(例如,芯纳米粒子10、荧光团(例如,在芯纳米粒子是的情况下的纳米晶体)和用于靶检测的单价接头14(图1a-1b)。设计所述分子纳米标签以提供检测在单个纳米尺寸囊泡表面上的单分子的方法。本发明人已经证明,除了通过荧光完全分辨为单个(单分子)粒子外,还可以在散射光本底噪声水平及其以上水平观察到29nmpeg化例如当在astrioseq上使用所述nanofacs方法时。
先前在结合入本文的farlow等人的出版物中公开的单价量子纳米晶体在图1c中显示。如该参考文献中所述,空间排斥使用70-90聚体dna序列,例如ttdna和ptdna。所述dna序列有效地产生具有独特尺寸、形状和由此具有独特光谱性能的单价纳米粒子。动态光散射分析显示,ptdna包裹的单价纳米晶体直径为12nm,与igg(虚线)尺寸相似且为常规链霉亲和素量子纳米晶体(22nm)尺寸的约一半。dna-包裹的量子纳米晶体可以通过寡核苷酸的3’-修饰被选择性地靶向。带有5’靶向修饰(例如,苄基鸟嘌呤(bg)、苄基胞嘧啶(bc)或脂质)的互补链允许mqd对链霉亲和素、snap-标签、clip-标签或细胞表面的模块化靶向。这些靶向技术也可以与本公开的分子纳米标签结合使用。
在图1d中说明了使用本发明的分子纳米标签的这种靶向方法,其中用核酸聚合物(或另一种分子,例如peg)12进行装甲的装甲纳米粒子40、50(例如,直径1-30的量子纳米晶体),其对量子纳米晶体半导体表面具有一定亲合力,并且从纳米粒子的表面在空间上排斥其它分子(包括聚合物)。接头14可以将所述装甲(例如,核酸聚合物、聚乙二醇(peg)或peg衍生物)连接于另一个装甲的纳米粒子(图1d的下图),或者连接于特异性地结合靶配体的标记16(图1d的上图),例如细胞外囊泡(ev)上的靶配体。
图4说明了分子纳米标签是包含模块化组分的新的标记种类,包括纳米级光散射元件(在一个描述的实施例中为芯纳米粒子)、荧光团(其也可以是在芯纳米粒子是量子纳米晶体或类似组分的情况下对散射强度有贡献的组分)和用于靶检测的单价接头。在图4所示的实施例中,量子纳米晶体用聚乙二醇(peg)聚合物空间排斥装甲进行peg化,所述装甲使组装的纳米标签的尺寸增加例如5-25nm。在具体的实施例中,装甲的量子纳米晶体具有小于50nm的直径,例如不超过20-40nm,例如不超过30nm。在图4中说明的实施例中,当在获自beckmancoulterlifesciences的astrioreq分类器上使用nanofacs高分辨率流式细胞术方法时,除了被荧光完全分辨为单个(单分子)粒子外,可以在散射光本底噪声水平及其以上的水平观察到29nmpeg化量子纳米晶体。仅使用pbs来显示设备噪声。在这个实施例中使用的655量子纳米晶体得自molecularprobes,且在图4中示出的量子纳米晶体的规格说明是在2.1μm的吸光度,656nm的最大荧光发射下,74%的量子产率。
实施例2:小分子psma靶向配体
本文中公开的分子纳米标签是具有广泛潜在应用的一类标记。作为一个例子,它们可用于肿瘤相关的细胞外囊泡(ev)组分的标记的鉴定。前列腺癌是产生携带相关肿瘤生物标志物的ev的肿瘤类型的一个例子,所述肿瘤生物标志物与预后和治疗响应模式高度相关。前列腺癌是常见的恶性肿瘤,在美国每7个男性中就有一个被确诊。预后取决于肿瘤在诊断时的阶段(散布的程度)、分级(或肿瘤细胞的侵略性)和肿瘤对可用治疗(例如,雄激素阻断)的敏感性。前列腺特异性膜抗原(psma)在前列腺肿瘤细胞上的表面表达与雄激素阻断疗法响应的丧失有关,并且有正在进行的试验研究psma配体(例如,dcfpyl)在分子成像研究中的应用,其目的是用于诊断评价,改进患者特异性治疗选项的首要选择,以及提供适应性治疗指导。这些成像形态(modalities)只可以分辨超过至少0.5cm的肿瘤细胞集合。因为表达psma的肿瘤细胞分泌表达psma的ev,且许多肿瘤细胞每单个肿瘤细胞产生许多数量级的ev,其浓度典型地超过健康组织,肿瘤相关的ev作为血浆、尿和其它生物流体的样品中可鉴别的肿瘤生物标志物正在被研究。本公开例如考虑了使用高分辨率流式细胞仪和对pmsa具有特异性的分子纳米标签对带有psma的ev进行非侵入性分析和量化。图5显示可以通过nanofacs检测表达psma的单个ev(关于方法的细节,参见morales-kastresana等人,scientificreports,7:1878,2017)。
图10a-10c说明了小分子psma配体的例子,所述psma配体可用作本公开的分子纳米标签上的标记,以靶向诸如ev的靶上的前列腺特异性配体。例如,可以将所述psma配体连接于装甲的量子纳米晶体,例如通过连接于装甲聚合物(例如,核酸或peg聚合物)的游离端,所述装甲聚合物在空间上排斥其它连接并提供对分子纳米标签进行单价标记的能力。因此,参考图1b,用于检测表达psma的ev的分子纳米探针可包括psma配体(例如,图10a-10c中的那些),其通过连接于装甲聚合物12(例如,核酸或peg聚合物)的游离端14而连接于装甲的量子纳米晶体20(参见例如,图11a-11f)。
实施例3:靶向配体与分子纳米标签的连接
图11a-11f进一步说明标记分子纳米标签的概念并将其与farlow等人(nat.methods10(12):1203-1205,2013)的现有设计进行对比,所述现有设计公开了具有硫代磷酸酯dna(ptdna)的装甲的量子纳米晶体,所述装甲在空间上排除了量子纳米晶体表面的其他反应。ptdna对半导体表面(例如,量子纳米晶体的表面)有亲和力。如farlow等人所述,在将商购的cdse:znsqd从有机相转移到水相之后,用不同序列和长度的ptdna处理量子纳米晶体。dna-官能化产生了具有离子性质的量子纳米晶体,可以通过琼脂糖凝胶电泳容易地将其与未官能化的qd区分开。用递增浓度的寡核苷酸滴定605nm发射的量子纳米晶体,所述寡核苷酸包含50腺苷酸ptdna结构域(as50)和20核苷酸ssdna靶向尾(产生长度约70个核苷酸的寡核苷酸)。在ptdna和量子纳米晶体的化学计量比或更高比例下,未观察到非官能化产物或多官能化产物的迹象,与单价产物的定量形成一致。farlow等人还表明,这些单价量子纳米晶体被模块化地和有效地靶向经常用于活细胞成像的蛋白质或脂质标签。靶向官能化通过ptdna的3’-修饰引入或通过将单价量子纳米晶体与带有5’-修饰的互补dna杂交来引入。这些策略可用于将它们与生物素、苄基鸟嘌呤(bg)、苄基胞嘧啶(bc)和脂质缀合,由此将它们分别靶向链霉亲和素、snap、clip和细胞膜。
本公开的分子纳米标签已经对farlow等人的公开进行改进。在图11b中所说明的一个例子中,单价聚合物的游离端被生物素化且连接于链霉亲和素(sa)/生物素,抗-psma抗体。在另一个例子中,单价聚合物的游离端被生物素化且连接于链霉亲和素(sa)/生物素,抗psma适配体(图11c)。在另一个例子中,单价聚合物的游离端被生物素化且连接于sa/生物素小分子psma配体(图11d)。或者,将单价聚合物的游离端叠氮化并连接于点击配偶体,例如,dcbo-teg-acupa/dcl(或其它小分子psma配体)(图11e)。新的分子纳米标签特别适用于靶向、分选和计数具有生物学意义的ev和其它纳米粒子靶。
在图11f的另一个说明的实施方案中,分子纳米标签包括cdse量子纳米晶体的芯,用peg涂层装甲,所述peg涂层空间上排除其它分子与纳米标签芯表面的连接。链霉亲和素(sa)被结合于peg涂层,且sa结合配偶体生物素将抗-psma特异性单克隆抗体缀合到生物素上。例如,链霉亲和素qdots可用于检测与ev结合的生物素化抗体,所述ev包含该抗体的配体。尺寸排阻色谱可用于分离结合/连接分子纳米标签标记的ev与未结合的分子纳米标签。在其它实施方案中,所述生物素缀合抗-psma适配体,如a9g,或抗-psma配体,如dcl(尽管在cdsecore-peg-sa-生物素-mab实施方案中没有明确地说明)。市售的链霉亲和素qdots可用于检测与ev结合的生物素化抗体,所述ev具有该抗体的配体。使用尺寸排阻色谱法分离具有标记的ev与未结合的标记。
实施例4:抗-psma适配体和配体
使用在dassie等人,mol.ther.22(11):1910-1922(2014),10.1038/mt.2014.117(其通过引用结合入本文)中所述的一些试剂,可以设计psma适配体。简而言之,使用体外转录的rna进行体外测定。所有的体内测定使用化学合成的用2′-氟代嘧啶、2′-羟基嘌呤和c12-nh25′末端修饰进行修饰的rna(integrateddnatechnologies,coralville,ia或trilinkbiotechnologies,sandiego,ca)进行。
如dassie等人先前所述对rna适配体进行转录。三种适配体的结构示出在图12a中。如图12b中所示,得到的a10-3.2适配体结合psma但不抑制细胞生长,a9g适配体结合psma且抑制细胞生长,而a9g.6适配体不结合psma且不抑制细胞生长。因此可以使用a9g适配体和a10.3适配体作为psma的rna适配体,与本公开的分子纳米标签一起使用。因此,参考图1b,用于检测psma(例如,ev上的psmba)的分子纳米探针可以包括psma适配体(例如,a9g或a10.3),其通过连接于装甲聚合物12(例如,核酸或peg聚合物)的游离端14而连接于装甲的量子纳米晶体20。
在一个实施例中,纳米粒子表面上的叠氮化单价聚合物,其通过点击化学缀合于psma配体,例如dcbo-teg(参见图11e)。可以缀合于纳米粒子的其它psma配体包括得自futurechemco.,ltd的psma配体,例如dkfz-psma-11(glu-co-lys(ahx)-hbed-cc、glu-nh-co-nh-lys(ahx)-hbed-cc);叔丁基-dcl-己基-nhs酯((s)-二叔丁基2-(3-((s)-1-(叔丁氧基)-6-(8-((2,5-二氧代吡咯烷-1-基)氧基)-8-氧代辛酰胺基)-1-氧代己-2-基)脲基)戊烷二酸酯);dcl(n-[n-[(s)-1,3-二羧基丙基]氨基甲酰基]-(s)-l-赖氨酸、2-[3-[5-氨基-1-羧基戊基]-脲基]-戊烷二酸);和叔丁基-dcl(2-{3-[1-叔丁基-羧酸酯-(5-氨基戊基)]-脲基}-二叔丁基戊烷二酸酯)。因此,参考图1b,用于检测psma(例如,ev上的psmba)的分子纳米探针可以包括psma适配体(例如,上述列举的那些),其通过连接于装甲聚合物12(例如,核酸或peg聚合物)的具有叠氮化物14的游离端而连接于装甲的量子纳米晶体20。
实施例5:单个外来体尺寸的粒子和单个分子的检测
所公开的纳米级分子标签例如可用于检测和确定特定分子的数目,所述特定分子与细胞外囊泡(例如,外来体)的生物学相关亚群相关。
在一些情况中,鉴定外来体亚群中的肿瘤特异性和/或免疫特异性生物标志物。本文公开的方法允许鉴定在单个外来体(或其它纳米粒子)上或中的特异性生物标志物。已经证明了单个量子纳米晶体(例如,)检测(图3)。单价量子纳米晶体能够实现单分子检测、计数和追踪,且可用于任何期望的生物标志物。
示例性的量子纳米晶体是可商购的,例如购自lifetechnologies(carlsbad,ca)。例如,(或其它量子纳米晶体)在uv波长中具有最大激发,且根据粒子具有525nm、545nm、565nm、585nm、605nm、625nm、655nm、705nm或800nm的最大荧光发射。官能化的量子纳米晶体在球形近似中可具有约10-30nm的整体尺寸,例如约20nm。量子纳米晶体例如可以具有硒化镉(cdse)/硫化锌(zns)、或硒碲化镉(cdsete)/zns的芯/壳组成。壳可以改进芯的荧光性能。
实施例6:在流式细胞术中使用纳米标签的方法
所公开的分子纳米标签可用于流式细胞仪,所述流式细胞仪配置为用于检测生物样品中的亚微米粒子,例如,纳米粒子。这种方法例如公开在美国专利公开号no.20130095575中,其通过引用结合入本文。尤其参见该专利公开中公开了nanofacs方法的实施例1和2。还参见danielson等人,plosone2016,11(1):e0144678,其通过引用结合入本文。
nanofacs具有使其可用于与分子纳米标签联合的多个特征。
(1)尽管荧光参数对使用nanofacs而言是整体的(integral),但是nanofacs不需要使用荧光触发。使用高分辨率散射参数允许在分选参数和门(gate)的选择上对所见、所分析和所处理的群有更全面的理解。
(2)nanofacs不需要若干ev聚集成单个珠,如用于研究ev和其它纳米粒子的其它流式细胞术方法中所用的那样。当使用适当的样品稀释和设备配置进行nanofacs时,粒子作为真正地单个例子是可视化的。粒子单态(singlet)比率(>99%)也优于使用已公开的用于单粒子分析的珠结合测定法所观察到的单体(singles)比率,其中90%的粒子呈现单态。仅通过检测粒子,无需使它们结合为珠,nanofacs方法更好地保留了粒子散射属性、生物学功能和表型亚群的能力。
(3)nanofacs提供了可用于预备性分选范围广泛的生物学纳米粒子或无机纳米粒子的高速方法,同时保留功能活性。与使用基于(慢)流动-室的平台进行的纳米级病毒分选相比,用本文中所述的高速的空气喷射系统(highspeedjet-in-airsystems)进行的nanofacs方法允许以ev的制备性分选和病毒研究的功能性测定所需的速率每小时制备100-1000倍更多的粒子。
(4)nanofacs方法以其预定的检测限范围使用流式细胞仪。因此,由于检测从液流中散射出的激光,阈值被设置在允许在阈值处和略高于阈值处具有被很好划定的基准噪声群的水平,并且可能存在被设置的阈值排除的相关感兴趣粒子。使用平行亚阈值群来提供粒子的部分代表,所述粒子被检测出与在该阈值处产生基准噪声的杂散光反射相关,可以在检测方面提供对被“遗漏”的性质有用的信息。分选时,这些信息告诉操作者何种类型的亚阈值事件与所选的分选群一起被收集,并且决定是否应该测试替代的染色或分离策略。
使用nanofacs方法,有可能以良好的保真度和以足以进行所选的功能性研究的制备量对纳米级ev和其它亚种群进行分析和分选。本文中公开的方法允许使用流通设备分离生物学亚微米粒子,例如,用于分选40-200nm范围的ev和分选100nm范围的hiv和其它小粒子,作为制备量的单个粒子,同时保留生物学活性。分子标签对于标记单个粒子以便对其进行分选和计数是有效的和有用的。
实施例7:减少不完全统计的改进
半导体纳米晶体(有时称为量子点)对于诸如荧光分子探针的应用而言是优异的发光体。它们的光学激发发射是有效的(量子效率可以接近统一)、窄带的和可调的,即,根据量子纳米晶体组成和尺寸,光输出颜色在从紫外光到可见光以及到红外光的范围内是精确可调的。吸收是准宽带的,便于激发且使得有可能使用单个激发源来激发多种量子纳米晶体,以获得一系列发射颜色,从而允许“光学条形编码(opticalbarcoding)”。然而,量子纳米晶体的光学性质对于表面厚度敏感且它们可以处于“暗(off)”态,所述“暗”态可导致它们在用于分子计数(例如,在流式细胞术中)时被“不完全统计”(图13a-13e)。本发明的方法克服了量子纳米晶体的壳由约6nm的常规厚度增加到至少10nm的厚度,例如,10-20nm的厚度(“巨型”量子纳米晶体)带来的缺点。
制备“巨型”量子纳米晶体的方法,例如,在vela等人,j.biophotonics3(10-11):706-717(2010);和hollingsworth等人,proc.spie7189:718904(march3,2009)中所公开的。所公开的制备这些“巨型”量子纳米晶体的方法通过引用结合入本文。简而言之,从3-4nmcdse量子纳米晶体芯开始,实现了具有抑制闪烁能力的非常厚、无缺陷的无机壳的生长。通过顺序施加无机壳的单层,粒子生长到~10-20nm的尺寸。使用基于连续离子层吸收和反应(silar)方法的改进方法,在cdse芯上生长所述壳单层—通常为cds,但也可以是cdxznys合金然后是zns。有效地,量子纳米晶体芯的波动作用与其表面分离,产生胶质的巨型量子纳米晶体。已经发现所述巨型量子纳米晶体不随长的观察时间而发生光漂白,且特征在于显著地抑制闪烁。
实施例8:分析(profiling)微泡的方法
分析微泡(包括,外来体)的方法公开在出版物中,例如美国专利公开号20130095575、20140228233和20140162888,其通过引用结合入本文。在一些实施例中,分析(profiling)包括对微泡(例如,ev)进行流式细胞术分析,以及在多种临床和研究应用中使用的分析。其中,抗原递呈细胞和肿瘤细胞产生大量亚微米粒子,即,外来体和微粒,它们调节肿瘤免疫应答和肿瘤微环境。在分辨率极限使用流式细胞仪允许对功能性形式的亚微米粒子进行分析、分选和研究,无需使用改变粒子生物学特性的电子显微术或聚集成珠。在已经公开的nanofacs方法中,细胞仪被配置用于对小粒子实现最大分辨率。可以通过添加过滤器和小粒子检测器两者,以及调节喷嘴高度以消除液滴驱动噪声(dropdrivenoise)来降低非特异性的背景噪声。使用本文公开的分子纳米探针极大地增强了该方法的分析能力。
微泡获自任何方便的生物样品。来自个体的血清样品是一种示例性样品,其可以多种方式进行处理,包括与用于鉴定和分选的亲合试剂结合。例如,可以用抗体对样品进行染色,所述抗体选择性结合免疫细胞的标志物、肿瘤标志物、辐射暴露标志物等。还可以针对感兴趣核酸(例如rna,包括微小rna)的存在对微泡进行分选和分析。微泡的数量和/或质量(例如,蛋白质或核酸标志物或其它感兴趣的标志物的存在)可用于监测对细胞毒性疗法的肿瘤应答(例如,在化疗和放射治疗中),对肿瘤疫苗的免疫应答,监测移植后的免疫细胞,包括移植抗宿主病的发展,生物剂量学(用于评价来自核事故、肮脏弹等的辐射暴露水平)。这种分析可包括检测相对于总血清蛋白质水平的微泡数量,且可以包括确定膜联蛋白v在微泡上的存在。在另一个实施方案中,所述方法还包括评价哺乳动物受试者的临床因素,所述受试者可以是人类受试者;且将所述评价与微泡分析相结合。
在一些实施方案中,对诸如血清样品的患者样品针对微泡的存在进行分析,所述微泡可以是包含感兴趣标志物的外来体或ev。在具体的实施方案中,所述分析是使用本发明方法的流式细胞术。感兴趣的标志物包括辐射特异性标志物、肿瘤特异性标志物、病原体特异性标志物和免疫细胞标志物,包括抗原递呈细胞,如树突状细胞标志物等。对患者的评价允许实现改进的护理,其中可以用适当的试剂治疗根据响应性分类的患者。可以根据最初的症状表现将患者分类,并可以随着病程进一步监测状态以维持适当的治疗,或者可以在疾病进展的任何适当阶段进行分类。可以基于所述分析选择和/或施用治疗方案(例如,手术、药物治疗或放射疗法)。在一个实施方案中,所述方法还包括基于所述分析为受试者确定疗程。
更广泛地,所述分子纳米标签可用于通过分析囊泡(例如膜囊泡或ev)来表征个体的表型。所述表型可以是受试者的任何可观察的特征或特点,例如疾病或病症、疾病阶段或病症阶段、对疾病或病症的易感性、疾病阶段或病症的预后、生理状态或对治疗法的响应。疾病的表型可以源自受试者的基因表达以及环境因素的影响和二者之间的相互作用,以及对核酸序列的表观遗传修饰。可以通过从受试者获得生物样品并分析来自该样品的一种或多种囊泡来表征受试者的表型。例如,表征受试者或个体的表型可包括检测疾病或病症(包括症前早期检测),确定疾病或病症的预后、诊断或治疗诊断(theranosis),或确定疾病或病症的阶段或进展。表征表型还可以包括为特定的疾病、病症、疾病阶段和病症阶段确定适当的治疗或治疗效力;疾病进展的预测和可能性分析,特别是疾病再发生、转移性蔓延或疾病复发。表型还可以是病症或疾病(例如,癌症或肿瘤)的临床上独特的类型或亚型。表型确定还可以是生理学状况的确定或对器官窘迫或器官排斥(例如,移植后)的评价。
囊泡分析还可以扩展到生物印记的确定,以预测受试者是否可能对疾病或病症的治疗有响应。表征表型包括预测受试者的应答者/非应答者状态,其中应答者对疾病的治疗有响应,而非应答者对治疗没有响应。可以分析受试者的囊泡并与已知对治疗有响应或无响应的先前受试者的囊泡分析相比较。如果受试者的囊泡生物印记更接近于已知对该治疗有响应的先前受试者的囊泡生物印记,则所述受试者可被表征为该治疗的应答者。类似地,如果受试者的囊泡生物印记更接近于对该治疗无响应的先前受试者的囊泡生物印记,则所述受试者可被表征为该治疗的非应答者。所述治疗可以用于任何适当的疾病、障碍或其它病症。所述方法可用于其中与应答者/非应答者状态相关的囊泡生物印记为已知的任何疾病环境。当生物印记指示受试者为特定治疗的应答者时,则可以给该受试者施用所述治疗。
在一些实施例中,使用在us9,739,700或yang等人,anal.chem.,81:2555-63,2009(二者都通过引用结合入本文)中公开的流式细胞术装置或方法。
实施例9:用于表征疾病的疾病靶的例子
细胞来源的囊泡,尤其是细胞外囊泡(ev),如微粒(mp)、微泡和外来体,可用于检测疾病。关于细胞外囊泡分析和它们作为潜在的疾病特异性标志物的用途的其他信息例如可以在julich等人,front.immunol.5:413,2014中找到,其通过引用结合入本文。指定疾病的已知mp/mv分析和mp/mv标志物包括得自julich等人的以下标志物:
关于细胞外囊泡在炎性疾病中的作用的其他信息在buzas等人,naturereviewsrheumatology10:356-364(2014)中提供,其通过引用结合入本文。
肿瘤细胞来源的ev以自分泌/旁分泌方式向其它肿瘤细胞传送致癌信号。这些ev携带可以促进肿瘤细胞增殖、迁移、入侵和转移的分子。值得注意的是,ev可以实现在其它情况中不会被分泌的分子(例如膜蛋白质)的非正常分泌(noncanonicalsecretion)。此外,最近的研究显示,肿瘤细胞分泌的evmirna还有助于癌症进展和/或促进宿主保护。可以用作分子纳米标签靶的体液中的特异性ev已经概括于katsuda等人,proteomics14:412-425(2014),doi10.1002/pmic.201300389,其通过引用结合入本文。
在具体的实施例中,所述靶可以是前列腺癌的生物标志物或生物印记,如在结合入本文的美国专利公开号20140162888中所述的。例如,微小rna(mir)可用于研究或区分bph和前列腺癌。可以从患者样品直接分离mir,和/或可以对来自患者样品的囊泡就该囊泡内的mir负载体进行分析。所述样品可以是体液,包括精液、尿液、血液、血清或血浆,或者是组织或活检组织样品。许多不同的方法可用于检测如本文所述的mir。在一些实施方案中,可以将以下生物标志物靶中的一种或组合用于这些目的。与pca样品相比,区分bph和pca的mir可以在bph样品中过表达,所述mir包括但不限于以下的一种或多种:hsa-mir-329、hsa-mir-30a、hsa-mir-335、hsa-mir-152、hsa-mir-151-5p、hsa-mir-200a和hsa-mir-145。或者,相对于bph样品,区分bph和pca的mir可以在pca样品中过表达,所述mir包括但不限于以下的一种或多种:hsa-mir-29a、hsa-mir-106b、hsa-mir-595、hsa-mir-142-5p、hsa-mir-99a、hsa-mir-20b、hsa-mir-373、hsa-mir-502-5p、hsa-mir-29b、hsa-mir-142-3p、hsa-mir-663、hsa-mir-423-5p、hsa-mir-15a、hsa-mir-888、hsa-mir-361-3p、hsa-mir-365、hsa-mir-10b、hsa-mir-199a-3p、hsa-mir-181a、hsa-mir-19a、hsa-mir-125b、hsa-mir-760、hsa-mir-7a、hsa-mir-671-5p、hsa-mir-7c、hsa-mir-1979和hsa-mir-103。
在具体的实施例中,在用于评价前列腺病的微泡中可以靶向如美国专利公开号no.2014016288中的以下循环生物标志物中的一种或多种,并鉴定微泡上可被有效区分的生物标志物:bcma、ceacam-1、hvem、il-1r4、il-10rb、trappin-2、p53、hsa-mir-103、hsa-mir-106b、hsa-mir-10b、hsa-mir-125b、hsa-mir-142-3p、hsa-mir-142-5p、hsa-mir-145、hsa-mir-151-5p、hsa-mir-152、hsa-mir-15a、hsa-mir-181a、hsa-mir-1979、hsa-mir-199a-3p、hsa-mir-19a、hsa-mir-200a、hsa-mir-20b、hsa-mir-29a、hsa-mir-29b、hsa-mir-30a、hsa-mir-329、hsa-mir-335、hsa-mir-361-3p、hsa-mir-365、hsa-mir-373、hsa-mir-423-5p、hsa-mir-502-5p、hsa-mir-595、hsa-mir-663、hsa-mir-671-5p、hsa-mir-760、hsa-mir-7a、hsa-mir-7c、hsa-mir-888、hsa-mir-99a及其组合。所述一种或多种循环生物标志物可以选自以下:hsa-mir-100、hsa-mir-1236、hsa-mir-1296、hsa-mir-141、hsa-mir-146b-5p、hsa-mir-17*、hsa-mir-181a、hsa-mir-200b、hsa-mir-20a*、hsa-mir-23a*、hsa-mir-331-3p、hsa-mir-375、hsa-mir-452、hsa-mir-572、hsa-mir-574-3p、hsa-mir-577、hsa-mir-582-3p、hsa-mir-937、mir-10a、mir-134、mir-141、mir-200b、mir-30a、mir-32、mir-375、mir-495、mir-564、mir-570、mir-574-3p、mir-885-3p及其组合。仍进一步地,所述一种或多种循环生物标志物可以选自以下:hsa-let-7b、hsa-mir-107、hsa-mir-1205、hsa-mir-1270、hsa-mir-130b、hsa-mir-141、hsa-mir-143、hsa-mir-148b*、hsa-mir-150、hsa-mir-154*、hsa-mir-181a*、hsa-mir-181a-2*、hsa-mir-18a*、hsa-mir-19b-1*、hsa-mir-204、hsa-mir-2110、hsa-mir-215、hsa-mir-217、hsa-mir-219-2-3p、hsa-mir-23b*、hsa-mir-299-5p、hsa-mir-301a、hsa-mir-301a、hsa-mir-326、hsa-mir-331-3p、hsa-mir-365*、hsa-mir-373*、hsa-mir-424、hsa-mir-424*、hsa-mir-432、hsa-mir-450a、hsa-mir-451、hsa-mir-484、hsa-mir-497、hsa-mir-517*、hsa-mir-517a、hsa-mir-518f、hsa-mir-574-3p、hsa-mir-595、hsa-mir-617、hsa-mir-625*、hsa-mir-628-5p、hsa-mir-629、hsa-mir-634、hsa-mir-769-5p、hsa-mir-93、hsa-mir-96。所述循环生物标志物可以是以下的一种或多种:hsa-mir-1974、hsa-mir-27b、hsa-mir-103、hsa-mir-146a、hsa-mir-22、hsa-mir-382、hsa-mir-23a、hsa-mir-376c、hsa-mir-335、hsa-mir-142-5p、hsa-mir-221、hsa-mir-142-3p、hsa-mir-151-3p、hsa-mir-21和hsa-mir-16。在一个实施方案中,所述循环生物标志物包括以下的一种或多种:cd9、psma、pcsa、cd63、cd81、b7h3、il6、opg-13、il6r、pa2g4、ezh2、runx2、serpinb3和epcam。所述循环生物标志物可以包括以下的一种或多种:fox01a、sox9、clns1a、ptgds、xpo1、letmd1、rad23b、abcc3、apc、ches1、ednra、frzb、hspg2和tmprss2_etv1融合物。参见wo2010056993,其申请以全文引用的方式结合入本文。
在另一个实施方案中,循环生物标志物包括以下的一种或多种:a33、a33n15、afp、ala、alix、alp、膜联蛋白v、apc、asca、asph(246-260)、asph(666-680)、asph(a-10)、asph(d01p)、asph(d03)、asph(g-20)、asph(h-300)、aurka、aurkb、b7h3、b7h4、bca-225、bcnp1、bdnf、brca、ca125(muc16)、ca-19-9、c-bir、cd1.1、cd10、cd174(lewisy)、cd24、cd44、cd46、cd59(mem-43)、cd63、cd66ecea、cd73、cd81、cd9、cda、cdac11a2、cea、c-erb2、c-erbb2、crmp-2、crp、cxcl12、cyfra21-1、dll4、dr3、egfr、epcam、epha2、epha2(h-77)、er、erbb4、ezh2、fasl、frt、frtc.f23、gdf15、gpcr、gpr30、gro-alpha、hap、hbd1、hbd2、her3(erbb3)、hsp、hsp70、hvegfr2、ic3b、il6unc、il-1b、il6unc、il6r、il8、il-8、insig-2、klk2、l1cam、lamn、ldh、macc-1、mapk4、mart-1、mcp-1、m-csf、mfg-e8、mic1、mif、misrii、mmg、mmp26、mmp7、mmp9、ms4a1、muc1、muc1seq1、muc1seq11a、muc17、muc2、ncam、ngal、npgp/npff2、opg、opn、p53、p53、pa2g4、pbp、pcsa、pdgfrb、pgp9.5、pim1、pr(b)、prl、psa、psma、psme3、pten、r5-cd9tube1、regiv、runx2、scrn1、seprase、serpinb3、sparc、spb、spdef、srvn、stat3、steap1、tf(fl-295)、tff3、tgm2、timp-1、timp1、timp2、tmem211、tmprss2、tnf-α、trail-r2、trail-r4、trkb、trop2、tsg101、tweak、unc93a、vegfa和ypsma-1。可以将这些标志物的任何组合用于生物印记,以评价前列腺癌。所述循环生物标志物可以与囊泡结合,例如,囊泡表面标志物或囊泡负载体。
实施例10:用量子点标记的ev的检测
本公开的分子纳米标签可用于检测细胞外囊泡(ev)。由具有链霉亲和素接头的qdot和抗-psma组成的分子纳米标签用于检测来自前列腺癌细胞的ev。将由具有链霉亲和素接头的qdot(sa-qdot)且无psma生物素组成的分子纳米标签用作阴性对照。使用100kdamwpalljumbosep过滤装置富集前列腺癌细胞系ev,然后用10mm荧光团cfse标记1x1011ev,随后使用尺寸排阻色谱从残余的cfse中进行纯化。ev与抗-psma-igg1-生物素抗体一起温育,随后使用尺寸排阻色谱除去残留抗体。然后用qdot625-链霉亲和素、40nm金链霉亲和素、40nm银-链霉亲和素或pe-链霉亲和素标记所述结合ev的抗-psma-igg1-生物素抗体。然后使用流式细胞术检测所得的经标记的ev,所述流式细胞术具有阈值设置在488nm或561nm的散射通道、低流速以及以下检测通道:405nmssc、488nm、561nmssc、640nmssc、pe、fitc和bv605。
如图18中所示,由具有链霉亲和素接头的qdot(sa-qdot)和psma组成的分子纳米标签(cfse+psma-sa-qd+ev)可用于检测来自前列腺癌细胞的ev,参见图的右上四分之一部分。未结合的qdots可见于左上四分之一部分,且cfseev可见于图的右下四分之一部分。尽管并非所有cfseev从右下移位到右上四分之一部分,但这很有可能是由于设备的荧光分辨率以及不具有qdot625的最佳过滤器这两个原因的组合所造成的。
实施例11:用金属纳米标签标记的ev的检测
所公开的分子纳米标签可用于检测ev。由链霉亲和素涂覆的银或金组成的,具有抗-psma-igg-生物素配体(或其它psma-结合配体,如a9g-teg-生物素)的分子纳米标签,可用于检测来自表达psma的前列腺癌细胞的ev。将前列腺癌细胞来源的ev用荧光团cfse标记,用尺寸排阻色谱去除残留的cfse。所得的ev与纳米标签一起温育。使用流式细胞术检测所得的经标记的ev,使用488nm和561nmss检测通道。关于方法的细节,参见morales-kastresana等人,scientificreports,7:1878,2017,其通过引用结合入本文。使用尺寸排阻色谱从大分子结构(例如,具有或者不具有结合标记的分子纳米标签或ev)中分离小分子和/或抗体。具体而言,使用nap5或葡聚糖凝胶g25-型柱将未结合的小分子(例如,核酸和psma结合分子,如图10b或图10c所示)与大分子结构(包括具有大于15nm芯结构的分子纳米标签)分离。使用基于琼脂糖凝胶-2b或琼脂糖凝胶-4b的树脂进行中等分辨率尺寸排阻色谱,和使用高分辨率树脂(例如但不限于sepharose6increase)通过fplc进行高分辨率尺寸排阻色谱。如morales-kastresana等人,scientificreports,7:1878,2017所述的,进行nanofacs高分辨率流式细胞术。
如图19a中所示,使用488nm和561nm散射参数检测的荧光阳性(cfse+)ev落在虚线(y=x)上。图19b示出了40nm-链霉亲和素-银纳米粒子,且示出了如果用这些银纳米标签标记时,所述群如何在488nm散射中向上移位。相反地,图19c示出了40nm-链霉亲和素-金纳米粒子,且示出了如果用这些银纳米标签标记时,所述群如何在561nm散射中向上移位。
实施例12:纳米粒子的检测
使用astrios和symphony流式细胞仪检测由银、银和金或聚苯乙烯组成的纳米粒子。
图20示出了金、银和聚苯乙烯粒子(箭头所示)针对设备基线噪声的相对散射功率。可以看出,可以在astrios设备的488ssc上检测到由金或银组成的小到40nm的粒子,而无需与任何结合。对于facssymphony设备而言,情况也是这样。因为可以分别地检测所述纳米粒子,它们可以被分别地量化。因此,可将所述纳米粒子用作独立、非聚集、非多聚化的单个标记。
实施例13:ev的生成、标记和检测
图21提供了对用于产生、标记和检测ev的方法的概述。这种方法允许单个纳米材料的产生和随后的量化/分析。
使用细胞产生上清液,所述细胞可以是原代细胞,如得自肿瘤的那些,或组织培养细胞。例如,在ev耗尽的培养基中生长细胞,并且例如通过连续超速离心(uc)或通过使用免疫原性捕获获得ev(关于示例性的细节,参见moraleskastresana等人,scientificreports,7:1878,2017,通过引用结合入本文)。如果需要,可以通过使用装甲(参见,图1的12)和配体结合元件(参见,图12的14)之间的可光解的接头进行的分离,或者通过(参见图1a的14)基于配体结合性能进行的洗脱,在流式细胞术分析之后除去ev结合的分子纳米标签,例如如果配体-结合元件以钙依赖性方式结合于例如磷脂酰丝氨酸(phosphatidylerine),则可使用edta将分子纳米标签与ev分离,或者,如果是使用链霉亲和素:生物素结合将分子纳米标签连接至ev结合配体,则通过添加脱硫生物素除去分子纳米标签(hirsch等人,analyticalchemistry,2002)。所得的ev可以通过纳米粒子追踪分析(nta)来量化。在一些实施例中,使用mehdiani等人(j.vis.exp.(95),e50974,doi:10.3791/50974,2015,其通过引用结合入本文)的方法制备ev。
所述经分离或纯化的ev可以用例如荧光团和本文提供的分子纳米标签来标记。例如,可以使用在morales-kastresana等人,scientificreports,7:1878,2017(通过引用结合入本文)中所述的方法,用cfse染料标记ev。
还可以用本文提供的分子纳米标签可检测地标记ev,例如包括金、银或两者,纳米粒子,和对ev上的第二结合配偶体(例如,ev膜蛋白或肿瘤抗原)具有特异性的第一结合配偶体(例如,抗体、核酸分子或配体)的分子纳米标签。例如,可以将纳米标签(1x109)和ev(1x109)在4℃下温育30分钟。
可以对所得的经标记的ev进行尺寸排阻色谱,并收集级分。这一步骤可用于除去未结合的纳米标签和未掺入的荧光团。
可以使用采用本文提供的方法的流式细胞术分析所洗脱的ev,所述ev目前包括一种或多种分子纳米标签(如果在ev上存在所述靶),在一些实例中还包括荧光团。
实施例14:纳米标签组成的光谱性能
具有高弹性散射功率的光学性质或具有可单独量化的具有高非弹性散射(荧光或拉曼散射)的组分的单分子纳米标签,允许基于对感兴趣的单个表位的结合来检测和分选ev或其它纳米材料。表型亚群是一种有效的工具,其需要每次标记一个以上的表位。为了同时标记一个以上的表位,使用具有独特光学性质的第二种或更多种纳米标签将其与第一种加以区别是有利的。可以看出,不同的金属在uv-可见光谱中在折射率和消光系数方面具有独特的分散性能(图6a)。这些光学性质可得自在线数据库,例如refractiveindex.info(图6b)。
使用米氏理论(mietheory),有可能利用这些光学性质使球的散射截面接近,并因此推断多个粒子如何由于它们在不同波长的散射分布图中具有独特的峰或谷而可以同时使用。这种方法可用于预测在不同激光波长具有多个侧向散射(ssc)检测通道(例如405nmssc、488ssc、561ssc、640ssc)的流式细胞仪(例如,astrioseq)检测具有不同直径和组成的粒子的能力。可以将用于不同纳米标签的特征性多波长侧向散射分布图与在一定波长范围(包括离散的波长或一个或多个连续的波长范围)所检测的侧向散射数值相比较。因此,可使用单色和宽带的照明源在包括纳米标签的靶上产生侧向散射。
这种建模技术被应用于不同的材料,包括金、银、聚苯乙烯、铂、二氧化钛、氧化铁和铜,图16a-16e。如图18a-18e中所示,约20-60nm球体的较小粒子产生独特的光谱峰和谷,例如,金和银。另外,可以看出,预计诸如金、铜和银的金属增强粒子检测(例如,与聚苯乙烯相比)。
如图22a-22b中所示,100nm的聚苯乙烯球体在常规流式细胞仪(例如,facssymphony)上是可检测的,且在400-800nm的波长范围内具有~1x10-16m2sr-1的散射截面。200nmag球体在380nm的照射波长时具有~1x10-16m2sr-1的散射截面,且40nm金球体在532nm的照射波长时具有~1x10-16m2sr-1的散射截面。
具有不同组成的粒子的这些固有散射特性允许与荧光标记同样的光谱标记方法,但用散射代替荧光进行标记。例如,在图16b中,在405nm的照射波长,从40nm银粒子收集的光散射比40nm金颗粒高~100倍。然而,在561nm的照射波长,从40nm金粒子收集的光散射比40nm银粒子高5-10倍。通过在astrioseq设备上以405、488、561和640nm的照射波长获取40nm银和金球体以评价可以如何利用光谱散射,这些模型数据得到验证。作为预测的模型,在561nm散射通道上从40nm银粒子收集的散射(红色)少于40nm金粒子(蓝色),而在405nm散射通道上从40nm银粒子收集的散射多于40nm金。
因此,基于设备上可用的具体ssc检测通道,有可能选择适当的材料来制造本文所述的的分子纳米标签。例如,如果设备具有405nmssc检测通道,则可以使用银纳米粒子;如果设备具有561或532nmssc检测通道,可以使用金纳米粒子,以此类推。具体的例子如在下表1中所示。
表1:材料和ss检测通道的示例性组合。
相比之下,如果在两个或更多个纳米粒子的信号之间几乎无差别,例如对金和银而言在640nm(参见,图17a)的情况下使用ss检测通道,则可以使用反卷积来确定散射的个体贡献(fogarty和warner,analyticalchemistry,53:259,1981;liu等人,photonicsresearch2:168-171,2014),其方式与将光谱反卷积应用于荧光或拉曼光谱数据相同。
另外的信息可以在2017年10月23日提交的美国临时申请62/575,988中找到,其通过引用结合入本文。
实施例15:纳米标签组成的光谱性能
使用米氏理论对球形粒子的光散射量进行建模并考虑流式细胞仪光学装置,对于捕获不同折射率的粒子的特定流式细胞仪,可能产生产生散射-直径关系的模型,图22a-22b。
使用welsh的方法(flowcytometeroptimisationandstandardisationforthestudyofextracellularvesiclesastranslationalbiomarkers),universityofsouthamptondoctoralthesis,209pp,2016),对astrioseq和facssymphony流式细胞仪进行建模,将获取的聚苯乙烯和二氧化硅微粒数据与模型数据拟合。这种方法在获取的流式细胞仪珠数据和建模的珠数据之间产生非常高的相关性,并允许推断流式细胞术设备对低和可变折射率粒子(例如,细胞外囊泡)的灵敏性,在图22a-22b中以绿色描述。
利用这种方法,检测的细胞外囊泡直径极限接近具有低折射率的ev,其对astrioseq而言大约为150nm,对symphony而言大约为200nm(图22b)。由于ev的模型直径倾向于在100nm区域内,亚种群经常出现在100nm以下,突显了大多数的常规流式细胞仪对于使用散射检测生物样品中细胞外囊泡的整个群而言是次优的,正如大多数流式细胞仪对于检测一个荧光素mesf等价物而言不够灵敏(nolan和jones,platelets28:256-62,2017;morales-kastresana等人,scientificreports,7:1878,2017)。
实施例16:ev的多重化(multiplexing)分析
使用流式细胞术,可采用荧光条型编码检测多个不同的珠群。图23a示出了来自市售的用于外来体分析的多重珠组的数据。将38个不同珠群表征为每个群具有不同量的红色和绿色标记,使得基于所确定的红色和绿色标记水平(所示的p1和p2参数)将各珠群进行条形编码。每个珠群还携带有在某些ev上发现的针对特定人表位的抗体,由此提供以38种不同的表位特异性捕获ev的方法。
图23b显示,在用38个珠组从血浆捕获ev之后(每个珠的结合能力>100ev),使用针对不同的ev表位的染色抗体来鉴定与带有该表位的ev相结合的3个珠群。在这个实施例中,珠是3微米珠,且在mesf对照的基础上,任何珠为阳性的检测需要存在>100个检测抗体-结合的荧光团,基于mesf对照。
图23c示出了分子纳米标签的用途,具有我们的nanofacs配置。分子纳米标签可用于产生允许单表位和单ev灵敏度的多元ev分析阵列。通过在装甲中掺入定制比例的不同荧光团实现条形编码,同时n种不同芯类型的弹性散射属性允许添加n个层,其中,例如使用金和银芯包括n=2种不同的芯组分,使得可以将具有38种有金芯的分子纳米标签的分子纳米标签阵列与38种有银芯的分子纳米标签组合,76种分子纳米标签类型中的每一种与对一种配体具有特异性的分子缀合,这将实现以对76种不同表位的单表位灵敏度检测具有76种不同表位的ev。用这样的方式,不同芯材料基于尺寸、材料或几何结构的独特散射性能提供了这样一种方法,其将多元方案(multiplexpanels)不仅扩展到包括基于荧光的条型编码,而且扩展到光散射条形编码。对与ev结合的这些分子纳米标签的群进行分选允许进行下游分析(例如,mirna分析)的多元分选。
图23d表明,可以检查由每种类型分子纳米标签捕获的ev的不同亚集的运载物(cargo)。图23d示出了基于对ev上psma的检测所分选的ev的mirna分布与整体ev群mirna或psma-阴性ev的mirna的对比。
考虑到本公开发明的原理可应用于许多可能的实施方案,应该认识到,所说明的实施方案只是本发明的实施例,而不应将其看作是对本发明范围的限制。相反,本发明的范围由随后的权利要求限定。因此,我们要求保护落入这些权利要求的范围和精神范围内的所有发明。
序列表
<110>美国政府
<120>分子纳米标签
<130>4239-95582-02
<150>62/411,324
<151>2016-10-23
<160>3
<170>patentinversion3.5
<210>1
<211>39
<212>rna
<213>人工序列
<220>
<223>适配体a10-3.2
<400>1
gggaggacgaugcggaucagccauguuuacgucacuccu39
<210>2
<211>43
<212>rna
<213>人工序列
<220>
<223>a9g适配体
<400>2
gggaccgaaaaagaccugacuucuauacuaagucuacguuccc43
<210>3
<211>43
<212>rna
<213>人工序列
<220>
<223>a9g.6适配体
<400>3
gggaccgaaaaagaccuggcuucuauacuaagucuacguuccc43
本文地址:https://www.jishuxx.com/zhuanli/20240726/121337.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表