一种产生重组细小病毒载体的昆虫相容性载体及昆虫细胞的制作方法
- 国知局
- 2024-08-19 14:22:01
本技术属于基因工程领域,更具体地,涉及一种产生重组细小病毒载体的昆虫相容性载体及昆虫细胞。
背景技术:
1、腺相关病毒(adeno-associated virus,aav),也称腺伴随病毒,属于细小病毒科依赖病毒属,是目前发现的一类结构最简单的单链dna缺陷型病毒,需要辅助病毒(通常为腺病毒)参与复制。aav的基因组是一条单链线性dna,约4700bp,包括上下游两个开放阅读框(orf):rep和cap,位于分别由145个核苷酸组成的2个t形反向末端重复序列(itr)之间,如图1所示。itr的作用是充当病毒复制起点和包装信号,rep基因参与病毒复制和整合,编码病毒复制蛋白,cap基因负责编码病毒三个衣壳蛋白。重组腺相关病毒(raav)由于具有宿主范围广、免疫原性低、安全性高、可介导外源基因在动物体内长期稳定表达等特点,是目前基因治疗领域最具应用前景的载体之一。随着第一种重组腺相关病毒(raav)介导的基因治疗药物的批准,对大规模aav载体制造技术的需求不断增加(yla-herttuala s.,2012,mol ther,20:1831-1832)。
2、目前,生产raav的体系主要有两大类:一种是利用哺乳动物细胞(如293细胞、cos细胞、hela细胞、kb细胞等)的常规生产体系;另一种是利用昆虫细胞的生产体系。其中,利用昆虫细胞的生产体系利用携带raav载体基因组、rep蛋白和cap蛋白的杆状病毒表达载体(baculovirus expression vectors,bevs)感染sf9昆虫细胞,从而产生raav病毒。借助sf9细胞可以大量表达重组蛋白的特点,该系统使用含有raav基因组以及aav-rep、aav-cap基因的昆虫杆状病毒转导sf9细胞,使raav在sf9细胞中组装,最终达到大规模生产raav的目的。
3、在该生产体系中,启动子起着重要作用。选择的外源基因置于天然启动子的控制下,然后在感染周期中表达,在细胞裂解过程中释放蛋白质。启动子可以被rna聚合酶辨认,并开始转录。在核糖核酸(rna)合成中,启动子可以和决定转录开始的转录因子产生相互作用,控制基因表达(转录)的起始时间和表达的程度,其包含核心启动子区域和调控区域,就像“开关”,决定基因的活动,继而控制细胞开始生产哪一种蛋白质。启动子本身并无编译功能,但它拥有对基因翻译氨基酸的指挥作用,就像一面旗帜,其核心部分是非编码区上游的rna聚合酶结合位点。
4、在杆状病毒的极晚期基因表达过程中,有两种高效表达的蛋白——多角体蛋白和p10蛋白。通常认为,驱动目的基因的启动子是多角体pol h(polyhedrin)启动子,在一些情况下可以用p10启动子替代多角体启动子。为了达到最大表达水平,多角体基因和p10基因的启动子polh和p10具有较强的启动能力,且均为病毒复制的非必需成分,因此这两个基因位点成为了杆状病毒表达载体系统理想的外源基因插入位点。p10启动子在末期阶段的早期激活,而多角体启动子在非常晚的末期才激活。尤其是在cap基因的表达中,pol h和p10是最常用的启动子。在非专利文献《intron splicing–mediated expression of aav repand cap genes and production of aav vectors in insect cells》(haifeng chen,www.moleculartherapy.org vol.16no.5may 2008)以及《insect cells as a factory toproduce adeno-associated virus type 2vectors》(masashi urabe etc,human genetherapy 13:1935–1943(november 1,2002))都公开了采用pol h启动子启动cap基因的表达的技术方案。
技术实现思路
1、针对现有技术的以上缺陷或改进需求,本技术提供了一种重组细小病毒载体的昆虫相容性载体及昆虫细胞,其目的在于通过构建包括位于相同或不同核酸构建体的cap基因表达盒以及rep基因表达盒,并用不同类型的启动子对不同蛋白的表达进行控制,从而更好地控制重组腺相关病毒(raav)生产所必需蛋白的相对含量和相对强度。
2、为实现上述目的,本技术提供了一种包括一至多个核酸构建体的昆虫相容性载体,包括位于相同或不同核酸构建体的cap基因表达盒以及rep基因表达盒;
3、所述cap基因表达盒从5’至3’包括可操作连接的:
4、第一启动子;
5、第一表达调控序列;
6、编码细小病毒vp1衣壳蛋白的核苷酸序列;
7、所述rep基因表达盒从5’至3’包括可操作连接的:
8、第二启动子;
9、第二表达调控序列;
10、编码细小病毒rep78/68蛋白的核苷酸序列;
11、用所述昆虫相容性载体感染昆虫细胞时,所述第一启动子在昆虫细胞感染周期的晚期活性达到最大,所述第二启动子不晚于第一启动子产生活性。
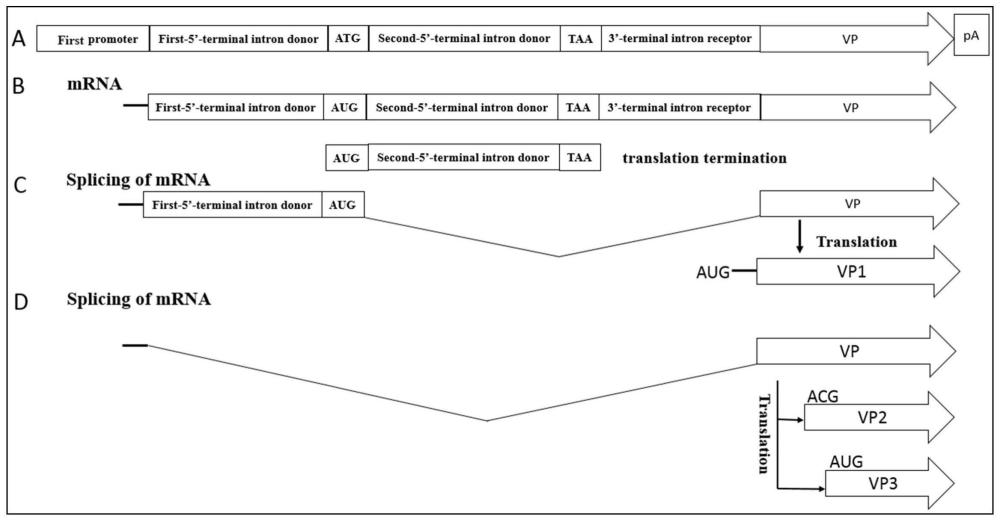
12、优选地,编码细小病毒rep78/68蛋白的核苷酸序列分别包含编码细小病毒rep52/40蛋白的开放阅读框;在所述编码细小病毒rep78/68蛋白的核苷酸序列的起始密码子的任意两个核苷酸之间,或者所述起始密码子与所述编码细小病毒rep52/40蛋白的开放阅读框的核苷酸序列之间包括:含有第三启动子的内含子。
13、作为进一步优选地,所述第一启动子为杆状病毒晚期启动子或以晚期启动子作为核心元件的融合启动子;所述第二启动子为组成型启动子、杆状病毒立即早期启动子、杆状病毒早期启动子或杆状病毒晚期启动子;所述第三启动子为杆状病毒极晚期启动子。
14、作为更进一步优选地,所述第一启动子为odv-e18、odv-ec27或p6.9。
15、作为更进一步优选地,所述第二启动子为deltaie1、ie1、39k、vp39、odv-e25、odv-ec27、odv-e18或p6.9。
16、作为更进一步优选地,所述第一启动子为p6.9或odv-e18,所述第二启动子为39k或vp39,所述第三启动子为polh或p10。
17、优选地,所述组合物还包括与cap基因表达盒以及rep基因表达盒位于相同或不同核酸构建体的转基因盒,所述转基因盒包含侧翼为至少一种细小病毒反向末端重复序列的转基因。
18、作为进一步优选地,所述转基因包括用于编码基因产物的核酸序列;所述基因产物为蛋白质、多肽、小干扰rna(sirna)、基于载体的短发夹rna(shrna)或微rna(mirna)或其他基因产物。
19、作为更进一步优选地,所述基因产物为脂蛋白酯酶、载脂蛋白、细胞因子、白细胞介素、干扰素、荧光蛋白、氯霉素乙酰转移酶、β-半乳糖苷酶、β-葡萄糖醛酸酶、海肾荧光素酶、萤火虫荧光素酶或碱性磷酸酶。
20、本技术的另一目的在于提供利用上述昆虫相容性载体感染的昆虫细胞。
21、在raav的生产过程中,平衡好产率和产品质量的关系是至关重要的。总体而言,通过本技术所构思的以上技术方案与现有技术相比,由于进一步优化了驱动cap和rep蛋白表达的启动子组合,使用早期或晚期启动子驱动rep78蛋白以及使用晚期启动子驱动cap的表达,并用于raav的生产。相比于cap基因盒利用极晚期启动子的对照组,使用在感染周期的晚期活性达到最大的启动子的实施例的实心率均提升了50%至1倍以上,且大部分提高了raav包装产率,从而提高了raav产物的质量,有利于建立稳定的下游纯化工艺。
本文地址:https://www.jishuxx.com/zhuanli/20240819/274917.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表