一种定制化仿生人工骨及其制备方法和应用与流程
- 国知局
- 2024-08-22 14:54:09
本发明涉及骨修复材料领域,特别涉及一种定制化仿生人工骨及其制备方法和应用。
背景技术:
1、骨缺损是伴随骨骼损伤常见的一种病理状态,广泛存在于骨折、感染、肿瘤摘除以及骨质疏松等病症中,严重影响患者的生活质量。骨骼的自愈能力有限,其再生需要足够的血液供应及特定的生理和机械环境,而且其修复重塑过程漫长。尤其在遭受严重骨缺损损伤时,仅依靠机体自身修复通常难以自愈,故常需医疗手段干预。自体骨移植是目前骨缺损治疗的金标准,优点包括无排斥反应,且具有较好的骨传导、骨诱导和成骨作用。缺点是自体骨数量有限,并且需要二次手术,可引发供骨区疼痛、增加创伤和感染风险。同种异体骨移植由于文化、伦理和法规的限制,其来源也相对有限,而且存在免疫排斥和疾病传播的风险。因此人工骨材料的替代使用显得尤为重要,其为骨缺损的填充、修复、再生提供了新的临床路径。
2、目前常用的生物材料如金属、高分子等仍存在一定的局限性。具体来说,金属材料的生物相容性并非最佳,缓释的金属离子可能导致组织的炎症反应。而且其刚度通常高于天然骨组织,可能导致应力屏蔽效应,影响新骨形成及重塑。聚合物材料如聚乳酸等的降解周期通常难以与新骨生成速率匹配,而且降解过程中产生的酸性产物可能导致局部炎症反应。相对而言,生物陶瓷材料具有良好的生物相容性和生物活性。20世纪80年代,生物陶瓷材料,如羟基磷灰石(ha)和β-磷酸三钙(β-tcp),成为仿生人工骨材料的主流选择。这些材料可有效促进骨细胞的黏附和骨组织的再生,成为当时仿生人工骨技术的重要突破。
3、在生物医用陶瓷材料的制备过程中,传统的制备方法包括湿化学合成法、溶胶-凝胶法、微乳液法、水热法、固相合成法以及气相沉积法等。这些方法各自依据不同的化学和物理原理,能够生产出具有致密或多孔结构的陶瓷产品。尽管这些传统制备技术成功实现了生物陶瓷的基本生产需求,使其在医用植入、骨修复等领域得到广泛应用,但在控制产品微观结构,尤其是微孔孔径的精确调控方面仍存在挑战。而且生物陶瓷材料通常强度和韧性不足,容易发生断裂或疲劳破坏,这限制了其在承重区的使用。
4、综上,该领域需进一步进行突破创新,目标设计出性能更加优异的人工骨材料以更好地满足临床需求。具体包括对患处解剖形态的精准适配,对生物陶瓷的微观结构进行高度控制和优化,并进一步提升材料的生物活性及其机械性能。融合多种功能特性的先进人工骨材料将促进骨缺损的快速有效修复,提高患者的生活质量。
技术实现思路
1、为解决上述问题,本发明提出一种定制化仿生人工骨及其制备方法和应用。
2、本发明的技术方案是这样实现的:
3、一种定制化仿生人工骨,包括人工骨支架;所述人工骨支架组分包括:羟基磷灰石和锰元素添加剂;所述锰元素添加剂包括有机锰化合物和/或无机锰化合物。
4、优选的,所述有机锰化合物为葡萄糖酸锰;所述无机锰化合物为氯化锰。
5、优选的,所述锰添加剂占羟基磷灰石的含量的0.01 -0.1wt%。
6、优选的,所述人工骨支架表面涂覆有涂层;所述涂层为聚乳酸-聚己内酯共聚物和重组人源化胶原蛋白形成的复合涂层;所述涂层与人工骨支架的质量比为0.5-2:100。
7、优选的,所述聚乳酸-聚己内酯共聚物和重组人源化胶原蛋白的质量比为1-3:1。
8、优选的,所述聚乳酸-聚己内酯共聚物中聚乳酸的质量分数为70%
9、本发明还提供了一种定制化仿生人工骨的制备方法,包括如下步骤:
10、s1、模型设计:获取患者待植入部位的医学影像数据,并据此设计构建植入物三维立体模型,生成stl文件;
11、s2、打印原料准备:将医疗级光敏树脂单体、引发剂、分散剂、羟基磷灰石、锰元素添加剂混合均匀;
12、s3、3d打印:将步骤s2中混合均匀的原料加入到3d打印机内,将步骤s1的stl文件载入3d打印机电脑控制端,开始打印;
13、s4、烧结:将s3打印完成的人工骨支架置于煅烧炉内烧结。
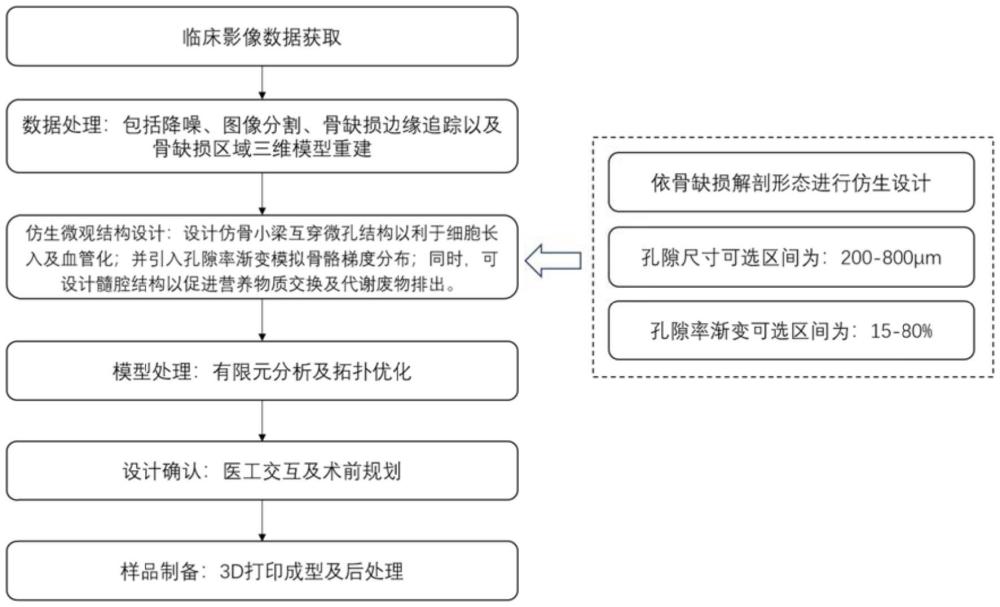
14、优选的,所述s1设计构建三维立体模型具体为:首先依骨缺损解剖形态进行定制化适配,同时按照骨骼位置及状态灵活按需设计髓腔结构,孔径大小、孔隙率渐变模拟骨骼梯度分布;所述模拟孔径大小区间为200-800μm,模拟孔隙率渐变为15%-80%。
15、优选的,所述步骤s2中医疗级光敏树脂单体为丙烯酸、丙烯酰胺或甲基丙烯酸酯中的一种,更优选为丙烯酰胺;所述引发剂为苯基双(2,4,6-三甲基苯甲酰基)氧化膦(bapo);所述分散剂为聚丙烯酸钠。
16、优选的,所述s2医疗级光敏树脂单体、引发剂、分散剂、羟基磷灰石的质量比为45-55:0.2-0.8:3-6:40-50;更优选的,所述医疗级光敏树脂单体、引发剂、分散剂、羟基磷灰石的质量比为50:0.5:4.5:45。
17、优选的,所述步骤s4烧结过程中从25℃开始以6-7℃/h的升温速率逐渐升高至400℃,再从400℃开始以25℃/h的升温速率逐渐升高至1300℃;1300℃条件下烧结2-3小时;整个烧结过程时间约4天。
18、本发明分阶段程序升温可以去除打印原料中包含的医疗级光敏树脂单体、引发剂、分散剂成分,光敏树脂以及引发剂、分散剂等是有机成分,一般在300℃左右挥发去除,前期升温过程较为缓慢,可以避免由有机物质挥发过程中产生内部应力及结构缺陷。有机物质挥发后,剩下的无机羟基磷灰石成分逐渐融合,并在最高烧结温度1300℃下获得紧密融合的生物陶瓷材料。
19、优选的,所述定制化仿生人工骨的制备方法还包括以下步骤:人工骨支架表面涂覆涂层,具体为:将聚乳酸-聚己内酯共聚物和重组人源化胶原蛋白分散在溶剂中,搅拌均匀后得到分散液,将人工骨支架沿垂直方向浸入在分散液中,然后缓慢抽出,将浸泡后的人工骨支架进行干燥。
20、优选的,所述聚乳酸-聚己内酯共聚物和重组人源化胶原蛋白总的质量分数为2-10%;所述溶剂为异丙醇、超纯水、二氯甲烷、乙醇组成的混合溶剂,异丙醇、超纯水、二氯甲烷、乙醇的质量比为2:7:9:1。
21、优选的,所述干燥为真空干燥,真空干燥温度为37℃,真空干燥时间为48h。
22、本发明还提供上述定制化仿生人工骨在骨缺损修复治疗中的应用,所述骨缺损修复治疗适用的骨骼部位包括但不限于四肢骨、口腔颌面骨、颅骨和脊椎骨。
23、本发明定制化仿生人工骨结构设计制备流程图如图1所示;图2是本发明定制化仿生人工骨微观结构设计示意图:(a)为设计的互穿微孔结构示意图,(b)为设计的孔隙率渐变示意图;按照本发明的设计方法可按需调节互穿微孔结构的孔径大小、孔隙率以及壁厚,以按需匹配不同的仿生定制化需求;图3是本发明定制化仿生人工骨支架材料代表性样品设计示意图:(a)为三维模型示意图,(b)为模型的截面图,突出中间的髓腔设计;髓腔结构有利于高效的营养物质运输及代谢废物的排出,有助于骨组织的再生修复,此外,样品渐变的孔隙结构模拟天然骨骼的梯度结构:其中外部较小的孔径可提供更强的机械强度,内部相对较大的孔径则仿生松质骨孔径及骨小梁结构,这种互穿微孔结构可为细胞粘附及毛细血管长入提供良好的微环境;图4是本发明定制化仿生人工骨材料样品图:(a)为3d打印后人工骨植入物样品图,(b)为样品光学显微镜图;可见3d打印后的成品有效实现了数字三维模型设计;图5是本发明定制化仿生人工骨支架材料表征图:(a)为扫描电镜图表征材料的微观孔径结构,(b)为扫描电镜图片,显示了3d打印层间紧密融合,(c)为高放大倍数扫描电镜图片,显示了晶粒间紧密融合,晶粒间以及打印层间的紧密融合是样品优异宏观机械强度的微观基础,(d)为扫描电镜图片以及对应的能谱分析,数据显示材料主要成分为钙、磷元素并含有微量的锰元素;图6是本发明定制化仿生人工骨应用案例:以患者ct数据为基础重建骨缺损区域三维模型示意图:(a)患者原始ct影像数据(b)在软件中选取骨缺损区域(c)对数据进行优化,进行三维重建并设计人工骨植入物模型;图7是将仿生微结构设计融入特定骨缺损解剖结构设计定制化仿生骨植入物模型示意图:(a)得到的骨植入物模型具有仿生微孔结构,(b)完美匹配骨缺损区域。
24、与现有技术相比,本发明的有益效果是:
25、(1)本发明提供了一种定制化仿生人工骨,可依患者的影像学数据进行三维建模,实现人工骨植入物与骨缺损解剖形态的定制化匹配。在人工骨微观结构方面通过3d打印技术精度实现了对植入物微孔结构的有效控制以模拟天然骨组织结构并促进细胞生长和物质交换,实现更好地模拟天然骨组织的结构和功能,进而提升生物医用陶瓷在临床应用中的效能。
26、(2)本发明提供了一种定制化仿生人工骨,在材料组分方面,通过在羟基磷灰石基础上加入微量元素锰不仅能够提升人工骨机械强度还可以提高人工骨生物活性。在机体中,锰元素通过多重机制发挥作用。特别地,锰在细胞内具有抗氧化性质,能够中和自由基,减少氧化应激造成的损伤,并促进氧气的释放,改善细胞的氧供应情况。同时胶原蛋白脯氨酰-4-羟化酶是一种氧依赖性酶,锰通过抗氧化作用产生的氧气作为底物可增强其活性,进而促进胶原蛋白的合成,加速骨组织的再生和修复过程。
27、(3)本发明提供了一种定制化仿生人工骨,在材料改性及性能优化方面,在烧结后的生物陶瓷表面引入了聚合物和重组人源化胶原蛋白复合涂层:其中聚合物为聚乳酸-聚己内酯共聚物,聚乳酸组分提供强度,聚己内酯组分提供韧性,共聚物的采用实现了强度与韧性的平衡,在生物陶瓷材料的基础上进一步提高了植入物的机械性能。而涂层中的重组人源化胶原蛋白组分可促进细胞的迁移粘附,进一步提高了材料的生物相容性和生物活性。改性后的仿生人工骨在为患处提供有效机械支撑的同时可促进骨组织的长入、再生,加速患者的骨骼修复过程。
本文地址:https://www.jishuxx.com/zhuanli/20240822/280321.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。