一种用光催化制备α位氘代酮类化合物的方法及其应用
- 国知局
- 2024-08-30 14:34:03
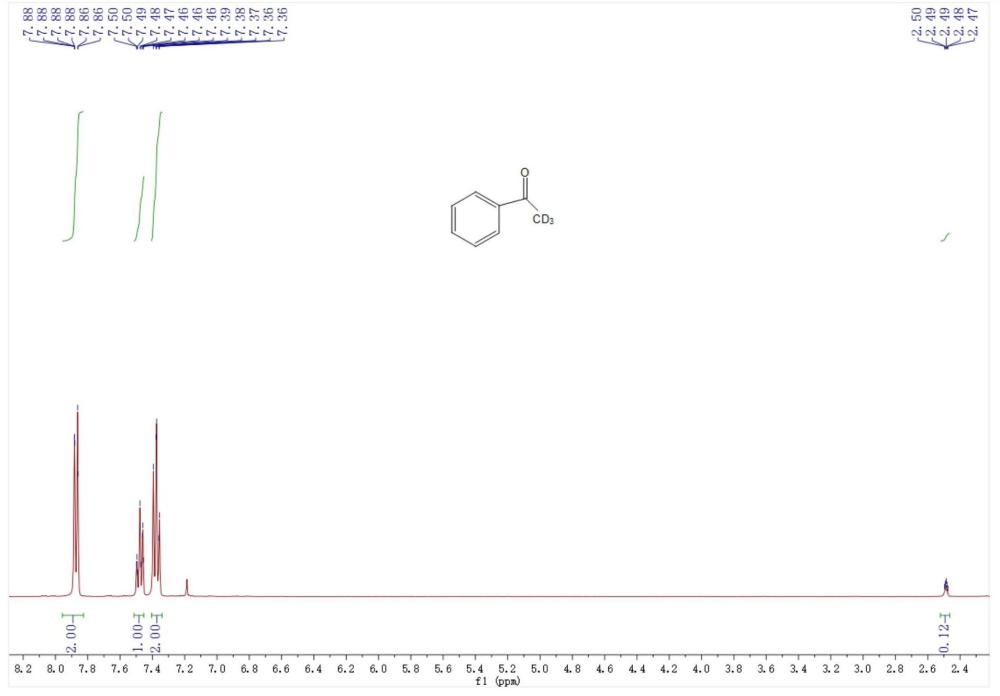
本发明涉及有机化学,尤其涉及一种用光催化制备α位氘代酮类化合物的方法及其应用。
背景技术:
1、氘原子作为氢的非放射性同位素,自1931年哈罗德·克莱顿·尤里首次发现氘以来,其在核科学、分析化学、物理有机化学和药物化学等领域发挥了重要作用。由于氘原子核具有一个质子和一个中子,使得其原子质量相较于氢高出一倍。与未经过氘标记的化合物相比,氘化物具有相似的物理性质,但质量差异显著,因此其通常被用作质谱法当中的定量内标物。在药物化学中,同位素标记药物用于研究药物的吸收、分布、代谢等特性。氢原子和氘原子之间的质量差也导致碳氘键(c-d)相对于碳氢键(c-h)而言,具有更低的零点能和更高的键解离能。因而氘标记化合物还可以用于通过动力学同位素效应(kinetic isotopeeffect,kie)实验来研究反应机理。
2、不仅于此,药物的特定位点氘化还可能会改变药物的药理学性质,提高代谢稳定性,从而达到减少药物的使用量和降低副作用的效果。例如austedo(deutetrabenazine)是美国食品和药物管理局(fda,u.s.)于2017年批准的第一种用于治疗亨廷顿舞蹈病的氘化药物。2021年,中国国家药品监督管理局(nmpa)也批准了氘代药物donafenib(多纳非尼)用于治疗肝癌。目前更多类型的氘化药物类似物正处在临床试验阶段。此外,氘代化学品的应用也逐渐扩展到了材料科学和生物化学。因此,研究者对有机分子氘代的研究热情正在不断上涨。目前的氘代途径主要包括氢氘(h/d)交换、还原性氘化和取代氘化反应。但它们都各自存在着一些仍待解决的缺陷,例如:氢氘交换的氘代位点难以控制;还原性氘化通常涉及高压条件、氘气(d2)这类昂贵的氘源以及高活性的金属试剂,总体成本高,对实验操作、设备等也有较高要求;取代氘化则大多需要使用价格较高的贵金属催化剂。因而开发一种能够针对有机物特定位点、操作简便、条件温和、成本低的氘代方法是本领域的重要研究方向之一。
3、公开号为cn114890878a的中国发明专利公开了一种用光催化制备氘代丙酮的方法,该方法的光催化氘代是通过在有机溶剂中,使用氘水作为氘源,在酸性条件下,以二氧化钛、卤代碱金属盐、硼烷衍生物和三氧化二铝为复合催化剂实现的。该反应主要依赖于二氧化钛的光响应,存在底物适用面窄的缺陷。
4、基于发明人课题组的在先研究成果,公开号为cn116535325a的中国发明专利提供了一种氘代安非他酮及其制备方法,该合成工艺以由闭式硼烷、贵金属原子与酞菁化合物的复合物为光催化剂,以四丁基溴化铵或四乙基溴化铵为助催化剂,使用氘水为氘源,在惰性气体保护下实现。该反应过程中,催化剂中的闭式硼烷与酞菁化合物复合物在光照射下,生成自由基状态,然后和氘源生成中间体,接着在贵金属原子活化作用下,通过氢氘交换反应实现安非他酮羰基的α位质子氢氘代,得到氘代安非他酮。与氘代丙酮工艺类似的,该方法同样存在底物适用面窄的问题,合成工艺尚只能针对特定的酮类化合物进行氘代。
5、综上所述,在现有技术的氘代机制外,提供一种新型的制备α位氘代酮类化合物的方法,满足成本更经济、操作简捷、底物适用性广的需求,对检测及生物医药等领域而言具有重要的应用及研究价值。
技术实现思路
1、有鉴于现有技术的上述缺陷,在本发明的第一方面,提供了一种操作简捷、经济高效、底物适用性广的用光催化制备α位氘代酮类化合物的方法,包括如下步骤:
2、光照环境下,酮类化合物与氘水通过cub10h10的催化进行氘代反应,使酮类化合物中与α-碳原子相连的氢原子被氘水提供的氘原子取代,得到α位氘代酮类化合物;
3、其中,酮类化合物包括如结构式ⅰ-ⅲ的化合物、2-萘乙酮、睾酮、黄体酮中的至少一种;
4、
5、结构式ⅰ中,r1选自氢原子、c1-c3的烷基、甲氧基、乙氧基、苯甲氧基、羟基、硝基、三氟甲基、卤原子中的一种,r2选自氢原子或甲氧基,r3选自氢原子或甲基;
6、结构式ⅱ中,r4选自卤原子或甲氧基;
7、结构式ⅲ中,n选自1-3的整数。
8、本发明首次采用硼簇阴离子[b10h10]2-与廉价金属离子cu2+之间形成的离子化合物作为光催化剂,在光照下实现了酮类化合物的α位氘代反应,采用廉价的氘水作为氘源,无需使用其他类型的复合催化剂或贵金属,与传统的氘代路径相比,降低了反应的成本。制备中以更丰富类型的酮类化合物为底物,通过光催化的方式直接实现了α位点的选择性氘代,不需要涉及复杂的前体合成工作,操作简便、反应时间短、条件温和、反应选择性好,且全程未额外添加有毒有害的添加剂,具有绿色环保的特点。
9、优选的,所述结构式ⅰ的化合物中,当r1选自卤原子时,卤原子为氯原子或氟原子。
10、优选的,所述结构式ⅱ的化合物中,当r4选自卤原子时,卤原子为氟原子。
11、当光源采用紫外光波段进行照射更有助于光催化剂的转化及α位的碳氢键活化,进而提高氘代的效果。因此,在合成中适宜采用紫外光进行照射,其他波段的光源亦可实现本发明的目的,但相对而言氘代效果会有所降低。本领域人员可以根据实际条件进行选择。
12、优选的,所述光照的波长为为315-400nm。
13、优选的,所述酮类化合物的用量为1-10mmol;所述氘水的用量为3-30ml;以酮类化合物的用量为1equiv.计,所述cub10h10的用量为0.1-1equiv.。
14、考虑到成本与分离等因素,cub10h10的用量适宜控制在合适的范围内,如本发明一个或多个实施例展示的,可优选0.3equiv.作为用量选择。本领域技术人员可以根据实际需求确定所述范围内的具体用量。
15、氘代反应所需的光催化剂可采用现有合适形式的cub10h10或通过简单的方式自制。
16、优选的,所述cub10h10的制备方法如下:向cucl2的水溶液中加入等摩尔量的cs2b10h10,室温下反应1-2h,得到cub10h10。
17、工艺中,氘代反应的进程可通过温度和时间进行控制,氘代反应适宜在合适的环境下进行。合适的反应温度可以加速反应速度、提高产率,并减少副反应和废物的生成。合理控制反应时间可以充分利用原料和催化剂,减少副反应和废物的生成,提高产率。过长或过短的参数选择都可能导致反应效果降低。
18、优选的,所述氘代反应的温度为40-60℃,反应时间为16-24h。
19、本领域技术人员可以根据实际条件选择合适的方式完成α位氘代酮类化合物的回收及纯化。如本发明一个或多个实施例所呈现的,通过滤膜过滤产物完成初步分离,利用有机溶剂进行萃取,随后过柱层析即可方便的得到目标产物。
20、优选的,所述用光催化制备α位氘代酮类化合物的方法的具体步骤如下:
21、(1)将酮类化合物与氘水、cub10h10混合,得到氘代反应液;
22、(2)氘代反应液在光照射下进行氘代反应,得到粗反应液;
23、(3)粗反应液经过滤、萃取,得到萃取液;萃取液干燥后经柱层析纯化,得到α位氘代酮类化合物。
24、在本发明的第二方面,提供了一种用光催化制备α位氘代酮类化合物的方法的应用,具体是以该方法制备的α位氘代酮类化合物作为内标物、氘标记化合物、氘代药物的应用。
25、优选的,所述用光催化制备α位氘代酮类化合物的方法可以作用于如睾酮、黄体酮、依普利酮、华法林钠等药物分子,均有较好的α位氘代效果。
26、基于以上技术方案,本发明的设计构思在于,以成本经济且来源广泛的氘水为氘源,采用cub10h10为光催化剂催化酮类化合物的氘代反应,得到α位氘代酮类化合物。不同于现有技术,本发明中α位氘代是基于cub10h10的独特催化机理实现的。在光照尤其是紫外光作用下,光催化剂的闭式硼烷簇转变为自由基状态,使酮类化合物α位的碳氢键得到活化,在氘水中实现α位的氢氘交换,完成对酮类化合物α位的氘代。而与闭式硼烷簇阴离子([b10h10]2-)以离子键相结合的cu2+,一方面将作为光生电子的俘获剂发挥作用,阻止光生载流子之间的复合,以保证闭式硼烷簇自由基存在的相对稳定;另一方面则用于增加催化剂自身的活性,促进氘水的分解。与现有技术相比,发明人将研究方向由使用贵金属活化碳氢键转向了利用闭式硼烷自由基来直接活化碳氢键,通过cu2+与其达成协同,仅使用单一光催化剂实现了多种底物的α位氘代,降低了成本并简化操作,提供了具有普适性更广的氘代方案。
27、与现有技术相比,本发明具有以下优点和有益效果:
28、本发明提供了一种用光催化制备α位氘代酮类化合物的方法,具有成本经济、操作简单、反应时间短、条件温和、反应选择性好,底物适用性更广的优势。
29、本发明提供了一种用光催化制备α位氘代酮类化合物的方法的应用,对检测及生物医药等领域具有重要的应用及研究价值。
本文地址:https://www.jishuxx.com/zhuanli/20240830/282737.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表