一种电泳联合HHRZ快速测定mRNApolyA尾长度的方法与流程
- 国知局
- 2024-08-30 15:06:41
本发明属于生物。更具体地,涉及一种电泳联合hhrz快速测定mrnapolya尾长度的方法。
背景技术:
1、信使rna (mrna)于20世纪60年代首次被科研人员发现,现已成为倍受瞩目的基础学科和应用研究领域。mrna被认为是在生命器官中调节基因功能的多功能分子,基于此出现许多不同类型的mrna疗法,例如mrna疫苗。mrna新冠疫苗其安全性和有效性得到了广泛验证,也证明了新一代mrna疗法的潜力。
2、在制备mrna疫苗技术中,由于mrna 3’端的polya尾可以保护mrna不被降解,增加mrna的稳定性,提高翻译效率,从而让mrna稳定发挥疗效。mrna polya尾存在易降解的问题,因此开发对mrna polya尾进行检测具有重要意义。而目前对体外转录合成的mrna原料的一系列质量测试主要包括mrna浓度及纯度、mrna序列完整性、表达能力及安全性等,少有对mrna polya尾长度的检测方法的研究。
3、传统mrna polya尾的检测方法主要是利用经典的rnase t1酶,以g残基为酶切位点,特异性降解mrna,进而获得含有polya尾的mrna片段,再用oligo dt磁珠富集技术,对含有polya尾的mrna片段进行富集纯化,利用lc-ms对其进行检测得到polya尾长度信息。另有中国发明专利申请cn116926163a披露了一种基于脱氧核酶的完整测定mrna polya尾的方法,以脱氧核酶在mrna的特定位点进行特异性酶切(gc,gu,ac,au或au,ac,ag,uc,ug,cg酶切位点),产生具有完整长度的polya片段后,同样利用o1igodt磁珠富集纯化后再利用lc-ms对富集纯化所得的具有完整长度的polya片段进行检测。但是,上述检测方法不仅需要对酶切片段进行o1igodt磁珠富集纯化,更重要的是依赖于lc-ms技术,实验周期长且检测成本很高。
4、目前缺乏快速、低成本的测定mrna polya尾长度的方法。
技术实现思路
1、本发明旨在克服现有mrna polya尾长度的检测方法周期长且检测成本高的问题,提供一种低成本的快速测定mrna polya尾长度的方法。本发明探索出了电泳联合hhrz快速测定mrna polya尾长度的方法,不依赖复杂技术体系、不依赖大型或昂贵仪器,且准确性能与lc-ms法相当。
2、本发明的目的是提供一种电泳联合hhrz快速测定mrna polya尾长度的方法及其应用。
3、本发明上述目的通过以下技术方案实现:
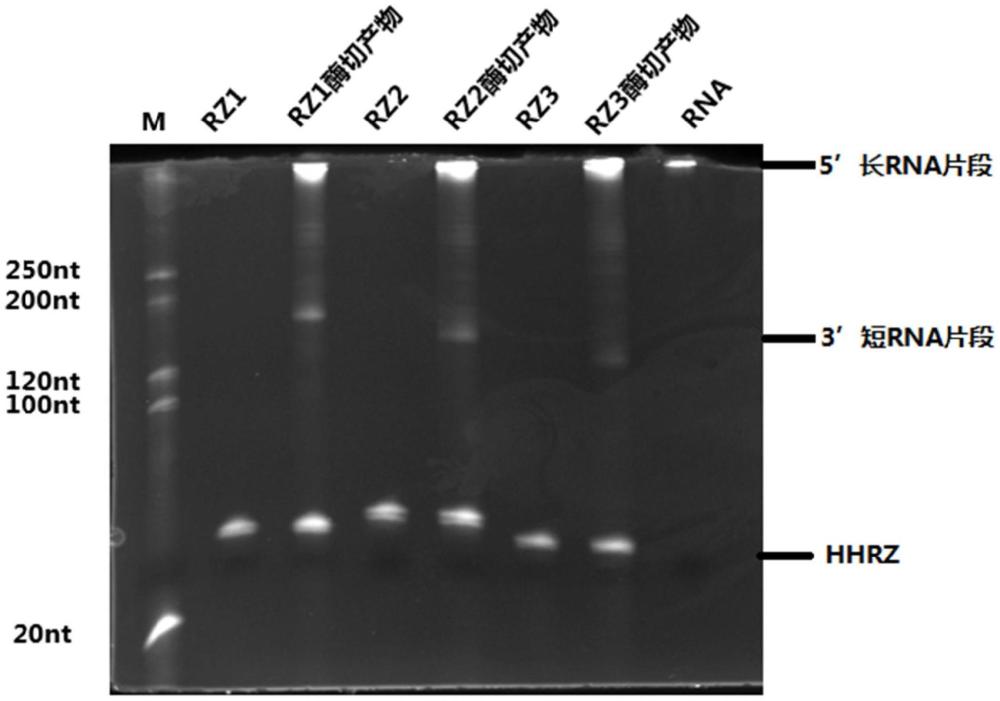
4、针对现有mrna polya尾长度检测技术周期长且检测成本高的问题,发明人首先尝试对检测技术中的各环节进行低成本替代,意外想到可否采用普通的极低成本的电泳来替代lc-ms进行polya片段长度的判断呢?以及以成本低、常见的rna片段纯化技术(如市售rna纯化试剂盒)替代o1igodt磁珠富集纯化技术?但是实验结果显示,无法有效跑出条带。进而发明人团队进行了研究摸索,寻找原因,经过不断地尝试,意识到可能是酶切的问题。我们发现,o1igodt磁珠富集纯化技术能够特异性回收polya片段,而常规的rna纯化试剂盒没有特异性,无法实现polya片段的特异性富集,而普通电泳技术的灵敏度是有限的,因此在酶切效率不高的情况下自然无法跑出条带。至此,发明人团队继续探索针对mrna polya尾的高效酶切技术,研究得到采用锤头型核酶(hhrz)在特定酶切位点的高效酶切方法,酶切产物可采用低成本的rna纯化试剂盒纯化结合普通电泳技术即可得到polya尾长度信息。
5、具体地,本发明提供了一种电泳联合hhrz快速测定mrna polya尾长度的方法,使用锤头型核酶对待检测mrna进行酶切,对酶切产物进行纯化回收,然后进行电泳检测,得到polya尾长度信息。
6、优选地,所述锤头型核酶的酶切位点为guc、auc、gua、aua或cuc。
7、更优选地,所述锤头型核酶的酶切位点为guc。
8、所述待检测mrna为含有guc、auc、gua、aua或cuc位点的mrna。
9、作为可选择的实施方案,所述酶切位点在polya尾上游20~500nt内。
10、作为可选择的实施方案,所述酶切位点在polya尾上游20nt内。
11、优选地,所述锤头型核酶的完整序列由左同源臂序列、核心序列和右同源臂序列组成;所述核心序列如seq id no.1所示。
12、具体地,左同源臂序列和右同源臂序列根据与待检测mrna碱基互补配对进行设计。
13、优选地,左同源臂序列和右同源臂序列长度为8-15个核苷酸。
14、优选地,所述酶切的体系为100~300mm tris-hcl缓冲液1~3μl、5~10μm锤头型核酶1~3μl、1~3μg mrna。
15、优选地,所述酶切的体系中加入终浓度为1~1.25mm的mg离子。
16、作为可选择的实施方案,所述mg离子由mgcl2提供。
17、优选地,所述电泳为毛细管电泳(ce电泳)、尿素-page电泳或琼脂糖凝胶电泳。
18、更优选地,所述电泳为尿素-page电泳或毛细管电泳。
19、作为可选择的实施方案,酶切产物进行ce电泳,通过已知大小的ladder确定目标峰的大小和数量,同时计算目标峰面积,以分析mrna polya尾的不同长度分布及比例。
20、作为可选择的实施方案,所述琼脂糖凝胶电泳的条件为电压100-150v运行30~40min;尿素-page电泳的条件为电压200v运行60~70min。
21、作为可选择的实施方案,所述琼脂糖凝胶电泳的琼脂糖凝胶浓度为1~4%;所述尿素-page电泳的page胶浓度为12~20%。
22、作为可选择的实施方案,所述琼脂糖凝胶电泳的琼脂糖凝胶浓度为3%;所述尿素-page电泳的page胶浓度为12%。
23、优选地,所述纯化回收的方法为通过rna纯化试剂盒对酶切产物进行纯化回收,或者通过氯化锂沉淀法对酶切产物进行纯化回收。
24、作为可选择的实施方案,酶切的方法包括如下步骤:
25、s1.配制酶切体系,酶切体系在93~98℃反应1~3min,室温孵育2~8min;
26、s2.向酶切体系加入1μl 20~25mm mgcl2,在37~45℃孵育60~120min。
27、优选地,酶切的方法包括如下步骤:
28、s1.配制酶切体系,酶切体系在95℃反应2min,室温孵育5min;
29、s2.向酶切体系加入1μl 20mm mgcl2,在37℃孵育60min。
30、另外,基于上述研究成果,上述锤头型核酶在检测mrna polya尾长度中的应用,以及上述方法在检测mrna polya尾长度中的应用,也应在本发明的保护范围之内。
31、本发明具有以下有益效果:
32、本发明提供了一种电泳联合hhrz快速测定mrna polya尾长度的方法,本发明通过实验研究设计出用于mrna polya尾酶切的锤头型核酶及特定酶切位点方案,酶切产物经纯化后通过琼脂糖凝胶电泳、尿素-page电泳或毛细管电泳等普通电泳技术即可对mrnapolya尾长度进行分析。与传统mrna polya尾检测方法比较,该方法所需时间和成本均大幅度减少,不依赖复杂技术体系、不依赖大型或昂贵仪器,且准确性能与lc-ms相当,可实现快速便捷、低成本、准确检测mrna polya尾长度的目的,并且本发明酶切电泳检测mrna polya尾长度的方法酶切效率极高,检测所需的rna用量很少,具有很好的应用价值。
本文地址:https://www.jishuxx.com/zhuanli/20240830/285530.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表