工程化纳米抗体及其制备方法和应用
- 国知局
- 2024-09-05 14:18:41
本发明属于生物医学,尤其涉及一种工程化纳米抗体及其制备方法和应用。
背景技术:
1、绿色荧光蛋白(gfp)广泛应用于生物学研究。尽管gfp可以轻松可视化,但由于高亲和力结合伴侣的可用性有限,操纵gfp的一种方法是寻找结合伙伴,包括抗体、纳米抗体等。由于抗体相对较大,在体内测定过程中需要形成二硫键,并且高度聚集的倾向阻碍了其应用。无疑,纳米抗体技术是最有前途的。纳米抗体的一个关键特征是它们的尺寸小,纳米抗体直径为2.5nm,高度为4nm,分子量约为12~15kda。其他特性包括高亲和力、高特异性、低脱靶性、高稳定性和良好的溶解度,能够耐受纯化和生化测定条件,并在所有细胞类型中表达。所以,纳米抗体越来越多地应用在生物技术和医学领域。
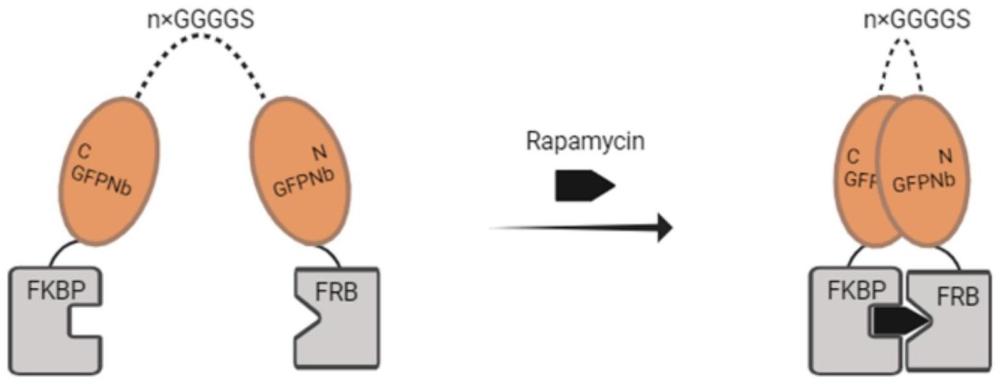
2、将生物活性蛋白分裂成能条件重组的片段是构建研究和控制生物系统的有力策略。这些系统的工作原理是将蛋白质分裂成两个片段来破坏蛋白质的功能。然后,两个片段被分别与伙伴蛋白相融合,这样,只有当伙伴蛋白相互作用时,分裂的蛋白质才会被重组,并恢复其功能。在化学诱导二聚体(cid)系统中,两种伙伴蛋白仅在小分子配体存在下才二聚化,以此来诱导融合蛋白发生邻近相互作用而调控细胞进程,目前从细胞信号转导,到基因表达调控等都可用cid方法,该方法已经成为调控细胞活性的重要手段。雷帕霉素(rapamycin)诱导的fkbp和frb二聚化是最常用的化学诱导蛋白质二聚化系统。fkbp与rapamycin结合后产生新的结合表面,然后frb识别该复合物并特异性结合。通过将fkbp和frb与感兴趣的蛋白质融合来有条件地控制蛋白质定位、分裂酶活性和蛋白质-蛋白质相互作用。将fkbp和frb与循环排列的nanobody相融合,利用雷帕霉素小分子诱导的二聚作用,使nanobody重组恢复其活性,进而可以在时间或空间分辨上对细胞进程进行调控。
3、蛋白酶是一种水解肽键的酶,作为合成传感或信号传导途径中的可调节控制元件具有巨大的潜力。蛋白酶在工程系统中感知和控制生化活动的用途源于其响应生化输入并以多种方式调节其他蛋白质的天然能力。蛋白酶已被设计为通过片段互补或底物招募来响应生物、化学和光学输入。其中,tev核包涵体a(nia)蛋白的27kda蛋白酶结构域,通常称为tev蛋白酶(tevp),是使用最广泛的蛋白酶之一。典型的tevp切割位点(tevcs)是enlyfq/s,tevp在真核细胞和动物中表达时具有良好的耐受性,可在哺乳动物细胞中完全裂解典型底物。在分裂蛋白合理设计中,tevcs可作为短连接子,并在空间上发挥一定阻断蛋白的生物活性的作用。通过tev蛋白酶的输入,完全切割tevcs,使分裂蛋白具有重组的能力。序列特异性蛋白酶已被证明是报告或控制细胞功能工具的通用构建模块。
技术实现思路
1、本发明要解决的技术问题是克服现有技术中存在的不足,提供一种基于小分子和蛋白酶控的设计方法。为了解决上述技术问题,本发明提供了一种工程化纳米抗体,所述工程化纳米抗体将gfp nanobody n末端和c末端以连接子相连进行循环排列,并依据cdr区的分布,选取五个位点将gfp nanobody进行拆分,由此得到了新的n末端和c末端,在新n末端融合fkbp,在新c末端融合frb,以获得工程化的纳米抗体;所述五个位点为:14/15,44/45,65/66,77/78,90/91;所述fkbp蛋白的质粒的dna序列如seq id no.1所示;所述frb蛋白的质粒的dna序列如seq id no.2所示。gfp nanobody共有九个β链,以每个β链之间的连接子是否为cdr区为依据,可以选取的拆分位点有五个,分别为14/15,44/45,65/66,77/78,90/91。上述的工程化纳米抗体,进一步的,所述连接子为n×ggggs或tevp底物,所述n×ggggs中n=1、6、10中的一种;1×ggggs的dna序列如seq id no.3所示;6×ggggs的dna序列如seqid no.4所示;10×ggggs的dna序列如seq id no.5所示;所述tevp底物的dna序列如seq idno.6所示。上述的工程化纳米抗体,进一步的,连接子为10×ggggs,拆分位点为14/15的工程化纳米抗体,dna序列如seq id no.7所示;连接子为1×ggggs,拆分位点为14/15的工程化纳米抗体,dna序列如seq id no.8所示;连接子为6×ggggs,拆分位点为14/15的工程化纳米抗体,dna序列如seq id no.9所示。上述的工程化纳米抗体,进一步的,连接子为10×ggggs,拆分位点为44/45的工程化纳米抗体,dna序列如seq id no.10所示;连接子为1×ggggs,拆分位点为44/45的工程化纳米抗体,dna序列如seq id no.11所示;连接子为6×ggggs,拆分位点为44/45的工程化纳米抗体,dna序列如seq id no.12所示。上述的工程化纳米抗体,进一步的,连接子为10×ggggs,拆分位点为65/66的工程化纳米抗体,dna序列如seq id no.13所示;连接子为1×ggggs,拆分位点为65/66的工程化纳米抗体,dna序列如seq id no.14所示;连接子为6×ggggs,拆分位点为65/66的工程化纳米抗体,dna序列如seq id no.15所示。上述的工程化纳米抗体,进一步的,连接子为tevp底物,拆分位点为14/15的工程化纳米抗体,dna序列如seq id no.16所示。上述的工程化纳米抗体,进一步的,连接子为tevp底物,拆分位点为44/45的工程化纳米抗体,dna序列如seq id no.17所示。上述的工程化纳米抗体,进一步的,连接子为tevp底物,拆分位点为65/66的工程化纳米抗体,dna序列如seq id no.18所示。
2、基于一个总的技术构思,本发明提供了一种所述的工程化纳米抗体的制备方法,包括以下步骤:s1、以pcnda3.1(+)为构建载体,将gfp与gal4 dbd融合到载体上得到表达gal4dbd-gfp蛋白的质粒;将gfp nanobody与vp64融合到载体上得到gfp nanobody-vp64蛋白的质粒;以5×uas-tata-mcherry作为报告质粒;s2、通过瞬时转染的方式递送进细胞进行蛋白表达。
3、基于一个总的技术构思,本发明提供了一种所述的工程化纳米抗体在制备调节蛋白的体内活性和操纵内源性蛋白的药物中的应用。工程化的纳米抗体可以由小分子和蛋白酶两种调控方式,与传统纳米抗体相比增加了调控方法。可用于调节蛋白的体内活性和操纵内源性蛋白功能。并且,可用于很多使用抗体片段的技术中,如嵌合抗原受体-t(car-t)细胞技术。另外,可将其转化为诱导抗体激活系统,应用于更广泛的药物激活体系。
4、与现有技术相比,本发明的优点在于:
5、(1)本发明提供了一种工程化纳米抗体,可由小分子和蛋白酶两种方式调控的纳米抗体,与gfp的特异性结合,相比较于现有的纳米抗体的调控方法,本发明使用循环排列、小分子诱导,蛋白酶切割的设计方法,具有多种可调控手段。
6、(2)本发明提供了一种工程化纳米抗体在在制备调节蛋白的体内活性和操纵内源性蛋白的药物中的应用。工程化的纳米抗体可以由小分子和蛋白酶两种调控方式,与传统纳米抗体相比增加了调控方法。可用于调节蛋白的体内活性和操纵内源性蛋白功能。并且,可用于很多使用抗体片段的技术中,如嵌合抗原受体-t(car-t)细胞技术。另外,可将其转化为诱导抗体激活系统,应用于更广泛的药物激活体系。
本文地址:https://www.jishuxx.com/zhuanli/20240905/285712.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表