新型VASH抑制剂、其缀合物及其作为药物或研究工具的用途的制作方法
- 国知局
- 2024-08-30 15:08:55
本发明涉及新的vash抑制剂,特别可用于预防和/或治疗vash肽酶相关病症和/或作为研究工具。本发明还涉及所述vash抑制剂与生物分子的缀合物及其作为药物或作为研究工具的用途。
背景技术:
1、微管(mt)是细胞骨架元件的主要类型,在神经元中特别丰富。它们是由α-和β-微管蛋白异二聚体聚合形成的。在细胞内,mt具有生长和收缩的能力,这种现象称为动态不稳定性。mt的动态行为使其能够支持多种细胞过程,包括细胞内运输、细胞运动、细胞分裂和细胞形态发生。微管的功能多样性是由影响微管蛋白的多种翻译后修饰(ptm)造成的。已知的ptm包括乙酰化、聚谷氨酰化、聚甘氨酰化、磷酸化和酪氨酸化/去酪氨酸化循环。这些修饰对微管动力学、其组织及其与其他细胞化合物和区室相互作用产生影响。
2、mt的功能障碍与神经发育障碍和神经退行有关。详细描述的功能障碍与微管蛋白(mt的组成部分)或调节mt功能的mt相关蛋白(map)的突变有关。许多map的结合是由α-和β-微管蛋白的c末端尾部介导的,这些尾部突出于mt表面,已知受到各种翻译后修饰的严重影响。神经元中最丰富的微管蛋白修饰是聚谷氨酰化,它在α-和β-微管蛋白c末端产生多种可变长度的谷氨酸侧链。带负电荷的谷氨酸被添加到c末端尾部,为各种mt相关蛋白(map)和分子马达提供结合位点。因此,聚谷氨酰化已被证明调节许多mt相互作用蛋白的活性或结合。早期研究表明,神经元map的结合(如阿尔茨海默病的关键参与蛋白tau)受到mt聚谷氨酰化的调节。最近的报告表明,在轴突生长和可塑性中发挥重要作用的mt切断酶(如spastin和katanin)的活性也受到这种修饰的控制。此外,聚谷氨酰化似乎可以调节kif1a驱动蛋白运动蛋白的速度和持续性(processivity),而该蛋白参与突触小泡的递送,从而能调节突触传递。总之,微管蛋白聚谷氨酰化控制着各种重要的神经元过程。聚谷氨酰化是可逆的,由属于微管蛋白酪氨酸连接酶样(ttll)家族的酶催化。相反,逆向酶是胞质羧肽酶(ccp)家族的成员。因此,特定细胞中微管蛋白聚谷氨酰化的总体水平是两种活动竞争的结果。
3、第一个被发现的微管蛋白修饰是去酪氨酸化,这是α微管蛋白特异性的,包括去除mt的c末端酪氨酸残基。酪氨酸化/去酪氨酸化循环特别涉及神经元细胞、肌肉细胞和分裂细胞中的微管调节。因此,微管去酪氨酸化改变涉及病症,如神经退行性疾病、神经元再生障碍、癌症、肌营养不良、心脏病、血管病、视网膜退行性病变、不孕症或纤毛病(ciliopathies)。
4、尽管去酪氨酸化作用已在近半个世纪前被发现,但参与去酪氨酸化生成的酶直到最近才被发现,这些酶具有微管蛋白羧肽酶(tcp)活性(nieuwenhuis j.等人,science,2017,358(6369):1453-1456;aillaud c.等人,science,2017,358(6369:1448-1453)。血管抑制素家族的成员vash1和vash2是催化这种修饰的酶。最近的研究尤其导致鉴定了这种蛋白质酶活性的可逆和不可逆抑制剂,这些抑制剂在治疗神经退行性病症方面具有特别的意义,包括但不限于tau蛋白病(例如,阿尔茨海默病、额颞叶痴呆、皮质基底痴呆等)以及上述病症(参见wo 2019/016259)。
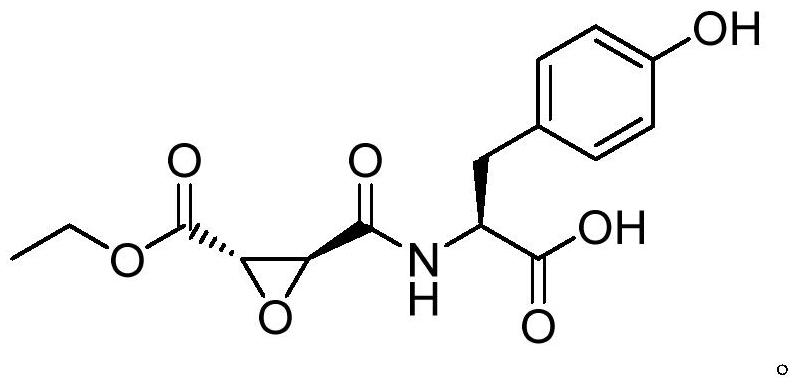
5、使用与点击化学兼容的定制设计的抑制剂,采用高亲和力纯化步骤,可以将vash识别为微管蛋白去酪氨酸化酶(aillaud,c.等人,science.2017,358(6369):1448-1453)。所述抑制剂中最有效的化合物称为epo-y(aillaud等人,2017),由连接到酪氨酸残基的活性基团(称为转环氧琥珀酸(tes)乙酯)组成,表示如下:
6、
7、epo-y(也称为epo-y)是一种不可逆的vash抑制剂,最初被认为是治疗涉及改变的微管去酪氨酸化病症的潜在候选药物。然而,该化合物在细胞内(in cellulo)显示出中等ic50,约15μm。鉴于潜在的生物医学应用,理想的抑制剂需要对vash具有高特异性和效力。小且高度亲电的环氧化物分子(如epo-y)可能会与其他蛋白质和半胱氨酸蛋白酶活性位点中存在的游离硫醇相互作用,尤其是在高μm范围浓度下。此外,它可能与酪氨酸激酶活性位点中的亲核赖氨酸残基发生反应,导致特异性丧失。值得注意的是,唯一报道的另一种去酪氨酸化抑制剂(称为小白菊内酯)过去是通过基于细胞的筛选鉴定的(fonrose等人,cancerres 2007;67(7):3371-8),在体外即使在高浓度下也不能抑制vash(hotta t.等人,curr.biol.,2021,31(4):900-907)。这表明观察到的小白菊内酯在细胞内中的作用不是由vash的直接抑制介导的。
8、因此,需要改进现有的vash抑制剂特异性、效力和生物利用度,以便提供用于治疗涉及改变的微管去酪氨酸化的病症的合适候选物。在本发明中,我们描述了高效的低纳摩尔至皮摩尔的细胞内vash抑制剂作为治疗神经退行性疾病的潜在药物。
技术实现思路
1、利用药物化学生成了化合物库,在理想的预测性体外系统中测量其效果,利用生物信息学建模,了解造成化合物生物活性变化的结构特性。因此,发明人开发了新的vash抑制剂,其与epo-y相比表现出高度增强的体外和/或细胞内活性。
2、因此,本发明涉及下式(i)化合物:
3、
4、或其药学上可接受的盐和/或溶剂化物,
5、其中
6、x是
7、r1是o-c1-c6烷基、o-c2-c6烯基、nr1ar1b或
8、r1a是h或c1-c6烷基、
9、r1b是oh或c1-c6烷基,所述烷基任选被c(o)oh、c(o)o-c1-c6烷基或芳基取代,
10、r是o-r2或nh-s(o)2-r9,
11、r2是h、c1-c6脂族链、芳基、杂芳基或c1-c6烷基-芳基,其中所述脂族链的多至4个亚甲基单元任选被o、c(o)、nh或n-c1-c6烷基替换,所述脂族链、芳基、杂芳基或烷基-芳基任选被取代,
12、r3是oh、o-c1-c6脂族链、o-芳基、o-c1-c6烷基-芳基、o-杂芳基、o-c1-c6烷基-杂芳基或nhoh,其中所述脂族链的多至4个亚甲基单元任选被o、c(o)、nh或n-c1-c6烷基替换,所述脂族链、芳基、杂芳基、烷基-杂芳基或烷基-芳基任选被取代,
13、r4是h或c1-c12脂族链,其中多至4个亚甲基单元任选被o、c(o)、nh或n-c1-c6烷基取代,所述c1-c12脂族链任选被取代,
14、y是–(ch2)m–或
15、r5是oh、o-c1-c6烷基、c2-c6烯基、c2-c6炔基、芳基、杂芳基、o-c1-c6烷基-芳基、o-c1-c6烷基-杂芳基、c(o)oh、c(o)o-c1-c6烷基、c(o)nhoh、c(o)nh2、c(o)nh-c1-c6烷基、c(o)nh-o-c1-c6烷基、nh-c1-c6烷基、n(c1-c6烷基)2、nh-c(o)-c1-c6烷基或nh-s(o)2-r9,所述烷基、烯基、炔基、芳基、杂芳基、烷基-芳基或烷基-杂芳基任选被取代,
16、r6是oh、o-c1-c6脂族链、nh-oh或nh-ch(r7)-(ch2)n-r8,所述脂族链任选被取代,
17、r7是h、c1-c6烷基、c2-c6烯基、c2-c6炔基、芳基、杂芳基、c1-c6烷基-芳基或c1-c6烷基-杂芳基,
18、r8是c(o)nh2、c(o)nh-c1-c6烷基、芳基、杂芳基、sh、nh2或s-c1-c6烷基,m和n是彼此独立的范围为0至6的整数,
19、r9是c1-c6脂族链或芳基,所述脂族链或芳基任选被取代,
20、条件是当x是并且r3是oh时,r1不是o-c1-c6烷基。
21、根据另一方面,本发明涉及药物组合物,其包含至少一种如上定义的式(i)化合物和至少一种药学上可接受的赋形剂。
22、根据另一个方面,本发明还涉及如上定义的式(i)化合物或药物组合物用作药物的用途。
23、本发明还涉及式(i)化合物用作研究工具的用途。
24、根据另一方面,本发明还涉及缀合物,其包含连接至生物分子的式(i)化合物。
25、根据另一方面,本发明涉及如上定义的缀合物用作药物或研究工具的用途。
本文地址:https://www.jishuxx.com/zhuanli/20240830/285654.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表