O-琥珀酰-L-高丝氨酸巯基转移酶突变体及其应用
- 国知局
- 2024-10-09 15:35:07
(一)本发明属于基因工程,具体涉及一种对甲硫醇钠耐受性提升的o-琥珀酰-l-高丝氨酸巯基转移酶突变体及其应用。
背景技术:
0、(二)背景技术
1、l-甲硫氨酸是人体和动物所必须的唯一含硫氨基酸,在医药、食品、饲料等领域具有重要的应用价值,其绿色高效合成受到了广泛关注。目前,l-甲硫氨酸的主流合成方法为化学法,但是过程中使用氢氰酸和甲硫醇等高挥发性有毒底物、反应条件苛刻、三废排放大,其应用越来越受到限制。而构建微生物细胞工厂直接进行发酵生产,由于代谢合成路径复杂,代谢调控困难,目前难以实现工业化。相比之下,发酵-酶催化耦合路线是l-甲硫氨酸合成的重要方法,以葡萄糖为底物,发酵生产前体o-琥珀酰-l-高丝氨酸,进一步在o-琥珀酰-l-高丝氨酸巯基转移酶(metz)作用下与甲硫醇反应生成l-甲硫氨酸,原子经济性高、三废排放少,具有重要应用前景。
2、metz是一种依赖于吡哆醛的磷酸酶折叠ⅰ型,其结构可分为二聚体和四聚体,需要5′-磷酸吡哆醛(plp)作为辅因子。metz是一种具有相似亚基的四聚体蛋白。每个单体都由三个亚区组成,分别是n-末端结构域、plp结合域和c-末端结构域。n-末端结构域具有环状结构,该结构从单体的主体部位突出,形成对邻近单体的夹持。每个单体内的plp结合域上都有一个β-折叠,其中包含活性位点,在该活性位点附近的赖氨酸通过席夫碱键(schiff)与plp辅因子结合,此外该活性部位需要另一个单体的n-末端结构域通过盐桥连接到plp的磷酸基团上。c-末端结构域带有轻微扭曲的反平行β-折叠,与plp结合域结合,有助于形成致密的单体形状。近年来,基于metz结构与功能的构效关系研究,对metz进行改造获得了活力提升的突变体,应用于催化osh和甲硫醇钠合成l-甲硫氨酸中(adv.synth.catal.2023,365,1048-1057)。但是,研究发现,以甲硫醇钠作为巯基供体时,其添加浓度的提高限制了反应速率,而metz在高浓度甲硫醇钠条件下耐受性差是主要原因,因此,开发在高浓度甲硫醇钠条件下耐受性好的metz,以满足发酵-酶法合成l-蛋氨酸的工业需求具有重要意义。
技术实现思路
0、(三)技术实现要素:
1、本发明目的是提供一种对甲硫醇钠耐受性提升的o-琥珀酰-l-高丝氨酸巯基转移酶突变体及其应用,
2、本发明采用的技术方案是:
3、本发明提供一种对甲硫醇钠耐受性提高的o-琥珀酰-l-高丝氨酸巯基转移酶突变体(记为metz-m),所述突变体是将seq id no.1所示来源于紫色杆菌chromobacteriumviolaceum的o-琥珀酰-l-高丝氨酸巯基转移酶氨基酸序列的第59位、第119位进行单突变或多突变获得的。
4、进一步,所述o-琥珀酰-l-高丝氨酸巯基转移酶突变体是将seq id no.1所示氨基酸序列突变为下列之一:(1)第59位的苏氨酸突变为异亮氨酸,其氨基酸序列如seq idno.2所示,记为metz-m1;(2)第119位的苏氨酸突变为酪氨酸,其氨基酸序列如seq id no.3所示,记为metz-m2;(3)第59位的苏氨酸突变为异亮氨酸以及第119位的苏氨酸突变为酪氨酸,其氨基酸序列如seq id no.4所示,记为metz-m3。
5、本发明提供所述o-琥珀酰-l-高丝氨酸巯基转移酶突变体的编码基因,重组质粒及重组基因工程菌,所述重组质粒优选以pet-28b为基础质粒,以大肠杆菌e.coli bl21(de3)为宿主菌。
6、本发明还提供一种所述o-琥珀酰-l-高丝氨酸巯基转移酶突变体在催化甲硫醇钠生产l-甲硫氨酸中的应用,所述的应用为:以含所述o-琥珀酰-l-高丝氨酸巯基转移酶突变体编码基因的工程菌经发酵培养获得的湿菌体或湿菌体超声破碎提取的纯酶液为催化剂,以o-琥珀酰-l-高丝氨酸(osh)和甲硫醇钠为底物,以ph7-9的缓冲液为反应介质构成反应体系,在30℃,800rpm的恒温震荡金属浴中反应,反应液分离纯化,获得l-甲硫氨酸。
7、进一步,所述反应体系中,湿菌体加入量为5-15g/l(优选10g/l);纯酶液加入量以蛋白浓度计为50-150mg/l(优选100mg/l);o-琥珀酰-l-高丝氨酸(osh)加入浓度20-80g/l(优选50g/l);甲硫醇钠体积加入浓度1-15%。
8、进一步,所述反应体系中还含有5′-磷酸吡哆醛(plp),加入终浓度为10-50mm。
9、进一步,所述缓冲液为2m,ph 8.0的tris-hcl缓冲液。
10、进一步,所述催化剂按如下方法制备:
11、(1)将含o-琥珀酰-l-高丝氨酸巯基转移酶突变体编码基因的工程菌接种至含终浓度50μg/ml卡那霉素的lb液体培养基中,在37℃、180r/min培养10-12h,获得种子液;将种子液以体积浓度1%接种量接种至新鲜的含有终浓度50μg/ml卡那霉素的lb培养基中,于37℃、180r/min培养od600至0.6~0.8,再向培养液中加入终浓度为0.1mm的iptg,于28℃下诱导表达12h后,4℃、8000r/min离心10min,弃去上清液,收集湿菌体;
12、(2)将湿菌体用tris-hcl缓冲液(100mm,ph8.0)重悬,采用超声破碎法进行破碎,破碎程序为:破碎时间3s,间隔时间4s,功率40w(注意:菌液应冰浴破碎),破碎结束后,悬浮液呈现透亮的土黄色,将细胞破碎液于4℃,12000rpm离心20min,收集上清液;
13、(3)上清液经过0.22μm滤膜超滤后装载于ni-nta凝胶柱,采用重力法控制流速上样,使用含有300mm nacl,50mm咪唑的ph 8.0、50mm tris-hcl缓冲液洗脱,流速1.0ml/min,对一些杂蛋白以及未结合的蛋白进行洗脱,直至蛋白纯化仪上的紫外检测达平衡;再使用含有300mm nacl,50mm咪唑的ph 8.0、500mm tris-hcl缓冲液洗脱,流速1.0ml/min,收集目的蛋白的洗脱液;将洗脱液装入透析袋(mwco为100000),以纯水为透析液,在4℃冰箱过夜透析,收集截流液,得到纯酶液。
14、与现有技术相比,本发明有益效果主要体现在:
15、(1)本发明通过半理性设计,定点突变技术改造metz,最终获得了在不损失酶活力的情况下对高浓度甲硫醇钠环境下耐受性提高的突变体。本发明的突变体对甲硫醇钠的耐受性大幅提高,由突变前的5%提高到15%,具有很大工业价值。
16、(2)分别在5%,10%,15%的甲硫醇钠下孵育,突变体t59i、t119y、t59i/t119y的半衰期相对于野生型的半衰期提升了300%-360%,其中突变体t59i/t119y半衰期较wt提升最高为360%。突变体t59i、t119y、t59i/t119y在10小时的残余酶活相对与wt提升了190%~210%,其中突变体t59i残余酶活相对与wt提升最高为210%。
17、(3)本发明突变体对底物的转化率显著提高。在10%甲硫醇钠的体系中,wt反应1.5h后转化率不再增加,最高转化率为32%。突变体t59i、t119y反应大概4h后转化率不再增加,其中突变体t59i转化率最高位60%,突变体t119y转化率为52%,对比wt均有提高,有利于生产应用。
18、(四)具体实施方式
19、下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
20、lb液体培养基组成:胰蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,溶于蒸馏水中;lb固体培养基在lb液体培养基中添加20g/l琼脂粉;121℃高压灭菌20min;使用前添加终浓度100μg/ml卡那霉素。
21、实施例1、metz酶活测定
22、1、野生型重组基因工程菌的构建
23、人工合成来源于紫色杆菌chromobacterium violaceum的o-琥珀酰-l-高丝氨酸巯基转移酶(metz,geneid:mk948096.1,氨基酸序列如seq id no.1所示)的编码基因,表达载体为pet-28b,宿主细胞为e.coli bl21(de3),筛选阳性克隆,获得野生型重组基因工程菌e.coli bl21(de3)-pet-28b-metz,记为wt。
24、2、野生型重组工程菌的诱导表达
25、将步骤1构建的野生型重组基因工程菌接种至含终浓度50μg/ml卡那霉素的lb液体培养基中,在37℃、180r/min培养10-12h,获得种子液;将种子液以体积浓度1%接种量接种至新鲜的含有终浓度50μg/ml卡那霉素的lb培养基中,于37℃、180r/min培养od600至0.6~0.8,再向培养液中加入终浓度为0.1mm的iptg,于28℃下诱导表达12h后,4℃、8000r/min离心10min,弃去上清液,取湿菌体并使用tris-hcl缓冲液(100mm,ph8.0)重悬湿菌体使其浓度为0.1g/l,备用。
26、3、野生型重组基因工程菌超声破碎
27、步骤2的菌悬液采用超声破碎法进行破碎。冰浴破碎程序为:破碎时间3s,间隔时间4s,功率40w。破碎结束后,悬浮液呈现透亮的土黄色。最后,将细胞破碎液于4℃,12000rpm离心20min,收集上清液。
28、4、酶分离纯化
29、步骤3的上清液经过0.22μm滤膜超滤后装载于ni-nta凝胶柱,采用重力法控制流速上样,使用含有300mm nacl,50mm咪唑的ph 8.0、50mm tris-hcl缓冲液(hcl调至ph为8.0后过膜超声)进行洗脱,流速1.0ml/min,对一些杂蛋白以及未结合的蛋白进行洗脱,直至蛋白纯化仪上的紫外检测达平衡。再使用含有300mm nacl,50mm咪唑的ph 8.0、500mm tris-hcl缓冲液(hcl调至ph为8.0后过膜超声)洗脱,流速1.0ml/min,收集目的蛋白的洗脱液;将洗脱液装入透析袋(mwco为100000),以纯水为透析液,在4℃冰箱过夜透析,收集截流液,得到纯酶液,经过sds凝胶电泳分析,得到条带正确的、高纯度的纯酶液,留存备用。
30、5、metz酶活性测定
31、(1)标准酶活检测
32、在2ml反应体系中,加入蛋白浓度0.1g/l溶于tris-hcl缓冲液(2m,ph 8.0)的纯酶液metz,在30℃下保温5min,加入终浓度为50g/l osh和1%(v/v)甲硫醇钠,于30℃,800rpm的恒温震荡金属浴中反应5min。反应结束后,取200μl反应液,加入10μl 6m hcl终止反应。催化反应结束后,于12000rpm离心1min,取上清,稀释,经衍生化后通过高效液相色谱(hplc)法测定产物l-甲硫氨酸的生成量,计算初始酶活。
33、(2)plp对酶活的影响
34、步骤(1)同样的条件下,向反应体系中添加终浓度10mm的5′-磷酸吡哆醛(plp),其他操作相同。步骤(1)不添加辅酶plp的野生型纯酶液酶活为71.30u/mg,步骤(2)添加plp的野生型纯酶液酶活为106.02u/mg。
35、(3)甲硫醇钠浓度对酶活的影响
36、步骤(1)中甲硫醇钠的体积加入浓度分别改为1%、5%、10%、15%,于30℃,800rpm的恒温震荡金属浴中反应5min改为30min,其他操作相同。以metz在1%甲硫醇钠体系中的酶活为100%,计算相对酶活,metz在5%甲硫醇钠体系中的酶活为79.3%,在10%甲硫醇钠体系中的酶活为53.3%,在15%甲硫醇钠体系中的酶活为39.7%。
37、酶活力定义:每分钟生成1μmol l-甲硫氨酸所需要的酶量定义为一个酶活力单位(u)。
38、酶比活力(u·mg-1)定义为:每毫克酶蛋白所含的酶活力单位数。
39、酶比活力计算公式为:酶比活力(u·mg-1)=酶活力(u)/蛋白量(mg)。
40、hplc检测方法:
41、衍生化试剂的配置:称取0.27g 4-氯-3,5-二硝基三氟甲苯(cnbf)与10ml乙腈混合,配制成母液,避光保存。
42、硼酸-硼砂缓冲液的配置:按照硼酸终浓度0.2mol/l与硼砂终浓度0.05mol/l,将硼酸和硼砂分别用无菌水溶解后混合,超声溶解。
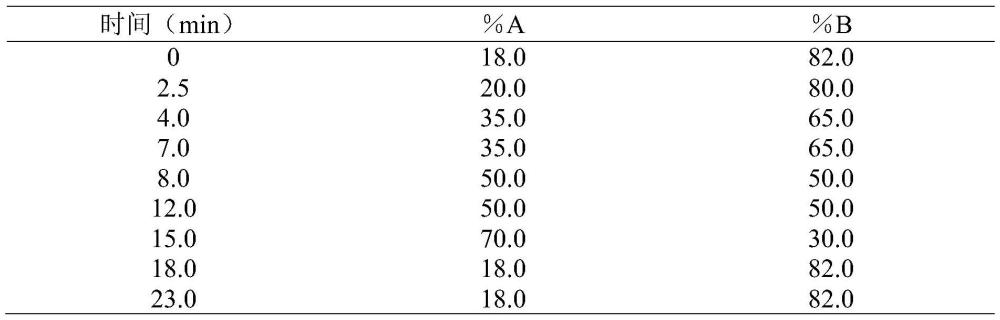
43、样品衍生化:将100μl样品、300μl衍生化试剂与500μl硼酸-硼砂缓冲液混合,在60℃,400rpm的恒温震荡金属浴中避光反应1h,后用0.22μm有机相过滤器过滤。滤液通过hplc分析方法对产物l-甲硫氨酸浓度进行定量分析。流动相的配置:流动相分为两瓶,其中流动相a为纯乙腈,流动相b按照水:乙腈:三乙胺:乙酸=850:150:2:7的比例配置,后过膜超声。色谱柱:welchromc18柱(4.6mm×250mm,5μm);工作温度:30℃。紫外检测波长:260nm;流速:0.8ml/min。洗脱方法:l-甲硫氨酸的检测采用梯度洗脱的方式,具体方法如表1所示。
44、表1hplc检测体系
45、
46、实施例2、metz单点突变体的构建与筛选
47、1.突变位点的选择
48、使用swiss-model工具对野生型metz进行蛋白质模拟建模,并利用pymol和caver软件对该酶的活性中心及底物通道进行预测,结合分子动力学模拟和计算机虚拟筛选,预测并锚定影响对甲硫醇钠耐受性的t59和t119位点,进行定点突变。
49、2.突变体的构建
50、根据metz的核苷酸序列(geneid:mk948096.1),设计突变引物,利用全质粒pcr技术,以重组载体pet28b-metz为模板,对seq id no.1所示metz氨基酸序列引入单点突变,所用引物如表2所示。
51、表2突变体构建的引物设计
52、
53、pcr反应体系:2×phanta max buffer 25μl,正/反向引物2μl,模板dna1μl,加入ddh2o至50μl。
54、pcr扩增条件为:98℃5min;(98℃30s,60℃30s,72℃2000bp/min);35循环;72℃,10min。
55、向pcr产物中加入dpni酶0.5μl、duffer1μl,37℃1h、70℃15min。取10μl的pcr产物,加入100μl冰浴的e.coli bl21(de3)感受态细胞悬液中,冰上静置30min后立即42℃热激90s,冰浴2~5min后加入lb培养基600μl,37℃复苏1h,4000r/min离心1min,弃掉部分上清,将剩余的菌液悬浮后涂lb平板(含卡那霉素,终浓度50μg/ml),37℃倒置培养12h。
56、3.重组工程菌的诱导表达
57、从平板上挑取单克隆于5ml含终浓度50μg/ml卡那霉素lb试管中,于37℃,180rpm培养12h。按照2%(v/v)接种量转接至100ml含终浓度50μg/ml卡那霉素lb液体培养基中,于37℃、180rpm培养2~3h(od600=0.6~0.8),加入iptg(终浓度为0.1mm),于28℃,180rpm诱导培养12h。培养结束后,于4℃,8000rpm离心10min,弃上清,收集湿菌体。
58、3.突变体的筛选
59、在tris-hcl缓冲液(2m,ph 8.0)中按照10g/l的量加入湿菌体,在30℃下保温5min,再加入终浓度50g/l osh和1%(v/v)甲硫醇钠构成2ml反应体系,于30℃,800rpm的恒温震荡金属浴中反应5min。反应结束后,采用实施例1方法测定产物l-甲硫氨酸的生成量,以metz在1%甲硫醇钠体系中的酶活为100%,计算相对酶活。
60、同样条件下,将甲硫醇钠体积浓度改为5%、10%、15%,其他操作相同,相对酶活见表3,t59i和t119y在不同浓度甲硫醇钠中进行孵育后,其残留酶活均有显著提高。
61、表3metz及其突变体对甲硫醇钠耐受性
62、
63、实施例3、饱和突变体的构建与筛选
64、根据实施例2构建的单突变体序列设计定点饱和突变的突变引物,利用全质粒pcr技术,以重组载体pet28b/metz为模板,对metz氨基酸序列的59位和119位进行饱和突变。引物序列如表4所示。
65、表4metz 59和119位点的饱和突变引物设计
66、
67、n代表a/t/g/c,k代表g/t。
68、采用实施例2方法构建突变体并进行诱导表达和筛选,结果如表5所示。
69、表5metz 59和119位点饱和突变体对不同浓度甲硫醇钠耐受性的筛选结果
70、
71、实施例4、组合突变体的构建与筛选
72、根据实施例2构建的单突变体序列设计组合突变,利用全质粒pcr技术,以重组载体pet28b/metz为模板,对metz氨基酸序列的59、119位进行组合突变。
73、采用实施例2方法构建突变体并进行诱导表达和筛选,结果如表6所示。
74、表6metz t59i/t119y组合突变体对不同浓度甲硫醇钠的耐受性
75、
76、经过检测,突变体t59i/t119y相比wt耐受性有进一步的提升。
77、实施例5、metz及其突变体对甲硫醇钠耐受性的测定
78、采用实施例1方法分别制备得到wt及其突变体t59i、t119y、t59i/t119y的湿菌体,采用实施例1方法检测湿菌体在10%的甲硫醇钠条件下的酶活。
79、结果表明,突变体t59i、t119y、t59i/t119y的半衰期相对于wt的提升了300%~360%,其中突变体t59i/t119y半衰期较wt提升最高为360%。突变体t59i、t119y、t59i/t119y在10小时的残余酶活相对与wt提升了190%~210%,其中突变体t59i残余酶活相对与wt提升最高为210%,说明突变体对甲硫醇钠的耐受性明显提高。
80、实施例6、metz及其突变体对转化率的测定
81、采用实施例1方法分别制备得到wt及其突变体t59i、t119y和t59i/t119y的湿菌体,用于底物转化。
82、在10ml反应体系中,加入10g/l溶于tris-hcl缓冲液(2m,ph 8.0)中的上述湿菌体,在30℃下保温5min后,一次性投入终浓度为60g/l osh、10.0%(v/v)甲硫醇钠以及50mmplp,在30℃,800rpm恒温震荡金属浴中持续反应。前3h,每隔30min取一次样,之后每隔1h取一次样,至8h结束。通过氨基酸分析仪测定底物osh的残余量,计算转化率。
83、wt反应1.5h后转化率不再增加,最高转化率为32%。突变体t59i、t119y反应大概4h后转化率不再增加,其中突变体t59i转化率最高位60%,突变体t119y转化率为52%,突变体t59i/t119y转化率最高达64%,对比wt均有提高,有利于生产应用。
本文地址:https://www.jishuxx.com/zhuanli/20241009/309260.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
上一篇
紫山药白酒及其制备方法
下一篇
返回列表