一种胰蛋白酶亲和材料及其制备方法与应用
- 国知局
- 2024-11-06 15:01:44
本发明涉及胰蛋白酶分离纯化,具体涉及一种胰蛋白酶亲和材料及其制备方法与应用。
背景技术:
1、胰蛋白酶是一种相对分子量约为24kda的丝氨酸蛋白水解酶,对精氨酸和赖氨酸残基羧基侧的肽键具有特异性水解作用。胰蛋白酶有两个大小几乎相等的结构域,每个结构域包含一组六条反向平行的多肽链,通过氢键形成β-折叠。his-57、asp-102和ser-195是胰蛋白酶的三个催化活性位点。作为一种特异性很强的蛋白酶,胰蛋白酶在食品、医药、纺织、皮革、洗涤剂和现代生物技术等领域具有广泛的应用。在食品加工方面,胰蛋白酶可提高蛋黄的乳化性能,增强蛋清蛋白的发泡能力,改善蛋清蛋白的加工性能,赋予食物均匀细腻的味道以及出色的质地特性。胰蛋白酶可用于去除鱼皮,或从鱼皮中提取明胶。胰蛋白酶在纺织工业中主要用于丝绸脱胶,改善蚕丝的表面性能。在制革加工中,胰蛋白酶主要用于皮革脱灰软化,去除非胶原蛋白和松散胶原纤维,使皮革更柔软、皮面更光滑富弹性。胰蛋白酶还可用作洗涤剂,去除织物污渍。在医药方面,胰蛋白酶可用于治疗胃肠道疾病、胰腺炎和营养不良等疾病。在现代生物技术方面,胰蛋白酶用于蛋白质消化、培养细胞和组织解离等。
2、胰蛋白酶主要来源于猪、牛或羊的胰脏,经分离纯化所得。胰脏中蛋白酶种类丰富,其中,糜蛋白酶原和弹性蛋白酶原与胰蛋白酶原的理化性质相近,采用传统分离方法难以将其分离开来。传统的蛋白酶分离纯化方法包括盐析沉淀法、等电点沉淀法、有机溶剂沉淀法、变性沉淀分离、离子交换层析、凝胶过滤等多种操作步骤。其中盐析沉淀法虽然作用条件温和,但沉淀物中含有大量的盐析剂,后续还需进行脱盐操作。等电点沉淀法操作简单,但是容易出现沉淀不完全的现象,而且分辨力差,一般只能用于蛋白的初步纯化。有机溶剂沉淀法在操作过程中容易破坏蛋白质的氢键而引起变性失活。变性沉淀分离方法结果不易控制且易使酶失活。离子交换层析需要与其他的纯化步骤结合操作,并且需要经常进行离子再生。凝胶过滤法虽然操作方便、不易影响蛋白活性,但也存在分辨率不高,分离操作较慢等不足之处。这些传统分离纯化蛋白酶的方法存在操作繁琐、耗时长、纯化效果差、得率低等一系列问题。因此,开发一种可以克服现有技术缺陷的能够高效纯化胰蛋白酶的方法是非常必要的。
技术实现思路
1、本发明提供了一种胰蛋白酶亲和材料及其制备方法与应用,有效解决了传统的分离纯化蛋白酶的方法存在操作繁琐、耗时长、纯化效果差、得率低等一系列技术问题,同时提供了一种使用方便、稳定性好、高容量的胰蛋白酶亲和吸附剂,从而实现了对胰蛋白酶的高效纯化。
2、本发明提供了一种胰蛋白酶亲和材料的制备方法,其特征在于,包括以下步骤:
3、制备聚多巴胺修饰的磁性fe3o4纳米粒子;
4、将n个荞麦胰蛋白酶抑制剂bti串联,得到nbti,所述bti的编码基因序列如seq idno.1所示;
5、以聚多巴胺修饰的磁性fe3o4纳米粒子为载体,加入所述nbti的配体溶液,于35~40℃搅拌,干燥,得到胰蛋白酶亲和材料。
6、作为一种优选的实施方式,所述n为2或3。
7、作为一种优选的实施方式,将所述nbti加入20mm ph=8的na2hpo4-kh2po4缓冲液,得到浓度为0.2mg/ml的nbti的配体溶液。
8、作为一种优选的实施方式,所述聚多巴胺修饰的磁性fe3o4纳米粒子与nbti配体的用量比为1g:8~30ml。
9、作为一种优选的实施方式,所述搅拌的时间为10min~4h。
10、作为一种优选的实施方式,所述聚多巴胺修饰的磁性fe3o4纳米粒子的制备方法为:取fe3o4磁性粒子于去离子水中超声20min,加入盐酸多巴胺,采用naoh溶液调节ph至8.5,于37℃搅拌,洗涤,真空冷冻干燥即得。
11、作为一种优选的实施方式,搅拌完成后,得到粗产物,分别用20mm ph=8的tris-hcl缓冲液和去离子水清洗所述粗产物,得到纯化产物。
12、本发明的第二个目的是提供一种上述制备方法制备得到的胰蛋白酶亲和材料。
13、本发明的第三个目的是提供一种上述胰蛋白酶亲和材料在分离纯化胰蛋白酶中的应用,其特征在于,所述应用具体为:将胰蛋白酶亲和材料与100μl1.5mg/ml提取的猪胰蛋白酶粗品混匀,于37℃,150~200rpm反应30min后,舍弃上清液,采用20mm ph=7.3的tris-hcl缓冲溶液冲洗样品3~5次,再采用体积百分比为3%的醋酸溶液洗脱,洗脱液即纯化样品。
14、作为一种优选的实施方式,所述提取的猪胰蛋白酶粗品的浓度为1.5mg/ml,所述胰蛋白酶亲和材料与提取的猪胰蛋白酶粗品的用量比为1g:1~12ml。
15、与现有技术相比,本发明的有益效果在于:
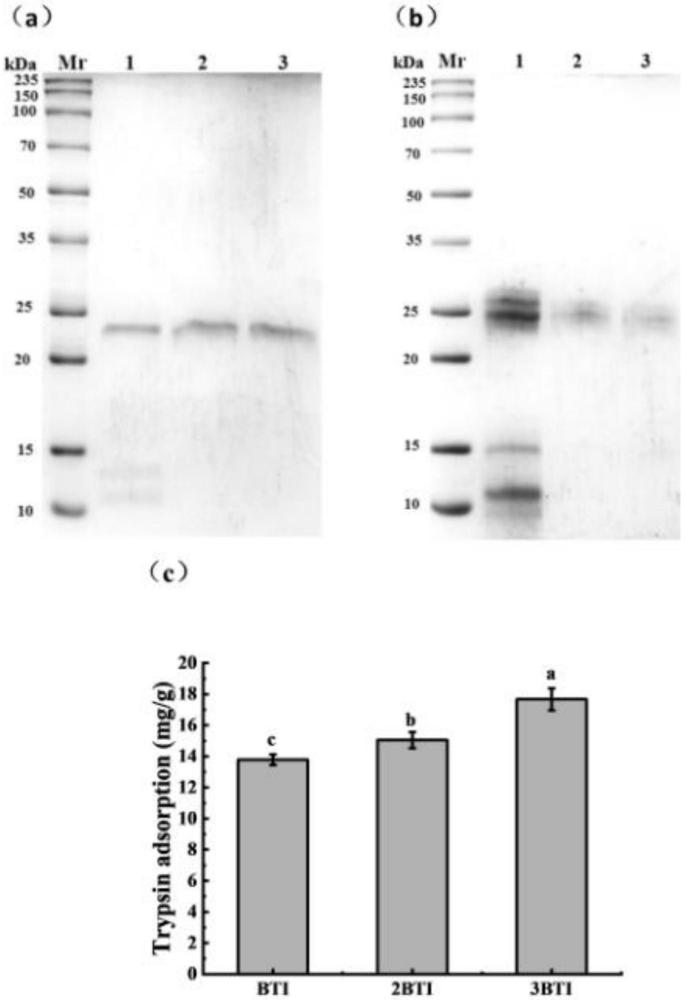
16、(1)本发明提供了一种胰蛋白酶亲和材料及其制备方法与应用,为了提高亲和材料对胰蛋白酶的纯化效果,本发明对配体bti进行优化,构建了串联2bti和3bti蛋白。以串联蛋白为新的配体,fe3o4@pda为载体材料,制备了两种新的亲和材料:fe3o4@pda@2bti和fe3o4@pda@3bti。通过pcr扩增,获得2bti和3bti产物,利用得到的pcr产物构建重组质粒pqe30-2bti和pqe30-3bti。对pqe30-2bti和pqe30-3bti诱导表达,结果显示重组蛋白均实现可溶性表达。使用ni2+柱亲和层析纯化和sephadex g-25柱脱盐,获得实验所需的2bti和3bti纯化蛋白。同样,2bti和3bti均固定化成功,并且确定最佳固定化条件:质量体积比为3.3%、2bti和3bti分别固定化4h和2h。此时,2bti和3bti的蛋白固载量分别为1.72±0.01mg/g和1.73±0.08mg/g。
17、(2)本发明对胰蛋白酶亲和材料的稳定性进行研究,两种亲和材料fe3o4@pda@2bti和fe3o4@pda@3bti均具备良好的ph稳定性、热稳定性和储存稳定性,固定化之后,各方面性能都有所提高。尤其是在重复使用性方面,fe3o4@pda@2bti和fe3o4@pda@3bti在重复使用10个循环之后,对胰蛋白酶的吸附率分别保留了75.66±0.76%和79.09±2.12%,并且分别比fe3o4@pda@bti高出30.31%和33.74%。与fe3o4@pda@bti相比,以串联配体制备的亲和材料重复使用性更好。fe3o4@pda@2bti和fe3o4@pda@3bti具备很强的有机溶剂耐受性。经50%乙醇和dmso处理1h后,fe3o4@pda@2bti分别保留102.06±1.34%和110.59±0.68%的剩余抑制率,fe3o4@pda@3bti分别保留108.23±1.66%和112.85±2.73%的剩余抑制率。8mol/l尿素作用1h后,fe3o4@pda@2bti和fe3o4@pda@3bti分别保留92.82±3.30%和100.32±2.50%的剩余抑制率。10%sds作用1h后,分别保留108.26±1.26%和106.82±3.63%的剩余抑制率。在高浓度盐溶液中仍保留较高的抑制活性,稳定性良好,其中kcl显著提高了fe3o4@pda@2bti和fe3o4@pda@3bti的抑制活性。在低浓度盐溶液中,100mmol/l的alcl3作用1h后,两种亲和材料的抑制活性出现下降,分别保留了62.32±2.44%和60.16±3.10%的剩余抑制率。
18、(3)在本发明的亲和材料对猪胰蛋白酶的纯化研究中,研究发现在更加复杂的混合蛋白体系中,两种亲和材料均能将猪胰蛋白酶纯化出来。fe3o4@pda@2bti和fe3o4@pda@3bti对胰蛋白酶的最大吸附量分别为15.05±0.52mg酶/g亲和材料和17.67±0.71mg酶/g亲和材料。与fe3o4@pda@bti相比,fe3o4@pda@2bti和fe3o4@pda@3bti对胰蛋白酶吸附量逐渐显著增大。本研究制备的亲和材料使用方便、稳定性好、能够高容量纯化胰蛋白酶,可通过高效纯化获得高纯度的胰蛋白酶。
本文地址:https://www.jishuxx.com/zhuanli/20241106/325013.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表