一种结合ELISA和SERS的Myo抗原检测方法
- 国知局
- 2024-11-18 18:24:20
本发明涉及生物检测,具体涉及一种结合酶联免疫吸附试验(elisa)和表面增强拉曼散射(sers)的心肌梗死标志物myo抗原检测方法。
背景技术:
1、免疫诊断包括放射免疫、酶联免疫、化学发光等。其中酶联免疫测定具有成本低、可大规模操作等特点,且酶联免疫吸附试验(elisa)是应用最广的技术,具有快速、敏感、简便、易于标准化等优点,已被广泛应用于多种细菌和病毒等疾病的诊断。
2、表面增强拉曼光谱是利用金属纳米结构对拉曼散射信号的增强效应的光谱技术。自1974年fleischmann等发现吸附在粗糙银电极表面上的吡啶分子拉曼信号有很大程度的提高以来,sers技术迅速得到发展,逐渐成为表面科学和电化学领域有力的研究手段。sers技术在许多领域具有广泛的应用,包括生物医学、环境监测、食品安全等,具有高灵敏度、高选择性和非破坏性等优点。
3、急性心肌梗死(ami)是最直接危及生命的急性冠状动脉综合征之一,所引起的心脏不适最为严重。目前,肌酸激酶同工酶(ck-mb)、肌红蛋白(myo)、肌钙蛋白t、肌钙蛋白i是具有价值的ami诊断生物标志物,其中myo是公认较好的早期心肌损伤标志物,在发病1-3h即可出现异常增高,出现最早,具有高度的敏感性。现已有比色法、荧光法、电化学法、电化学法和电化学法检测myo。这些方法为获得生物活性分子的定性和定量信息提供了有利条件,但缺乏高特异性的分子识别能力。
4、因此,需要开发一种更快速便捷、高灵敏度和特异性的myo抗原检测手段。
技术实现思路
1、本发明的目的在于克服现有技术存在的缺陷,提供一种结合elisa和sers的myo抗原检测方法。通过elisa提供高灵敏度的免疫反应和定量分析,通过sers提供高特异性的分子识别能力;利用双抗夹心结构中作为标记抗体上的拉曼信号分子的拉曼信号值来判断样品中是否含有myo抗原,利用便携式拉曼光谱仪,即可实现对急性心肌梗死标志物myo的抗原快速检测。
2、为了实现以上目的,本发明的技术方案之一为:一种结合elisa和sers的myo抗原检测方法,具体包括如下步骤:
3、s1:制备金纳米粒子;
4、s2:制备拉曼信号金纳米粒子:将步骤s1制备的金纳米粒子稀释后与拉曼信号分子溶液进行混合,获得拉曼信号金纳米粒子;
5、s3:制备免疫信号金纳米粒子:将步骤s1制备的拉曼信号金纳米粒子与肌梗死标志物myo抗体进行混合,并封闭活性位点,获得免疫信号金纳米粒子;
6、s4:制备包被抗体的微量滴定板:将myo抗体加入elisa微量滴定板进行孵育,并封闭未被占据的空隙,获得包被抗体的微量滴定板;
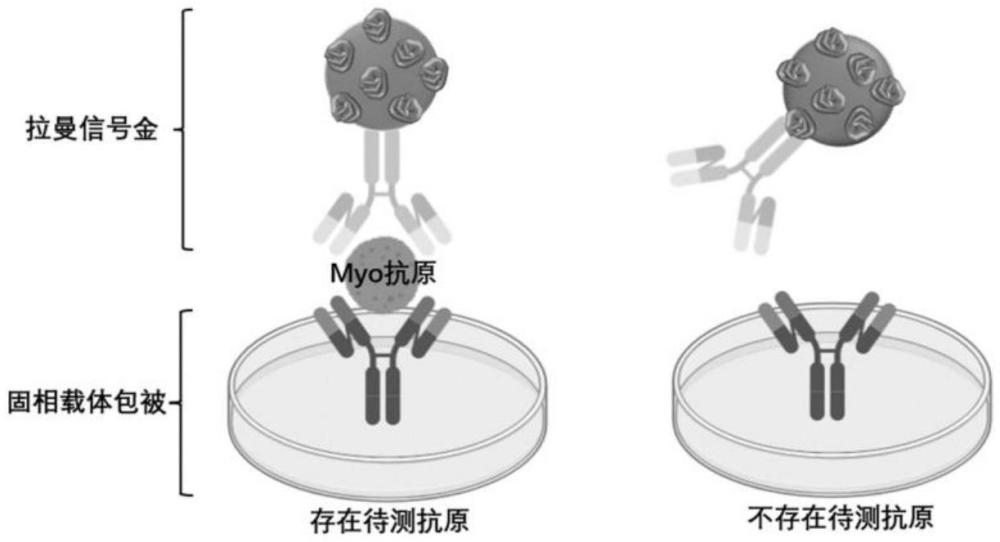
7、s5:双抗夹心结构的制备:将待测样品、步骤s3制得的免疫信号金纳米粒子分别加入步骤s4制得的包被抗体的微量滴定板中一起混合、孵育、清洗,获得双抗夹心结构;
8、s6:myo抗原的检测:将步骤s5获得的双抗夹心结构进行拉曼检测,得到myo抗原的拉曼光谱结果;通过拉曼信号值定性识别myo抗原,拉曼信号值≤200cps,myo抗原为空白;拉曼信号值>200cps,myo抗原为阳性。
9、elisa微量滴定板可通过直接吸附来修饰特异性识别myo抗原的抗体,免疫信号金纳米粒子具备拉曼信号表达和标记抗体的修饰。
10、在本发明的一个优选实施方案中,所述步骤s1中金纳米粒子制备方法:取150-250ml质量分数为0.005-0.015wt%的氯金酸溶液在磁力搅拌下加热至沸腾,然后取1-4ml质量分数为0.5-1.5wt%的柠檬酸钠溶液,加入沸腾的氯金酸溶液中,待沸腾20-30min反应结束,冷却至室温,制得金纳米粒子。
11、在本发明的一个优选实施方案中,所述步骤s1中金纳米粒子的粒径为30-55nm,紫外吸收波长为526nm。
12、在本发明的一个优选实施方案中,所述步骤s2中拉曼信号金纳米粒子的制备方法如下:将金纳米粒子用去离子水稀释80-120倍,所得金纳米粒子溶液与拉曼信号分子溶液按照体积比为80-120:1进行混合,用缓冲液清洗后再重新分散于缓冲液中,制得拉曼信号金纳米粒子。
13、进一步优选的,所述拉曼信号分子包括但不限于ir808。
14、在本发明的一个优选实施方案中,所述步骤s3中免疫信号金纳米粒子的制备方法如下:在拉曼信号金粒子中分别加入20-50ul 4-6mm edc和20-30ul 4-6mm nhs,活化40-80min,再加入20ug-50ug myo抗体,在2-6℃孵育过夜,离心后加入封闭液,在室温下反应0.5-1.5h封闭剩余活性位点,离心后再次分散在封闭液中,制得所述的免疫信号金纳米粒子。
15、进一步优选的,所述拉曼信号分子溶液浓度为0.01-100mm,缓冲液包括但不限于1-100mm ph5.5-8的柠檬酸-柠檬酸钠缓冲液(cpbs),硼酸-硼砂缓冲液(bb),柠檬酸-硼砂缓冲液(cbs)等。
16、在本发明的一个优选实施方案中,所述步骤s4中包被抗体的微量滴定板的制备方法如下:将纯化后的抗体用ph 5.5-8的pb稀释,滴入微量滴定板中,每孔抗体量为100-600ng,37℃孵育2h,pbs清洗一次,所述pbs溶液包括0.1-0.3m磷酸氢二钠、0.1-0.3m磷酸二氢钠和140-160mm pb,加入封闭液在30-40℃封闭1-3h,封闭滴定板未被占据的空隙。
17、进一步优选的,所述封闭液包括1-20wt%bsa、1-200mm ph 5.5-8的pb溶液、15-100mm无机氯盐和1-10wt%表面活性剂。
18、更进一步优选的,所述表面活性剂包括但不限于tw-20、tw-60、tw-80、chaps、triton-x100,所述无机氯盐包括但不限于nacl、kcl、mgcl2。
19、在本发明的一个优选实施方案中,所述步骤s5双抗夹心结构制备方法如下:将待测样品、步骤s3制得的免疫信号金纳米粒子分别加入步骤s4制得的包被抗体的微量滴定板中一起混合、在30-50℃孵育3-7min,吸走滴定板内的溶液,使用pbs-t清洗,获得双抗夹心结构;所述pbs-t溶液为pbs溶液和tw-20的混合溶液,所述pbs-t溶液中tw-20的质量分数为1-10wt%。
20、在本发明的一个优选实施方案中,所述步骤s5中在elisa微量滴定板中获得双抗夹心结构,经pbs-t清洗之后,在板子底部铺上铝箔进行sers检测。
21、在本发明的一个优选实施方案中,所述步骤s6中拉曼光谱仪为便携式拉曼光谱仪或其他类型拉曼光谱仪,激发波长优选为785nm。
22、与现有技术相比,本发明具有如下有益效果:
23、1、本发明构建了一种双模式检测平台:其中elisa提供高灵敏度的免疫反应和定量分析,而sers提供高特异性的分子识别能力,使得本发明兼顾快速便捷、高灵敏度和高特异性,可以达到指纹识别;
24、2、本发明以myo抗体作为特异性识别元件,特异性识别myo抗原,与核酸检测相比,抗体血清学检测的血液标本更易获得且标本质量有保证,操作简单便捷,且本发明筛选的包被-标记抗体对也能在很大程度上提高检测的准确性;
25、3、本发明相比于单一sers检测方法,捕获抗体的修饰更加简单,直接通过物理吸附使抗体包被在elisa微量滴定板上,无需衬底的制作,操作更加简单。
本文地址:https://www.jishuxx.com/zhuanli/20241118/328614.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。