用于基于PSA糖基化来管理前列腺癌的方法与流程
- 国知局
- 2024-11-21 12:28:49
背景技术:
1、2020年,全球有超过140万患者被诊断患有前列腺癌(pca)(sung等人,ca cancerj.clin.71:209-249,2021)。血清中前列腺特异性抗原(psa)浓度用作pca的早期检测和预测方法;然而,该测试表现出低敏感性、特异性,且预测值差(wolf等人,ca-cancerj.clin.60:70-98,2010)。初步研究表明,psa的糖基化可以为更具体的pca诊断提供有希望的线索。最近,莱顿大学医学中心的蛋白质组学和代谢组学中心(cpm)建立了高性能psa糖组学测定(pga),其允许进行详细的糖基化分析,包括区分α2,6唾液酸化异构体与α2,3唾液酸化异构体(图1;kammeijer等人,anal.chem.90:4414-4421,2018)。那些异构体也被暗示为侵袭型癌症的潜在生物标志物(schultz等人,cancer metastasis rev.31:501-518,2012)。pga包括psa亲和纯化步骤,然后进行胰蛋白酶消化和通过毛细管电泳-电喷雾电离(ce-esi)进行的质谱法(ms)分析(kammeijer等人,anal.chem.90:4414-4421,2018),
2、使用psa作为生物标志物有严重的缺点:首先,psa不是pca特异性生物标志物,因为其体液水平(通常是血液)不能有效地区分pca与其他前列腺疾病,诸如良性前列腺增生(bph)或前列腺炎(hudson等人,jurol.151:1291–1291,1989)。此外,psa血清水平受如年龄、合并症、射精、导尿和药物的多种因素的影响(hatekeyama等人,int j clin oncol,22:214-221,2017)。pca与前列腺良性疾病之间的psa区分在2ng/ml至10ng/ml范围的所谓“灰色区域”中(barry,m.j.,n engl j med.360(13):1351-4,2009)以及在惰性pca与侵袭性pca之间的区别中尤其低效(lamy等人,eur urol focus.4(6):790-803,2018)。
3、用psa筛查pca已经引起晚期疾病和疾病特异性死亡率的降低。然而,代价是对即使不及时治疗也不会在男性的一生中造成临床后果的病例的过度诊断。过度诊断又已经导致过度治疗,存在重大风险,如来自活检的副作用或治疗的负面后果(loeb等人,eur urol,65(6):1046–1055,2014)。根据www.uspreventiveservicestaskforce.org(finalrecommendation statement:screening for prostate cancer and final evidencereview:screening for prostate cancer.u.s.preventive services task force.2018年5月。www.uspreventiveservicestaskforce.org),20%至50%的确诊男性患有惰性、非威胁性形式的pca。这些数据清楚地表明了过度诊断的主要问题,以及改进的、更具体的pca诊断和癌症侵袭性评定工具的需要。
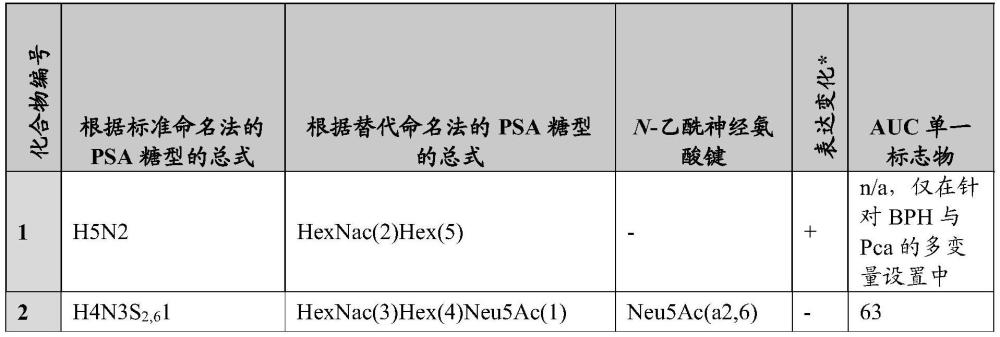
4、psa的单个n-连接糖基化位点(n69)被非常异质的聚糖组占据,从而产生具有相同蛋白质骨架的各种所谓的糖型。先前的研究推测,psa糖型的详细分析可以提供更有效的pca诊断(vermassen等人(同上);jankovic等人,clin.biochem.38:58-65,2005;peracaula等人,glycobiology.13:457-470,2003);saldova等人glycobiology.21:195-205,2011)。对psa糖基化分子特征(诸如触角修饰和核心岩藻糖基化)的后续研究也表明,通过将传统psa测试与特定n-聚糖特征相结合改进了pca诊断(kyselova等人j.proteome res.6:1822-1832,2007;vermassen等人electrophoresis.35:1017-1024,2014;yoneyama等人,biochem.biophys.res.commun.448:390-396,2014),然而测试队列的规模有限,并且仍然非常需要鉴定新的二醇结构。此外,需要鉴定用于评定pca侵袭性的生物标志物。
5、目前使用基于凝集素或质谱法的方法进行psa糖型检测(llop等人,theranostics.6(8):1190-204,2016;kuzmanov等人,bmc med.11:31,2013)。凝集素应用的局限性是仅对糖残基有反应性,而不对蛋白质骨架有反应性。此外,凝集素分辨相关聚糖结构的特异性较低,其反应性主要基于高亲和力(avidity)而不是亲和力(affinity)。另一方面,基于质谱法需要更多的纯化步骤,尤其是在复杂基质(例如血清或血浆)的情况下。
技术实现思路
1、本发明人已经证明,从前列腺细胞分泌到生物学流体(诸如血液和尿液)中的前列腺特异性抗原(psa)被不同程度地糖基化,并且令人惊讶地发现,特定psa糖型的水平增加,而患有侵袭性形式的pca的受试者中的其他psa糖型的水平降低。本发明依赖于一种或多种特定psa糖型水平的这些变化来检测受试者是否患有或是否可能患有侵袭性形式的pca。因此,本发明的方法可以用于确定患有或疑似患有前列腺疾病(其可以为任何形式的pca或非癌性前列腺疾患,诸如前列腺炎或bph)的受试者是否可能患有惰性疾病或侵袭性pca。然后,该表征可以用于为下一次治疗或分析干预提供信息。例如,可以选择确定可能患有侵袭性pca的个体进行活检和/或治疗性治疗。可以选择确定可能未患有侵袭性pca的个体进行“观察等待”,即定期监测但不进行(直接)干预。
2、根据本发明的第一方面,提供了一种辅助确定受试者是否患有侵袭性形式的前列腺癌的方法,该方法包括:
3、(a)确定来自受试者的生物流体样品中至少一种单触角psa糖型的水平和至少一种双触角psa糖型的水平;
4、(b)使用(a)中确定的水平来计算针对受试者的侵袭性得分;
5、(c)将(b)中受试者的侵袭性得分与针对所述侵袭性得分的参考值进行比较;以及
6、(d)使用(c)中的比较来辅助确定受试者是否患有侵袭性形式的前列腺癌。
7、根据本发明的第二方面,提供了一种用于确定受试者是否患有侵袭性形式的前列腺癌的方法,该方法包括:
8、(i)从来自受试者的生物流体样品中的其他蛋白质中分离psa蛋白;
9、(ii)用蛋白酶处理经分离的psa蛋白;
10、(iii)确定样品中两种或更多种n69糖肽形式中的每一者的水平,其中n69糖肽形式中的至少一者为单触角糖型并且n69糖肽形式中的至少一者为双触角糖型;
11、(iv)使用(iii)中的每种n69糖肽形式的水平来确定针对受试者的侵袭性得分;
12、(v)将(iv)中的侵袭性得分与针对所述侵袭性得分的参考值进行比较;以及
13、(vi)基于步骤(v)中的比较确定受试者是否患有侵袭性形式的pca。
14、在特定的实施例中,步骤(iii)中确定的水平是归一化水平。在特定的实施例中,使用对psa蛋白具有特异性的结合蛋白(诸如抗体)从来自受试者的生物流体样品中分离psa蛋白。
15、在特定的实施例中,psa糖型的水平对应于psa糖型(例如,n69糖肽)相对于所有测量的psa糖型(例如,表1a中所示的所有糖型)的量的总和的归一化量。
16、在特定的实施例中,psa糖型的水平对应于与psa糖型(例如,n69糖肽)的量相关的归一化信号(例如,曲线下面积),其被归一化至所有测量的psa糖型(例如,表1a所示的所有糖型)的信号。在特定的实施例中,使用对psa蛋白具有特异性的结合蛋白(诸如抗体)将psa蛋白与生物流体样品中的其他组分(诸如其他抗体)分离/分开。
17、应当理解,经分离的psa蛋白可以含有多种不同的蛋白聚糖物种(psa糖型)。蛋白酶用于将psa蛋白消化成较小的肽形式,使得各种蛋白聚糖物种与较小的肽附接。合适的蛋白酶是胰蛋白酶,其将产生n69k二肽蛋白聚糖群体。另一种合适的蛋白酶是arg-c(梭菌蛋白酶),其将生成n69ksvillgr(seq id no:3)蛋白聚糖群体。
18、在特定的实施例中,针对本发明的第一方面确定侵袭性得分。在特定的实施例中,针对本发明的第一方面确定参考侵袭性得分。
19、本发明的第一和第二方面涉及至少两种psa糖型的水平的测量。然而,从表6可以看出,三种psa糖型(化合物21、2和9)的水平分别能够比游离psa更好地区别侵袭性pca与惰性pca和bph(接受者操作特征(roc)分析中较高的曲线下面积(auc))。因此,这三种psa糖型中每一者的水平可以单独用于辅助确定受试者是否患有侵袭性pca的方法中。
20、因此,根据本发明的第三方面,提供了一种辅助确定受试者是否患有侵袭性形式的前列腺癌的方法,该方法包括:
21、(a)确定选自由以下项组成的组的psa糖型的水平:来自受试者的生物流体样品中的h4n5f1s2,31s2,61;h4n3s2,61;和h5n4f1s261;
22、(b)将(a)中针对psa糖型水平的值与针对所述psa糖型的参考值进行比较;或者将考虑(a)中所述psa糖型水平的侵袭性得分与针对所述侵袭性得分的参考值进行比较;以及
23、(c)使用(b)中的比较来辅助确定受试者是否患有侵袭性形式的前列腺癌。
24、根据本发明的第四方面,提供了一种辅助确定受试者是否患有侵袭性形式的前列腺癌的计算机实现方法,该方法包括以下步骤:
25、(a)接收针对受试者的生物流体样品中的第一单触角psa糖型的水平的值;
26、(b)接收针对受试者的生物流体样品中的第一双触角psa糖型的水平的值;
27、(c)基于(a)和(b)中接收的水平来计算针对受试者的侵袭性得分;
28、(d)将(c)中的受试者的侵袭性得分与所述侵袭性得分的参考值进行比较;以及
29、(e)使用(d)中的比较来辅助确定受试者是否患有侵袭性形式的前列腺癌。
30、在特定的实施例中,步骤(a)的第一单触角psa糖型选自化合物2、3、4或5(如表1a和1b中所示)。
31、在特定的实施例中,步骤(b)的第一双触角psa糖型选自化合物7、9、10、11、13、16、18、21、24或25(如表1a和1b中所示)。
32、在特定的实施例中,步骤(c)中的侵袭性得分是通过步骤(a)和(b)中接收的水平的组合来计算的。在特定的实施例中,步骤(c)中的侵袭性得分是通过将步骤(a)和(b)中接收的水平导入等式(例如,加权计算矩阵、比率等)来计算的。
33、(a)和(b)中接收的值可以从本发明第一方面中确定的psa糖型获得。适合于本发明的第一方面的实施例可以在适当时应用于本发明的该第四方面。
34、根据本发明的第五方面,提供了一种用于辅助确定受试者是否患有侵袭性形式的pca的计算机实现方法,该方法包括以下步骤:
35、(a)接收受试者的生物流体样品中的针对选自由以下项组成的组的psa糖型的水平的值:h4n5f1s2,31s2,61;h4n3s2,61;和h5n4f1s2,61;
36、(b)将(a)中接收的针对psa糖型水平的值与针对所述psa糖型的参考值进行比较;或者将考虑(a)中接收的psa糖型水平的侵袭性得分与针对所述侵袭性得分的参考值进行比较;以及
37、(c)使用(b)中的比较来辅助确定受试者是否患有侵袭性形式的前列腺癌。
38、在本发明的第五方面的特定的实施例中,提供了一种辅助确定受试者是否患有侵袭性形式的前列腺癌的计算机实现方法,该方法包括以下步骤:
39、(a)接收受试者的生物流体样品中的针对选自由以下项组成的组的psa糖型的水平的值:h4n5f1s2,31s2,61;h4n3s2,61;和h5n4f1s2,61;
40、(b)将(a)中接收的针对psa糖型水平的值与针对所述psa糖型的参考值进行比较;以及
41、(c)使用(b)中的比较来辅助确定受试者是否患有侵袭性形式的前列腺癌。
42、(a)中接收的值可以从本发明的第三方面中确定的psa糖型获得。适合于本发明的第三方面的实施例可以在适当时应用于本发明的该第五方面。
43、合适地,用于在根据本发明的第一、第二、第四和第五方面的方法中使用的单触角psa糖型选自化合物2、3、4和5中的一者或多者,如表1a和1b中所鉴定的。
44、合适地,用于在根据本发明的第一、第二、第四和第五方面的方法中使用的双触角psa糖型选自化合物7、9、10、11、13、16、18、21、24和25中的一者或多者,如表1a和1b中所鉴定的。
45、本发明的第一、第二、第三、第四和第五方面的方法可以用于辅助确定受试者是否患有侵袭性形式的pca或辅助确定受试者是否未患有侵袭性形式的pca,诸如惰性前列腺疾病。适当地,本发明的第一、第二、第三、第四或第五方面的方法可以用于辅助确定受试者是否患有惰性前列腺疾病,诸如bph。
46、根据本发明的第六方面,提供了一种用于在根据本发明的第一、第二、第三、第四或第五方面的方法中使用或与该方法一起使用的试剂盒(或试剂盒的用途),该试剂盒包括前列腺癌侵袭性得分或评分系统(例如具有指示侵袭性pca的psa糖型阈值的确定系统)。任选地,试剂盒还包括psa蛋白结合剂,诸如单克隆抗体。此类psa蛋白结合剂可以用于分离或纯化psa蛋白。在实施例中,试剂盒可以包括蛋白酶。蛋白酶可以用于生成psa糖肽,可以经由质谱法测量该psa糖肽。在实施例中,试剂盒可以是用于psa糖型的质谱法检测的试剂盒。
本文地址:https://www.jishuxx.com/zhuanli/20241120/335438.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
上一篇
自动分析装置的制作方法
下一篇
返回列表