具有增强的稳定性特征的药物组合物的制作方法
- 国知局
- 2024-08-05 11:52:05
本发明涉及特别适合用于口服递送的药物方法和组合物。薄膜产品可以包含薄膜形成聚合物、活性成分和干燥剂。所述组合物还可以包含赋形剂,该赋形剂包括稳定剂、抗氧化剂、渗透增强剂或肾上腺素受体相互作用剂中的一种或多种。
背景技术:
1、虽然活性药物成分可以以各种形式施用,但薄膜递送可以提供优异的感官特性产品,并改善替代剂型的物理和化学稳定性。然而,这种递送方法可能与缓慢的药物释放和渗透性、薄膜易碎和差的稳定性特征有关。需要在递送有效量的活性药物成分的同时表现出改善的溶出速率和改善的稳定性的改善的制剂。
技术实现思路
1、一般而言,具有增强的溶出的药物组合物可以包含活性成分、薄膜形成聚合物(包括淀粉醚)和干燥剂。
2、在某些实施方案中,淀粉醚可以是淀粉的羟烷基醚。
3、在某些实施方案中,淀粉的羟烷基醚可以是淀粉的羟丙基醚。
4、在某些实施方案中,薄膜形成聚合物可以是豌豆淀粉。
5、在某些实施方案中,干燥剂可以包括二氧化硅。在某些实施方案中,干燥剂可以包括气相二氧化硅或介孔二氧化硅。在某些实施方案中,薄膜形成聚合物和干燥剂可以具有按重量计10:1至2:1的比率。
6、在某些实施方案中,活性成分按重量计可占组合物的0.1%至80%。
7、在某些实施方案中,药物组合物可以包含稳定剂。在某些实施方案中,稳定剂可以包括螯合剂。在某些实施方案中,药物组合物进一步包含抗氧化剂。在某些实施方案中,稳定剂可以包括离子交换树脂。树脂可以是阳离子交换树脂。
8、在某些实施方案中,药物组合物可以包含渗透增强剂。在某些实施方案中,包含渗透增强剂的药物组合物可以包含肾上腺素受体相互作用剂。
9、在某些实施方案中,渗透增强剂可以包括丁香油酚。
10、在某些实施方案中,药物组合物可以包含加工溶剂。加工溶剂可为有机加工溶剂。
11、在某些实施方案中,加工溶剂可以包括乙醇、丙酮、乙腈、叔丁醇、甲醇、1-丙醇、异丙醇、四氢呋喃、乙醛、二氧六环或甲基异腈中的一种或多种。
12、在某些实施方案中,加工溶剂可包括至少20%乙醇。在某些实施方案中,加工溶剂可包括至少30%乙醇。在某些实施方案中,加工溶剂可包括至少40%乙醇。在某些实施方案中,加工溶剂可包括至少50%乙醇。
13、在某些实施方案中,药物组合物可以包含增塑剂。在某些实施方案中,增塑剂可以包括多元醇。在某些实施方案中,增塑剂可以包括五醇。在某些实施方案中,增塑剂可以包括三氯蔗糖;糖醇,诸如山梨醇、甘露醇或木糖醇。
14、在某些实施方案中,药物组合物可以包含增粘剂。
15、在某些实施方案中,增粘剂可以包括明胶、黄原胶、乙基纤维素、羟丙基纤维素、甲基纤维素、微晶纤维素、壳聚糖、天然树胶、聚乙烯、交联聚合物或其他合成聚合物。在某些实施方案中,药物组合物可以包含表面活性剂。在某些实施方案中,表面活性剂可以包括在某些实施方案中,表面活性剂可以包括gmo。
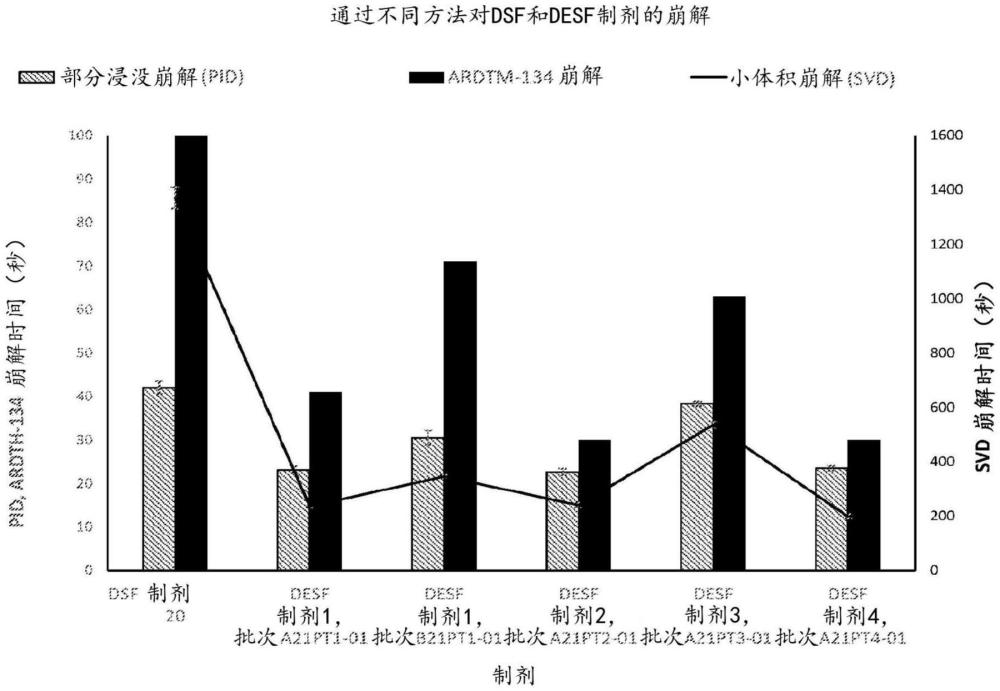
16、在某些实施方案中,药物组合物可以包含酯酶抑制剂。在某些实施方案中,酯酶抑制剂可包括naf。在某些实施方案中,药物组合物可以包含甜味剂。在某些实施方案中,甜味剂可包括三氯蔗糖。在某些实施方案中,甜味剂可包括magnasweet。
17、在某些实施方案中,药物组合物可以包含调味剂。
18、在某些实施方案中,药物组合物可以包含着色剂。
19、一般而言,用于递送具有增强的稳定性的药物组合物的药物组合物可以包含活性成分、ph调节剂(包括hcl)以及增塑剂(包括非还原糖)。
20、在某些实施方案中,非还原糖可以是多元醇。在某些实施方案中,非还原糖可以是五醇。在某些实施方案中,非还原糖可以是木糖醇。
21、在某些实施方案中,ph调节剂可导致制剂ph为2.5至3.5并且增塑剂具有按重量计1:20至1:8的比率。
22、一般而言,药物薄膜产品可以包含活性成分、稳定剂、增塑剂,并且该薄膜产品可以具有在如根据小体积崩解试验测量的在约1至约240秒范围内的小体积崩解值。
23、在某些实施方案中,薄膜产品可以具有在约2至约30秒范围内的小体积崩解时间。在某些实施方案中,薄膜产品可以具有在约2至约10秒范围内的小体积崩解时间。
24、一般而言,制造具有增强的稳定性的药物组合物的方法可以包括形成具有如根据小体积崩解试验测量的在约1至约60秒范围内的溶出特征的组合物。
25、在某些实施方案中,薄膜产品具有如根据小体积崩解试验测量的在约2至约30秒的范围内的部分浸没溶出值。在某些实施方案中,薄膜产品具有如根据小体积崩解试验测量的在约2至约10秒的范围内的部分浸没溶出值。
26、一般而言,制造具有增强的溶出速率的药物制剂的方法可以包括提供活性成分、掺入干燥剂(包括介孔二氧化硅)以及应用薄膜形成聚合物(包括豌豆淀粉)。
27、一般而言,制造具有增强的稳定性的药物制剂的方法可以包括提供活性成分、掺入ph调节剂(其导致制剂ph为2.5至3.5)以及掺入增塑剂(包括木糖醇)。
28、一般而言,稳定透粘膜递送的肾上腺素的方法可以包括施用药物组合物,该药物组合物包含活性成分、ph调节剂(其导致制剂ph为2.5至3.5)、干燥剂(包括介孔二氧化硅)、增塑剂(包括木糖醇);并在不到1小时内达到肾上腺素的药物活性形式的有效血浆浓度。在某些实施方案中,ph调节剂可以是hcl。
29、在某些实施方案中,活性成分可以包括肾上腺素的前药。
30、在某些实施方案中,组合物可包含降解物。该降解物可以是肾上腺素前药的水解产物。
31、在某些实施方案中,降解物可以是递送至受试者的递送活性成分的一部分。
32、在某些实施方案中,在6个月结束时降解物水平可以以约3.5%或更高存在。
33、在某些实施方案中,在12个月结束时降解物水平可以以约2.3%或更高存在。
34、在某些实施方案中,在24个月结束时降解物水平可以以约2.4%或更高存在。
35、在某些实施方案中,降解物可以具有约2.2x10-3%的降解速率。
36、在某些实施方案中,降解物在25℃储存的保质期可以持续至少3年。
37、在某些实施方案中,降解物在25℃储存的保质期可以持续至少4年。
38、在某些实施方案中,降解物在25℃储存的保质期可以持续至少5年。
39、在某些实施方案中,降解物增长的速率可以基本上不变持续至少3个月。
40、在某些实施方案中,降解物增长的速率可以基本上不变持续至少5个月。
41、根据以下描述、附图和权利要求书,其他方面、实施方案和特征将是显而易见的。
技术特征:1.具有增强的溶出的药物组合物,其包含
2.权利要求1所述的组合物,其中所述淀粉醚是淀粉的羟烷基醚。
3.权利要求2所述的组合物,其中所述淀粉的羟烷基醚是淀粉的羟丙基醚。
4.权利要求1所述的组合物,其中所述薄膜形成聚合物是豌豆淀粉。
5.权利要求1所述的组合物,其中所述干燥剂包括二氧化硅。
6.权利要求1所述的组合物,其中所述干燥剂包括气相二氧化硅或介孔二氧化硅。
7.权利要求1所述的组合物,其中所述薄膜形成聚合物和所述干燥剂具有按重量计10:1至2:1的比率。
8.权利要求1所述的组合物,其中所述活性成分按重量计占组合物的0.1%至80%。
9.权利要求1所述的组合物,其进一步包含稳定剂。
10.权利要求9所述的组合物,其中所述稳定剂包括螯合剂。
11.权利要求1所述的组合物,其进一步包含抗氧化剂。
12.权利要求9所述的组合物,其中所述稳定剂包括离子交换树脂。
13.权利要求12所述的组合物,其中所述离子交换树脂是阳离子交换树脂。
14.权利要求1所述的组合物,其进一步包含渗透增强剂。
15.权利要求1所述的组合物,其进一步包含渗透增强剂,所述渗透增强剂包括肾上腺素受体相互作用剂。
16.权利要求13所述的组合物,其中所述渗透增强剂包括丁香油酚。
17.权利要求1所述的组合物,其进一步包含加工溶剂。
18.权利要求16所述的组合物,其中所述加工溶剂是有机加工溶剂。
19.权利要求16所述的组合物,其中所述加工溶剂包括乙醇、丙酮、乙腈、叔丁醇、甲醇、1-丙醇、异丙醇、四氢呋喃、乙醛、二氧六环或甲基异腈中的一种或多种。
20.权利要求16所述的组合物,其中所述加工溶剂包括至少20%乙醇。
21.权利要求16所述的组合物,其中所述加工溶剂包括至少30%乙醇。
22.权利要求16所述的组合物,其中所述加工溶剂包括至少40%乙醇。
23.权利要求16所述的组合物,其中所述加工溶剂包括至少50%乙醇。
24.权利要求1所述的组合物,其进一步包含增塑剂。
25.权利要求23所述的组合物,其中所述增塑剂包括多元醇。
26.权利要求23所述的组合物,其中所述增塑剂包括五醇。
27.权利要求23所述的组合物,其中所述增塑剂包括三氯蔗糖;糖醇诸如山梨醇、甘露醇、木糖醇。
28.权利要求1所述的组合物,其进一步包含增粘剂。
29.权利要求27所述的组合物,其中所述增粘剂包括明胶、黄原胶、乙基纤维素、羟丙基纤维素、甲基纤维素、微晶纤维素、壳聚糖、天然树胶、聚乙烯、交联聚合物或其他合成聚合物。
30.权利要求1所述的组合物,其进一步包含表面活性剂。
31.权利要求29所述的组合物,其中所述表面活性剂包括
32.权利要求29所述的组合物,其中所述表面活性剂包括gmo。
33.权利要求1所述的组合物,其进一步包含酯酶抑制剂。
34.权利要求32所述的组合物,其中所述酯酶抑制剂包括naf。
35.权利要求1所述的组合物,其进一步包含甜味剂。
36.权利要求34所述的组合物,其中所述甜味剂包括三氯蔗糖。
37.权利要求32所述的组合物,其中所述甜味剂包括magnasweettm。
38.权利要求1所述的组合物,其进一步包含调味剂。
39.权利要求1所述的组合物,其进一步包含着色剂。
40.用于递送具有增强的稳定性的药物组合物的药物组合物,其包含活性成分,
41.权利要求37所述的组合物,其中所述非还原糖是多元醇。
42.权利要求37所述的组合物,其中所述非还原糖是五醇。
43.权利要求37所述的组合物,其中所述非还原糖是木糖醇。
44.权利要求1所述的组合物,其中所述ph调节剂导致制剂ph为2.5至3.5并且增塑剂具有按重量计1:20至1:8的比率。
45.药物薄膜产品,其包括
46.权利要求42所述的药物薄膜产品,其中所述薄膜产品具有在约2至约30秒的范围内的小体积崩解时间。
47.权利要求42所述的药物薄膜产品,其中所述薄膜产品具有在约2至约10秒的范围内的小体积崩解时间。
48.制备具有增强的稳定性的药物组合物的方法,其包括形成具有如根据小体积崩解试验测量的在约1至约60秒的范围内的溶出特征的组合物。
49.权利要求45所述的方法,其中所述膜产品具有如根据小体积崩解试验测量的在约2至约30秒的范围内的部分浸没溶出值。
50.权利要求42所述的药物薄膜产品,其中所述薄膜产品具有如根据小体积崩解试验测量的在约2至约10秒的范围内的部分浸没溶出值。
51.制备具有增强的溶出速率的药物制剂的方法,其包括
52.制备具有增强的稳定性的药物制剂的方法,其包括
53.稳定透粘膜递送的肾上腺素的方法,其包括:
54.权利要求49所述的方法,其中所述ph调节剂是hcl。
55.权利要求50所述的方法,其中所述ph调节剂是hcl。
56.权利要求1所述的组合物,其中所述活性成分包括肾上腺素的前药。
57.权利要求56所述的组合物,其进一步包含降解剂。
58.权利要求57所述的组合物,其中所述降解物是所述肾上腺素的前药的水解产物。
59.权利要求57所述的组合物,其中所述降解物是向受试者递送的活性成分的一部分。
60.权利要求57所述的组合物,其中在6个月结束时所述降解物水平以约3.5%或更多存在。
61.权利要求58所述的组合物,其中在12个月结束时所述降解物水平以约2.3%或更多存在。
62.权利要求58所述的组合物,其中在24个月结束时所述降解物水平以约2.4%或更多存在。
63.权利要求58所述的组合物,其中所述降解物具有约2.2x10-3%的降解速率。
64.权利要求58所述的组合物,其中所述降解物在25℃储存的保质期持续至少3年。
65.权利要求58所述的组合物,其中所述降解物在25℃储存的保质期持续至少4年。
66.权利要求58所述的组合物,其中所述降解物在25℃储存的保质期持续至少5年。
67.权利要求58所述的组合物,其中降解物增长的速率基本上不变持续至少3个月。
68.权利要求58所述的组合物,其中降解物增长的速率基本上不变持续至少5个月。
技术总结可溶性药物递送薄膜可以表现出增强的稳定性。技术研发人员:S·P·瓦加基,R·K·凯恩坦,V·布诺,A·M·朔贝尔,M·库恩斯,M·古德里奇,G·特索迪科夫受保护的技术使用者:阿奎斯蒂弗医疗股份有限公司技术研发日:技术公布日:2024/8/1本文地址:https://www.jishuxx.com/zhuanli/20240802/259804.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表