一种特异性干扰Fe代谢和原位催化功能的配位纳米制剂及其制备方法和应用
- 国知局
- 2024-09-11 14:16:52
本发明属于生物材料学领域,具体涉及一种特异性干扰铁(fe)代谢和原位催化功能的配位纳米制剂及其制备方法和应用。
背景技术:
1、转移、复发和化疗耐药性一直是恶性肿瘤治疗成功的主要障碍。越来越多的证据证明,肿瘤组织中存在具有干细胞特征的一小部分肿瘤细胞亚群,称为肿瘤干细胞(cscs),其具有自我更新、表型可塑性、高度致瘤性和侵袭性等特性,是导致上述肿瘤转移、复发和化疗耐药性的重要原因。在抗cscs策略中,分化治疗被认为是一种非常有前途的方法,其通常通过使用分子制剂如全反式维甲酸(atra)、维生素d3等,来破坏cscs的可塑性,并诱导cscs分化为更成熟的、侵袭性更差的肿瘤细胞(即非cscs)。随着纳米技术和生物医学的不断结合发展,各种各样的纳米材料被开发、设计成药物递送载体,以提高小分子试剂的生物利用度和特异性,用于增强抗cscs治疗。另外,还有一小部分纳米材料本身也显示出能诱导cscs分化的能力,如金属富勒烯纳米颗粒、化学改性的金纳米粒子等。然而,目前分化治疗受到利用这些分子制剂所导致的分化诱导能力较弱的限制,可能无法根除cscs群。而且更重要的是,这种治疗方式缺乏强大的肿瘤特异性致死作用,会导致剩余大量肿瘤细胞,它们可以通过上皮-间充质转化(emt)过程转化为cscs。尽管已经报道了一些基于纳米技术的联合疗法用于抗cscs和肿瘤清除,但复杂的制备和操作以及不可避免的副作用仍会对其实际应用构成巨大挑战。因此,发展新的可行策略来实现同时有效分化cscs和处理大块肿瘤细胞对改善肿瘤治疗并解决肿瘤复发和转移问题具有重要意义。
2、fe与肿瘤发生和癌症进展密切相关。最近的研究表明,与非cscs相比,cscs对fe的依赖性增强,这是由于fe在cscs维持和自我更新激活中扮演重要角色。基于此,利用临床常用的铁螯合剂进行铁消耗的策略最近已被证明可以抑制cscs相关的信号通路和干性。然而,这种策略对肿瘤细胞的治疗作用较弱。另一方面,肿瘤细胞保持一定量ros的存在以维持其本身的生存、快速增殖过程,但在肿瘤细胞内过量产生ros(如羟基自由基(·oh))会诱导有害的氧化应激反应,破坏氧化还原稳态,并通过凋亡、铁死亡等途径致使细胞死亡。另外,证据表明,cscs会维持低的细胞内ros水平,这有利于其干性特征维持,而ros的升高能促进cscs分化。从上述角度来看,如果能够同时操纵细胞内fe代谢和ros产生有望协同消除cscs和大块肿瘤细胞,但实现这一治疗策略极具挑战性。幸运的是,功能纳米系统的设计和应用为实现优化癌症治疗提供广泛的机会。
3、因此,设计开发一种能够同时干预肿瘤fe代谢和氧化还原稳态的功能纳米系统,有望实现协同消除cscs和杀死大块肿瘤细胞,以增强肿瘤抑制效果以及解决肿瘤复发和转移问题,呈现极大的应用潜力。
技术实现思路
1、针对现有技术中存在的问题,本发明提供了一种特异性fe3+感应且能同时干预肿瘤fe代谢和氧化还原稳态的配位纳米制剂及其制备方法和抗肿瘤应用。所述的这种配位纳米制剂及其制备方法旨在解决现有技术中的对存在cscs的恶性肿瘤治疗效果不佳以及无法处理肿瘤复发和转移的问题。
2、第一方面,本发明提供了一种特异性干扰fe代谢和原位催化功能的配位纳米制剂,包括:zndht配位纳米颗粒,以及修饰在zndht配位纳米颗粒上的壳聚糖cs。
3、本发明中,配位纳米制剂是由2,5-二羟基对苯二甲酸(dht)和锌离子(zn2+)配位而成并进一步修饰壳聚糖(cs)形成的zndht nm配位纳米制剂,具有级联特异性fe3+捕获、促进原位催化活性氧(ros)产生、zn2+释放能力,可实现催化促进分化治疗新策略,同时扰乱肿瘤fe代谢和氧化还原稳态,使能够同时减少肿瘤干细胞(cscs)种群和杀死大块肿瘤细胞,从而促进抑制肿瘤生长、术后复发和转移,在抗恶性肿瘤治疗方面具有潜在应用价值。
4、较佳的,所述zndht配位纳米颗粒是由2,5-二羟基对苯二甲酸(dht)配体和zn2+配位而成;优选地,所述zndht配位纳米颗粒中dht和zn2+的摩尔比为0.5~1。
5、较佳的,所述zndht配位纳米颗粒和壳聚糖cs的质量比为(0.2~2):1。
6、较佳的,所述配位纳米制剂的形貌呈长棒状,短边为50纳米~3微米,长边为100纳米~30微米。优选地,所述配位纳米制剂的形貌呈长棒状,短边为50纳米~180纳米,长边为100纳米~600纳米。
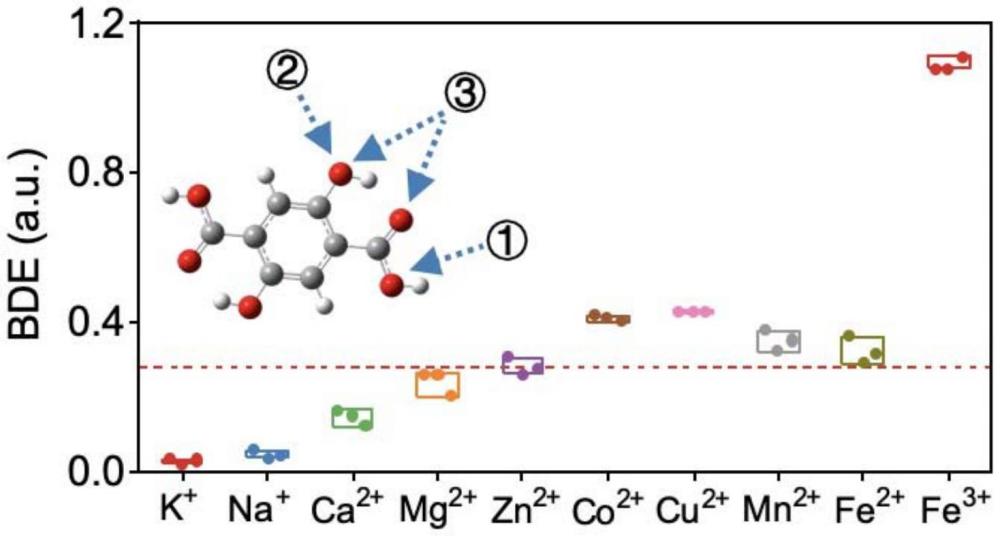
7、较佳的,所述配位纳米制剂对fe3+具有特异性感应能力,特异性捕获环境中的fe3+离子并以fe-o配位键形成稳定的fe-dht配位结构,且同时释放zn2+离子。本发明中,探究配位纳米制剂在含不同金属离子的水溶液中,如k+、na+、ca2+、mg2+、zn2+、co2+、fe2+、al3+、fe3+等,只对fe3+具有特异性感应能力,这得益于dht配体对fe3+相对于其他金属离子呈现更强的结合力。相对于dht分子,所述配位纳米制剂具有持续、缓慢、更优的fe3+感应性能(螯合fe3+性能),这种螯合作用具有较好的ph稳定性,且螯合后不会重新释放回环境(水、pbs、培养基等)中。
8、第二方面,本发明提供了一种特异性干扰fe代谢和原位催化功能的配位纳米制剂的制备方法,包括:将zndht配位纳米颗粒分散于包含壳聚糖(cs)的水溶液中,并超声振荡,再经二次离心和清洗,得到所述特异性干扰fe代谢和原位催化功能的配位纳米制剂;
9、较佳的,所述壳聚糖为壳聚糖季铵盐。所述超声振荡的参数包括:工作频率为30~70khz,功率为50~100%,设定温度为20~37℃;所述超声振荡的时间为10~60分钟。
10、较佳的,所述zndht配位纳米颗粒的制备方法包括:
11、(1)将dht分子溶于n,n-二甲基甲酰胺(dmf)和h2o的混合溶剂中,经超声实现充分溶解,形成a溶液;
12、(2)将锌源溶于dmf和h2o的混合溶剂中,经超声实现充分溶解,形成b溶液;
13、(3)将a溶液在1~5分钟内全部倒入b溶液,在常温下磁力搅拌,形成乳黄色液体;
14、(4)将乳黄色液体转移至水热釜中,在60~150℃下溶剂热反应12~48小时后室温冷却,再经离心和洗涤,得到黄色的zndht配位纳米颗粒。
15、较佳的,所述锌源为含锌的盐类,优选为zn(ch3coo)2·2h2o。
16、较佳的,所述混合溶剂中h2o和dmf的体积比vh2o:vdmf为0~0.32。本发明中,通过h2o和dmf的体积比,可以实现配位纳米制剂的形貌、尺寸调控。具体地,随着混合溶剂中h2o的含量占比增加,配位纳米制剂的尺寸和长径比先减小后增大,尺寸调节范围为50纳米~5微米。所述配位纳米制剂在水溶液中具有优异的分散性。
17、较佳的,所述磁力搅拌所用转子的转速为300~1200转/分钟,时间为10~30分钟。
18、第三方面,本发明提供了一种可注射溶液,其特征在于,包括:基质溶液,以及分散于基质溶液中的特异性干扰fe代谢和原位催化功能的配位纳米制剂;
19、优选地,所述基质溶液为0.9%nacl水溶液;
20、优选地,所述特异性干扰fe代谢和原位催化功能的配位纳米制剂的浓度为0.1~10mg/ml。
21、第四方面,本发明提供了一种特异性干扰fe代谢和原位催化功能的配位纳米制剂在制备抗恶性肿瘤药物中的应用。
22、第五方面,本发明提供了一种可注射溶液在制备抗恶性肿瘤药物中的应用。
23、本发明中,所述配位纳米制剂的特异性fe3+捕获能力具有较好的ph稳定性(ph 4~8),且螯合后不会重新释放回环境(水、pbs、培养基等)中。
24、较佳的,所述以fe-o配位键形成的fe-dht配位结构具有高还原性,这得益于fe3+和dht配位结合后在配体场作用下电子易于从配位转移到金属中心。所述fe-dht配位结构具有高还原性,相对于fe3+,在酸性和加过氧化氢(h2o2)条件下增强了催化产生羟基自由基(·oh)。具体地,所述具有高还原性的fe-dht配位结构相对于fe3+在酸性(ph=4.0~7.4)且加过氧化氢(h2o2,浓度为50μm~50mm)条件下增强催化产生·oh。
25、进一步的,对制备的配位纳米制剂进行性能表征发现,该配位纳米制剂在模拟生理环境中具有较好的稳定性。其能被肿瘤细胞有效内在化,并在细胞内实现fe捕获和zn离子释放。该配位纳米制剂没有在正常细胞内诱导ros产生,仅在肿瘤细胞内诱导明显的ros产生,且在模拟肿瘤酸性、h2o2过表达的微环境条件下增强原位催化ros产生。一方面,该配位纳米制剂可以通过fe代谢干预和促进ros产生共同实现cscs分化治疗,明显减少cscs种群比例,减少干细胞特性;另一方面,该配位纳米制剂可以通过促进肿瘤特异性的ros产生和zn2+介导的抗氧化防御失衡(谷胱甘肽还原酶(gr)活性抑制和还原型谷胱甘肽(gsh)水平下调)来增加肿瘤细胞的氧化破坏以诱导其死亡。结果证明,该配位纳米制剂可实现催化促进分化治疗策略,能同时减少cscs种群和杀死肿瘤细胞,效果优于临床药物,如阿霉素(dox)、甲磺酸去铁胺(dfom)等。
26、本发明中,通过建立原位乳腺癌动物模型进行动物实验,其中给药的剂量为25~400μg/只,结果发现:该配位纳米制剂可以在肿瘤部位消耗内源性fe、释放zn离子以及诱导ros产生;该配位纳米制剂可以减少肿瘤部位cscs种群比例,诱导大量肿瘤细胞凋亡和铁死亡,呈现有效抑制原位乳腺癌生长的效果,效果优于临床药物dox、dfom等;该配位纳米制剂可以有效抑制原位乳腺癌手术切除后复发和转移,明显延长生存期;效果优于临床药物dox、dfom等;该配位纳米制剂在体内呈现较好的生物安全性。
27、本发明的有益效果:
28、本发明中,zndht nm配位纳米制剂具有级联特定内源性fe3+干扰和原位催化功能,可用于实现催化增强分化治疗新策略。该配位纳米制剂主要由2,5-二羟基对苯二甲酸(dht)配体和zn2+配位而成,且修饰cs,具有优异的分散性、稳定性。由于dht配体对fe3+呈现比其他金属离子更强的结合力,该配位纳米制剂能够选择性地捕获环境中的fe3+,通过原位形成高还原性的fe-dht配位结构进一步实现在酸性环境下促进催化ros产生,并同时释放本身基体的zn2+。该配位纳米制剂的形貌、尺寸可通过合成条件中的溶剂精准调控,小到50纳米,大到30微米,可直接影响其理化性能和生物学效应。该配位纳米制剂既能通过同时干扰肿瘤fe代谢和原位催化ros产生来有效分化cscs,又能通过促进肿瘤细胞特异性ros产生和zn2+介导的抗氧化防御破坏来诱导肿瘤细胞氧化应激死亡。作为肿瘤fe代谢及氧化还原稳态双重破坏者,该配位纳米制剂可同时减少cscs种群和杀死大块肿瘤细胞,有效对抗体内原位乳腺癌生长、肿瘤术后复发和转移,且无明显副作用,在抗肿瘤生长、抑制肿瘤复发和转移方面呈现巨大的潜力。本发明和已有技术相比,其技术进步是显著的。
本文地址:https://www.jishuxx.com/zhuanli/20240911/289983.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。