山梨醇-6-磷酸脱氢酶突变体及在山梨醇-6-磷酸合成中的应用
- 国知局
- 2024-09-11 14:49:18
本发明属于生物,涉及热稳定性提高的山梨醇-6-磷酸脱氢酶突变体,其编码核酸,含有该核酸的重组表达载体、重组表达转化体,山梨醇-6-磷酸脱氢酶突变体催化剂,以及山梨醇-6-磷酸脱氢酶突变体或山梨醇-6-磷酸脱氢酶突变体催化剂在山梨醇-6-磷酸合成中的应用。
背景技术:
1、山梨醇(sorbitol)是一种多元醇,其甜度约为蔗糖的60%,可用于糖果、口香糖、甜点、冰淇淋以及糖尿病食品。此外,它还被广泛用于各种食品,不仅用作甜味剂,还用作保湿剂、质地调节剂和柔软剂。它是生产维生素c的重要前体。其他用途包括药品、山梨糖、丙二醇、合成增塑剂和醇酸树脂等。由于山梨醇作为稳定剂和赋形剂在药物制剂以及合成维生素c的制备中的应用越来越多,制药行业对山梨醇的需求可能会出现高速增长。
2、目前,有几种方法可以制取山梨醇。其中,工业化生产山梨醇是通过化学方法利用雷尼镍等作为催化剂使葡萄糖催化加氢从而合成山梨醇,这种方法的好处是来源稳定且转化率高,但是在催化加氢过程中容易形成副产物葡萄糖酸易使ni大量流失,从而造成催化剂性能下降;同时,由于ni易溶解于山梨醇,会影响山梨醇质量,增加分离成本。除此之外,还有几种生物方法合成山梨醇。chun等人发现运动发酵单胞菌(zymomonas mobilis)体内含有葡萄糖-果糖氧化还原酶(gfor),该酶可以以葡萄糖和果糖为底物,将葡萄糖转化为葡萄糖酸,将果糖转化为山梨醇;之后liu等人利用二价金属离子,使gfor活性提高了1.7倍,山梨醇的产率从89%提高到接近100%,但是由于果糖的价值高于山梨醇,所以不符合经济效应。de boech等人敲除了干酪乳杆菌中利用山梨醇的基因gutb,使得干酪乳杆菌可以通过分批发酵的方式将乳糖转化为山梨醇,产量为0.05(g/g)。ikeuchi等人利用蓝藻光合作用生产山梨醇,通过基因工程改变其底物的供应,通过高表达山梨醇-6-磷酸脱氢酶、果糖-1,6-二磷酸酶以及产生nadph的膜结合酶,使得蓝藻具有可持续生产山梨醇的能力,产量为312mg/l。但是除了使用运动发酵单胞菌能够得到较高的山梨醇,干酪乳杆菌和蓝藻的山梨醇产量都过低,距离工业化还有很长的距离。
3、体外多酶从淀粉合成山梨醇被认为是一种可行的方法,游淳等人已经开发出体外多酶级联从淀粉到氨糖以及甘露醇的合成,这两条路径有相同的步骤,即从淀粉到果糖-6-磷酸的合成:以淀粉为底物,首先通过α-淀粉磷酸化酶将淀粉转化为葡萄糖-1-磷酸,再通过磷酸葡萄糖变位酶将其转化为葡萄糖-6-磷酸,最后通过磷酸葡萄糖异构酶将葡萄糖-6-磷酸转化为果糖-6-磷酸。在此基础上,山梨醇-6-磷酸脱氢酶可以将果糖-6-磷酸转化为山梨醇-6-磷酸,再通过山梨醇-6-磷酸脱磷酶脱去磷酸根最终合成山梨醇,这种方法更加符合经济效应,且理论产率可达100%。
4、酶作为生物催化剂,在生物经济中发挥着关键作用,其应用范围不断扩大,包括可持续的、绿色生产的精细化学品和生物燃料。然而,与传统的化学催化剂相比,酶的应用容易受到稳定性差的限制,大部分的自然酶只能在温和的条件下催化反应,反应温度过高容易导致酶的结构功能改变,从而影响反应性能,酶用量大,反应转化率低。因此探索具有优异催化活性和热稳定性的山梨醇-6-磷酸脱氢酶是至关重要的。
技术实现思路
1、本发明所要解决的技术问题是克服现有技术的不足,通过蛋白质工程改造,提供山梨醇-6-磷酸脱氢酶突变体及在山梨醇-6-磷酸合成中的应用。
2、本发明通过对蛋白质结构进行半理性设计以及非理性设计,提供了几种热稳定性显著提高的山梨醇-6-磷酸脱氢酶突变体,缓解了由于其热稳定性差而导致山梨醇产物较少问题。
3、具体而言,本发明提供具有高催化活性且热稳定性显著提高的山梨醇-6-磷酸脱氢酶突变体,其基因、含有该基因的重组表达载体和重组表达转化体、山梨醇-6-磷酸脱氢酶突变体催化剂,并提供使用山梨醇-6-磷酸脱氢酶突变体或山梨醇-6-磷酸脱氢酶突变体催化剂,高效催化果糖-6-磷酸的还原。
4、本发明的目的可以通过以下技术方案来实现:
5、本发明的技术方案之一:提供一种热稳定性显著提高且保持高催化活性的山梨醇-6-磷酸脱氢酶突变体,所述山梨醇-6-磷酸脱氢酶突变体是在如seq id no.2所示的氨基酸序列中经过取代一个或几个氨基酸形成的热稳定性提高的衍生蛋白质。
6、优选地,所述山梨醇-6-磷酸脱氢酶突变体选择如下氨基酸序列对应的蛋白质:
7、(1)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸;
8、(2)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸;
9、(3)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第106位天冬氨酸替换为异亮氨酸;
10、(4)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第23位丙氨酸替换为缬氨酸;
11、(5)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第23位丙氨酸替换为缬氨酸,第233位甲硫氨酸替换为缬氨酸;
12、(6)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第23位丙氨酸替换为缬氨酸,第233位甲硫氨酸替换为缬氨酸,第40位丙氨酸替换为谷氨酸;
13、(7)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第23位丙氨酸替换为缬氨酸,第233位甲硫氨酸替换为缬氨酸,第32位缬氨酸替换为亮氨酸;
14、(8)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第23位丙氨酸替换为缬氨酸,第233位甲硫氨酸替换为缬氨酸,第77位谷氨酸替换为酪氨酸;
15、(9)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第23位丙氨酸替换为缬氨酸,第233位甲硫氨酸替换为缬氨酸,第166位谷氨酰胺替换为丝氨酸;
16、(10)将如seq id no.2所示氨基酸序列的第66位谷氨酰胺替换为天冬氨酸,第74位甘氨酸替换为甲硫氨酸,第23位丙氨酸替换为缬氨酸,第233位甲硫氨酸替换为缬氨酸,第40位丙氨酸替换为谷氨酸,第92位丙氨酸替换为缬氨酸。
17、本发明以文献中报道的山梨醇-6-磷酸脱氢酶s6pdh为基础,借助计算机的理性设计以及随机突变对其进行热稳定性的改造,获得热稳定性显著提高且对果糖-6-磷酸保持高催化活性的山梨醇-6-磷酸脱氢酶突变体。其中,山梨醇-6-磷酸脱氢酶s6pdh的氨基酸序列如seq id no.2所示,能够有效催化果糖-6-磷酸还原获得产物山梨醇-6-磷酸。
18、其中,山梨醇-6-磷酸脱氢酶s6pdh在文章“purification and properties of d-mannitol-1-phosphate dehydrogenase ec-1.1.1.17and d-glucitol-6-phosphatedehydrogenase ec-1.1.1.140from escherichia-coli.”(j.bacteriol.,1984,986-990)中报道过。
19、在本发明的一个实施方式中,山梨醇-6-磷酸脱氢酶s6pdh来源于大肠杆菌k12(escherichia coli k12)。
20、本发明的技术方案二:提供一种分离的核酸,所述核酸是编码所述山梨醇-6-磷酸脱氢酶突变体的核酸分子。
21、本发明的技术方案三:提供一种包含所述山梨醇-6-磷酸脱氢酶突变体核酸的重组表达载体。
22、所述重组表达载体为通过本领域常规的方法将所述山梨醇-6-磷酸脱氢酶突变体核酸克隆到各种表达载体上而获得。所述的表达载体包括本领域常规的各种载体,如市售的质粒、噬菌体或是病毒载体等,优选质粒pet-28a(+)。
23、本发明的技术方案四:提供一种包含所述山梨醇-6-磷酸脱氢酶突变体核酸或所述重组表达载体的重组表达转化体。
24、所述重组表达转化体可通过将上述重组表达载体转化至宿主细胞中制得。所述宿主细胞为本领域常规的宿主细胞,只要能满足重组表达载体可稳定地自行复制,并且其所携带的本发明的山梨醇-6-磷酸脱氢酶突变体的基因可被有效表达即可。所述宿主细胞优选为大肠杆菌,更优选的为大肠杆菌e.coli bl21(de3)。将所述重组表达载体转化至大肠杆菌e.coli bl21(de3)中,即可获得本发明优选的重组表达转化体。其中所述的转化方法为本领域常规方法,如热激法、电转法等,更优选的为热激法。
25、本发明的技术方案五:提供一种所述山梨醇-6-磷酸脱氢酶突变体的制备方法。
26、本发明所述重组山梨醇-6-磷酸脱氢酶突变体的制备方法较优为:培养如上所述的重组表达转化体,分离获得重组表达的山梨醇-6-磷酸脱氢酶突变体。其中所述的培养重组表达转化体所用的培养基为本领域任何可使转化体生长并产生本发明所述重组山梨醇-6-磷酸脱氢酶突变体的培养基。所述培养基优选lb培养基,其配方为:蛋白胨10g/l,酵母膏5g/l,nacl 10g/l,ph 7.0。培养方法和培养条件等可以根据宿主细胞类型和培养方法等因素的不同进行适当的选择,只要使转化体能够生长并生产所述的山梨醇-6-磷酸脱氢酶即可。
27、重组表达转化体培养的具体操作可按本领域常规操作进行。优选所述的重组大肠杆菌,接种至含有卡那霉素的lb培养基中,37℃培养,当培养液的od600达到0.5~1.0时,加入终浓度为0.1~0.5mmol/l的β-d异丙基-硫代吡喃半乳糖苷(iptg)进行诱导,在16℃继续培养24h,即可高效表达本发明所述的山梨醇-6-磷酸脱氢酶突变体。培养结束后,离心收集沉淀的菌体细胞,即为重组表达转化体的静息细胞;将所得细胞悬浮于tris-hcl缓冲液(tris,200mmol/l,ph 7.5)中,超声破碎,破碎液离心,收集上淸液,即可获得含有所述山梨醇-6-磷酸脱氢酶突变体的粗酶液。
28、本发明的技术方案六:提供一种山梨醇-6-磷酸脱氢酶突变体催化剂,是以下形式中的任意一种:
29、(1)培养所述重组表达转化体,分离含有山梨醇-6-磷酸脱氢酶突变体的转化体细胞;
30、(2)对含有所述山梨醇-6-磷酸脱氢酶突变体的转化体细胞进行破碎,获得含有所述山梨醇-6-磷酸脱氢酶突变体的细胞破碎液即粗酶液;
31、(3)将含有所述山梨醇-6-磷酸脱氢酶突变体的细胞破碎液进行纯化得到纯酶液。
32、本发明中提供了酶的比活检测:利用紫外-可见分光光度计测定山梨醇-6-磷酸脱氢酶的活力,通过检测nadh在340nm处吸光值的变化来计算。测活体系为1ml,包括970μl的tris-hcl缓冲液(200mm,ph 7.5),10μl的底物果糖-6-磷酸(100mm),10μl的nadh(15mm),10μl的酶液(稀释到合适浓度)。体系中所有物质依次加入到比色皿中,混合均匀后放入紫外分光光度计中,在30℃下测定吸光值变化。酶活力的单位定义为,每分钟内氧化1μmol的nadh所需要的酶量。酶活计算公式如下:
33、酶活力(u)=ew×v×103/(6220×l)
34、式中,ew为1分钟内340nm处吸光度的变化;v为反应液的体积,单位为ml;6220为nadh的摩尔消光系数,单位为l/(mol·cm);l为光程距离,单位为cm。1个酶活力单位(u)对应于上述条件下每分钟催化lμmol nadh氧化所需的酶量。
35、本发明采用的技术方案七:使用如上所述山梨醇-6-磷酸脱氢酶突变体或山梨醇-6-磷酸脱氢酶突变体催化剂催化果糖-6-磷酸还原合成山梨醇-6-磷酸的方法。
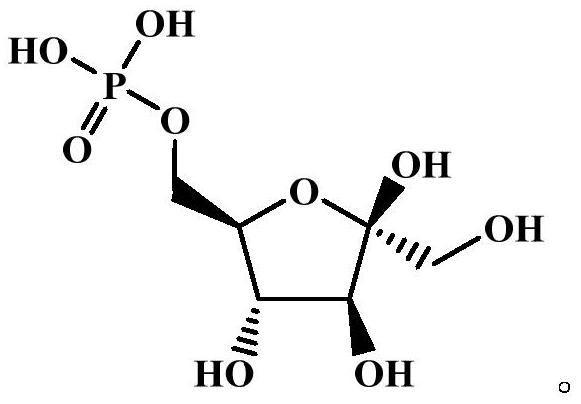
36、其中所述的果糖-6-磷酸结构如下所示:
37、
38、以果糖-6-磷酸还原合成山梨醇-6-磷酸,以山梨醇-6-磷酸脱氢酶s6pdh突变体与葡萄糖脱氢酶bmgdh偶联从而实现nadh的辅酶循环,示意如下:
39、
40、所述的还原反应的条件可按本领域此类反应的常规条件进行选择,较佳的,所述的应用包括下述步骤:将所述山梨醇-6-磷酸脱氢酶突变体或山梨醇-6-磷酸脱氢酶突变体催化剂与葡萄糖脱氢酶的粗酶冻干粉加入反应缓冲液中,加入底物、葡萄糖以及nad+,在30℃下混合反应。所述山梨醇-6-磷酸脱氢酶突变体或山梨醇-6-磷酸脱氢酶突变体催化剂与果糖-6-磷酸的用量比较佳的为10ku/mol~20ku/mol底物,葡萄糖与果糖-6-磷酸的比较佳用量为200g/mol~300g/mol。反应缓冲液为实验室常规缓冲液,ph范围在6.0~8.0,优选为tris-hcl缓冲液,浓度较佳的为0.1~0.2mol/l,额外添加的nad+的用量以0~0.15mmol/l较佳。反应温度较佳的为25~35℃,反应过程以在搅拌条件下进行较佳。反应过程中,间歇取样测定反应转化率,反应时间以底物完全转化或反应转化率停止增长的时间为准,一般为1~24h。反应转化率采用液相色谱法进行分析。待还原反应结束后,反应液用等量500mm硫酸试剂停止反应,使用水系膜过滤。
41、山梨醇-6-磷酸脱氢酶催化的果糖-6-磷酸还原反应可以与山梨醇-6-磷酸脱磷酶催化反应耦联,从而实现山梨醇的生产。
42、与现有技术相比,本发明的创新和改进效果在于:
43、本发明的山梨醇-6-磷酸脱氢酶突变体具有高催化活性、显著提升的热稳定性的优势,从而在相同催化剂用量的条件下,可以实现较高的转化率。最优突变体可在30℃内转化30g/l的底物,30℃时的转化率相较于母本提升显著,反应产物脱磷后为山梨醇,在山梨醇的生产中具有很好的应用前景。
本文地址:https://www.jishuxx.com/zhuanli/20240911/292220.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表